Three‐weekly cisplatin dose is accepted for standard treatment for concurrent chemo‐radiotherapy in nasopharyngeal carcinoma. However, different chemotherapy schedules are presented in the literature.
ObjectiveWe intend to compare toxicity and outcomes of high dose 3‐weekly cisplatin versus low dose weekly‐cisplatin and cumulative dose of cisplatin in the patients with nasopharyngeal carcinoma.
Methods98 patients were included in the study, between 2010 and 2018. Cumulative doses of cisplatin (≥200mg/m2 and <200mg/m2) and different chemotherapy schedules (weekly and 3‐weekly) were compared in terms of toxicity and survival. Besides prognostic factors including age, gender, T category, N category and radiotherapy technique were evaluated in uni‐multivariate analysis.
ResultsMedian follow‐up time 41.5 months (range: 2–93 months). Five year overall survival, local relapse‐free survival, regional recurrence‐free survival and distant metastasis‐free survival rates were; 68.9% vs. 90.3% (p=0.11); 66.2% vs. 81.6% (p=0.15); 87.3% vs. 95.7% (p=0.18); 80.1% vs. 76.1% (p=0.74) for the group treated weekly and 3 weekly, respectively. There was no statistically significant difference between groups. Five year overall survival, local relapse‐free survival, regional recurrence‐free survival and distant metastasis‐free survival rates were; 78.2% vs. 49.2% (p=0.003); 75.8% vs. 47.9% (p=0.055); 91% vs. 87.1% (p=0.46); 80% vs. 72.2% (p=0.46) for the group treated ≥200mg/m2 and <200mg/m2 cumulative dose cisplatin. There was statistically significant difference between groups for overall survival and there was close to being statistically significant difference between groups for local relapse‐free survival. Age, gender, T category, N category, chemotherapy schedules were not associated with prognosis in the uni‐variety analysis. Radiotherapy technique and cumulative dose of cisplatin was associated with prognosis in uni‐variate analysis (HR=0.21; 95% CI: 0.071–0.628; p=0.005 and HR=0.29; 95% CI: 0.125–0.686; p=0.003, respectively). Only cumulative dose of cisplatin was found as an independent prognostic factor in multivariate analysis (HR=0.36; 95% CI: 0.146–0.912; p=0.03). When toxicities were evaluated, such as hematological toxicity, dermatitis, mucositis, nausea and vomiting, there were no statistically significant differences between cumulative dose of cisplatin groups (<200mg/m2 and ≥200mg/m2) and chemotherapy schedules (3‐weekly and weekly). But malnutrition was statistically significant higher in patients treated with 3‐weekly cisplatin compared with patients treated with weekly cisplatin (p=0.001).
ConclusionA cisplatin dose with ≥200mg/m2 is an independent prognostic factor for overall survival. Chemotherapy schedules weekly and 3‐weekly have similar outcomes and adverse effects. If patients achieve ≥200mg/m2 dose of cumulative cisplatin, weekly chemotherapy schedules may be used safely and effectively in nasopharyngeal carcinoma patients.
Três doses semanais de cisplatina com quimiorradioterapia concomitante são aceitas como o tratamento‐padrão para carcinoma nasofaríngeo. No entanto, diferentes esquemas quimioterápicos são recomendados na literatura científica.
ObjetivoComparar a toxicidade e os resultados de 3 doses altas semanais de cisplatina versus dose baixa semanal de cisplatina em pacientes com carcinoma nasofaríngeo e verificar a dose cumulativa de cisplatina.
MétodoForam incluídos 98 pacientes, entre 2010 e 2018. As doses cumulativas de cisplatina (≥ 200mg/m2 e < 200mg/m2) e diferentes esquemas de quimioterapia (semanal e a cada 3 semanas) foram comparadas em termos de toxicidade e sobrevida. Além disso, fatores prognósticos, inclusive idade, sexo, categoria T, categoria N e técnica de radioterapia, foram avaliados na análise uni‐multivariada.
ResultadosO tempo médio de seguimento foi de 41,5 meses (intervalo: 2–93 meses). Sobrevida global de cinco anos, sobrevida livre de recidiva local, sobrevida livre de recidiva regional e sobrevida livre de metástases a distância foram: 68,9% vs. 90,3% (p=0,11); 66,2% vs. 81,6% (p=0,15); 87,3% vs. 95,7% (p=0,18); e 80,1% vs. 76,1% (p=0,74) para os grupos tratados semanalmente e 3 x/semana, respectivamente. Não houve diferença estatisticamente significante entre os grupos. Taxas de sobrevida global, sobrevida livre de recidiva local, sobrevida livre de recidiva regional e sobrevida livre de metástases a distância em cinco anos foram; 78,2% vs. 49,2% (p=0,003); 75,8% vs. 47,9% (p=0,055); 91% vs. 87,1% (p=0,46); 80% vs. 72,2% (p=0,46) para o grupo tratado com ≥ 200mg/m2 e < 200mg/m2 de dose cumulativa de cisplatina. Houve diferença estatisticamente significante entre os grupos para sobrevida global e houve uma diferença quase estatisticamente significante entre os grupos para sobrevida livre de recidiva local. Idade, sexo, categoria T, categoria N e esquemas de quimioterapia não foram associados ao prognóstico na análise univariada. A técnica de radioterapia e dose cumulativa de cisplatina foram associadas ao prognóstico na análise univariada (HR=0,21; IC 95%: 0,071±0,628; p=0,005 e HR=0,29; IC 95%: 0,125±0,686; p=0,003, respectivamente). Apenas a dose cumulativa de cisplatina foi considerada um fator prognóstico independente na análise multivariada (HR=0,36; IC 95%: 0,146±0,912; p=0,03). Quando as toxicidades foram avaliadas, como toxicidade hematológica, dermatite, mucosite, náusea e vômito, não houve diferença estatisticamente significante entre a dose cumulativa dos grupos cisplatina (< 200mg/m2 e ≥ 200mg/m2) e esquemas de quimioterapia (semanal e a cada 3 semanas). Entretanto, a desnutrição foi estatisticamente maior em pacientes tratados com cisplatina a cada 3 semanas em comparação com pacientes tratados com cisplatina semanalmente (p=0,001).
ConclusãoUma dose de cisplatina ≥ 200mg/m2 é fator prognóstico independente para sobrevida global. Os esquemas de quimioterapia semanais e a cada 3 semanas têm resultados e efeitos adversos semelhantes. Se os pacientes atingirem uma dose cumulativa ≥ 200mg/m2 de cisplatina, os esquemas semanais de quimioterapia podem ser usados com segurança e eficácia em pacientes com carcinoma nasofaríngeo.
O carcinoma nasofaríngeo (CNF) é uma neoplasia maligna de cabeça e pescoço endêmica no sul da China, sudeste da Ásia e no Mediterrâneo. A radioterapia (RT) é o tratamento básico para CNF em estágio inicial, devido à alta radiossensibilidade.1 Entretanto, o CNF localmente avançado está relacionado com maior risco de recidiva locorregional e metástases a distância.1,2 A quimiorradioterapia concomitante é considerada como o tratamento‐padrão do CNF localmente avançado, com base em vários estudos que demonstraram melhoria na sobrevida global (SG),3–9 sobrevida livre de progressão (SLP),6,7,10 sobrevida livre de doença (SLD),8 sobrevida livre de recidiva locorregional10 e controle distante em comparação com a RT isolada. Para CNF localmente avançado, a quimioterapia combinada com RT pode prolongar a sobrevida global, com um benefício de sobrevida absoluta de 5 anos de 4%.3,4,11
As diretrizes do National Comprehensive Cancer Network (NCCN) recomendam a quimiorradioterapia concomitante (CCRT) à cisplatina como tratamento de primeira linha para o CNF, porque as terapias sistêmicas são mais eficazes no CNF do que em outros tipos de cânceres sólidos.12,13 O protocolo padrão na América do Norte é o esquema de tratamento Intergrupo‐0099, que consiste em cisplatina 100mg/m2 administrada nos dias 1, 22 e 43, concomitantemente à RT, e seguida por cisplatina adjuvante e 5‐fluorourasil.1,6 O ensaio clínico NPC‐0099 demonstrou que a alta dosagem de cisplatina é melhor do que a RT isolada para pacientes com CNF avançado em termos de SG e SLP, mas esse regime está associado a significativa toxicidade aguda, o que pode limitar o uso da dose.14 A quimioterapia adjuvante tem sido frequentemente omitida devido à toxicidade cumulativa e até recentemente os estudos não demonstraram um benefício clínico claro que apoiasse o seu uso.15
Na literatura, os ensaios mostraram reações adversas agudas graves em pacientes com câncer de laringe localmente avançado que usaram altas doses de cisplatina, tanto na quimiorradioterapia pós‐operatória quanto na quimiorradioterapia definitiva orgãoprotetora.15–18 Além disso, atualizado em 2013, o estudo Radiation Therapy Oncology Group (RTOG) 91–11 demonstrou uma taxa cumulativa de 33% em 10 anos de toxicidade tardia de grau 3–5 e alta incidência de morte não relacionada ao câncer de laringe em pacientes tratados com quimiorradioterapia à base de cisplatina para preservação da laringe.19 Embora o protocolo de alta dose de cisplatina a cada 3 semanas demostre alta toxicidade, os protocolos semanais de baixa dose de cisplatina resultaram em menor toxicidade em diferentes estudos.10 Um estudo randomizado de Fase III revelou que o esquema semanal (cisplatina 40mg/m2) concomitante com radioterapia foi mais facilmente tolerado pelos pacientes e mostrou benefícios de sobrevida em comparação com a RT isolada.10
A quimiorradioterapia concomitante é a terapia‐padrão para CNF localmente avançado; entretanto, o esquema ideal para a administração da dose de cisplatina ainda não foi estabelecido. Neste estudo retrospectivo de base populacional, objetivamos comparar a toxicidade e os resultados de 3 doses altas semanais de cisplatina versus dose baixa de cisplatina semanal em pacientes com CNF.
MétodoSeleção de pacientesO diagnóstico de CNF foi confirmado por um conselho multidisciplinar de tumores antes do início do tratamento. Noventa e oito pacientes com CNF tratados com quimiorradioterapia concomitante entre 2010 e 2018 foram incluídos. Os critérios de inclusão compreenderam CNF confirmado histologicamente por biópsia, sem metástases a distância, funções hepáticas normais (bilirrubina total sérica ≤ 1,6mg/dL e níveis séricos de transaminases <2,5 vezes maiores do que o limite superior); função renal normal (creatinina sérica ≤ 1,5mg/dL e clearance de creatinina ≥ 60mL/min); hemograma completo normal (hemoglobina> 10g/dL, leucócitos ≥ 4000μL, plaquetas ≥ 100.000μL); Escore de desempenho de Karnofsky (KPS)> 70; e receber apenas cisplatina durante a quimiorradioterapia concomitante. Este estudo foi aprovado pelo comitê de ética local em pesquisa e o consentimento informado por escrito foi fornecido por todos os pacientes (comitê de ética em pesquisa local ID: 2019/160 e data: 06.03.2019).
Estadiamento clínicoO estadiamento foi determinado pelo exame clínico de cabeça e pescoço, nasoendoscopia com fibra óptica, ressonância magnética (RM) e tomografia computadorizada por emissão de pósitrons (PET‐CT). Todos os pacientes foram reestadiados de acordo com a 8ª edição do sistema American Joint Committee on Cancer (AJCC).20
TratamentoA técnica de radioterapia conformada em 2/3D foi aplicada antes de 2012 e a técnica de radioterapia com modulação de intensidade (IMRT) foi aplicada após 2012. A dose‐padrão e o fracionamento para RT conformada em 2/3D foram de 70Gy para o tumor primário; 50–60Gy para os nódulos afetados em 35 frações diárias. A dose total e a fração para IMRT foram 70Gy/ 2,12Gy por fração para o volume alvo de planejamento de alto risco (volume do tumor primário e nódulos afetados), 60 Gy/1,8Gy por fração para o volume alvo de planejamento de risco intermediário e 54Gy/ 1,65Gy por fração para o volume alvo de planejamento de baixo risco. O esquema de cisplatina consiste em infusão intravenosa de 100mg/m2 a cada 3 semanas ou 50mg/m2 de infusão intravenosa semanalmente. A quimioterapia foi iniciada no primeiro dia de tratamento com radiação para todos os pacientes.
As informações sobre toxicidade foram registradas pela equipe médica durante o tratamento e coletadas dos prontuários dos pacientes. A avaliação da toxicidade aguda do tratamento foi feita de acordo com o National Cancer Institute Common Toxicity Criteria versão 3.0.21
SeguimentoO seguimento dos pacientes foi definido desde o primeiro dia de tratamento até o último exame ou morte. Tanto a RM como a PET‐CT foram feitas para avaliar a resposta ao tratamento no terceiro mês após o último dia de tratamento. A avaliação da resposta ao tratamento foi feita de acordo com o Response Evaluation Criteria in Solid Tumors (Critérios de Avaliação de Resposta em Tumores Sólidos – Recist).22 A resposta ao tratamento foi classificada como resposta completa (RC), resposta parcial (RP), doença estável (DE) ou doença progressiva (DP). Se a resposta fosse completa, os pacientes eram monitorados a cada 3 meses nos primeiros 2 anos com RM e os exames de acompanhamento eram feitos a cada 6 meses até a morte.
Análise estatísticaO local da primeira recidiva clínica foi aceito como falha local, se o local da recidiva fosse na nasofaringe. O local da primeira recidiva clínica foi aceito como falha regional, se o local da recidiva fosse na região nodal. Se o local da recidiva estivesse além das áreas acima mencionadas, era considerado como falha distante. A duração da sobrevida livre de doença (SLD), sobrevida livre de recidiva local e sobrevivência livre de recidiva regional (SLRL e SLRR) e sobrevida livre de metástases a distância (SLMD) foram calculados a partir do dia 1 do tratamento até que a falha do tratamento fosse documentada. A sobrevida global (SG) foi calculada a partir do dia 1 do tratamento até a morte ou a data do último acompanhamento. A análise estatística dos dados foi feita com o programa IBM SPSS Statistics 22.0 (IBM Corp., Armonk, Nova York, EUA). Todos os dados foram expressos como médias±DP, a menos que indicado de outra forma e controlados para normalidade com o teste de Shapiro‐Wilk. Os testes de qui‐quadrado e exato de Fisher foram usados para comparar as variáveis categóricas, tais como idade diferente, sexo, estágio T, estágio N e esquema de quimioterapia. O tempo de sobrevida entre os grupos foi comparado com os testes de análise de Kaplan‐Meier e log‐rank. As diferenças foram consideradas significantes quando p <0,05. Os fatores determinantes na sobrevida global e na sobrevida livre de recidiva locorregional foram analisados pelo modelo multivariado de regressão de Cox (método de Backward/Wald). A probabilidade de remoção para stepwise foi tomada como p <0,10. O valor de p <0,05 denotou significância estatística.
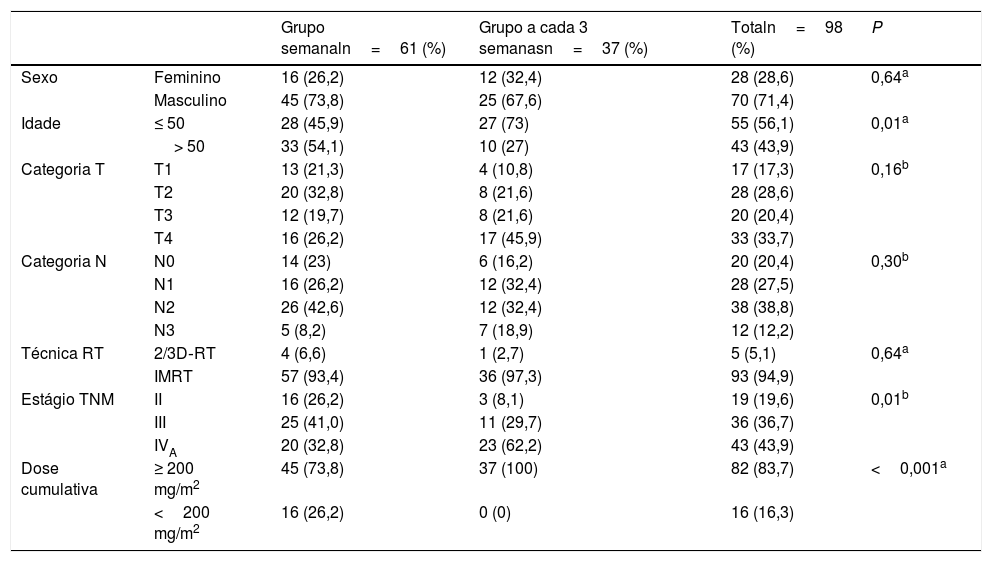
ResultadosCaracterísticas dos pacientesDe 2010 a 2018, foram avaliados 98 (28 mulheres e 70 homens) pacientes elegíveis. A mediana da idade foi de 49,5 anos (variação de 16–75). Dos 98 pacientes, 17 (17,3%), 28 (28,6%), 20 (20,4%) e 33 (33,7%) tinham câncer nos estágios T1, T2, T3, e T4, respectivamente. Dos 98 pacientes, 20 (20,4%), 28 (28,6%), 38 (38,8%) e 12 (12,2%) tinham neoplasias nos estágios N0, N1, N2, e N3, respectivamente. Dos 98 pacientes, 19 (19,4%), 36 (36,7%) e 43 (43,9%) tinham câncer de estágio II, estágio III e estágio IVA, respectivamente. Sessenta e um pacientes (62,2%) receberam cisplatina semanal e 37 (37,8%) receberam cisplatina a cada 3 semanas. Cinco dos 98 pacientes (5,1%) foram tratados com a técnica de RT conformada em 2/3D. Noventa e três dos 98 pacientes (94,9%) foram tratados com a técnica IMRT. Após a quimiorradioterapia, 80 pacientes (81,6%) foram avaliados como apresentando resposta completa e 18 pacientes (18,4%) como resposta parcial. Uma dose cumulativa ≥ 200mg/m2 foi alcançada em 46 de 61 (74%) pacientes no grupo de cisplatina semanal e todos os pacientes (100%) no grupo de cisplatina a cada 3 semanas recebeu uma dose cumulativa ≥ 200mg/m2. A mediana dos dias de tratamento foi de 48 dias (intervalo: 30‐87 dias). As características dos pacientes estão resumidas na tabela 1.
Comparação das características dos pacientes entre os grupos
| Grupo semanaln=61 (%) | Grupo a cada 3 semanasn=37 (%) | Totaln=98 (%) | P | ||
|---|---|---|---|---|---|
| Sexo | Feminino | 16 (26,2) | 12 (32,4) | 28 (28,6) | 0,64a |
| Masculino | 45 (73,8) | 25 (67,6) | 70 (71,4) | ||
| Idade | ≤ 50 | 28 (45,9) | 27 (73) | 55 (56,1) | 0,01a |
| > 50 | 33 (54,1) | 10 (27) | 43 (43,9) | ||
| Categoria T | T1 | 13 (21,3) | 4 (10,8) | 17 (17,3) | 0,16b |
| T2 | 20 (32,8) | 8 (21,6) | 28 (28,6) | ||
| T3 | 12 (19,7) | 8 (21,6) | 20 (20,4) | ||
| T4 | 16 (26,2) | 17 (45,9) | 33 (33,7) | ||
| Categoria N | N0 | 14 (23) | 6 (16,2) | 20 (20,4) | 0,30b |
| N1 | 16 (26,2) | 12 (32,4) | 28 (27,5) | ||
| N2 | 26 (42,6) | 12 (32,4) | 38 (38,8) | ||
| N3 | 5 (8,2) | 7 (18,9) | 12 (12,2) | ||
| Técnica RT | 2/3D‐RT | 4 (6,6) | 1 (2,7) | 5 (5,1) | 0,64a |
| IMRT | 57 (93,4) | 36 (97,3) | 93 (94,9) | ||
| Estágio TNM | II | 16 (26,2) | 3 (8,1) | 19 (19,6) | 0,01b |
| III | 25 (41,0) | 11 (29,7) | 36 (36,7) | ||
| IVA | 20 (32,8) | 23 (62,2) | 43 (43,9) | ||
| Dose cumulativa | ≥ 200 mg/m2 | 45 (73,8) | 37 (100) | 82 (83,7) | <0,001a |
| <200 mg/m2 | 16 (26,2) | 0 (0) | 16 (16,3) |
2/3D‐RT, radioterapia bidimensional ou tridimensional; IMRT, radioterapia com modulação de intensidade; TNM, categorias T e N de acordo com o sistema de estadiamento da 8ª edição do American Joint Commission on Cancer.
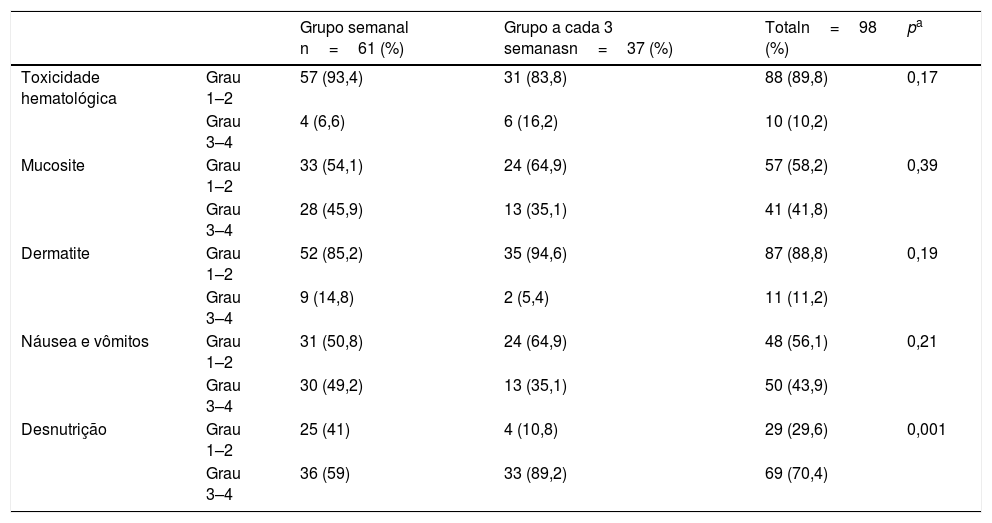
Toxicidade hematológica grau 1–2 foi observada em 88 dos pacientes (89,8%) e toxicidade hematológica grau 3–4 foi observada em 10 dos pacientes (10,2%). Seis dos pacientes com toxicidade hematológica de Grau 3–4 estavam no grupo de cisplatina a cada 3 semanas e 4 dos pacientes com toxicidade Grau 3–4 estavam no grupo de cisplatina semanal. Não houve diferença estatisticamente significante entre os dois grupos (p=0,17). Mucosite de grau 1–2 foi observada em 57 dos pacientes (57,2%) e mucosite de grau 3–4 foi observada em 41 dos pacientes (41,8%). Treze dos pacientes com mucosite Grau 3–4 estavam no grupo de cisplatina a cada 3 semanas e 28 dos pacientes com mucosite Grau 3–4 estavam no grupo de cisplatina semanal. Não houve diferença estatisticamente significante entre os dois grupos (p=0,39). Oitenta e sete dos pacientes (88,8%) apresentaram dermatite Grau 1–2 e 11 dos pacientes (11,2%) apresentaram dermatite Grau 3–4. Nove pacientes com dermatite Grau 3–4 estavam no grupo de tratamento com cisplatina semanal e dois pacientes com dermatite Grau 3–4 estavam no grupo de cisplatina a cada 3 semanas. Não houve diferença estatisticamente significante entre os dois grupos (p=0,199).
A toxicidade mais frequentemente determinada foi a desnutrição. Em comparação com o esquema semanal, o esquema de tratamento com cisplatina a cada 3 semanas induziu toxicidade significantemente mais grave para os nutrientes. Sessenta e nove dos pacientes (69/98) apresentaram desnutrição. A porcentagem média de desnutrição no grupo de cisplatina semanal foi de 59% (36/61) e no grupo de cisplatina a cada 3 semanas, 89,2% (33/37). A desnutrição não foi observada em 25 pacientes (41%) no grupo de cisplatina semanal e não foi observada em apenas 4 pacientes (10,8%) no grupo de cisplatina a cada 3 semanas. Houve diferença estatisticamente significante entre os grupos em termos de desnutrição (p=0,001). O grupo de cisplatina semanal mostrou‐se mais confortável quanto à toxicidade para nutrientes. As características da toxicidade dos pacientes estão resumidas na tabela 2.
Comparação de toxicidade entre o grupo semanal e a cada 3 semanas
| Grupo semanal n=61 (%) | Grupo a cada 3 semanasn=37 (%) | Totaln=98 (%) | pa | ||
|---|---|---|---|---|---|
| Toxicidade hematológica | Grau 1–2 | 57 (93,4) | 31 (83,8) | 88 (89,8) | 0,17 |
| Grau 3–4 | 4 (6,6) | 6 (16,2) | 10 (10,2) | ||
| Mucosite | Grau 1–2 | 33 (54,1) | 24 (64,9) | 57 (58,2) | 0,39 |
| Grau 3–4 | 28 (45,9) | 13 (35,1) | 41 (41,8) | ||
| Dermatite | Grau 1–2 | 52 (85,2) | 35 (94,6) | 87 (88,8) | 0,19 |
| Grau 3–4 | 9 (14,8) | 2 (5,4) | 11 (11,2) | ||
| Náusea e vômitos | Grau 1–2 | 31 (50,8) | 24 (64,9) | 48 (56,1) | 0,21 |
| Grau 3–4 | 30 (49,2) | 13 (35,1) | 50 (43,9) | ||
| Desnutrição | Grau 1–2 | 25 (41) | 4 (10,8) | 29 (29,6) | 0,001 |
| Grau 3–4 | 36 (59) | 33 (89,2) | 69 (70,4) |
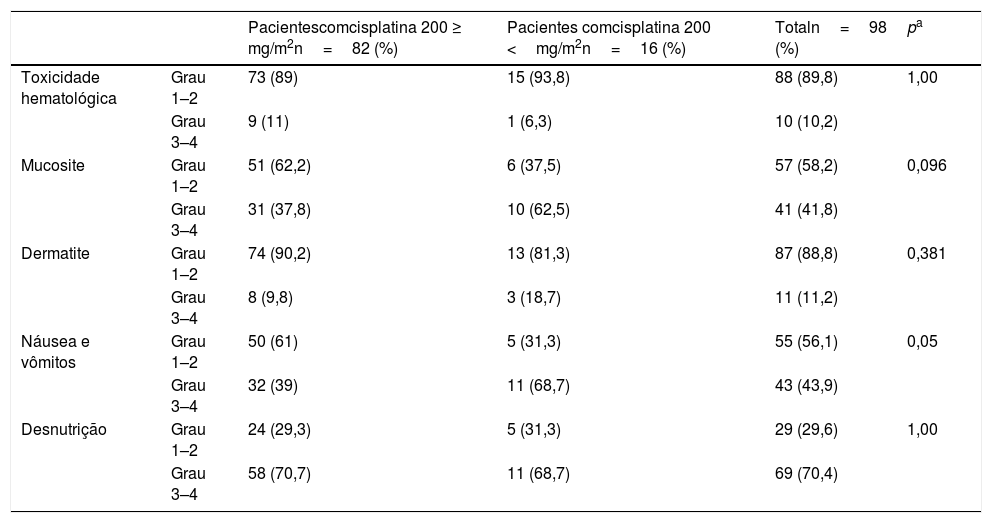
A cisplatina cumulativa em altas doses não mostrou diferença estatisticamente significante nas toxicidades de Grau 3–4, inclusive toxicidade hematológica, mucosite, dermatite e desnutrição, em comparação à cisplatina cumulativa em baixas doses (p=1,00; p=0,09; p=0,38; p=1,00 respectivamente). Para náuseas e vômitos, a diferença entre os grupos foi próxima de ser estatisticamente significante (p=0,051). A comparação entre as toxicidades e a dose cumulativa administrada de cisplatina está resumida na tabela 3.
Comparação da dose cumulativa de cisplatina administrada e toxicidade
| Pacientescomcisplatina 200 ≥ mg/m2n=82 (%) | Pacientes comcisplatina 200 <mg/m2n=16 (%) | Totaln=98 (%) | pa | ||
|---|---|---|---|---|---|
| Toxicidade hematológica | Grau 1–2 | 73 (89) | 15 (93,8) | 88 (89,8) | 1,00 |
| Grau 3–4 | 9 (11) | 1 (6,3) | 10 (10,2) | ||
| Mucosite | Grau 1–2 | 51 (62,2) | 6 (37,5) | 57 (58,2) | 0,096 |
| Grau 3–4 | 31 (37,8) | 10 (62,5) | 41 (41,8) | ||
| Dermatite | Grau 1–2 | 74 (90,2) | 13 (81,3) | 87 (88,8) | 0,381 |
| Grau 3–4 | 8 (9,8) | 3 (18,7) | 11 (11,2) | ||
| Náusea e vômitos | Grau 1–2 | 50 (61) | 5 (31,3) | 55 (56,1) | 0,05 |
| Grau 3–4 | 32 (39) | 11 (68,7) | 43 (43,9) | ||
| Desnutrição | Grau 1–2 | 24 (29,3) | 5 (31,3) | 29 (29,6) | 1,00 |
| Grau 3–4 | 58 (70,7) | 11 (68,7) | 69 (70,4) |
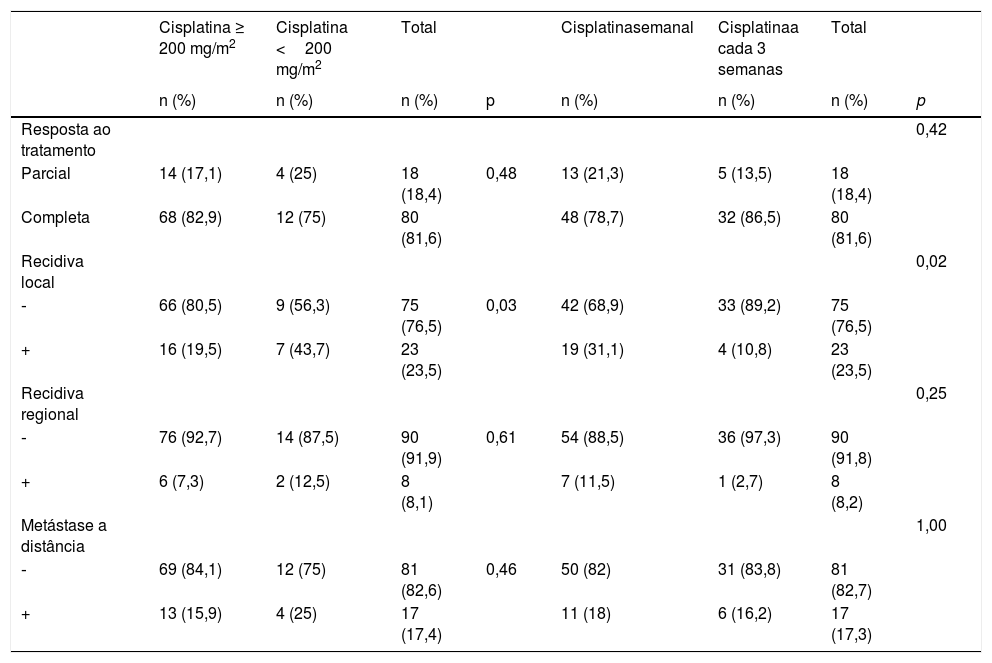
A mediana do seguimento foi de 41,5 meses (intervalo: 2–93 meses). Recidiva local foi observada em 23 dos 98 pacientes. A taxa de recidiva local foi de 19,4% (19/61) no grupo de cisplatina semanal e de 4,1% (4/37) no grupo de cisplatina a cada 3 semanas (p=0,02) (tabela 4). A recidiva regional foi observada em 8 dos 98 pacientes. A taxa de recidiva regional foi de 7,1% (7/61) no grupo de cisplatina semanal e 1% (1/37) no grupo de cisplatina a cada 3 semanas (p=0,25) (tabela 4). Metástase a distância foi observada em 17 dos 98 pacientes. A taxa de metástase a distância foi de 11,2% (11/61) no grupo de cisplatina semanal e de 6,1% (6/37) no grupo de cisplatina a cada 3 semanas (p=1,00) (tabela 4).
Comparação dos resultados do tratamento entre os grupos
| Cisplatina ≥ 200 mg/m2 | Cisplatina <200 mg/m2 | Total | Cisplatinasemanal | Cisplatinaa cada 3 semanas | Total | |||
|---|---|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | p | n (%) | n (%) | n (%) | p | |
| Resposta ao tratamento | 0,42 | |||||||
| Parcial | 14 (17,1) | 4 (25) | 18 (18,4) | 0,48 | 13 (21,3) | 5 (13,5) | 18 (18,4) | |
| Completa | 68 (82,9) | 12 (75) | 80 (81,6) | 48 (78,7) | 32 (86,5) | 80 (81,6) | ||
| Recidiva local | 0,02 | |||||||
| ‐ | 66 (80,5) | 9 (56,3) | 75 (76,5) | 0,03 | 42 (68,9) | 33 (89,2) | 75 (76,5) | |
| + | 16 (19,5) | 7 (43,7) | 23 (23,5) | 19 (31,1) | 4 (10,8) | 23 (23,5) | ||
| Recidiva regional | 0,25 | |||||||
| ‐ | 76 (92,7) | 14 (87,5) | 90 (91,9) | 0,61 | 54 (88,5) | 36 (97,3) | 90 (91,8) | |
| + | 6 (7,3) | 2 (12,5) | 8 (8,1) | 7 (11,5) | 1 (2,7) | 8 (8,2) | ||
| Metástase a distância | 1,00 | |||||||
| ‐ | 69 (84,1) | 12 (75) | 81 (82,6) | 0,46 | 50 (82) | 31 (83,8) | 81 (82,7) | |
| + | 13 (15,9) | 4 (25) | 17 (17,4) | 11 (18) | 6 (16,2) | 17 (17,3) |
Enquanto a dose de cisplatina ≥ 200mg/m2 foi atingida em 82 dos 98 pacientes, a dose de cisplatina <200mg/m2 foi atingida em 16 dos 98 pacientes. Enquanto a taxa de resposta completa foi de 82,9% nos pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2, verificou‐se que foi de 75% nos pacientes que atingiram uma dose de cisplatina <200mg/m2 e as diferenças entre os grupos não foram estatisticamente significantes (p=0,48) (tabela 4). Enquanto a taxa de recidiva local foi de 19,5% nos pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2, foi de 43,8% dos pacientes que atingiram uma dose <200mg/m2 de cisplatina e a diferença entre os grupos foi estatisticamente significante (p=0,03) (tabela 4). Em termos de taxa de recidiva regional, a diferença não foi estatisticamente significante entre os pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2 e os pacientes que atingiram uma dose de cisplatina <200mg/m2 (p=0,61) (tabela 4). Em termos de taxa de metástase a distância, a diferença não foi estatisticamente significante entre os pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2 e aqueles que atingiram uma dose de cisplatina <200mg/m2 (p=0,46) (tabela 4).
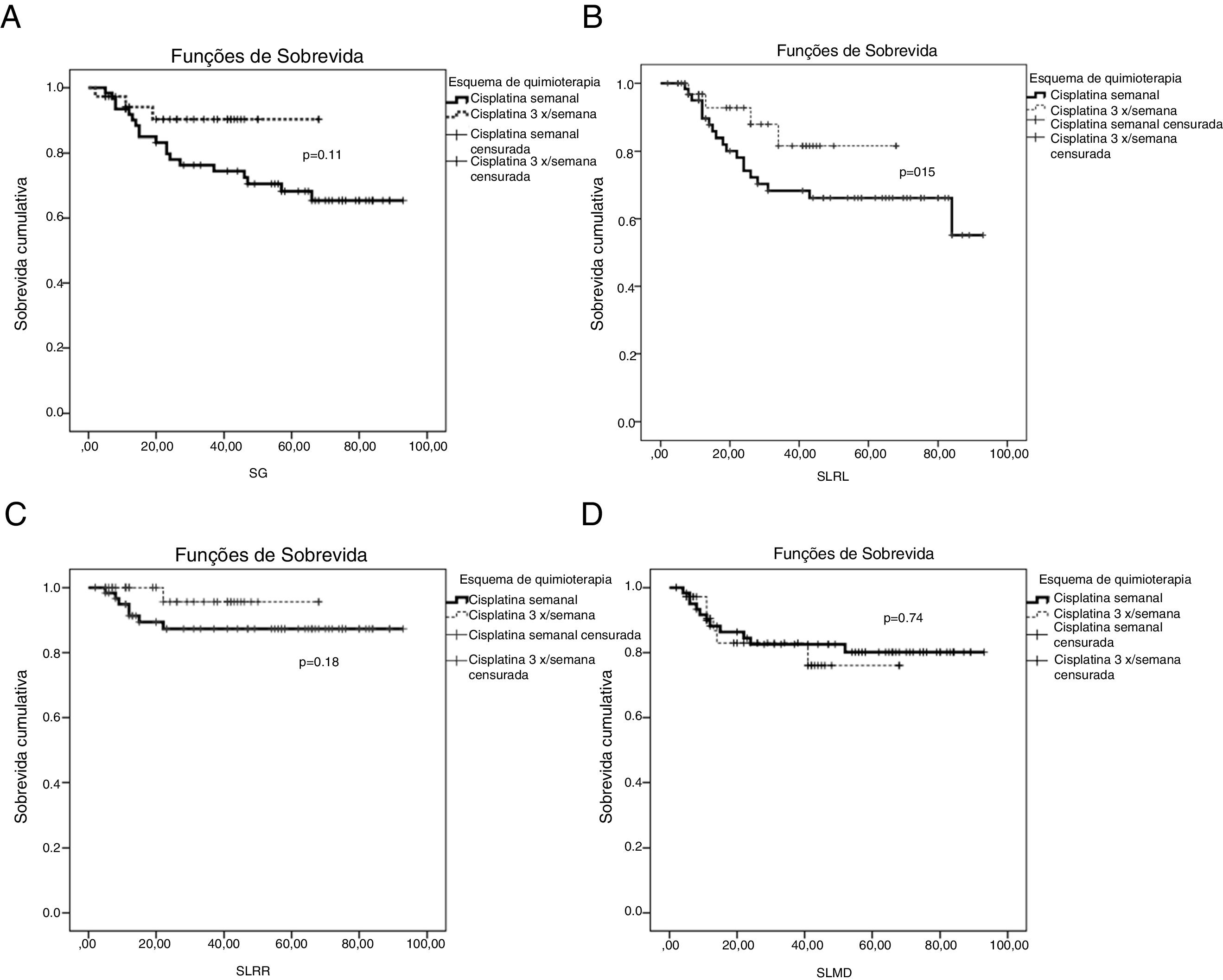
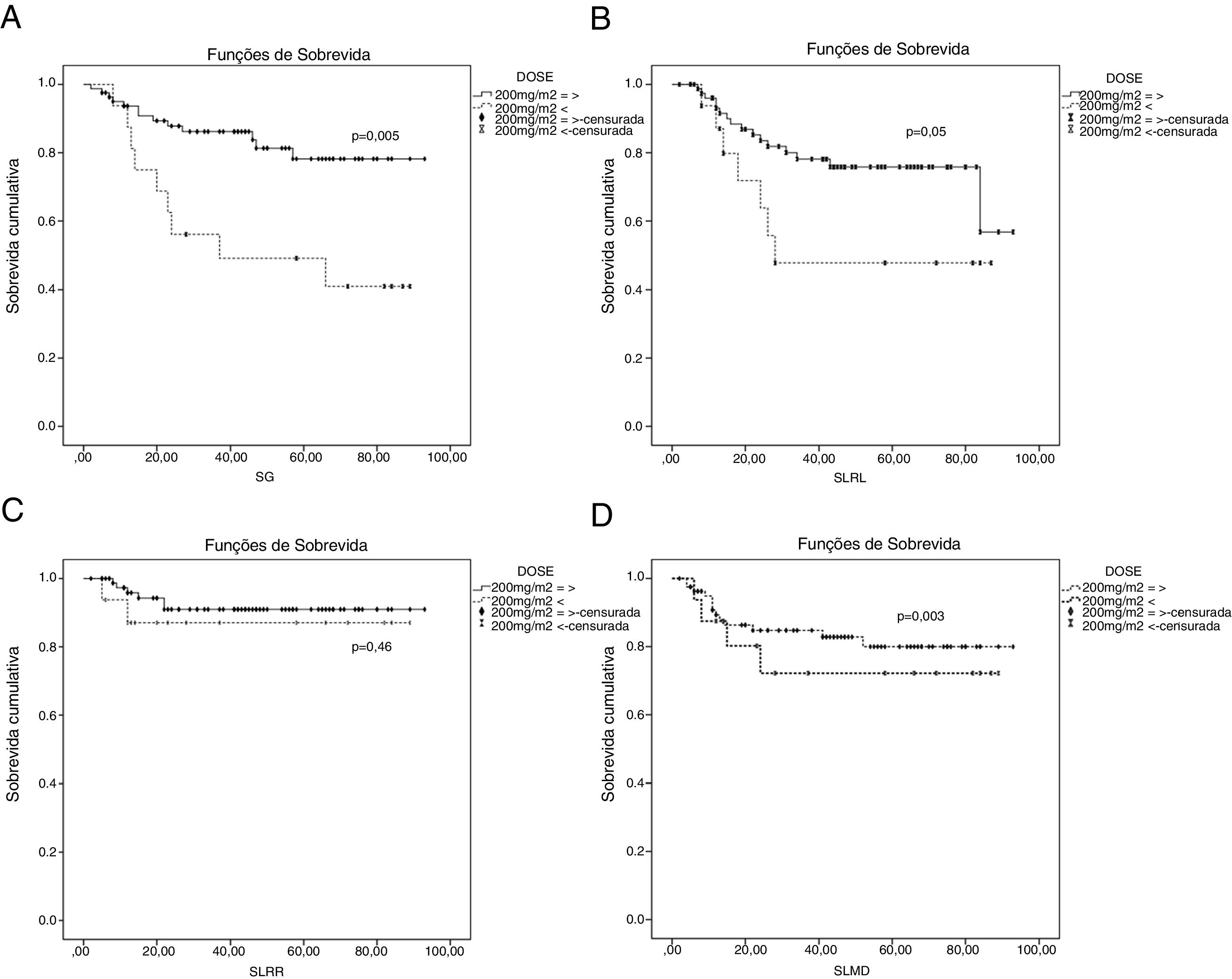
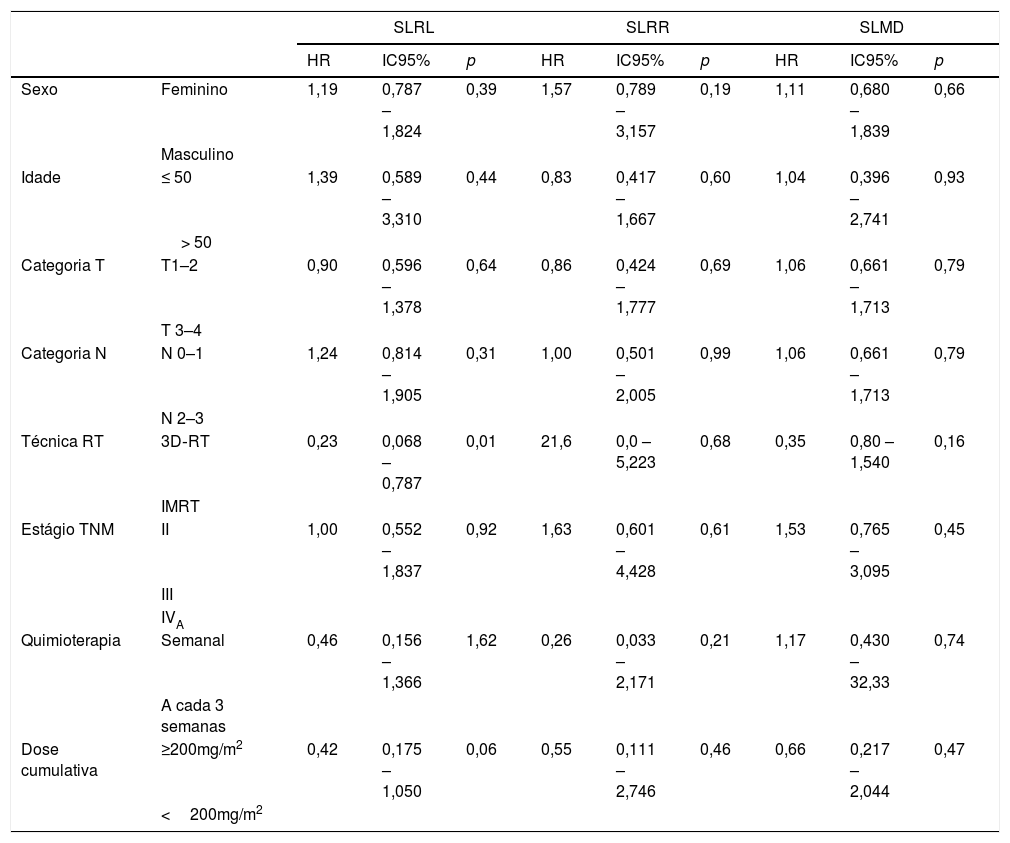
A SLRL média foi 70,7 meses para todos os pacientes. As taxas de SLRL em 5 anos no grupo de cisplatina semanal e no grupo de cisplatina a cada 3 semanas foram de 66,2% e 81,6%, respectivamente. Não houve diferença estatisticamente significante entre os grupos (p=0,15) (fig. 1). As taxas de SLRL em 5 anos nos pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2 e nos pacientes que atingiram uma dose de cisplatina <200mg/m2 foram 75,8% e 47,9%, respectivamente. A diferença entre os grupos foi próxima de ser estatisticamente significante (p=0,055) (fig. 2). Os parâmetros clínicos, sexo, idade, categoria T, categoria N, estágio TNM, esquema de quimioterapia e dose cumulativa de cisplatina, não tiveram qualquer efeito sobre a SLRL, exceto para a técnica de RT. A SLRL foi influenciada pela técnica de RT (HR=0,23, IC95%: 0,068–0,787, p=0,01) (tabela 5).
(A) Curva de sobrevida global entre os grupos semanal e a cada 3 semanas; (B) curva de sobrevida livre de recidiva local entre os grupos semanal e a cada 3 semanas; (C) curva de sobrevida livre de recidiva regional entre os grupos semanal e a cada 3 semanas; (D) curva de sobrevida livre de metástases a distância entre os grupos semanal e a cada 3 semanas.
Curvas de Kaplan‐Meier para pacientes que recebiam cisplatina ≥ 200mg/m2 e < 200mg/m2. (A) Curva de sobrevida global entre ≥ 200mg/m2 e < 200mg/m2; (B) Curva de sobrevida livre de recidiva local entre ≥ 200mg/m2 e < 200mg/m2; (C) Curva de sobrevida livre de recidiva regional entre ≥ 200mg/m2 e < 200mg/m2, (D) Curva de sobrevida livre de metástases a distância entre ≥ 200mg/m2 e < 200mg/m2.
Análise univariada para sobrevida livre de recidiva local, sobrevida livre de recidiva regional e sobrevida livre de metástases à distância
| SLRL | SLRR | SLMD | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | HR | IC95% | p | ||
| Sexo | Feminino | 1,19 | 0,787 – 1,824 | 0,39 | 1,57 | 0,789 – 3,157 | 0,19 | 1,11 | 0,680 – 1,839 | 0,66 |
| Masculino | ||||||||||
| Idade | ≤ 50 | 1,39 | 0,589 – 3,310 | 0,44 | 0,83 | 0,417 – 1,667 | 0,60 | 1,04 | 0,396 – 2,741 | 0,93 |
| > 50 | ||||||||||
| Categoria T | T1–2 | 0,90 | 0,596 – 1,378 | 0,64 | 0,86 | 0,424 – 1,777 | 0,69 | 1,06 | 0,661 – 1,713 | 0,79 |
| T 3–4 | ||||||||||
| Categoria N | N 0–1 | 1,24 | 0,814 – 1,905 | 0,31 | 1,00 | 0,501 – 2,005 | 0,99 | 1,06 | 0,661 – 1,713 | 0,79 |
| N 2–3 | ||||||||||
| Técnica RT | 3D‐RT | 0,23 | 0,068 – 0,787 | 0,01 | 21,6 | 0,0 – 5,223 | 0,68 | 0,35 | 0,80 – 1,540 | 0,16 |
| IMRT | ||||||||||
| Estágio TNM | II | 1,00 | 0,552 – 1,837 | 0,92 | 1,63 | 0,601 – 4,428 | 0,61 | 1,53 | 0,765 – 3,095 | 0,45 |
| III | ||||||||||
| IVA | ||||||||||
| Quimioterapia | Semanal | 0,46 | 0,156 – 1,366 | 1,62 | 0,26 | 0,033 – 2,171 | 0,21 | 1,17 | 0,430 – 32,33 | 0,74 |
| A cada 3 semanas | ||||||||||
| Dose cumulativa | ≥200mg/m2 | 0,42 | 0,175 – 1,050 | 0,06 | 0,55 | 0,111 – 2,746 | 0,46 | 0,66 | 0,217 – 2,044 | 0,47 |
| <200mg/m2 | ||||||||||
3D‐RT, radioterapia tridimensional; IMRT, radioterapia com modulação de intensidade; TNM, categorias T e N de acordo com o sistema de estadiamento da 8ª edição do American Joint Commission on Cancer.
A SLRR média foi de 85,2 meses para todos os pacientes. As taxas de SLRR em 5 anos no grupo de cisplatina semanal e no grupo de cisplatina a cada 3 semanas foram de 87,3% e 95,7%, respectivamente. Não houve diferença estatisticamente significante entre os grupos (p=0,18) (fig. 1). As taxas de SLRR em 5 anos em pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2 e em pacientes que atingiram uma dose de cisplatina <200mg/m2 foram de 91,0% e 87,1%, respectivamente. Não houve diferença estatisticamente significante entre os grupos (p=0,46) (fig. 2). A SLRR não foi influenciada por qualquer parâmetro clínico na análise univariada (tabela 5).
A SLMD média foi de 77,1 meses para todos os pacientes. As taxas de SLRR em 5 anos no grupo de cisplatina semanal e no grupo de cisplatina a cada 3 semanas foram de 80,1% e 76,1%, respectivamente. Não houve diferença estatisticamente significante entre os grupos (p=0,74) (fig. 1). As taxas de SLMD em 5 anos nos pacientes que atingiram uma dose ≥ 200mg/m2 de cisplatina e nos pacientes que atingiram uma dose <200mg/m2 de cisplatina foram de 80% e 72,2%, respectivamente. Não houve diferença estatisticamente significante entre os grupos (p=0,47) (fig. 2). O SLMD não foi influenciado por qualquer parâmetro clínico na análise univariada (tabela 5).
A SG média foi de 73,6 meses para todos os pacientes. As taxas de SG em 5 anos no grupo de cisplatina semanal e no grupo de cisplatina a cada 3 semanas foram de 68,3% e 90,3% respectivamente. Não houve diferença estatisticamente significante entre os grupos (p=0,11) (fig. 1). As taxas de SG em 5 anos nos pacientes que atingiram uma dose de cisplatina ≥ 200mg/m2 e nos pacientes que atingiram uma dose de cisplatina <200mg/m2 foram de 78,2% e 49,2%, respectivamente. A diferença entre os grupos foi estatisticamente significante (p=0,003) (fig. 2).
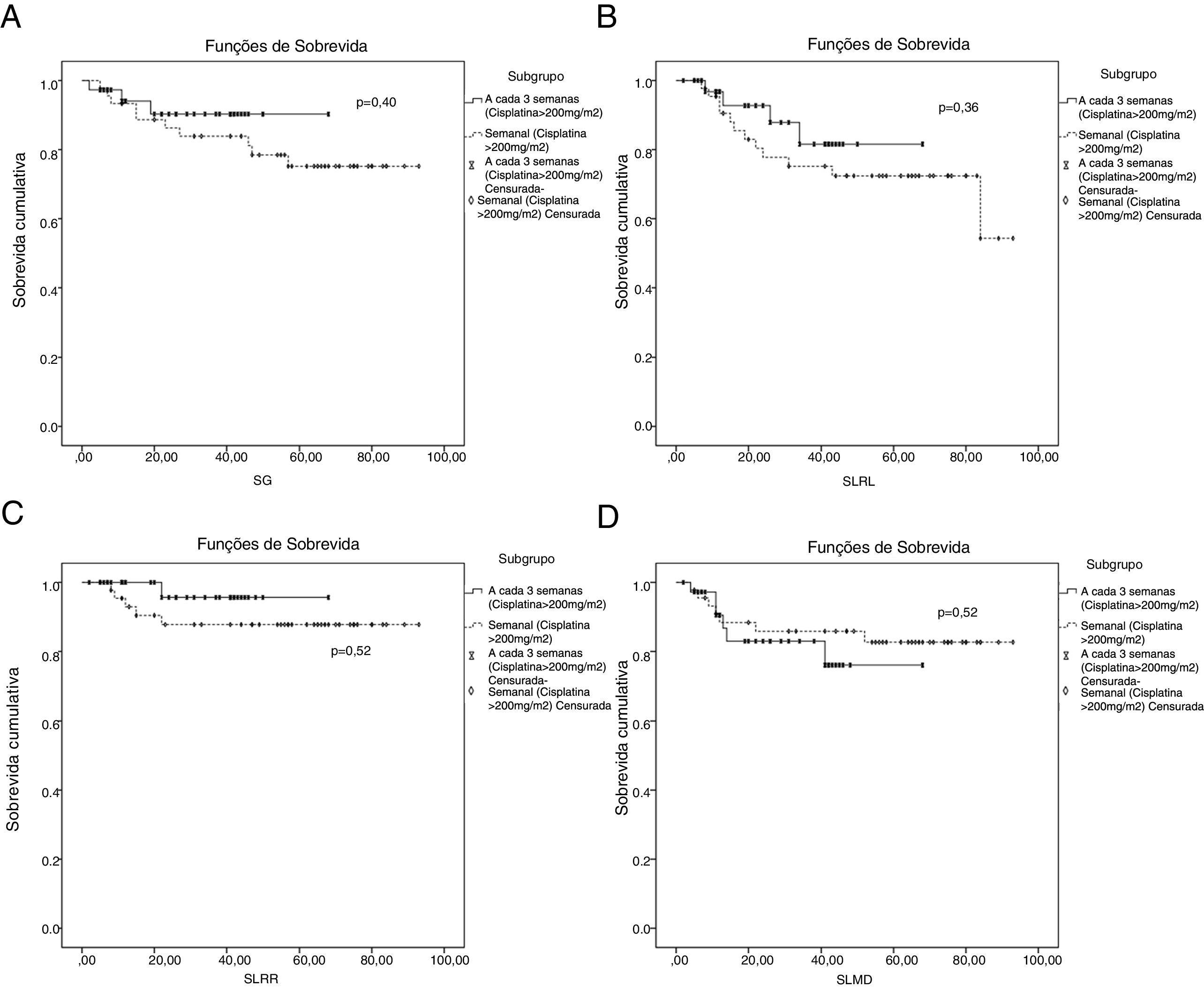
Quando avaliados na análise de subgrupo, não houve diferença estatisticamente significante em termos de SG, SLRL, SLRR e SLMD (p=0,40, p=0,36, p=0,22 e p=0,22, respectivamente) (fig. 3) entre os esquemas de quimioterapia a cada 3 semanas e semanais em pacientes com dose cumulativa de cisplatina ≥ 200mg/m2.
Curvas de sobrevida entre esquema semanal de quimioterapia e esquema a cada 3 semanas em pacientes com dose cumulativa de cisplatina ≥ 200mg/m2. (A) Curva de sobrevida global; (B) sobrevida livre de recidiva local; (C) curva de sobrevida livre de recidiva regional; (D) curva de sobrevida livre de metástase à distância.
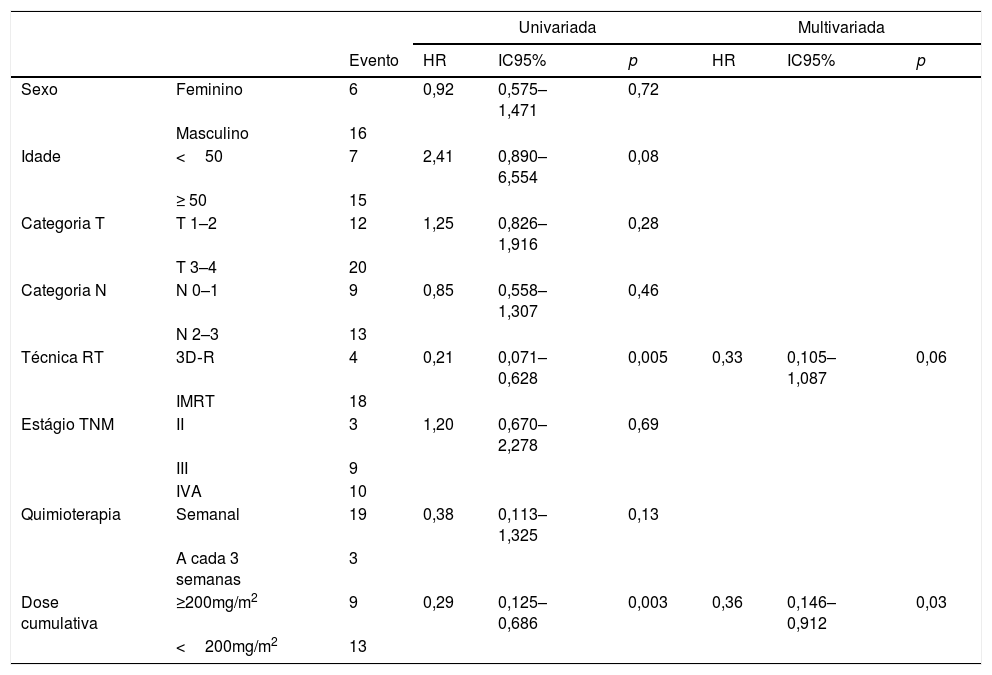
A dose cumulativa de cisplatina e a técnica de RT foram efetivas na análise univariada da SG. A RT conformada em 2/3D e a dose de cisplatina <200mg/m2 foram associadas a menor SG na análise univariada (HR=0,21, IC 95%: 0,071‐0,628, p=0,005 e HR=0,29, IC 95%: 0,125‐0,686, p=0,003, respectivamente) (tabela 6). Entre os parâmetros clínicos, apenas dose de cisplatina <200mg/m2 foi um fator prognóstico para a SG na análise multivariada (HR=0,36, IC 95%: 0,146‐0,912, p=0,03) (tabela 6).
Análise de regressão Cox univariada e multivariada para sobrevida global
| Univariada | Multivariada | |||||||
|---|---|---|---|---|---|---|---|---|
| Evento | HR | IC95% | p | HR | IC95% | p | ||
| Sexo | Feminino | 6 | 0,92 | 0,575–1,471 | 0,72 | |||
| Masculino | 16 | |||||||
| Idade | <50 | 7 | 2,41 | 0,890–6,554 | 0,08 | |||
| ≥ 50 | 15 | |||||||
| Categoria T | T 1–2 | 12 | 1,25 | 0,826–1,916 | 0,28 | |||
| T 3–4 | 20 | |||||||
| Categoria N | N 0–1 | 9 | 0,85 | 0,558–1,307 | 0,46 | |||
| N 2–3 | 13 | |||||||
| Técnica RT | 3D‐R | 4 | 0,21 | 0,071–0,628 | 0,005 | 0,33 | 0,105–1,087 | 0,06 |
| IMRT | 18 | |||||||
| Estágio TNM | II | 3 | 1,20 | 0,670–2,278 | 0,69 | |||
| III | 9 | |||||||
| IVA | 10 | |||||||
| Quimioterapia | Semanal | 19 | 0,38 | 0,113–1,325 | 0,13 | |||
| A cada 3 semanas | 3 | |||||||
| Dose cumulativa | ≥200mg/m2 | 9 | 0,29 | 0,125–0,686 | 0,003 | 0,36 | 0,146–0,912 | 0,03 |
| <200mg/m2 | 13 | |||||||
3D‐RT, radioterapia tridimensional; IMRT, radioterapia com modulação de intensidade; TNM, categorias T e N de acordo com o sistema de estadiamento da 8ª edição do American Joint Commission on Cancer.
Neste estudo, todos os pacientes apresentavam tipo histopatológico de tumor indiferenciado não queratinizado, o qual é altamente responsivo ao tratamento. Ambos os grupos de tratamento com cisplatina semanal e a cada 3 semanas foram comparáveis em termos de sexo, categoria T, categoria N e técnica de RT.
Em nosso centro, observamos que o esquema semanal de cisplatina tende a ser mais frequentemente aplicado em pacientes idosos e em pacientes com comorbidades. Os esquemas semanais podem ter sido preferidos pelos médicos a fim de evitar os efeitos adversos da cisplatina em pacientes com menor desempenho clínico, comorbidades e pacientes mais velhos. Várias doses de cisplatina, como 20–40mg/m2, foram relatadas na literatura.10,23–26 Os estudos prospectivos NPC‐9901 e NPC‐9902 mostraram que pelo menos 2 ciclos de esquema a cada 3 semanas de administração de cisplatina proporcionam melhoria na sobrevida livre de recidiva local e SG em comparação com a administração de ciclo único.27 Além disso, foi relatado que mais de 5 aplicações de cisplatina foi um fator prognóstico independente em aplicações concomitantes de quimiorradioterapia (radioterapia conformada 2D ou 3D) com cisplatina semanal (40 mg/m2).28 No presente estudo, administramos uma dose de cisplatina de 50mg para pacientes que recebiam quimioterapia semanal. Dezesseis dos 61 pacientes que receberam cisplatina semanal receberam menos de 5 ciclos de quimioterapia. Uma taxa significativamente alta de recidiva local (26%) foi detectada no grupo de tratamento com cisplatina semanal, o que pode ser devido a uma baixa dose cumulativa de cisplatina.
Em nosso estudo, 37 pacientes no grupo de cisplatina a cada 3 semanas e 45 pacientes no grupo de cisplatina semanal atingiram doses cumulativas de cisplatina ≥ 200mg/m2 (82 de 98 pacientes). A dose cumulativa de cisplatina está associada a resultados de sobrevida em longo prazo em pacientes com CNF tratados com quimiorradioterapia.14,29,30 Os estudos NPC‐9901 e NPC‐9902 declararam que pelo menos dois ciclos de cisplatina (100mg/m2 em cada ciclo) melhoraram a SLRL e a SG em comparação com um ciclo de cisplatina.14 No estudo de Loong et al.,28 eles demonstraram que os pacientes que receberam uma dose de cisplatina ≥ 200mg/m2 tiveram sobrevida mais longa do que os pacientes que receberam uma dose <200mg/m2. Além disso, Ou et al. relataram que uma dose total de cisplatina>300mg/m2 foi um fator prognóstico independente para SG, SLD e SLMD em pacientes com CNF.31 De maneira oposta, no estudo de Peng H. et al.,32 a dose cumulativa de cisplatina> 240 mg/m2 não foi um fator prognóstico independente para SG. O valor de corte da dose cumulativa de cisplatina ainda é controverso.
Nosso estudo também mostrou que os pacientes com dose de cisplatina>200mg/m2 apresentaram sobrevida em longo prazo estatisticamente significante e isso é compatível com a literatura. Além disso, o SLRL em pacientes com dose cumulativa de cisplatina ≥ 200mg/m2 foi próximo de atingir um valor estatisticamente significativo.
Neste estudo retrospectivo, observamos que a quimiorradioterapia concomitante semanal ou a cada 3 semanas com cisplatina demonstrou os mesmos resultados de tratamento em termos de SG, SLMD, SLRL e SLRR em pacientes com CNF. Vários estudos mostraram que não houve diferença entre os esquemas de cisplatina semanais e a cada 3 semanas para SG, SLD e SLMD em pacientes com CNF.29–33 Os resultados do nosso estudo foram compatíveis com a literatura. Verificou‐se que a técnica de RT foi um fator prognóstico em análises univariadas para SLRL. Enquanto doses cumulativas de cisplatina e a técnica de RT mostraram ser fatores prognósticos em análises univariadas para SG, apenas doses cumulativas de cisplatina mostraram ser um fator prognóstico independente para SG na análise multivariada.
Perfil de toxicidade pareceu ser semelhante com ambos os esquemas de tratamento. Não houve diferenças estatisticamente significantes em termos de efeitos adversos, consistiram em toxicidade hematológica, mucosite, dermatite, náuseas e vômitos, exceto pela desnutrição. A mucosite foi o efeito adverso mais comum, como esperado. Desnutrição de grau 3–4 foi observada em 33 dos 37 pacientes no grupo de tratamento com cisplatina a cada 3 semanas. No estudo de Tao CJ et al., mucosite de Grau 3–4 foi mais observada no grupo de tratamento com cisplatina semanal do que no grupo de tratamento com cisplatina a cada 3 semanas.26 No entanto, em nosso estudo, não houve diferença estatisticamente significante para a mucosite entre os grupos. Além disso, nenhum dos pacientes necessitou de nutrição enteral.
As limitações do estudo são o desenho retrospectivo, a expressão da experiência de um único centro, o número insuficiente de pacientes e o curto período de seguimento.
ConclusãoOs esquemas semanais ou a cada 3 semanas de cisplatina em regimes de quimiorradioterapia concomitantes podem ser indicados de acordo com a experiência no centro de tratamento para pacientes com CNF. O esquema semanal de cisplatina tem desfechos de tratamento e efeitos adversos semelhantes durante o tratamento, em comparação com o regime a cada 3 semanas. Se os pacientes atingirem uma dose de cisplatina ≥ 200mg/m2, os esquemas semanais de quimioterapia podem ser usados de forma segura e eficaz. De acordo com os desfechos do nosso estudo, a dose de cisplatina ≥ 200mg/m2 é um fator prognóstico independente em pacientes com CNF em termos de sobrevida global. Mais estudos prospectivos são necessários para confirmar os resultados do presente estudo.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Gundog M, Basaran H, Bozkurt O, Eroglu C. A comparison of cisplatin cumulative dose and cisplatin schedule in patients treated with concurrent chemo‐radiotherapy in nasopharyngeal carcinoma. Braz J Otorhinolaryngol. 2020;86:676–86.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.