A migrânea vestibular é a causa mais comum de vertigem episódica espontânea em pacientes adultos e a segunda causa mais comum de vertigem em pacientes de todas as idades.
ObjetivoAvaliar a eficácia da aplicação dos tipos de medicamentos orais (propranolol, flunarizina e amitriptilina) e da toxina botulínica tipo A sobre os sintomas vestibulares, intensidade da cefaleia e frequência das crises em pacientes com migrânea vestibular.
MétodoSessenta pacientes com migrânea vestibular foram incluídos. Trinta pacientes receberam tratamento com toxina botulínica tipo A e medicação oral (Grupo B+), enquanto 30 pacientes receberam apenas medicação oral (Grupo B‐). A intensidade da cefaleia foi avaliada pelo migraine disability assessment scale e a gravidade da vertigem foi avaliada com o dizziness handicap inventory. A frequência das crises de migrânea vestibular nos últimos três meses também foi avaliada.
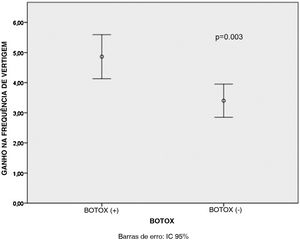
ResultadosHouve um decréscimo estatisticamente significativo na média dos escores do dizziness handicap inventory e migraine disability assesment scale e na frequência das crises de vertigem após o tratamento em todos os pacientes, p <0,001 para todos os pacientes dos grupos B+ e B‐. Os ganhos médios no escore do migraine disability assesment scale (p <0,001) e na frequência das crises de vertigem (p=0,003) foram significantemente maiores nos pacientes B+ do que nos pacientes B‐.
ConclusõesOs pacientes de ambos os grupos B+ e B‐ exibiram melhoria significativa na frequência das crises de migrânea vestibular e nos valores dos escores do dizziness handicap inventory e do migraine disability assesment scale. No entanto, a aplicação da toxina botulínica tipo A teve um efeito mais pronunciado para os valores de ganho no escore do migraine disability assesment scale e na frequência das crises de migrânea vestibular, mas não para os valores de ganho no escore do dizziness handicap inventory. Portanto, a aplicação de toxina botulínica tipo A deve ser considerada para pacientes com migrânea vestibular, cujos graus de intensidade da cefaleia são mais marcantes. O tipo de medicação oral (propranolol, flunarizina ou amitriptilina) não diferiu em relação à frequência das crises de migrânea vestibular e aos valores de ganho dos escores do dizziness handicap inventory e do migraine disability assesment scale.
A migrânea vestibular (MV) é a causa mais comum de vertigem episódica espontânea em pacientes adultos e a segunda causa mais comum de vertigem em pacientes de todas as idades.1–3 Os pacientes com MV geralmente dão entrada em clínicas de tratamento para vertigem com queixas de tontura e vertigem, porém não há sintomas ou achados diagnósticos confirmatórios. Portanto, esses pacientes são frequentemente subdiagnosticados. A tontura e a vertigem episódica podem ocorrer espontaneamente ou por movimentos da cabeça, mudanças de posição ou estímulos visuais. Essas crises geralmente podem ser estimuladas por estresse, distúrbios do sono, desidratação, menstruação ou certos alimentos.4 A cefaleia occipital ou hemicraniana comumente acompanha a vertigem.5 A MV tem uma alta incidência de situações incapacitantes, o que diminui a qualidade de vida e a força de trabalho. Portanto, a MV requer diagnósticos precisos e opções de tratamento eficazes.6 Neuhauser et al., propuseram critérios diagnósticos para MV definitiva e provável.7 Onze anos depois, esses critérios foram revisados pela Barany Society e pela International Headache Society em uma declaração de consenso.8 O diagnóstico é feito de acordo com a descrição clínica das queixas e dos sintomas relatados pelos pacientes. Além disso, outras potenciais causas secundárias devem ser excluídas por meio de investigação apropriada. As causas subjacentes da fisiopatologia da MV não são totalmente compreendidas. As atuais hipóteses propostas são as mesmas da migrânea. Relatou‐se que as conexões recíprocas entre os núcleos vestibulares do tronco cerebral e as estruturas que modulam as entradas nociceptivas do trigêmeo podem estar envolvidas na patogênese da MV.6 Serotonina, noradrenalina, dopamina etc. podem estar envolvidos na patogênese da MV. Durante o tratamento de pacientes com MV, esses neurotransmissores podem ser considerados como opções.9 Por não haver protocolos de tratamento padronizados baseados em evidências, a reabilitação vestibular foi usada como tratamento profilático e complementar. Atualmente, vários agentes farmacológicos antienxaqueca são comumente adaptados e usados no tratamento da MV. Esses agentes são os betabloqueadores (tais como, propranolol, bisoprolol, metoprolol), os bloqueadores do canal de cálcio (como, verapamil, amlodipina, flunarizina, cinarizina), as drogas antiepilépticas (como, ácido valproico, lamotrigina) e os antidepressivos tricíclicos (como a amitriptilina).6 Infelizmente, a eficácia desses agentes é insatisfatória. Recentemente, relatou‐se que apenas a toxina botulínica tipo A (TBA) e o topiramato demonstraram eficácia na migrânea crônica.10 Neste estudo, comparamos a eficácia de propranolol, amitriptilina, flunarizina e injeção de TBA na profilaxia da MV em relação aos sintomas vertiginosos e queixas de cefaleia.
MétodoDesenho do estudoEste ensaio clínico ambulatorial, aberto, prospectivo, não randomizado e controlado com grupos paralelos foi conduzido em nosso departamento de otorrinolaringologia. Entre janeiro de 2020 e setembro de 2020, 60 dos 74 pacientes foram inscritos. A aprovação do comitê de ética local (número de aprovação: 2020/386) e as assinaturas de todos os pacientes em termos de consentimento livre e esclarecido foram obtidas antes do início do estudo.
SujeitosTodos os pacientes adultos enquadrados nos critérios de MV, de acordo com a definição da Barany Society e da International Headache Society, foram inscritos no estudo.11 Após os exames neurológico e otoneurológico, foram feitos exames de ressonância magnética (RM) de ossos temporais, avaliação audiométrica, videonistagmografia, prova de agitação cefálica de alta frequência, teste de impulso cefálico por vídeo e prova calórica bitérmica para exclusão de outros distúrbios vestibulares ou neurológicos. Todos os pacientes fora dos critérios de inclusão foram excluídos antes da randomização.
Critérios de exclusão- 1.
Pacientes com história conhecida de reações alérgicas ao propranolol, flunarizina, amitriptilina ou toxina botulínica.
- 2.
Pacientes que não apresentavam migrânea típica.
- 3.
Pacientes do sexo feminino que estavam grávidas, planejavam engravidar ou amamentar.
- 4.
Pacientes com doença ou condição médica significativa, como câncer, insuficiência hepática ou renal.
- 5.
Pacientes com determinadas condições clínicas que poderiam interferir nas ações de propranolol, bloqueadores dos canais de cálcio, antidepressivo tricíclico ou TBA.
Após o diagnóstico inicial de MV, perguntou‐se a todos os pacientes se aceitavam tomar a injeção de TBA (Botox, 100 unidades/frasco, Allergan, Reino Unido), além da terapia medicamentosa oral com um dos tipos de medicamentos orais (propranolol, amitriptilina ou flunarizina). Os pacientes que aceitaram a injeção de TBA foram incluídos no Grupo B+ e os pacientes que recusaram o tratamento com TBA foram incluídos no grupo B‐. Esses dois grupos foram novamente divididos em três subgrupos de acordo com a prescrição de um dos três medicamentos (propranolol, flunarizina ou amitriptilina) de acordo com seus sintomas e condições clínicas. Os pacientes dos dois grupos (Grupo B+ e Grupo B‐) receberam propranolol (Grupo B+P e Grupo B‐P), flunarizina (Grupo B+F e Grupo B‐F) e amitriptilina (Grupo B+A e Grupo B‐A). Os pacientes que apresentavam sintomas depressivos e de distúrbios do sono receberam prescrição de amitriptilina. Propranolol foi administrado aos pacientes com palpitações e frequência do pulso acima de 80‐hora. Flunarizina foi administrada aos pacientes jovens e magros. No total, 155 unidades de TBA foram injetadas com agulha de calibre 30×8mm no grupo de músculos frontal, corrugador, prócero, occipital, temporal, trapézio e paraespinhal no grupo B+.12,13 Os pacientes dos grupos B+P e B‐P receberam propranolol em uma dose flexível de 20mg a 80mg, a dosagem crescente iniciou em 20mg por via oral pela manhã e 20mg à noite durante uma semana, seguida de 40mg pela manhã e 40mg à noite durante três meses. Dessa forma, a dose total foi de até 80mg/dia. Nos pacientes dos grupos B+F e B‐F, a flunarizina foi iniciada com 5mg à noite durante uma semana, seguida de 10mg à noite durante três meses. Dessa forma, a dose total foi de até 10mg/dia. Os pacientes dos grupos B+A e B‐A receberam amitriptilina 25–75mg à noite por três meses. A mesma modificação da dieta e restrição alimentar foi sugerida a todos os pacientes. Mudança de hábitos cotidianos, restrição de alguns alimentos (cafeína, álcool), regulação do padrão de sono, atividade física (caminhada de 50min/dia) e reabilitação vestibular (RV) (girar a cabeça de 30 a 180 graus com os olhos abertos) foram sugeridas a todos os pacientes do grupo de estudo.
AvaliaçãoO desfecho primário foi comparar a eficácia de TBA, propranolol, flunarizina e amitriptilina na redução dos sintomas vestibulares e no alívio da cefaleia em pacientes com MV. O inventário das deficiências devido à tontura (dizziness handicap inventory – DHI) e o número de crises vertiginosas no início e no terceiro mês de tratamento foram usados para avaliar os efeitos do tratamento sobre os sintomas vestibulares.14 Como mencionado, os escores do DHI foram escalonados entre 0–100 pontos para cada paciente antes e três meses depois do tratamento. As subescalas do inventário, inclusive as subescalas funcionais, emocionais e físicas, também foram registradas para cada paciente.14 O número de crises vestibulares foi avaliado de acordo com o número de crises vertiginosas três meses antes e três depois do tratamento. Os critérios diagnósticos definidos pela declaração de consenso da Barany Society e da International Headache Society foram usados para o diagnóstico provável de MV.8 Assim, os sintomas vestibulares, como vertigem espontânea, posicional, induzida pela visão e induzida pelo movimento da cabeça, foram avaliados no primeiro, segundo e terceiro meses. O desfecho secundário foi avaliar o efeito do tratamento sobre a cefaleia. O questionário MIDAS (do inglês migraine disability assesment scale) foi usado para quantificar a intensidade da cefaleia antes e três meses depois do tratamento.15 Além disso, para comparar os efeitos da injeção de toxina botulínica e do tipo de medicação oral sobre as queixas de MV, os ganhos nos escores MIDAS e DHI e na frequência de vertigem também foram medidos, subtraindo‐se os valores pós‐tratamento dos valores iniciais.
AcompanhamentoApós o início dos tratamentos, todos os pacientes foram convidados a retornar à clínica quinzenalmente para uma consulta de avaliação dos efeitos adversos e para a certificação de que os pacientes haviam aderido à dosagem do medicamento. Todos os pacientes foram orientados a registrar quaisquer crises de vertigem, dor de cabeça e o número de crises de vertigem experimentado durante o tratamento. Além disso, efeitos adversos e motivos para exclusão, como recusa em participar e intolerância ao tratamento, foram registrados durante as consultas dos pacientes.
Análise estatísticaA análise estatística foi feita com o programa SPSS versão 24.0 (IBM SPSS, New York, USA, 2016). Os dados foram expressos em média ± desvio‐padrão para as variáveis contínuas e em número de casos para as variáveis categóricas. Os dados foram controlados para distribuição normal com o teste de Shapiro‐Wilk. O teste do qui‐quadrado foi usado para comparar as diferenças de gênero e número de pacientes, de acordo com os tipos de medicamentos orais entre os pacientes dos grupos B+ e B‐. O teste t de amostra pareada foi usado para comparar os escores médios do MIDAS, do DHI e da frequência de crises de vertigem antes e depois do tratamento. Além disso, o teste U de Mann‐Whitney foi usado para comparar a média de idade e o ganho no escore MIDAS, o ganho no escore DHI e o ganho nos valores da frequência de crises de vertigem entre os pacientes dos grupos B+ e B‐. O teste Anova de variância simples foi usado para comparar os ganhos médios no escore MIDAS, no escore DHI e nos valores da frequência de crises de vertigem entre os tipos de medicamentos orais. A regressão linear multivariada foi feita para avaliar o efeito relativo das variáveis independentes (estado de aplicação do Botox e tipo de medicamento oral) sobre os ganhos no escore MIDAS, no escore DHI e nos valores da frequência de crises de vertigem. O coeficiente de correlação foi usado para avaliar a correlação entre os valores do ganho no escore MIDAS e os valores do ganho no escore DHI. O valor de p <0,05 foi considerado estatisticamente significante.
ResultadosQuatorze pacientes foram excluídos do estudo porque não compareceram às consultas de controle ou exibiram efeitos colaterais (pulso decrescente ˂ 50min, hipotensão, sensação de fadiga ou sonolência diurna). Quatro pacientes não compareceram às consultas de controle, seis não toleraram o propranolol, três não toleraram a flunarizina e um interrompeu o tratamento com amitriptilina. Havia 60 pacientes no grupo de estudo. A média de idade foi de 45,86±15,25 (min=18, max=75). Quarenta e oito pacientes (80%) eram do sexo feminino e 12 (20%) do masculino. Trinta pacientes (50%) receberam tratamento com TBA adicional à terapia medicamentosa oral, os outros 30 receberam apenas tratamento medicamentoso oral. Vinte e cinco pacientes (83,3%) do grupo B+ e 23 (76,6%) do grupo B‐ eram do sexo feminino. A média das idades dos pacientes era de 42,33±13,21 no Grupo B+ e de 48,8±16,29 no Grupo B‐. Dez pacientes (33,3%), tanto do Grupo B+ quanto do Grupo B‐, receberam tratamento com amitriptilina. O número de pacientes que recebei tratamento com propranolol foi 11 (36,6%) no grupo B+ e nove (30%) no grupo B‐. O número de pacientes que recebeu tratamento com flunarizina foi nove (30%) no grupo B+ e 11 (36,6%) no grupo B‐. Não houve diferença estatisticamente significativa entre os pacientes dos grupos B+ e B‐ em relação ao sexo (p=0,519), média de idade (p=0,081) e tipo de medicação oral (p=0,819).
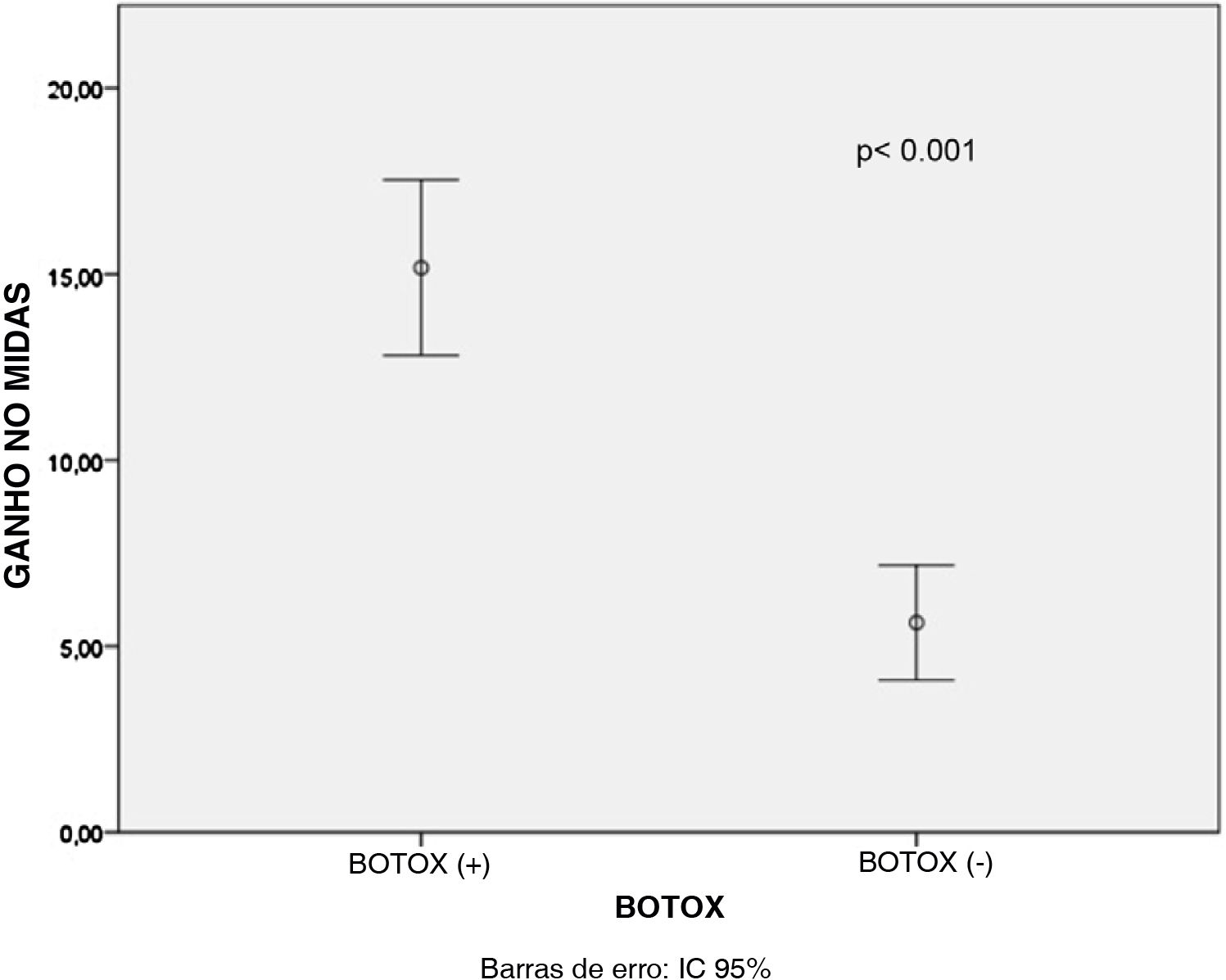
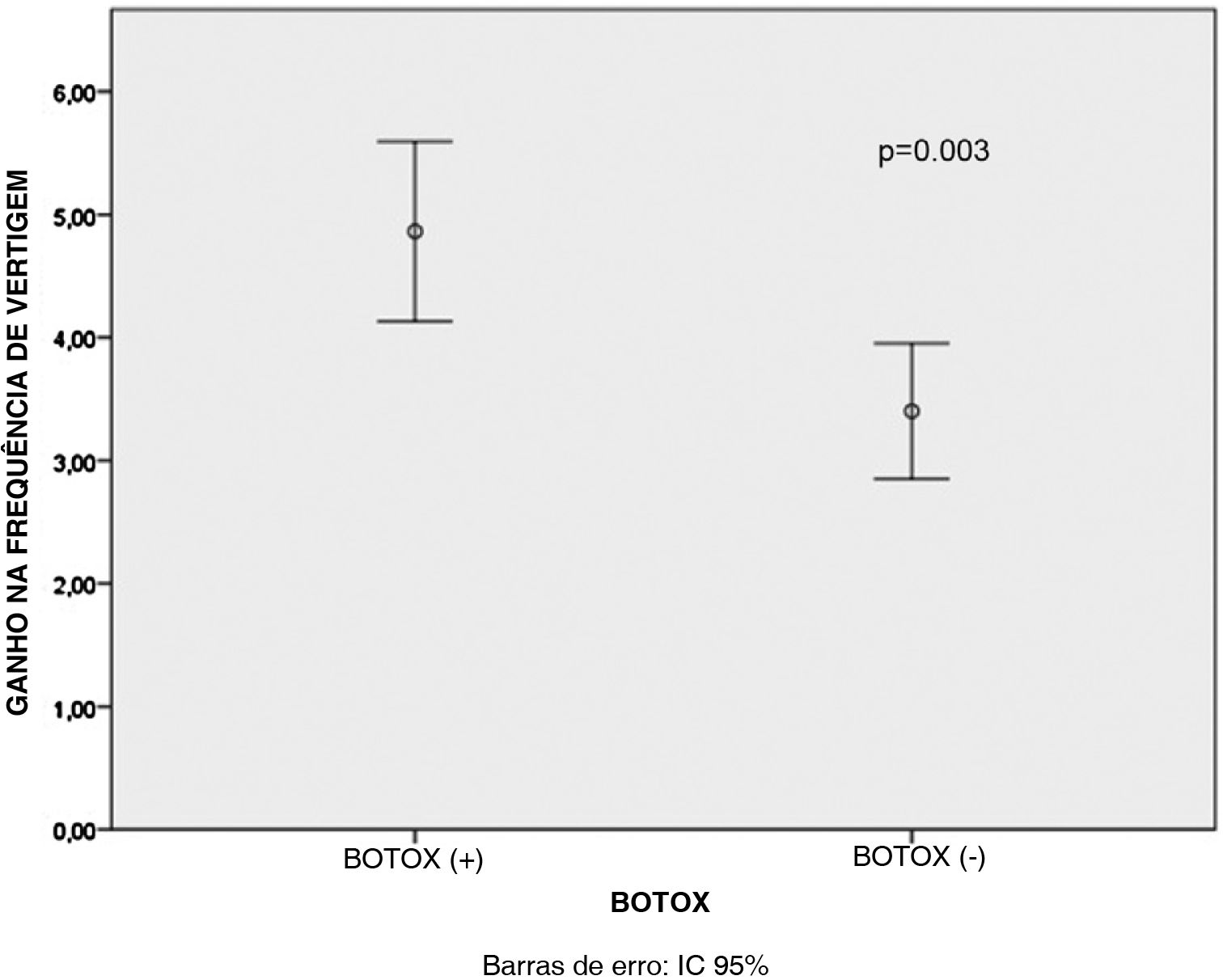
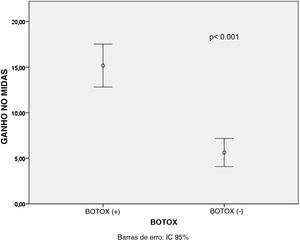
Houve um decréscimo estatisticamente significante nos escores médios de DHI, MIDAS e de frequência das crises de vertigem após o tratamento para todos os pacientes dos grupos B+ e B‐ (p <0,001 para todos), conforme mostrado na tabela 1. Além disso, os ganhos médios no escore MIDAS (p <0,001) e nos valores da frequência de crises de vertigem (p=0,003) foram significativamente maiores nos pacientes do Grupo B+ do que nos pacientes do Grupo B‐ (figs. 1 e 2). Porém, não houve diferença significativa entre os pacientes dos grupos B+ (40,9±16,4) e B‐ (37,7±18,1) em relação à média dos valores do ganho no escore DHI (p=0,466).
Comparação dos escores DHI, escores MIDAS e valores da frequência de vertigem nos pacientes antes e depois do tratamento
| Escore total DHI | Pré‐tratamento (Média±DP) | Pós‐tratamento (Média±DP) | p‐valor |
|---|---|---|---|
| Todos os pacientes | 60,8±20,3 | 21,6±13 | <0,001a |
| Pacientes B+ | 63,6±18,3 | 22,7±15,6 | <0,001a |
| Pacientes B‐ | 58,2±22 | 20,5±10,2 | <0,001a |
| Escore DHI‐P | |||
| Todos os pacientes | 17,7±6,9 | 4,9±4,1 | <0,001a |
| Pacientes B+ | 19,1±6,4 | 6,1±5 | <0,001a |
| Pacientes B‐ | 16,3±7,2 | 3,7±2,6 | <0,001a |
| DHI‐E score | |||
| Todos os pacientes | 19,2±9,1 | 9,9±6,2 | <0,001a |
| Pacientes B+ | 18,1±9,4 | 8,9±6,32 | <0,001a |
| Pacientes B‐ | 20,3±8,9 | 10,9±6,2 | <0,001a |
| Escore DHI‐F | |||
| Todos os pacientes | 24±8,8 | 6,9±5,2 | <0,001a |
| Pacientes B+ | 26,3±7,6 | 7,8±6,5 | <0,001a |
| Pacientes B‐ | 21,7±9,4 | 6±3,6 | <0,001a |
| Escore MIDAS | |||
| Todos os pacientes | 15,7±7,3 | 5,4±4,3 | <0,001*a |
| Pacientes B+ | 18,8±6,9 | 3,6±3,5 | <0,001a |
| Pacientes B‐ | 12,8±6,5 | 7,1±4,4 | <0,001a |
| Frequência de vertigem | |||
| Todos os pacientes | 5,4±1,7 | 1,3±1 | <0,001a |
| Pacientes B+ | 6±2 | 1,1±1 | <0,001a |
| Pacientes B‐ | 4,9±1,3 | 1,5±1 | <0,001a |
DH, Dizziness handicap inventory (inventário das deficiências devido à tontura); B+, Pacientes com aplicação de toxina botulínica; B‐, Pacientes sem aplicação de toxina botulínica; P, Físico; E, Emocional; F, Funcional; MIDAS, Migraine disability assessment (questionário de avaliação da incapacidade devido à migrânea).
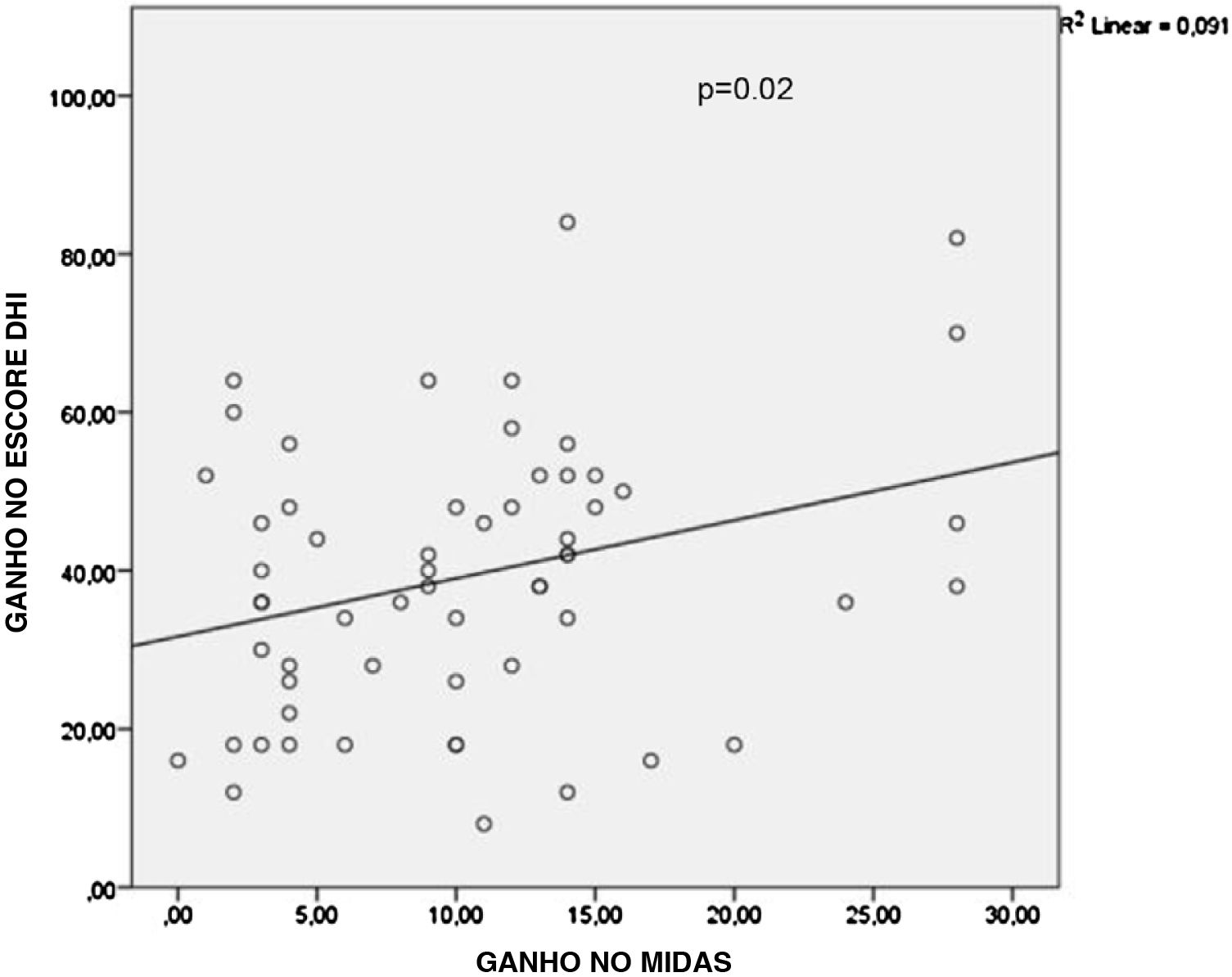
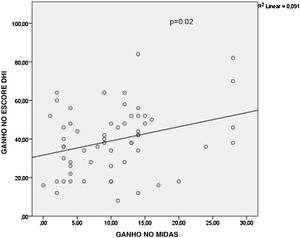
Observou‐se que não houve diferença estatisticamente significativa entre os tipos de medicamentos orais em relação ao ganho médio nos escores MIDAS (p=0,667), DHI (p=0,4) e nos valores da frequência de vertigem (p=0,388), conforme mostrado na tabela 2. Quando os resultados da regressão linear multivariada foram analisados posteriormente, a aplicação de TBA teve efeito estatisticamente significante sobre o ganho médio no escore MIDAS (p <0,001) e na frequência de vertigem (p=0,003) comparado ao tipo de medicação oral, conforme mostrado nas tabelas 3 e 4. No entanto, o estado de aplicação da TBA (p=0,488) ou o tipo de medicamento oral (p=0,383) não tiveram efeitos significantes sobre os valores do ganho no escore DHI, conforme mostrado na tabela 5. A análise de correlação de Pearson demonstrou que houve uma correlação significante entre os valores do ganho no escore MIDAS e no escore DHI (r=0,302, p=0,02) (fig. 3).
Comparação do ganho no escore MIDAS, ganho no escore DHI e ganho nos valores da frequência de vertigem entre os tipos de medicamentos orais
| Tipo de medicação | Ganho médio no escore MIDAS | p‐valor |
|---|---|---|
| Amitriptilina | 9,15±6,5 | 0,667 |
| Propranolol | 10,9±6,7 | |
| Flunarizina | 11±8,2 |
| Tipo de medicação | Ganho médio no escore DHI | p‐valor |
|---|---|---|
| Amitriptilina | 43,3±16,8 | 0,4 |
| Propranolol | 36±16 | |
| Flunarizina | 38,4±18,9 |
| Tipo de medicação | Ganho médio na frequência de vertigem | p‐valor |
|---|---|---|
| Amitriptilina | 4,1±2 | 0,388 |
| Propranolol | 4,6±1,7 | |
| Flunarizina | 3,7±1,9 |
MIDAS, Migraine diasability assessment (questionário de avaliação da incapacidade devido à migrânea); DHI, Dizziness handicap inventory (inventário das deficiências devido à tontura).
Resultados da regressão linear multivariada para o efeito das variáveis independentes sobre os valores do ganho no escore MIDAS
| Variável independente | β | Erro padrão | Significância |
|---|---|---|---|
| Estado da aplicação de toxina botulínica (aplicada vs. não aplicada) | 9,57 | 1,36 | <0,001a |
| Tipo de medicamento oral (amitriptilina vs. propranolol vs. flunarizina) | 1,057 | 0,837 | 0,212 |
| Constante | 3,52 | 1,92 | 0,073 |
Resultados da regressão linear multivariada para o efeito das variáveis independentes sobre os valores do ganho na frequência de vertigem
| Variável independente | β | Erro padrão | Significância |
|---|---|---|---|
| Estado da aplicação de toxina botulínica (aplicada vs. não aplicada) | 1,458 | 0,448 | 0,002a |
| Tipo de medicamento oral (amitriptilina vs. propranolol vs. flunarizina) | ‐0,132 | 0,276 | 0,634 |
| Constante | 3,664 | 0,635 | <0,001 |
B, Coeficiente beta.
Resultados da regressão linear multivariada para o efeito das variáveis independentes sobre os valores do ganho no escore DHI
| Variável independente | β | Erro padrão | Significância |
|---|---|---|---|
| Estado da aplicação de toxina botulínica (aplicada vs. não aplicada) | 3.146 | 4.51 | 0.488 |
| Tipo de medicamento oral (amitriptilina vs. propranolol vs. flunarizina) | ‐2.441 | 2.774 | 0.383 |
| Constante | 42.548 | 6.387 | <0.001 |
B, Coeficiente beta; DHI, Dizziness handicap inventory (inventário das deficiências devido à tontura).
A correlação entre os valores de ganho nos escores MIDAS e DHI foi demonstrada para os pacientes com migrânea vestibular. MIDAS, Migraine disasability assessment (questionário de avaliação da incapacidade devido à migrânea); DHI, Dizziness handicap inventory (inventário das deficiências devido à tontura).
Durante o tratamento dos 60 pacientes, vários efeitos colaterais foram relatados. Os efeitos colaterais mais comumente observados foram diminuição da pressão arterial e da frequência cardíaca em 12 de 20 pacientes. Além disso, houve relato de diminuição da libido e impotência sexual por dois pacientes do sexo masculino durante o tratamento com propranolol. Os efeitos colaterais mais comumente relatados para a flunarizina foram sonolência e ganho de peso por nove de 20 pacientes. Sonolência diurna foi relatada por cinco de 20 pacientes. Nenhum paciente exibiu efeitos colaterais importantes, como fraqueza muscular ou reações cutâneas em relação à aplicação de TBA. Seis pacientes (20%) sentiram dor leve no local da injeção de TBA no dia da aplicação.
DiscussãoNeste estudo, observamos que a aplicação de TBA obteve um ganho significativo para a intensidade da cefaleia no escore MIDAS e para os valores na frequência de crises nos pacientes com MV. Por outro lado, a aplicação de TBA não diminuiu significantemente a gravidade das crises de vertigem no escore DHI nesses pacientes. Além disso, o tipo de medicação oral (amitriptilina, propranolol, flunarizina) não diferiu quanto aos ganhos no escore MIDAS, no escore DHI e nos valores da frequência de crises. Os resultados da análise multivariada demonstraram que a aplicação de TBA foi o principal determinante do ganho no escore MIDAS e nos valores da frequência de crises, em vez do tipo de medicação oral para os pacientes com MV. Houve uma correlação significante entre os valores dos ganhos nos escores MIDAS e DHI.
Os principais sintomas dos pacientes com MV são vertigem episódica, cefaleia e desequilíbrio. Esses sintomas podem ocorrer de forma isolada ou concomitante durante as crises, e muitos pacientes não sabem que as dores de cabeça se originam da MV.3,16
Várias opções de tratamento diferentes foram escolhidas aleatoriamente para a profilaxia da MV pela maioria dos estudos.4,17–19 Várias pesquisas investigaram a eficácia dos betabloqueadores e dos antidepressivos na profilaxia da MV. A eficácia geral do propranolol foi relatada entre 72% e 100%.17–20 Salviz et al. relataram que tanto o propranolol quanto a venlafaxina fornecem benefícios clinicamente relevantes para pacientes com MV. Além disso, os autores descobriram que a venlafaxina é mais eficaz do que o propranolol para pacientes com MV e sintomas depressivos graves.4 Salmito et al. relataram que amitriptilina, flunarizina, propranolol e topiramato melhoraram os sintomas dos pacientes com MV e não houve diferença significante entre esses medicamentos na profilaxia da MV quanto aos efeitos de melhora dos sintomas.17 Os sintomas da MV, conforme o curso de sua natureza, diminuem ou aumentam espontaneamente durante o período de tratamento; portanto, a avaliação da resposta terapêutica ao tratamento pode ser difícil no curto prazo. Para conferir melhor confiabilidade da resposta terapêutica, um período de acompanhamento mais longo pode ser necessário. Logo, uma maior duração do tratamento e do acompanhamento pode aumentar os efeitos adversos do tratamento. Portanto, comparamos os escores de sintomas dos pacientes por três meses antes de iniciar o tratamento e por três meses após o tratamento.
Efeitos colaterais graves podem ser observados durante a administração de medicamentos escolhidos aleatoriamente a pacientes com comorbidades. Em nossa experiência clínica, pensamos que os medicamentos não podem ser escolhidos aleatoriamente, mas devem ser escolhidos de acordo com as condições médicas dos pacientes, presença de comorbidades e sintomas. Dominguez‐Duran et al. prescreveram de forma não aleatória um dos seguintes medicamentos: acetazolamida, amitriptilina, flunarizina, propranolol ou topiramato e verificaram o mesmo efeito desses medicamentos na redução dos sintomas e das crises. Eles também sugeriram que os medicamentos para o tratamento profilático da MV podem ser escolhidos de acordo com as comorbidades dos pacientes.21
A TBA é outra opção terapêutica eficaz para o tratamento da migrânea crônica.22–24 A TBA também foi aprovada pela Agência Europeia de Medicamentos e pela Food and Drug Administration dos EUA para a profilaxia da migrânea crônica. Recentemente, as indicações e a dosagem do uso da toxina botulínica na migrânea crônica também foram enfatizadas pelas diretrizes da European Headache Federation.25 Dodick et al. relataram que apenas a TBA e o topiramato demonstraram eficácia na migrânea crônica.10 Neste estudo, também observamos que a TBA teve um efeito razoável na melhoria dos sintomas da MV, mas esse efeito é mais acentuado nos escores de cefaleia do que nos escores de gravidade da vertigem.
Para aumentar a tolerabilidade e diminuir os efeitos adversos dos medicamentos (amitriptilina, propranolol e flunarizina), o tratamento foi iniciado com doses mais baixas que foram gradualmente aumentadas. No entanto, dez pacientes não toleraram os medicamentos e foram excluídos do estudo. Os efeitos colaterais leves dos medicamentos durante o tratamento foram bem tolerados pelos pacientes e esses efeitos colaterais diminuíram uma semana após o início do tratamento. Melhoria mais acentuada do sintoma dor de cabeça foi observada com a aplicação de TBA neste estudo.
A fisiopatologia da MV não é bem estabelecida. Observações de pacientes durante o período interictal sugeriram que se tratava de um distúrbio vestibular central, mas razões vestibulares periféricas não podem ser excluídas.26 O mecanismo da aura da migrânea e dos sintomas cerebelares pode ser explicado pela teoria da depressão alastrante cortical.27 Alguns autores acreditam que a interrupção das entradas aferentes vestibulares, visuais, proprioceptivas e somatossensoriais seja originária da disfunção da rede tálamo‐cortical.28 Outros, que a tontura não relacionada às dores de cabeça ocorre a partir da liberação de neuropeptídeos (substância P, neurocinina A e peptídeo relacionado ao gene da calcitonina).29 A liberação assimétrica de neuropeptídeos resultaria em vertigem e aumento da sensibilidade ao movimento.30
A maioria dos pacientes com MV apresenta incompatibilidade vestíbulo‐visual, portanto a reabilitação vestibular (RV) é uma opção terapêutica não medicamentosa eficaz no tratamento da tontura e disfunção do equilíbrio e baseia‐se em mecanismos centrais de neuroplasticidade. A reabilitação vestibular facilita a compensação vestibular por adaptação, habituação e substituição.31,32 A despeito do controle da vertigem com medicação profilática, a RV pode ser indicada para resolver o desequilíbrio persistente.3 Portanto, alguns pacientes com sintomas persistentes podem se beneficiar da RV. Supressores vestibulares não são sugeridos devido à preocupação de que afetem a taxa de compensação central.33 Mudança de hábitos, restrição de alguns alimentos, regulação do padrão de sono, atividade física e RV foram recomendadas a todos os nossos pacientes. Portanto, a eficácia dessas atividades e restrições não pode ser avaliada devido à falta de um grupo controle apenas para a RV.
ConclusãoA terapia medicamentosa oral única ou a combinação de terapia medicamentosa oral com a aplicação da TBA melhorou os escores do DHI e do MIDAS e diminuiu significantemente as frequências das crises nos pacientes com migrânea vestibular. Além disso, a aplicação de TBA com a terapia de medicamento oral obteve um ganho significante no escore MIDAS e nos valores da frequência de crises, comparado à terapia com um único medicamento oral. No entanto, a aplicação de TBA não teve efeito adicional nos valores do ganho no escore DHI, comparado à terapia medicamentosa oral. Portanto, a aplicação de TBA deve ser considerada para pacientes com MV cujos graus de intensidade da cefaleia são mais marcantes. Os pacientes com MV também devem ser informados de que a aplicação de TBA, além da terapia medicamentosa por via oral, não exibe diminuição significativa da gravidade da vertigem durante as crises de MV, mas diminui a frequência das crises de modo significante, comparado à modalidade de tratamento por via oral com um único medicamento. Não houve diferença no tipo de medicamento oral (propranolol, flunarizina ou amitriptilina) em relação à frequência das crises de MV, ao ganho no escore DHI e ao ganho no escore MIDAS.
FinanciamentoEsta pesquisa não recebeu subsidio específico de agências de fomento nos setores público, comercial ou sem fins lucrativos.
Aprovação éticaEste estudo foi aprovado pelo conselho local de revisão institucional da Mersin University (Data: 27/05/2020; n° 2020/386).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Görür K, Gür H, İsmi O, Özcan C, Vayisoğlu Y. The effectiveness of propranolol, flunarizine, amitriptyline and botulinum toxin in vestibular migraine complaints and prophylaxis: a non‐randomized controlled study. Braz J Otorhinolaryngol. 2022;88:975–81.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.