A função da metaloproteinase da matriz 2 e 9 nas metástases e no desenvolvimento de carcinoma hipofaríngeo ainda não foi esclarecida.
ObjetivosObservar a relação entre a metaloproteinase da matriz 2 e 9 e as metástases e o desenvolvimento de carcinoma hipofaríngeo.
MétodoEste estudo incluiu 42 pacientes com câncer hipofaríngeo. Os níveis de expressão de mRNA e proteína de metaloproteinase da matriz 2 e 9 no carcinoma hipofaríngeo e nos tecidos paracancerígenos foram detectados por reação em cadeia da polimerase com transcrição reversa e Western blot.
ResultadosA detecção por reação em cadeia da polimerase com transcrição reversa mostrou que o mRNA de metaloproteinase da matriz 2 e 9 foi expresso nos tecidos cancerígenos e do pericarcinoma, mas quase não foi expresso em tecidos de controle polipoides. A intensidade da expressão no tecido cancerígeno foi significativamente maior do que no tecido do pericarcinoma (metaloproteinase da matriz 2: t=2,529, p=0,015; metaloproteinase da matriz 9: t=4,781, p=0,001). A expressão do mRNA no tecido cancerígeno aumentou com o aumento do estágio clínico do tumor (metaloproteinase da matriz 2: F=4,003, p=0,026; metaloproteinase da matriz 9: F=5,501, p=0,008). Sua intensidade de expressão foi associada à metástase de linfonodos (estadiamento N) e aumentou com o grau de metástase linfática (metaloproteinase da matriz 2: F=8,965, p=0,005; metaloproteinase da matriz 9: F=5,420, p=0,025). Não houve alteração significativa no estadiamento T do tumor. Com o aumento do estágio patológico do tumor, a expressão do mRNA de metaloproteinase da matriz 2 e 9 foi aumentada (metaloproteinase da matriz 2: F=3,884, p=0,029; metaloproteinase da matriz 9: F=3,783, p=0,032). O nível de expressão proteica da MMP‐2 e MMP‐9 foi o mesmo do que o do mRNA.
ConclusãoA expressão de metaloproteinase da matriz 2 e 9 no carcinoma hipofaríngeo foi significativamente maior do que a do tecido do pericarcinoma e se ampliou com o aumento do estágio clínico. O nível de expressão foi relacionado à metástase linfonodal e ao estágio patológico do tumor. Assim, a metaloproteinase da matriz 2 e 9 pode estar envolvida na ocorrência, no desenvolvimento, na invasão e metástase de carcinoma hipofaríngeo por meio de vários mecanismos.
O tumor de cabeça e pescoço é um dos principais cânceres que colocam em risco a saúde humana, é classificado como o 10° tipo de câncer mais comum no mundo.1 O carcinoma hipofaríngeo é um dos tipos mais comuns de tumores de cabeça e pescoço, permanece como uma doença altamente letal e uma séria ameaça à vida humana. Apesar dos avanços no diagnóstico e tratamento do câncer hipofaríngeo, inclusive cirurgia, radioterapia e quimioterapia, o prognóstico ainda não é o ideal.2,3
Nesse contexto, a invasão e as metástases do câncer hipofaríngeo, como a maioria dos cânceres humanos, contribuem muito para a mortalidade relacionada a essa doença. A invasão tumoral e as metástases são um processo complexo e contínuo que envolve vários estágios e diversas moléculas, especialmente as metaloproteinases de matriz (MMPs).4 As metaloproteinases de matriz (MMPs), que representam a família de proteinases mais relevante associada à tumorigênese, são uma família de endopeptidases dependentes de zinco.5 A degradação da membrana basal e da matriz extracelular (MEC) pelas MMPs facilita a invasão e proliferação de células tumorais no ambiente metastático.6 A membrana basal e a MEC, por um lado, fornecem substratos e nutrição para o crescimento e metástase de tumores; por outro lado, representam grandes bloqueios na prevenção de invasão e metástase de células tumorais.7 Durante a degradação da MEC e da membrana basal, as MMPs são as enzimas mais importantes e desempenham um papel fundamental nesse processo de degradação. A expressão e a ativação das MMPs também estão envolvidas em vários eventos fisiológicos e patológicos, como inflamação, fibrose tecidual, angiogênese, invasão e metástase tumoral. Especificamente, as MMPs degradam seletivamente diferentes componentes da MEC8 e, assim, regulam numerosos eventos biológicos, inclusive crescimento celular, inflamação, invasão e angiogênese, eliminam proteínas da superfície celular, como o receptor de citocinas, moléculas de adesão celular e receptores de uroquinase.5,9,10 Entre todos os membros das MMPs, foi relatado que a MMP‐2 e a MMP‐9 se correlacionam com a metástase tumoral. 11,12
No presente estudo, as expressões de mRNA e das proteínas de MMP‐2 e MMP‐9 foram analisadas no nível do tecido por reação em cadeia da polimerase com transcrição reversa (RT‐PCR, Reverse Transcription Polymerase Chain Reactions) e análise de western blot para investigar a função e o significado clínico da MMP‐2 e MMP‐9 no carcinoma hipofaríngeo e seu envolvimento na patogênese e metástase desse carcinoma.
MétodoPacientes e amostrasO presente estudo incluiu 42 pacientes com média de 59,45± 8,36 anos (variação de 47 a 78) diagnosticados histologicamente com carcinoma hipofaríngeo e 8 pacientes com pólipos de pregas vocais, com média de 55,68±8,27 anos (variação, 48–75), que serviram como controles pareados por idade e gênero. O estadiamento do tumor foi determinado de acordo com o American Joint Committee on Cancer (AJCC) e a classificação Tumor‐Node Metastasis (TNM). Nenhum paciente recebeu quimioterapia, radioterapia ou imunoterapia nos 2 meses anteriores à cirurgia. Foram excluídos pacientes com outras doenças crônicas, como tuberculose, diabetes, doenças autoimunes ou outros tumores malignos. Os tecidos cancerígenos e os pré‐cancerígenos foram identificados por estereoscopia e corte pós‐congelamento rápido. Dois pedaços de tecidos foram coletados e congelados rapidamente para extração de RNA e preparação de proteínas. Da mesma forma, controles normais que apresentaram febre ou infecção viral na última semana, gravidez ou acidente recente também foram excluídos do estudo. O protocolo foi aprovado pelo comitê de ética do Institute of Basic Medicine da Shandong Academy of Medical Sciences e todos os participantes assinaram o termo de consentimento livre e esclarecido. Amostras representativas de tumores e de tecidos de controle normais foram coletadas na cirurgia, congeladas imediatamente em tubos Eppendorf e armazenadas a ‐80°C para evitar a degradação de RNA e proteínas até o corte para análise por RT‐PCR e western blot.
Reagente principalO kit de extração de RNA total foi adquirido da Transgen Biotech Company (Pequim, China). A transcriptase reversa M‐MLV e a polimerase Taq DNA foram adquiridas da Promega Corporation (Madison, WI, EUA). Os primers de PCR para a detecção do mRNA da MMP‐2, MMP‐9 e β‐actina foram projetados com o Oligo Primer Analysis Software, versão 5.0 (NBA, Software and Research Services for Tomorrow's Discoveries, National Biosciences, Plymouth, MN, EUA). Os oligômeros de PCR foram sintetizados por um sintetizador de DNA/RNA (Applied Biosystems) na BioSune Biological Technology Corporation, Xangai, China. As sequências de primers estão listadas na tabela 1. O anticorpo monoclonal de coelho anti‐MMP‐2 e o anticorpo policlonal de coelho anti‐MMP‐9 foram adquiridos na Abcam Company (Cambridge, Inglaterra). O anticorpo policlonal de coelho antiactina foi adquirido da Santa Cruz Biotechnology, Inc. (Santa Cruz, CA, EUA). O IgG de cabra anticoelho marcado com peroxidase de rábano silvestre foi comprado da Beijing Zhongshan Golden Bridge Biotechnology Co., Ltd. (Pequim, China).
Sequência de primers de MMP‐2, MMP‐9 e β‐actina para RT‐PCR
| Gene alvo | Sequência de oligonucleotídeos | Tamanho do produto (pb) |
|---|---|---|
| MMP‐2 | (F) 5’ TTGGCAGTGCAATACCTGAA 3’ | 425 |
| (R)5’ GAGTCCGTCCTTACCGTCAA 3’ | ||
| MMP‐9 | (F) 5’ CATCGTCATCCAGTTTGGTG 3’ | 669 |
| (R) 5’ CAGAAGCCCCACTTCTTGTC 3’ | ||
| β‐actina | (F) 5’GTGGGCGCCCAGGCACCA3’ | 539 |
| (R) 5’CTCCTTAATGTCACGCACGATTT3’ |
MMP, metaloproteinases da matriz; F, primerforward; R, primerreverse.
O método RT‐PCR foi descrito brevemente. O RNA foi extraído dos tecidos com o método de guanidina tiocianato‐fenol‐clorofórmio. A qualidade do rendimento de RNA foi avaliada por eletroforese em gel de agarose a 1,5% em tampão Tris/Borato/EDTA a 0,5 moL. A densidade óptica das amostras de RNA foi medida e as amostras que mostraram uma razão A260/A280 de 1,8±2,0 foram usadas para obter o cDNA. A RT‐PCR foi feita com um kit de RNA PCR (Perkin Elmer, Norwalk, CT, EUA). A intensidade relativa (IR) de cada banda foi determinada de acordo com a seguinte equação: IR=a densidade da soma do gene alvo/a densidade da soma da β actina. Para excluir a possibilidade de contaminação, as reações que continham reagentes de RT‐PCR, inclusive primers de citocina‐PCR sem RNA da amostra, foram usadas como grupos de controle negativo.
Ensaio de western blotA SDS PAGE e o ensaio de immunoblotting (western blot) foram feitos de acordo com as técnicas‐padrão. Resumidamente, os tecidos preparados (100mg) foram lisados a 4μ por 30min em tampão de lise (Beijing Leagene Biotech. Co, Ltd, Beijing, China). Os lisados foram centrifugados a 15.000rpm por 20min a 4μ para remover núcleos e tecidos não lisados. A concentração de proteína foi determinada com a solução para ensaio de proteína Bio Rad (Bio‐Rad Laboratories, Inc., Hercules, CA, EUA) com albumina de soro bovino como padrão.13 As amostras de proteína foram fervidas por 10min e carregadas em um gel de SDS PAGE a 10%, seguido de eletroforese por 2h. As proteínas foram transferidas por eletroforese para uma membrana de nitrocelulose de 0,22μm. A membrana de nitrocelulose foi bloqueada com leite desnatado a 5% à temperatura ambiente por 1h e submetida a immunoblotting com anticorpos monoclonais de coelho anti‐MMP‐2 humano, anticorpos policlonais de coelho anti‐MMP‐9 humano e anticorpos primários de β‐actina. Após a membrana ter sido lavada três vezes em intervalos de 5min em PBS‐T, foi incubada com IgG‐HRP de cabra anticoelho diluída a 1:2000 por 1h em temperatura ambiente. Após a membrana ter sido lavada três vezes a intervalos de 5 minutos em PBS‐T, os immunoblots foram então visualizados com o equipamento LAS4000 Chemiluminescence Imager (Fijifilm, Tóquio, Japão) com o software associado. Para apresentação, os immunoblots foram abertos no PhotoShop CS2 (Adobe Systems, Mountain View, CA, EUA).
Análise estatísticaPara determinar os níveis de MMP‐2 e MMP‐9 no carcinoma hipofaríngeo, a análise dos dados foi feita com o software estatístico SPSS 17.0 (SPSS, Inc., Chicago, IL, EUA). Os dados foram apresentados como média±desvio‐
padrão. O teste t de amostras pareadas foi usado para comparar as diferenças entre os tecidos do carcinoma hipofaríngeo e do pericarcinoma. A análise de variância one‐way foi usada para comparar as diferenças entre os grupos em diferentes estágios clínicos, metástase linfonodal e estágio patológico do tumor. Considerou‐se p <0,05 para indicar diferença estatisticamente significante.
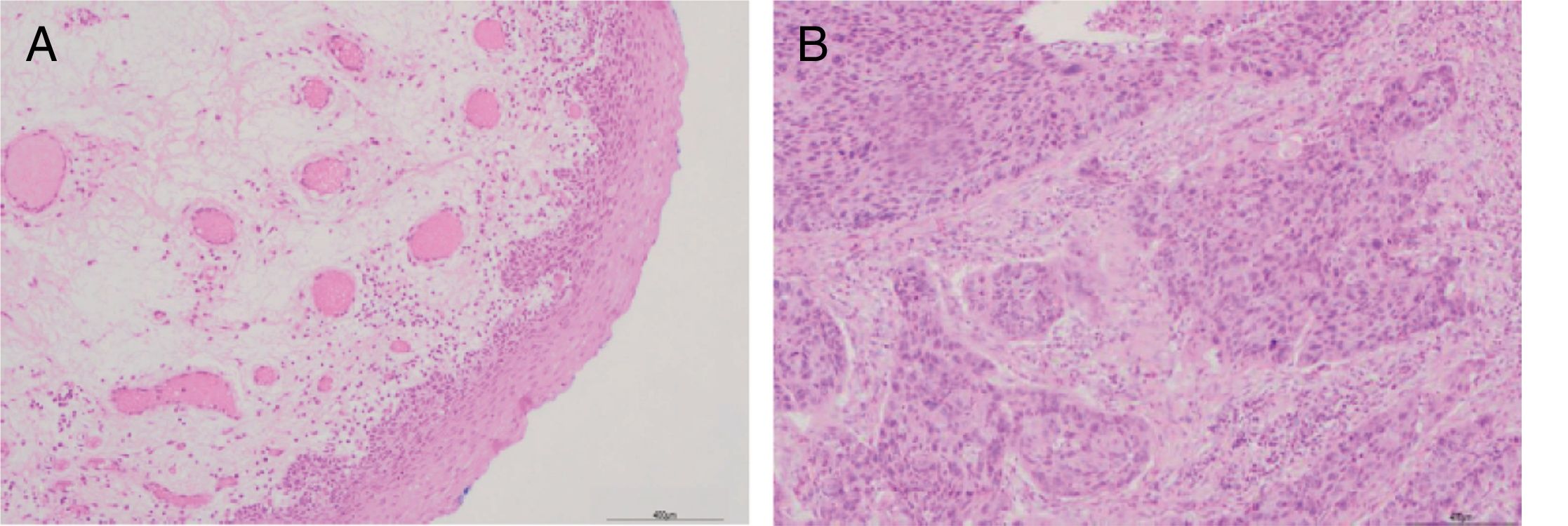
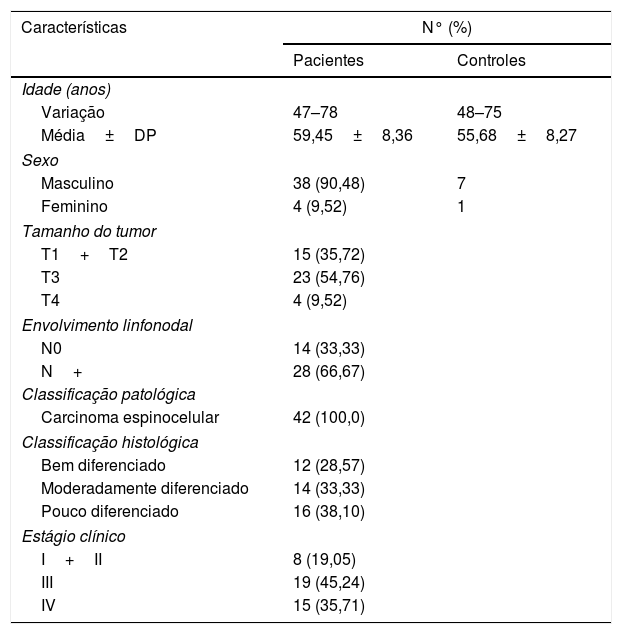
ResultadosCaracterísticas clínico‐patológicas do pacienteA tabela 2 mostra as características descritivas dos indivíduos do estudo, que incluem 42 pacientes com carcinoma hipofaríngeo e média de 59,45±8,36 anos (47 a 78) e 8 pacientes com pólipos de pregas vocais com média de 55,68±8,27 anos (48 a 75). Dos 42 pacientes com carcinoma hipofaríngeo, 38 (90,48%) eram do sexo masculino e apenas 4 (9,52%) do feminino, com razão de homens para mulheres de até 9,5. De acordo com a classificação TNM, a maioria dos pacientes apresentou tumores grandes (T3+T4; 64,28%) e comprometimento linfonodal (N+; 66,67%). A maioria dos pacientes apresentou doença em estágio avançado (estágio III+IV; 80,95%), enquanto 19,05% apresentaram câncer em estágio inicial (estágioI+II). Todos os pacientes foram diagnosticados patologicamente com carcinoma espinocelular (fig. 1). Histologicamente, 71,43% dos pacientes apresentaram tumores pouco ou moderadamente diferenciados.
Características clínico‐patológicas dos sujeitos do estudo
| Características | N° (%) | |
|---|---|---|
| Pacientes | Controles | |
| Idade (anos) | ||
| Variação | 47–78 | 48–75 |
| Média±DP | 59,45±8,36 | 55,68±8,27 |
| Sexo | ||
| Masculino | 38 (90,48) | 7 |
| Feminino | 4 (9,52) | 1 |
| Tamanho do tumor | ||
| T1+T2 | 15 (35,72) | |
| T3 | 23 (54,76) | |
| T4 | 4 (9,52) | |
| Envolvimento linfonodal | ||
| N0 | 14 (33,33) | |
| N+ | 28 (66,67) | |
| Classificação patológica | ||
| Carcinoma espinocelular | 42 (100,0) | |
| Classificação histológica | ||
| Bem diferenciado | 12 (28,57) | |
| Moderadamente diferenciado | 14 (33,33) | |
| Pouco diferenciado | 16 (38,10) | |
| Estágio clínico | ||
| I+II | 8 (19,05) | |
| III | 19 (45,24) | |
| IV | 15 (35,71) | |
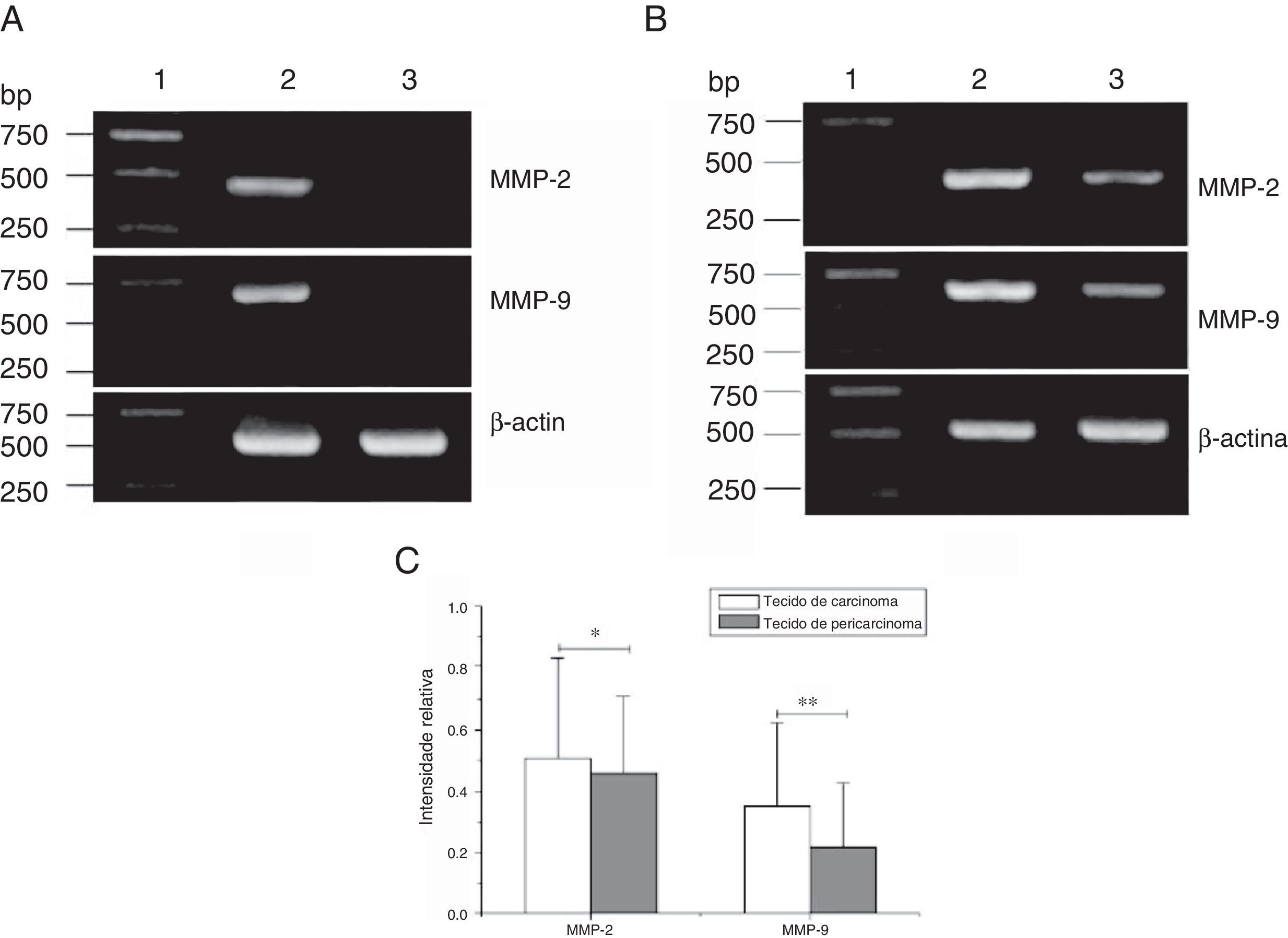
Preparou‐se o RNA total de 84 amostras de tecidos frescos obtidos de pacientes com carcinoma hipofaríngeo e 8 amostras de tecidos das pregas vocais obtidos dos pacientes com pólipos de pregas vocais. Os perfis de expressão de mRNA dos tecidos acima mencionados foram analisados por RT‐PCR. Para excluir a possibilidade de contaminação por transferência, as reações que continham todos os reagentes de RT‐PCR, inclusive os primers de citocina PCR sem RNA da amostra, foram usadas como controles negativos. Nenhuma contaminação foi detectada. Foram analisadas as expressões de mRNA de MMP‐2 e MMP‐9 nos tecidos. A capacidade de expressão (medida como Intensidade Relativa [IR]/proporção de β‐actina) dos pacientes para MMP‐2 e MMP‐9 foi maior nos tecidos do carcinoma hipofaríngeo do que nos tecidos do pericarcinoma. Não houve expressão de mRNA de MMP‐2 e MMP‐9 nos pólipos de tecidos das pregas vocais (fig. 2). Nos 42 pacientes, 37 tecidos cancerígenos (88,1%) e 34 tecidos de pericarcinoma (81,0%) expressaram mRNA de MMP‐2 (IR 0,509±0,319 e 0,353±0,268, respectivamente; t=2,529, p=0,015); e 35 tecidos de cancerígenos (83,3%) e 30 tecidos de pericarcinoma (71,4%) expressaram mRNA de MMP‐9 (IR 0,461±0,249 e 0,218±0,208, respectivamente; t=4,781, p <0,001). Os tecidos cancerígenos exibiram uma expressão de mRNA com nível mais alto de MMP‐2 e MMP‐9 do que os tecidos de pericarcinoma, e essa diferença foi estatisticamente significante.
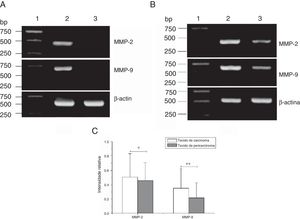
Expressão do mRNA de MMP‐2 e MMP‐9 em tecidos tumorais, tecidos de pericarcinoma e tecidos polipoides de controle obtidos de pacientes com carcinoma hipofaríngeo e pólipo de cordas vocais de pacientes. (A) Expressão representativa de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais e tecidos de controle polipoides. Os tecidos de câncer mostraram uma expressão de mRNA mais intensa de MMP‐2 e MMP‐9, mas quase não houve expressão em tecidos polipoides de controle (faixa 1, 1kb na escada de DNA; faixa 2, tecido de carcinoma; faixa 3, tecido polipoide de controle). (B) Expressão representativa de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais e tecidos de pericarcinoma. Os tecidos cancerígenos mostraram uma expressão de mRNA com nível mais alto de MMP‐2 e MMP‐9 do que os tecidos de pericarcinoma (faixa 1, 1kb na escada de DNA; faixa 2, tecido de carcinoma; faixa 3, tecido de pericarcinoma). (C) Intensidade relativa da expressão de mRNA de MMP‐2 e MMP‐9 em tecidos de carcinoma e de pericarcinoma. Os tecidos de carcinoma exibiram níveis mais altos de expressão de mRNA de MMP‐2 e MMP‐9 do que os tecidos de pericarcinoma. (* p <0,05 e ** p <0,01).
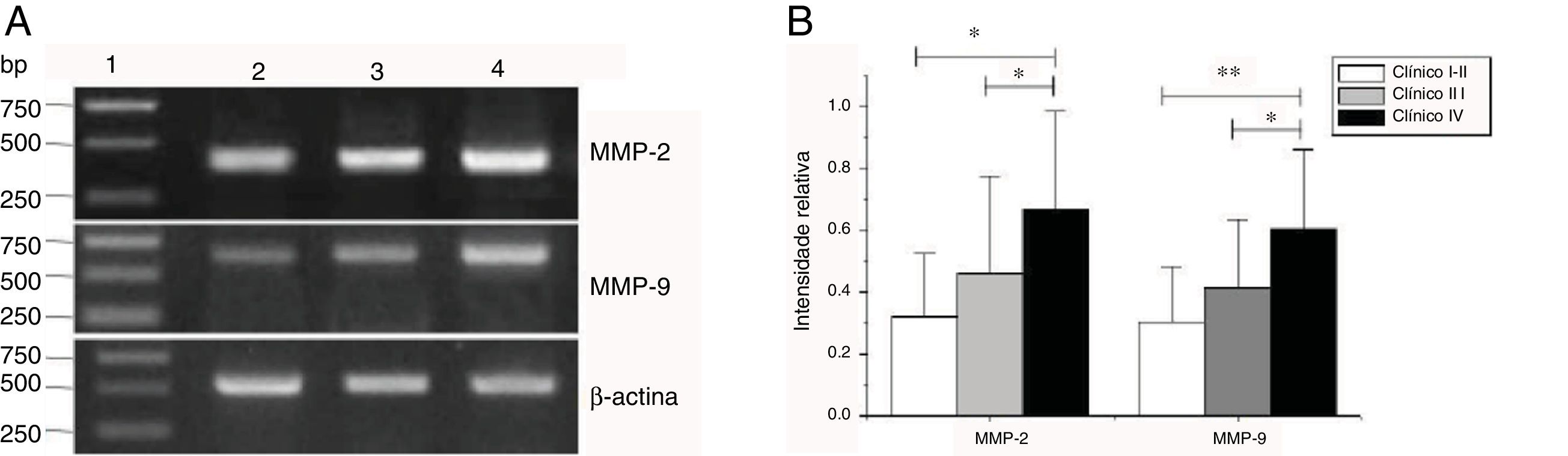
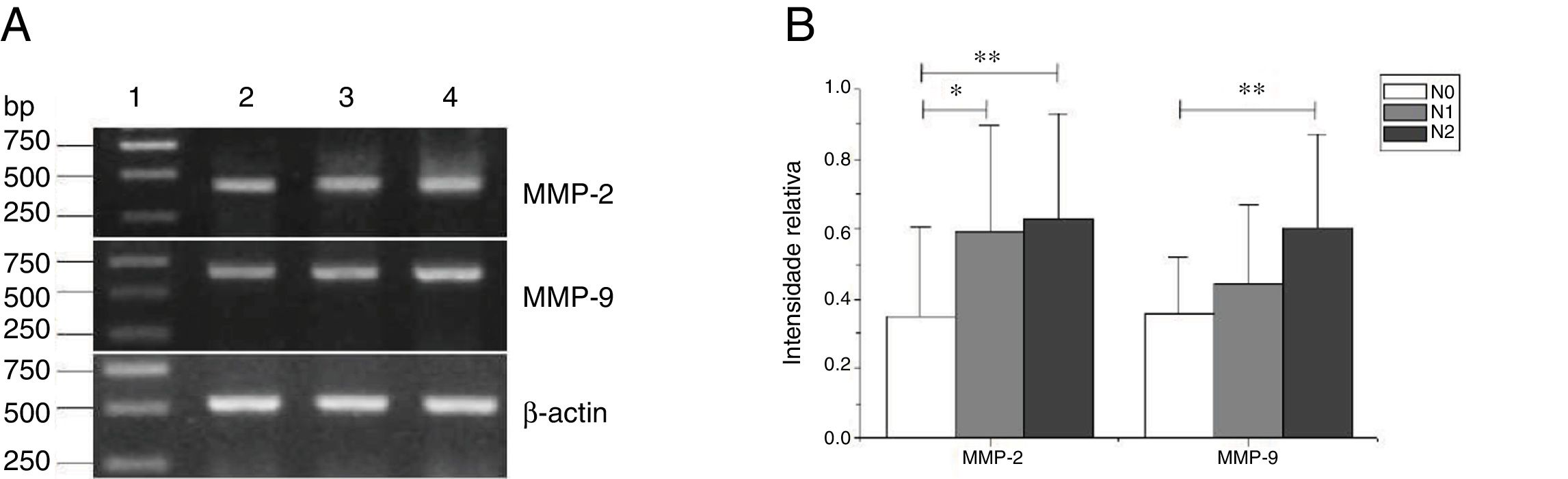
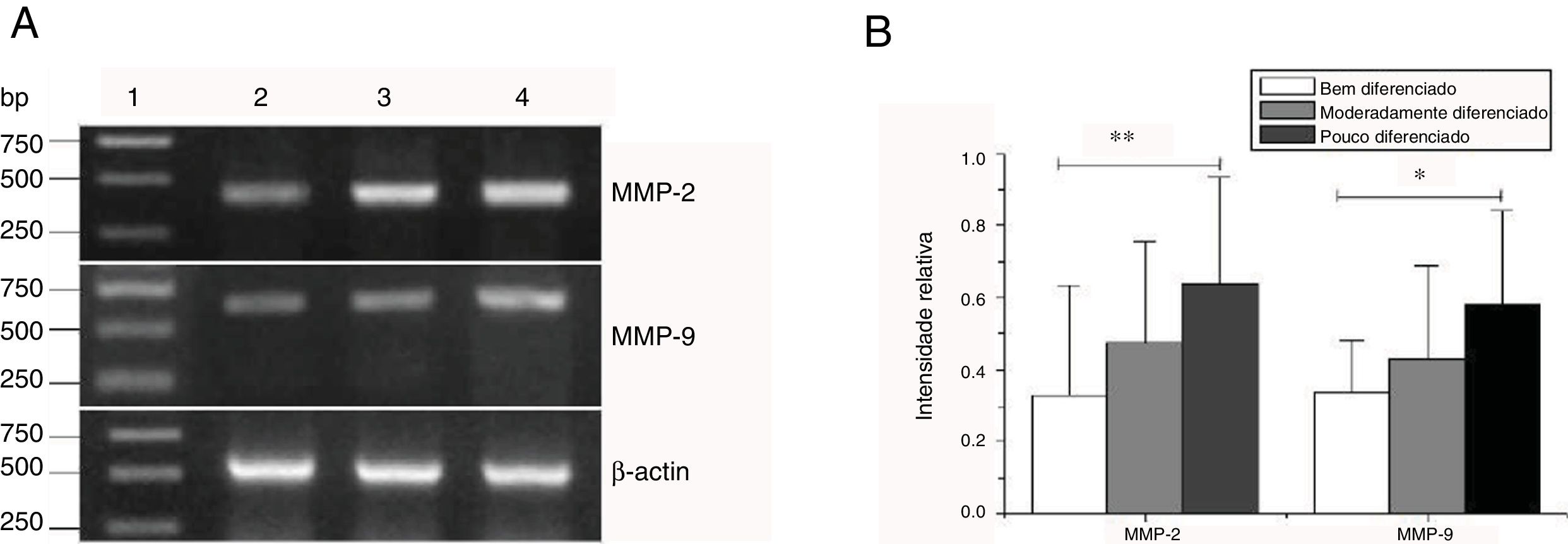
As expressões de mRNA de MMP‐2 e MMP‐9 foram maiores nos tumores com estágios clínicos mais avançados (MMP‐2: F=4,003, p=0,026, MMP‐9: F=5,501, p=0,008). Especialmente no estágio IV, eram claramente maiores do que nos estágios I+II (fig. 3). Sua intensidade de expressão estava associada à metástase dos linfonodos (estadiamento N) e aumentou com o maior grau de metástase linfática (MMP‐2: F=4,584, p=0,016; MMP‐9: F=4,643, p=0,006) (fig. 4) A expressão de MMP‐2 e MMP‐9 nos tecidos cancerígenos aumentou com o avanço do estágio histopatológico do tumor (MMP‐2: F=3,884, p=0,029, MMP‐9: F=3,783, p=0,032) (fig. 5).
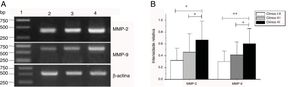
Expressão de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios clínicos obtidos de pacientes com carcinoma hipofaríngeo. (A) Expressão representativa de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios clínicos. A expressão de MMP‐2 e MMP‐9 estava mais intensa nos estágios clínicos mais avançados (faixa 1, 1kb na escada de DNA; faixa 2, pacientes no Estágio I+II; faixa 3, pacientes no Estágio III; faixa 4, pacientes no estágio IV). (B) Intensidade relativa da expressão do mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios clínicos. Pacientes em estágio avançado exibiram níveis mais altos de expressão de mRNA de MMP‐2 e MMP‐9 do que pacientes em estágio inicial (*p <0,05 e ** p <0,01).
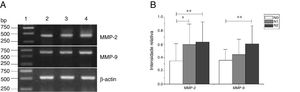
Expressão de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios N obtidos de pacientes com carcinoma hipofaríngeo. (A) Expressão representativa de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios N. A expressão de MMP‐2 e MMP‐9 aumentou com o aumento do estágio N (faixa 1, 1kb na escada de DNA; faixa 2, paciente estágio N0; faixa 3, paciente estágio N1; faixa 4, paciente estágio N2); (B) Intensidade relativa da expressão de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios N. Os pacientes com metástase linfática exibiram níveis mais altos de expressão de mRNA de MMP‐2 e MMP‐9 do que os pacientes no estágio N0 (* p <0,05 e ** p <0,01).
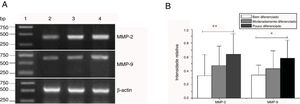
Expressão de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios histopatológicos obtidos de pacientes com carcinoma hipofaríngeo. (A) Expressão representativa de mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios patológicos. A expressão de MMP‐2 e MMP‐9 foi reduzida com a melhora do grau de diferenciação (faixa 1, 1kb na escada de DNA; faixa 2, paciente bem diferenciado; faixa 3, paciente moderadamente diferenciado; faixa 4, paciente pouco diferenciado); (B) Intensidade relativa da expressão do mRNA de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios histopatológicos. Pacientes pouco diferenciados exibiram níveis mais altos de expressão de mRNA de MMP‐2 e MMP‐9 do que pacientes bem diferenciados (*p <0,05 e ** p <0,01).
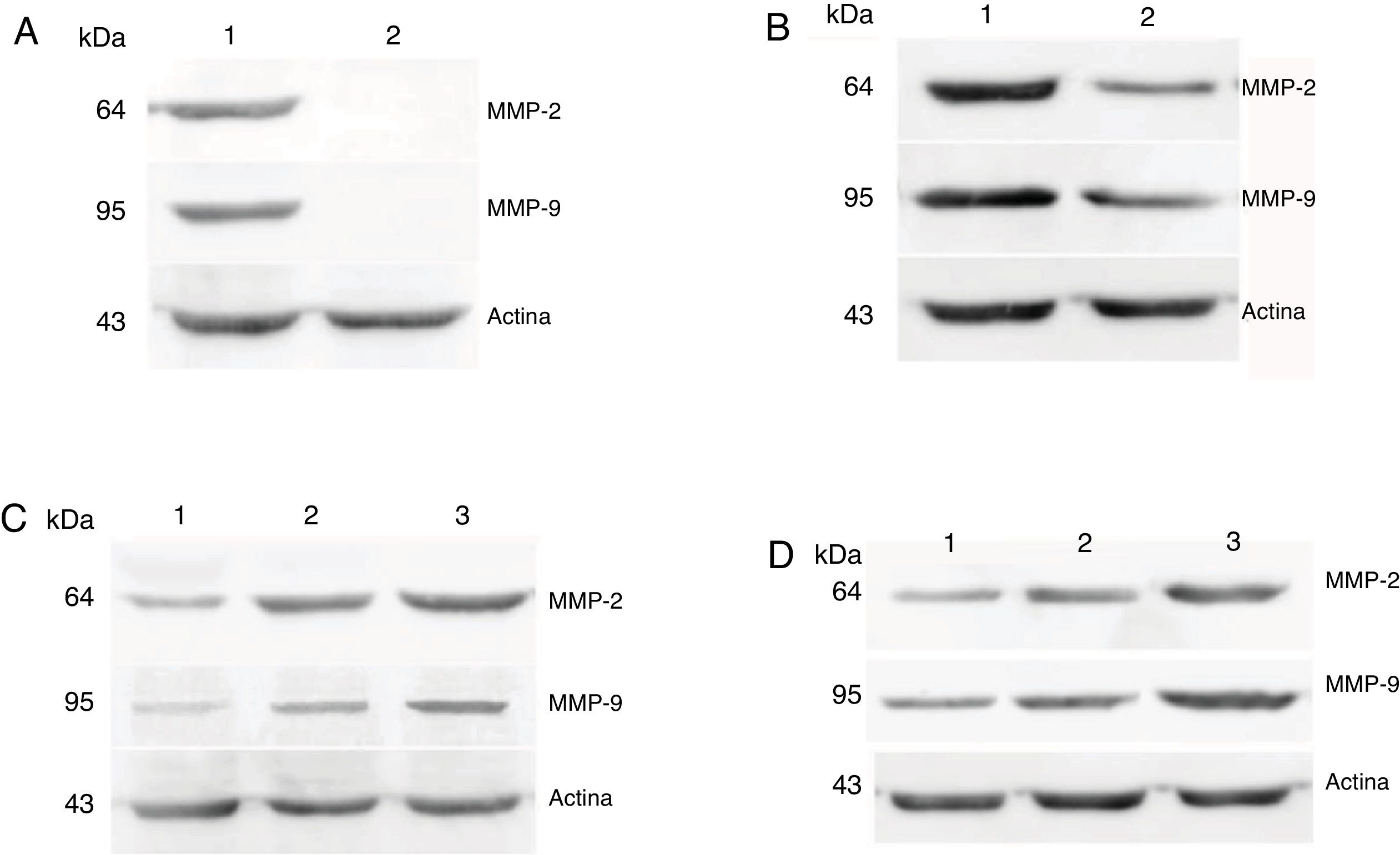
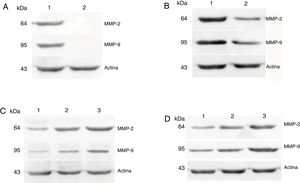
As expressões proteicas de MMP‐2 e MMP‐9 foram analisadas com o ensaio de western blot. Os resultados mostraram que os níveis de expressão proteica de MMP‐2 e MMP‐9 eram consistentes com a expressão de mRNA em tecidos de carcinoma hipofaríngeo e pericarcinoma. A expressão proteica de MMP‐2 e MMP‐9 em tecidos cancerígenos foi maior do que em tecidos de pericarcinoma. Não houve expressão proteica nos pólipos dos tecidos das pregas vocais (tecidos controle). O nível de expressão proteica de MMP‐2 e MMP‐9 foi significantemente maior nos estágios clínicos do tumor e as metástases dos linfonodos (estadiamento N) mais avançados (fig. 6).
Expressões proteicas de MMP‐2 e MMP‐9 em tecidos tumorais e tecidos de pericarcinoma obtidos de pacientes com carcinoma hipofaríngeo. (A) Expressão proteica representativa de MMP‐2 e MMP‐9 em tecidos tumorais e tecidos de controle polipoides. Os tecidos cancerígenos exibiram uma expressão proteica mais intensa de MMP‐2 e MMP‐9, mas quase não houve expressão nos tecidos de controle polipoides (faixa 1, tecido tumoral; faixa 2, tecido de controle polipoide). (B) Expressão proteica representativa de MMP‐2 e MMP‐9 em tecidos tumorais e tecidos de pericarcinoma. A expressão das proteínas MMP‐2 e MMP‐9 foi maior nos tecidos tumorais do que nos tecidos de pericarcinoma (faixa 1, tecido tumoral; faixa 2, tecido de pericarcinoma). (C) Expressão proteica representativa de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios clínicos. A expressão proteica da MMP‐2 e MMP‐9 aumentou com nos estágio clínicos mais avançados (faixa 1, pacientes Estágio I+II; faixa 2, paciente Estágio III; faixa 3, paciente Estágio IV). (D) Expressão proteica representativa de MMP‐2 e MMP‐9 em tecidos tumorais de diferentes estágios N. A expressão proteica de MMP‐2 e MMP‐9 aumentou com o aumento do estágio N (faixa 1, paciente N0; faixa 2, paciente N1; faixa 3, paciente N2).
O carcinoma espinocelular da cabeça e pescoço contribui de forma importante para a morbimortalidade mundial. Mais de 500.000 novos casos em todo o mundo são relatados anualmente1. Como o trato respiratório superior é o primeiro local de contato com agentes cancerígenos ambientais, inclusive certos produtos químicos (fumaça de cigarro ou álcool), poluentes atmosféricos14 e vírus oncogênicos, 15 provavelmente a incidência de câncer de cabeça e pescoço continuará a aumentar na próxima década.16 O câncer hipofaríngeo é um carcinoma espinocelular indiferenciado de cabeça e pescoço (CECCP). Representa uma entidade clínica distinta de outros tipos de câncer da região da cabeça e pescoço. É menos prevalente do que outros cânceres de cabeça e pescoço, é responsável por 3% a 5% de todos os CECCP.17 Geralmente é difícil detectar o carcinoma hipofaríngeo em um estágio inicial devido aos sintomas faríngeos imperceptíveis.18 Apesar dos consideráveis avanços na terapia multimodal, inclusive cirurgia, radioterapia e quimioterapia, a taxa de sobrevida global para pacientes com CECCP é de apenas 15% a 45%.2,19 Esses pacientes geralmente se apresentam tardiamente, com 60% a 80% deles com metástase nodal ipsilateral e até 40% com depósitos tumorais nodais ocultos contralaterais na apresentação.20,21 Na apresentação ou durante o acompanhamento, os pacientes com CECCP geralmente são diagnosticados em estágio tardio e a recorrência local do tumor e as metástases a distância ocorrem com bastante frequência após as terapias convencionais, as quais são a principal causa de baixa sobrevida dos pacientes.2,19 Ainda há falta de uma estratégia eficaz para o melhor tratamento22 e, portanto, os regimes terapêuticos permanecem controversos. Neste estudo, todos os pacientes tinham carcinoma espinocelular; deles, 66,7% apresentavam metástase linfonodal. Dos pacientes, 80,95% encontravam‐se em estágio clínico avançado (III–IV); moderadamente diferenciados e pouco diferenciados representavam 71,4% de todos os pacientes. A classificação dos pacientes foi consistente com a literatura relatada anteriormente.
As MMPs desempenham um papel fundamental na remodelação da MEC e estão envolvidas em uma variedade de processos, inclusive inflamação, migração, diferenciação, angiogênese e fibrose. Embora a expressão de algumas MMPs seja considerada constitutiva (MMP‐2) ou induzível (MMP‐9) no tecido inativo, muitos fatores afetam sua síntese. Portanto, o significado clínico das MMPs, em particular as MMP‐2 e MMP‐9, tem sido demonstrado em muitas condições patológicas, como neoplasias, doenças autoimunes e inflamação crônica.23,24 Uma produção aumentada de MMP‐2 e MMP‐9 parece ser um marcador útil de vários distúrbios autoimunes e neoplasias.25 Bo et al.26 observaram que as metaloproteinases de matriz (MMPs) são importantes no desenvolvimento e na expansão de células tumorais em metástases ósseas e osteólise esquelética. A degradação da matriz extracelular pelas MMPs facilita a invasão e proliferação de células tumorais no ambiente metastático.6 Entre todos os membros das MMPs, as MMP‐1, 2, 3, 9 e 13 foram relatadas como correlacionadas com metástases tumorais.12 Neste estudo, a intensidade da expressão de MMP‐2 e MMP‐9 foi associada à metástase de linfonodos (estadiamento N) e aumentou com o grau mais avançado de metástase linfática. As MMP‐9 e MMP‐2 pertencem à família das gelatinases, um dos cinco grupos da família MMP, com base na especificidade de estrutura e substrato.27 A MMP‐2 é secretada pelas células tumorais e intersticiais na forma de um zimogênio e pode degradar especificamente o colágeno IV quando é hidrolisado e ativado. Nossos resultados mostraram que o mRNA e a proteína da MMP‐2 foram expressos nos tecidos cancerígenos e de pericarcinoma e a intensidade da expressão no tecido cancerígeno foi significantemente maior do que no tecido de pericarcinoma. A MMP‐9 aumenta a metástase das células tumorais, degrada as proteínas de colágeno da MEC após ser ativada por proteases extracelulares em diferentes condições fisiológicas e patológicas. No presente estudo, a expressão do mRNA e da proteína da MMP‐9 se apresentou mais aumentada nos estágios histopatológico mais avançados do tumor. Assim, a MMP‐2 e a MMP‐9 são importantes proteases usadas na invasão e metástase de vários tumores, pela degradação da MEC e da membrana basal. 28 Lee et al. demonstraram que a inibição de MMP‐2 e MMP‐9 prejudica a capacidade de degradação óssea pela metástase tumoral.29,30
ConclusãoA expressão de MMP‐2 e MMP‐9 no carcinoma hipofaríngeo foi significantemente maior do que no tecido do pericarcinoma e se apresentou mais aumentada nos estágios clínicos mais avançados do tumor. O nível de expressão foi relacionado à metástase linfonodal e ao estágio histopatológico do tumor. Assim, a MMP‐2 e a MMP‐9 podem estar envolvidas na ocorrência, no desenvolvimento, na invasão e metástase do carcinoma hipofaríngeo por meio de vários mecanismos. Investigações adicionais são necessárias para determinar os mecanismos exatos. Isso pode fornecer um novo alvo para a terapia direcionada ao carcinoma hipofaríngeo.
FinanciamentoNatural Science Foundation of Shandong Province (número de concessão ZR2018HL011). Projeto de ciência e tecnologia da Shandong Academy of Medical Sciences (número de concessão 2016‐16).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Song Z, Wang J, Su Q, Luan M, Chen X, Xu X. The role of MMP‐2 and MMP‐9 in the metastasis and development of hypopharyngeal carcinoma. Braz J Otorhinolaryngol. 2021;87:521–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.