A discussion in literature about a standardized decision support tool for the management of thyroid nodules remains.
ObjectiveThe purpose of this study was to create a statistical prediction model for thyroid nodules management.
MethodsTwo hundred and four benign and 57 malignant thyroid nodules were selected for a retrospective study. The variables age, gender and ultrasonographic features were examined using univariate and multivariate models. A statistical formula was used to calculate the risk of cancer of each case.
ResultsIn multivariate analysis, irregular shape, absence of halo, lower mean age, homogeneous echotexture, microcalcifications and solid content were associated with cancer. After applying the formula, 20 cases (7.6%) with a calculated risk for malignancy ≤3.0% were found, all of them benign. Setting the calculated risk in ≥80%, 21 (8.0%) cases were selected, and in 85.7% of them cancer was confirmed in histopathology. Internal accuracy of the prediction formula was 92.5%.
ConclusionsThe prediction formula reached high accuracy and may be an alternative to other decision support tools for thyroid nodule management.
Persiste na literatura uma discussão sobre uma ferramenta padronizada de apoio à decisão para o manejo de nódulos tireoidianos.
ObjetivoCriar um modelo de previsão estatística para o manejo de nódulos tireoidianos.
MétodoForam selecionados 204 casos de nódulos tireoidianos benignos e 57 malignos para o estudo retrospectivo. As variáveis idade, sexo e características ultrassonográficas foram analisadas com modelos univariados e multivariados. Uma fórmula estatística foi usada para calcular o risco de câncer de cada caso.
ResultadosNa análise multivariada, a forma irregular, a ausência de halo, menor idade média, ecotextura homogênea, microcalcificações e conteúdo sólido foram associadas ao câncer. Após a aplicação da fórmula, foram encontrados 20 casos (7,6%) com risco calculado de malignidade ≤ 3,0%, todos benignos. Definiu‐se o risco calculado em ≥ 80%, 21 casos (8,0%) foram selecionados e em 85,7% deles o câncer foi confirmado pela histopatologia. A precisão interna da fórmula de previsão foi de 92,5%.
ConclusõesA fórmula de previsão alcançou alta precisão e pode ser uma opção para outras ferramentas de apoio à decisão para o manejo de nódulos da tireoide.
A incidência de câncer de tireoide tem aumentado em todo o mundo.1–3 Apesar da alta prevalência de nódulos tireoidianos (19%‐67% na ultrassonografia [USG]), a maioria deles é benigna. Apenas cerca de 5%‐10% dos nódulos diagnosticados são malignos, embora seja bem conhecido o fato de que essa frequência pode ser maior quando se considera o diagnóstico ocasional de pequenos microcarcinomas.4–6
A investigação dessas lesões geralmente requer exame clínico e de imagem do pescoço, às vezes associado à punção aspirativa com agulha fina (PAAF). Entre os exames de imagem, a USG é uma ferramenta segura, barata, não invasiva e não radioativa, capaz de detectar e avaliar qualitativamente os nódulos. Até esta data, nenhum sinal à USG mostrou ser patognomônico de malignidade; no entanto, a combinação de várias características pode ajudar a determinar o risco de malignidade de um nódulo.7–9
Diferentes sensibilidades, especificidades, valores preditivos negativos e positivos foram observados à USG. Existem variações nos critérios de terminologia e malignidade da USG, bem como uma sobreposição entre as características de nódulos malignos e benignos entre os diferentes estudos. As características clínicas não são comumente usadas quando se aplicam modelos de predição.10,11 Além disso, o viés de verificação ocorre com frequência, pois muitos estudos não são projetados de forma que todos os diagnósticos por PAAF sejam verificados através de cirurgia ou observação clínica.
Alguns estudos bem projetados investigaram a confiabilidade dos achados da USG em comparação com a histopatologia.7,10,12–14 Três estudos usaram uma fórmula baseada na análise das características da USG para prever a malignidade.7,15,16 No entanto, nenhum deles incluiu características clínicas. Park et al. propuseram um modelo preditivo baseado em uma fórmula logit, estratificaram cada lesão em diferentes categorias de abordagem, permitiram que ele seja usado em futuras análises de decisão.16 Um modelo semelhante ao usado por Park et al. foi aplicado a uma amostra de casos tratados cirurgicamente no nosso serviço de atendimento, desenvolveu‐se uma ferramenta de apoio à decisão estatística, baseada no sexo, na idade e nas características da USG. A análise interna de acordo com a citologia pré‐operatória também foi feita.
MétodoTodos os pacientes submetidos à tireoidectomia entre janeiro de 2009 e dezembro de 2013, cuja USG e biópsia com PAAF guiada por USG foram feitas na nossa instituição, foram avaliados retrospectivamente. A aprovação do conselho institucional foi registrada sob o número 3593/11.
Durante o período estudado, foram incluídos 192 pacientes, corresponderam a 261 nódulos. Cada nódulo foi analisado como um caso individual. O exame histopatológico foi feito pelo mesmo profissional (MBB) em 238 casos (91,1%). Em 86 casos (32,9%), a cirurgia foi devido à presença de bócio com sintomas compressivos ou indicações relativas (como nódulos grandes em pacientes mais jovens); em 67 casos (25,6%), devido a nódulos com citologia indeterminada; em 47 casos (18,0%), devido a nódulos sólidos com citologia repetida não diagnóstica; e em 61 casos (23,3%), devido a nódulos citologicamente (45‐17,2%) ou clinicamente suspeitos de malignidade (16‐6,1%).
Os exames de USG em modo bidimensional e Color Doppler foram feitos com o equipamento Toshiba Xario (SSA 660A), com um transdutor linear de alta resolução (7,5‐14MHz). A PAAF guiada por USG foi feita com uma agulha de calibre 24. Quando na presença de bócio multinodular, foram coletadas amostras dos nódulos com maior índice de suspeita na ultrassonografia. Em nódulos parcialmente císticos, a agulha foi direcionada para a porção sólida. Como a estrutura deste estudo foi modelada em 2008, escolheu‐se o uso da antiga classificação de Bethesda. Os diagnósticos citológicos foram classificados em: I) Não diagnóstico; II) Benigno; III) Indeterminado; IV) Suspeita de malignidade; e V) Maligno. Nos casos com mais de dois resultados citológicos em um paciente, o resultado mais provável de ser maligno foi considerado. Após o estudo histopatológico, os nódulos ressecados foram classificados como: I) Maligno (carcinoma papilar, carcinoma folicular, carcinoma anaplásico, carcinoma mal diferenciado e medular); ou II) benigno (hiperplasia nodular, bócio coloidal, tireoidite linfocítica nodular ou de Hashimoto e adenoma folicular).
Os achados da USG, sexo e idade de todos os pacientes foram obtidos dos arquivos. Também foram obtidos todos os resultados citológicos e histológicos de pacientes submetidos a tireoidectomias. As seguintes variáveis foram inseridas em um banco de dados específico: idade, sexo, achados da USG, resultados citológicos e histológicos. As características da USG dos nódulos foram classificadas em: I) Ecogenicidade (acentuadamente hipoecoica, predominantemente hipoecoica, predominantemente isoecoica, predominantemente hiperecoica ou predominantemente anecoica); II) Conteúdo interno (predominantemente sólido (porção líquida ≤ 10% do volume do nódulo); misto sólido‐cístico (porção líquida > 10% mas ≤ 50% do volume do nódulo), predominantemente cístico (porção líquida > 50%, mas ≤ 90% do volume do nódulo), puramente cística (porção líquida > 90% do volume do nódulo); III) Ecotextura (homogênea ou heterogênea); IV) Calcificação (microcalcificações, macrocalcificações ou calcificações da borda periférica, também denominadas calcificações em “casca de ovo“); V) Halo (presente e completo, parcialmente presente ou ausente); VI) Margens (“definida“ou “indefinida“); VII) Formato (regular, irregular ou lobulado); VIII) Fluxo vascular (predominantemente central, predominantemente periférico, misto central e periférico ou ausente); IX) Localização do nódulo ou lobo afetado (lobo direito, istmo ou lobo esquerdo).
Foram calculadas as frequências e a distribuição de cada variável selecionada. Os autores usaram média (desvio‐padrão [DP]), frequências absolutas e porcentagens, conforme apropriado. Para as diferenças entre os grupos, os autores usaram os testes de qui‐quadrado para variáveis categóricas e o teste t de Student para variáveis contínuas. A regressão logística foi usada para identificar características da USG associadas de forma independente com malignidade (variável dependente). O nível de significância estatística foi estabelecido em 5%. Todas as análises estatísticas foram feitas com o software SPSS, versão 15.0 (SPSS Inc., Chicago, IL).
Foi usada uma fórmula para calcular a probabilidade de malignidade com base nos resultados da análise de regressão múltipla: Probabilidade Probability(Z)=1/1+e−(α+∑βiXi); onde “e“e “α“representam constantes matemáticas e “β“o coeficiente de cada variável independente (“X“).
Aplicando a ferramenta estatística, os autores puderam observar um risco variável de malignidade, dependeu da configuração das variáveis. A fórmula matemática para a previsão de risco foi aplicada em todos os casos analisados, que foram estratificados em baixo risco, risco intermediário e alto risco de malignidade, consideraram‐se pontos de corte específicos adaptados aos resultados obtidos. Foram feitas análises internas de acordo com os resultados citológicos.
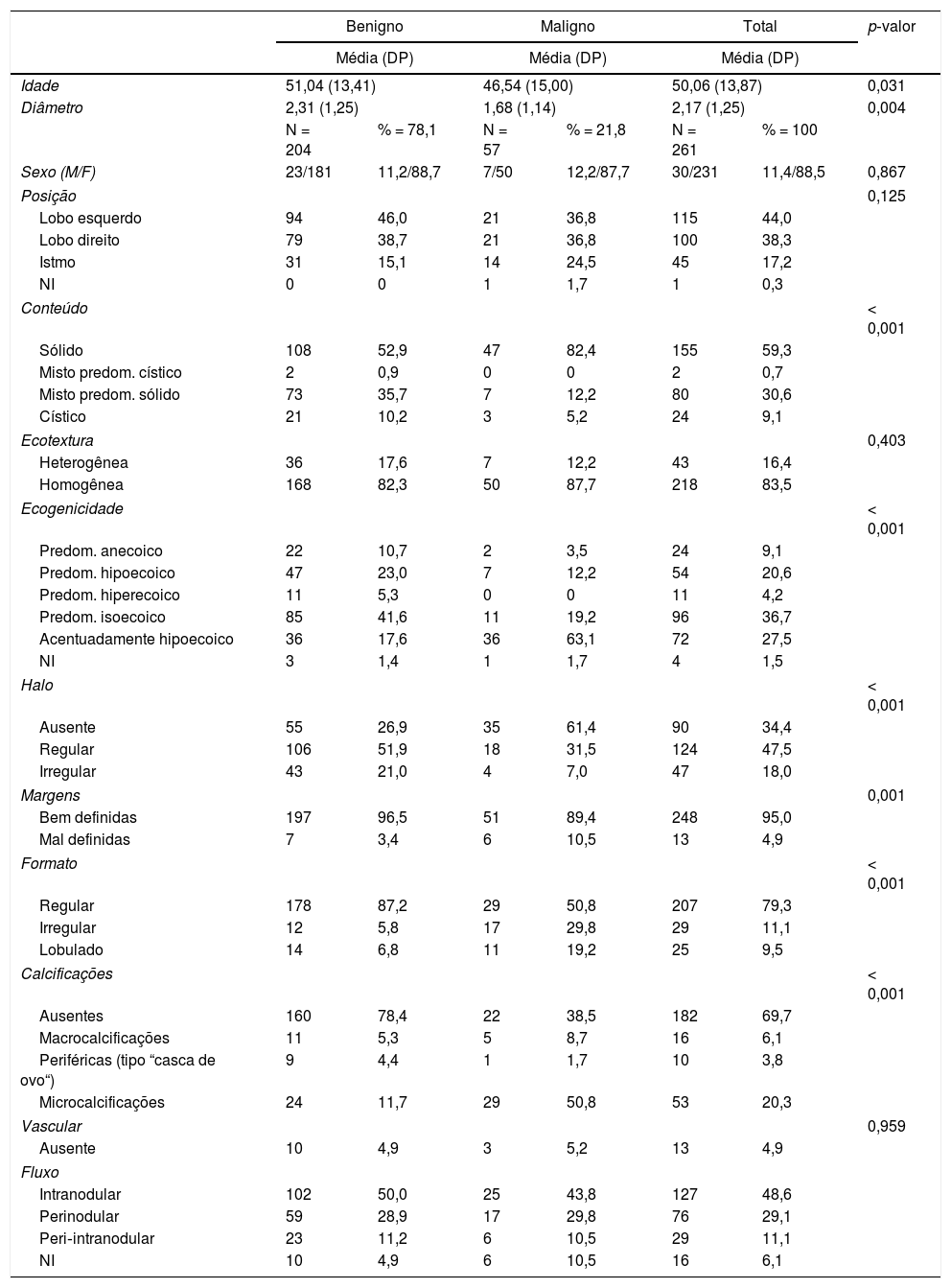
ResultadosAs características USG da amostra estão resumidas na tabela 1. A idade média dos pacientes foi de 50,06 anos (13 a 87), com uma razão homens:mulheres de 1:7,7. O tamanho médio do nódulo foi de 2,17cm (0,3‐6,6).
Análise univariada: características clínicas e ultrassonográficas entre casos malignos e benignos
| Benigno | Maligno | Total | p‐valor | ||||
|---|---|---|---|---|---|---|---|
| Média (DP) | Média (DP) | Média (DP) | |||||
| Idade | 51,04 (13,41) | 46,54 (15,00) | 50,06 (13,87) | 0,031 | |||
| Diâmetro | 2,31 (1,25) | 1,68 (1,14) | 2,17 (1,25) | 0,004 | |||
| N = 204 | % = 78,1 | N = 57 | % = 21,8 | N = 261 | % = 100 | ||
| Sexo (M/F) | 23/181 | 11,2/88,7 | 7/50 | 12,2/87,7 | 30/231 | 11,4/88,5 | 0,867 |
| Posição | 0,125 | ||||||
| Lobo esquerdo | 94 | 46,0 | 21 | 36,8 | 115 | 44,0 | |
| Lobo direito | 79 | 38,7 | 21 | 36,8 | 100 | 38,3 | |
| Istmo | 31 | 15,1 | 14 | 24,5 | 45 | 17,2 | |
| NI | 0 | 0 | 1 | 1,7 | 1 | 0,3 | |
| Conteúdo | < 0,001 | ||||||
| Sólido | 108 | 52,9 | 47 | 82,4 | 155 | 59,3 | |
| Misto predom. cístico | 2 | 0,9 | 0 | 0 | 2 | 0,7 | |
| Misto predom. sólido | 73 | 35,7 | 7 | 12,2 | 80 | 30,6 | |
| Cístico | 21 | 10,2 | 3 | 5,2 | 24 | 9,1 | |
| Ecotextura | 0,403 | ||||||
| Heterogênea | 36 | 17,6 | 7 | 12,2 | 43 | 16,4 | |
| Homogênea | 168 | 82,3 | 50 | 87,7 | 218 | 83,5 | |
| Ecogenicidade | < 0,001 | ||||||
| Predom. anecoico | 22 | 10,7 | 2 | 3,5 | 24 | 9,1 | |
| Predom. hipoecoico | 47 | 23,0 | 7 | 12,2 | 54 | 20,6 | |
| Predom. hiperecoico | 11 | 5,3 | 0 | 0 | 11 | 4,2 | |
| Predom. isoecoico | 85 | 41,6 | 11 | 19,2 | 96 | 36,7 | |
| Acentuadamente hipoecoico | 36 | 17,6 | 36 | 63,1 | 72 | 27,5 | |
| NI | 3 | 1,4 | 1 | 1,7 | 4 | 1,5 | |
| Halo | < 0,001 | ||||||
| Ausente | 55 | 26,9 | 35 | 61,4 | 90 | 34,4 | |
| Regular | 106 | 51,9 | 18 | 31,5 | 124 | 47,5 | |
| Irregular | 43 | 21,0 | 4 | 7,0 | 47 | 18,0 | |
| Margens | 0,001 | ||||||
| Bem definidas | 197 | 96,5 | 51 | 89,4 | 248 | 95,0 | |
| Mal definidas | 7 | 3,4 | 6 | 10,5 | 13 | 4,9 | |
| Formato | < 0,001 | ||||||
| Regular | 178 | 87,2 | 29 | 50,8 | 207 | 79,3 | |
| Irregular | 12 | 5,8 | 17 | 29,8 | 29 | 11,1 | |
| Lobulado | 14 | 6,8 | 11 | 19,2 | 25 | 9,5 | |
| Calcificações | < 0,001 | ||||||
| Ausentes | 160 | 78,4 | 22 | 38,5 | 182 | 69,7 | |
| Macrocalcificações | 11 | 5,3 | 5 | 8,7 | 16 | 6,1 | |
| Periféricas (tipo “casca de ovo“) | 9 | 4,4 | 1 | 1,7 | 10 | 3,8 | |
| Microcalcificações | 24 | 11,7 | 29 | 50,8 | 53 | 20,3 | |
| Vascular | 0,959 | ||||||
| Ausente | 10 | 4,9 | 3 | 5,2 | 13 | 4,9 | |
| Fluxo | |||||||
| Intranodular | 102 | 50,0 | 25 | 43,8 | 127 | 48,6 | |
| Perinodular | 59 | 28,9 | 17 | 29,8 | 76 | 29,1 | |
| Peri‐intranodular | 23 | 11,2 | 6 | 10,5 | 29 | 11,1 | |
| NI | 10 | 4,9 | 6 | 10,5 | 16 | 6,1 | |
%, frequência relativa; diâmetro em centímetros; DP, desvio‐padrão; idade em anos;
M/F, masculino/ feminino; N, frequência absoluta; NI, não informado; Predom, predominantemente; p‐valor, nível de significância usado.
Malignidade foi diagnosticada após estudo histopatológico em 57 (21,8%) nódulos ressecados (55 carcinomas papilares e dois carcinomas foliculares). A multifocalidade foi encontrada em 24 casos (9,1%). Entre os diagnósticos benignos, 45 (22,0%) eram casos de adenoma folicular; 132 (64,7%), hiperplasia folicular; 10 (4,9%), nódulos coloides; e 17 (8,3%), forma nodular de tireoidite de Hashimoto. O resultado da PAAF foi benigno em 95 (36,3%) nódulos; suspeito, em 16 (6,1%); maligno, em 30 (11,4%); indeterminado, em 73 (27,9%); e não diagnóstico, em 47 (18,0%).
Com base na descrição histopatológica e ultrassonográfica, foi possível determinar, nos casos de bócio multinodular, a histologia de cada nódulo submetido à PAAF. Dentre todos os casos benignos confirmados pela histopatologia, um carcinoma papilar de tireoide incidentalmente diagnosticado foi encontrado em outras partes da glândula em 26 (9,9%) casos (nódulos que não foram objeto da investigação). O diâmetro médio dos carcinomas diagnosticados incidentalmente foi de 0,73cm (0,2‐2,4). Entre eles, 23 (95,8%) eram microcarcinomas.
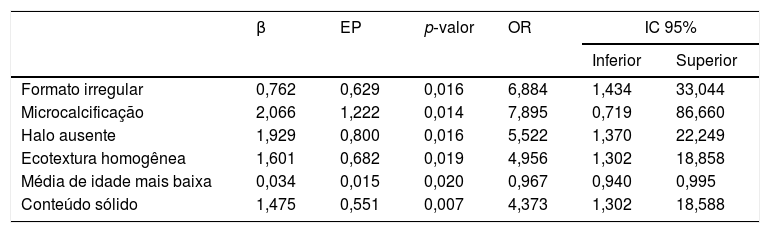
Na análise univariada, as seguintes características foram associadas à malignidade: média de idade menor (p = 0,031), menor diâmetro (p = 0,004), conteúdo sólido (p < 0,001), ausência de halo (p < 0,001), formato irregular ou lobulado (p < 0,001 e p < 0,041, respectivamente), microcalcificação (p < 0,001), textura hipoecoica (p < 0,001) e margens mal definidas (p = 0,001) (tabela 1). Na análise multivariada, formato irregular (p = 0,039), ausência de halo (p = 0,016), média de idade menor (p = 0,020), ecotextura homogênea (p = 0,019), microcalcificação (p = 0,014) e conteúdo sólido (p = 0,007) foram associados à malignidade (tabela 2). Com os resultados da análise de regressão, os autores elaboraram uma equação para calcular o risco de malignidade de um determinado nódulo tireoidiano (z), conforme mostrado abaixo. Os autores encontraram inconsistências ao trabalhar com a variável ecogenicidade na análise multivariada. Os autores também consideraram o diâmetro como um viés de seleção. Ambas as variáveis foram excluídas da equação:
Fatores clínicos e ultrassonográficos independentes associados à malignidade após regressão múltipla
| β | EP | p‐valor | OR | IC 95% | ||
|---|---|---|---|---|---|---|
| Inferior | Superior | |||||
| Formato irregular | 0,762 | 0,629 | 0,016 | 6,884 | 1,434 | 33,044 |
| Microcalcificação | 2,066 | 1,222 | 0,014 | 7,895 | 0,719 | 86,660 |
| Halo ausente | 1,929 | 0,800 | 0,016 | 5,522 | 1,370 | 22,249 |
| Ecotextura homogênea | 1,601 | 0,682 | 0,019 | 4,956 | 1,302 | 18,858 |
| Média de idade mais baixa | 0,034 | 0,015 | 0,020 | 0,967 | 0,940 | 0,995 |
| Conteúdo sólido | 1,475 | 0,551 | 0,007 | 4,373 | 1,302 | 18,588 |
EP, erro padrão; IC, intervalo de confiança; OR, odds ratio; p‐valor, nível de significância; β, coeficiente de determinação.
Z = 1/1 + EXP (−(−4,642 + 0,465 * X1 − 0,033 * X2 + 0,916 * X3 + 0,353 * X4 − 0,061 * X5 + 1,475 * X6 + 1,600 * X7 + 1,708 * X8 + 0,889 * X9 − 0,283 * X10 + 1,929 * X11 + 0,762 * X12 + 0,418 * X13 + 1,461 * X14 + 2,133 * X15 − 0,898 * X16 − 0,817 * X17 − 0,078 * X18)) * 100
As constantes de X mostradas nessa equação são definidas na tabela 3.
Definição das variáveis independentes usadas na equação para calcular o risco de malignidade de um nódulo tireoidiano
| Variável | Características |
|---|---|
| X1 | Sexo: Feminino = 0; Masculino = 1 |
| X2 | Idade: em anos |
| X3 | Localização no istmo = 1; se estiver no lobo esquerdo ou direito = 0 |
| X4 | Localização no lobo direito = 1; se estiver no istmo ou lobo esquerdo = 0 |
| X5 | Conteúdo predominantemente ou totalmente cístico = 1; se predominantemente sólido ou misto sólido‐cístico = 0 |
| X6 | Conteúdo predominantemente sólido = 1; se predominantemente ou totalmente cístico ou misto sólido‐cístico = 0 |
| X7 | Ecotextura homogênea = 1; heterogênea = 0 |
| X8 | Halo: se ausente = 1; se presente e completo ou parcialmente presente = 0 |
| X9 | Halo: se presente e completo = 1; se parcialmente presente ou ausente = 0 |
| X10 | Margens indefinidas = 1; definidas = 0 |
| X11 | Formato irregular = 1; se o formato for regular ou lobulado = 0 |
| X12 | Formato lobulado = 1; se irregular ou regular = 0 |
| X13 | Calcificação: se ausente = 1; se micro ou macrocalcificações ou calcificações periféricas na borda = 0 |
| X14 | Calcificação: se houver macrocalcificações = 1; se ausentes ou se houver microcalcificações ou calcificações periféricas na borda = 0 |
| X15 | Calcificação: se houver microcalcificações = 1; se ausentes ou se houver macrocalcificações ou calcificações periféricas na borda = 0 |
| X16 | Fluxo vascular ausente = 1; se predominantemente central, periférico ou misto = 0 |
| X17 | Fluxo vascular misto = 1; se ausente, predominantemente central ou periférico = 0 |
| X18 | Fluxo vascular periférico = 1; se ausente, predominantemente central ou misto = 0 |
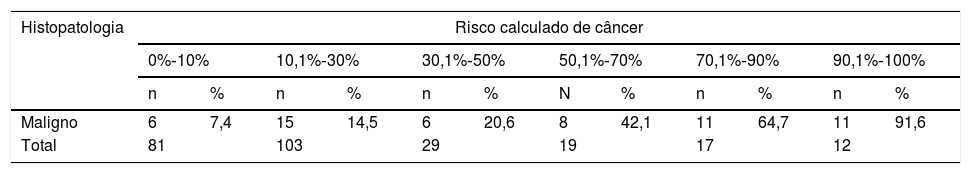
A aplicação da fórmula de predição resultou em um risco calculado de malignidade que variou de 0,49% ‐97,64% na coorte atual. Dividindo‐se essa amostra de acordo com o risco calculado, observou‐se uma proporção crescente de casos de malignidade à medida que o risco de câncer calculado aumentou (tabela 4). Vinte casos (7,6%) tiveram um risco calculado ≤ 3,0%, todos com doenças benignas comprovadas. Por outro lado, estabeleceu‐se o risco calculado em ≥ 80%, 21 (8,0%) casos foram selecionados e 85,7% deles tiveram a presença de malignidade confirmada na histopatologia. Com esses pontos de corte, os valores de sensibilidade, especificidade, precisão, valores preditivos negativos e positivos da fórmula de predição foram 100%, 86,3%, 92,5%, 85,7% e 100%, respectivamente (tabela 5).
Os resultados da fórmula de predição foram estratificados de acordo com a citologia e os mesmos pontos de corte anteriores foram aplicados. Entre os 73 casos indeterminados, 10 (13,6%) casos foram classificados como de baixo risco e nenhum deles teve confirmação de malignidade. Além disso, quando o risco calculado foi ≥ 80%, apenas um caso foi identificado, esse com confirmação de malignidade. Entre os 47 casos com citologia não diagnóstica, apenas quatro (8,5%) ficaram abaixo do ponto de corte inferior (todos eles confirmados como benignos na histopatologia) e apenas um (2,1%) ficou acima do ponto de corte (esse confirmado como um caso de câncer). Entre os casos com resultados benignos, confirmatórios e suspeitos para câncer na citologia, a fórmula de predição foi menos útil. No grupo benigno, quatro casos (4,2%) estavam acima do ponto de corte superior, apenas um foi confirmatório para câncer. Por outro lado, entre casos suspeitos ou confirmatórios, apenas um caso estava abaixo do ponto de corte inferior, sem confirmação de malignidade na histopatologia.
DiscussãoA melhoria da qualidade da USG e a ampla indicação dos exames de imagem do pescoço resultaram em taxas crescentes de detecção de nódulos tireoidianos.1 De acordo com as recomendações da American Thyroid Association (ATA),17 a PAAF é o método diagnóstico com maior precisão para a detecção de câncer em pacientes com nódulos tireoidianos, enquanto os exames citológicos em todos os nódulos tireoidianos não são custo‐efetivos. Alguns pesquisadores recomendam a PAAF apenas em pacientes com nódulos de alto risco.16,18 Os autores encontraram combinações de características de USG, idade e sexo capazes de prever com precisão a presença de câncer de tireoide. Um esquema de estratificação de risco, expresso em valores relativos (%), permite ao paciente e ao cirurgião tomar uma melhor decisão sobre o tratamento recomendado. A aplicação de dois pontos de corte foi sugerida (≤ 3,0% e ≥ 80%), evitaram‐se biópsias em 15,6% dessa amostra. De fato, a PAAF até mesmo aumentaria o número de cirurgias desnecessárias no grupo de baixo risco, já que em apenas cinco (25%) casos, os resultados citológicos foram indicativos de doença benigna e outros 15 (75%) casos seriam levados à cirurgia devido aos critérios citológicos. No grupo de alto risco, a PAAF mostrou ser desnecessária, pois os resultados citológicos foram sugestivos ou confirmatórios de malignidade em 17 casos (80,9%).
Exceto pelo diâmetro, todas as outras variáveis foram incluídas na fórmula estatística. Cada variável, mesmo sem resultado estatisticamente significativo após a análise multivariada, apresenta algum efeito sobre o resultado, atua em uma rede de relações dinâmicas. Os autores optaram por excluir o diâmetro da fórmula estatística, pois foi considerado um viés de seleção. Pequenos nódulos submetidos à PAAF geralmente são mais suspeitos para câncer.
Vários estudos relataram resultados promissores com o uso da USG para avaliar o risco de malignidade em casos com citologia indeterminada,19,20 e não diagnóstica.21 Apesar da baixa representatividade de ambos os subgrupos na amostra estudada, foi identificada uma parte desses grupos que não se beneficia da cirurgia devido ao risco extremamente baixo de câncer e outro grupo com um risco tão alto que poderia ser levado ao tratamento cirúrgico sem a necessidade da PAAF. Se o ponto de corte inferior proposto fosse reduzido para ≤ 13%, a cirurgia seria evitada em 21 (44,6%) casos com citologia não diagnóstica, sem risco de não diagnosticar a malignidade.
Outros autores já descreveram os achados característicos da USG associados ao câncer de tireoide. Os resultados obtidos foram semelhantes aos de outros estudos, com algumas variações quando a análise de regressão logística foi aplicada. Koike et al. observaram que o formato irregular, a textura ecossólida, margens mal definidas, características hipoecoicas e calcificações finas são estatisticamente associados com malignidade após análise de regressão múltipla.7 Semelhantemente aos resultados dos autores, outros pesquisadores também encontraram menor média de idade como preditor independente de malignidade após análise multivariada.11,22,23 Gul et al., em um estudo grande e bem projetado, combinaram os recursos da USG e encontraram margens irregulares, seguidas de padrões hipoecoicos e microcalcificações como as características mais importantes da USG para predição de malignidade. Em seu estudo, foi observado que a combinação de hipoecogenicidade, microcalcificação e irregularidade de margem constituía o modelo mais preditivo para câncer (sensibilidade de 65,2%, especificidade de 98,7% e VPP de 71,6%).13 Alguns estudos compararam as características da USG com resultados mistos histológicos malignos e citológicos benignos.24–26 Embora também tenha sido encontrada uma associação entre os recursos clássicos da USG e o câncer de tireoide, esse estudo pode ser afetado pelo viés de verificação, uma vez que os autores inferiram uma precisão similar da PAAF e histopatologia para doenças da tireoide.
Diferentes formas de agrupar as características da USG e os vários tipos de escalas de predição já foram descritas na literatura. Horvath et al. elaboraram o sistema Thyroid Imaging Reporting and Data System (Tirads), tomaram o sistema BI‐Rads (Breast Imaging‐Reporting and Data System) como modelo.17 Ito et al. classificaram as características da USG em cinco níveis de risco,12 similarmente ao estudo de Tomimori et al., que dividiram os resultados da USG em quatro níveis.27 Kwak et al. observaram um risco crescente de malignidade à medida que o número de características suspeitas da USG aumentou. De acordo com Kwak et al., o conteúdo sólido, a hipoecogenicidade, a forma microlobulada ou irregular, a presença de microcalcificações e os nódulos mais altos do que largos foram todos associados à malignidade após a análise multivariada.14 Lin et al. desenvolveram uma classificação dicotômica da USG: maligna, quando a estrutura ecossólida, hipoecogenicidade, calcificação fina e margens mal definidas estavam presentes; e benigna, quando nenhuma dessas características estava presente.28
Park et al. usaram uma equação para predizer a presença de um nódulo maligno, embora esses autores também incluíssem casos com somente resultados citológicos no grupo benigno.16 Eles foram além e simplificaram a probabilidade de malignidade para cada nódulo com o uso de um intervalo de confiança de 95% e 99%, resumiram os achados representativos da USG em uma configuração clínica aplicável. Nixon et al. produziram um nomograma capaz de prever a necessidade de fazer PAAF guiada por ultrassonografia em um nódulo tireoidiano com base em características bioquímicas, clínicas e de ultrassonografia de 158 pacientes, todos submetidos à tireoidectomia. A textura hipoecoica e as microcalcificações demonstraram o maior valor preditivo.10
No presente modelo preditivo, os autores padronizaram a descrição ultrassonográfica antes do início do projeto, usaram uma metodologia simples e reprodutível, como a proposta por Andrioli et al.29 Algumas características clínicas disponíveis (idade e sexo) foram adicionadas a um modelo estatístico já explorado por outros autores,7,15,16 trouxeram essa ferramenta estatística para a realidade da prática médica. Certamente, esse modelo poderia ser melhorado, incluiria mais variáveis ultrassonográficas e clínicas, conforme explorado por Nixon et al.,10 testaria a fórmula preditiva do autor em uma amostra externa ou compararia seus resultados com outros modelos de predição, como o Tirads.
A análise de cada caso pelo mesmo radiologista e, na maioria dos casos, pelo mesmo patologista torna mais fácil padronizar e interpretar dados, apesar de aumentar o risco de viés, uma vez que não há um confronto desse exame dependente do examinador com outras opiniões. Elaborar um trabalho baseado em uma amostra de pacientes tratados em um centro de referência terciária pode não ser aplicável a uma configuração comunitária. Em parte, testar a ferramenta de apoio à decisão do autor em uma amostra externa poderá aproximar esse modelo de predição à prática clínica e minimizar os dois vieses acima mencionados.
ConclusãoHouve uma base suficiente para observar pacientes com nódulos tireoidianos com baixo risco ultrassonográfico sem usar a PAAF, mesmo aqueles maiores do que 1cm. Também foi possível identificar um grupo expressivo com alto risco de malignidade, dispensar a necessidade de PAAF. A ferramenta de apoio à decisão dos autores parece ser prática também no manejo de nódulos de tireoide com citologia indeterminada e não diagnóstica. Os autores sugerem uma abordagem baseada em um risco extremamente baixo e extremamente elevado de câncer. No entanto, outros casos poderiam ser incluídos em uma abordagem observacional ou mais agressiva, depende de quantos casos cada um se sinta à vontade de não identificar ou tratar excessivamente.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Dr. Luiz Felipe Osowski, por nos ajudar com a padronização de relatos dos EUA; ao Dr. Marinez Bizarro Barra, por seu apoio com a análise patológica; e a Felipe Lhywinskh Guella, por ajudar na aquisição de dados.
Como citar este artigo: Girardi FM, Silva LM, Flores CD. A predictive model to distinguish malignant and benign thyroid nodules based on age, gender and ultrasonographic features. Braz J Otorhinolaryngol. 2019;85:24–31.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.