Sensorineural hearing loss is a common challenge all over the world, including a section of the young population. While there have been many published reports associating glutamate metabotropic receptor 7 with sensorineural hearing loss, there is no report, till date, about the association of glutamate metabotropic receptor 7 polymorphisms with sensorineural hearing loss at different ages.
ObjectiveTo test the association between the single nucleotide polymorphisms rs11928865 and rs11920109 of the glutamate metabotropic receptor 7 with sensorineural hearing loss in adults of different age groups.
MethodsA total of 1661 subjects were studied. The individuals aged between 30 and 50, and between 51 and 70 years with sensorineural hearing loss comprised group A and group B, respectively. Individuals aged between 30 and 50; and between 51 and 70 years without hearing loss comprised control groups C and D, respectively. The MassARRAY method was used to analyze the genotypes.
ResultsThe difference in genotypes for the glutamate metabotropic receptor 7 rs11928865 single nucleotide polymorphism between patients in the groups B and D was statistically significant (p=0.018). The distribution frequencies of genotypes in patients that were aged between 30 and 50 years were not significantly different. The difference in genotypes for the rs11920109 single nucleotide polymorphism between the sensorineural hearing loss groups and control groups showed no statistical significance.
ConclusionThe rs11928865 single nucleotide polymorphism was associated with the susceptibility to hearing loss in patients in group B but not with those in group A.
A perda auditiva neurossensorial é um desafio comum no mundo todo, inclui uma parte da população jovem. Embora haja muitos relatos que associem o gene do receptor metabotrópico de glutamato 7 com perda auditiva neurossensorial, não há relato, até a presente data, sobre a associação de polimorfismos do receptor metabotrópico de glutamato 7 com perda auditiva neurossensorial em diferentes faixas etárias.
ObjetivoTestar a associação entre os polimorfismos de nucleotídeo único, rs11928865 e rs11920109 do receptor metabotrópico de glutamato 7 e perda auditiva neurossensorial em adultos de diferentes faixas etárias.
MétodoUm total de 1661 indivíduos foram estudados. Os indivíduos com idade entre 30 e 50 anos e entre 51 e 70 anos com perda auditiva neurossensorial constituíram o grupo A e o grupo B, respectivamente. Indivíduos com idade entre 30 e 50 anos; e entre 51 e 70 anos sem perda auditiva foram os grupos controle C e D, respectivamente. O método MassARRAY foi utilizado para analisar os genótipos.
ResultadosA diferença nos genótipos para o polimorfismo de nucleotídeo único rs11928865 do gene receptor metabotrópico de glutamato 7 entre os pacientes dos Grupos B e D foi estatisticamente significante (p=0,018). As frequências de distribuição dos genótipos nos pacientes entre 30 e 50 anos não foram significantemente diferentes. A diferença nos genótipos para o polimorfismo de nucleotídeo único rs11920109 entre os grupos com perda auditiva neurossensorial e os grupos controle não mostrou significância estatística.
ConclusãoO polimorfismo de nucleotídeo único rs11928865 foi associado à suscetibilidade para perda auditiva em pacientes do grupo B, mas não àqueles do grupo A.
Polimorfismos de nucleotídeo único (SNPs) podem causar alterações na qualidade ou quantidade de expressão de proteína, o que pode estar relacionado à ocorrência de determinadas doenças ou à susceptibilidade a doenças. O glutamato é um importante neurotransmissor do sistema auditivo. O produto da proteína do gene do receptor metabotrópico de glutamato 7 (GRM7), mGluR7, é amplamente distribuído nas células ciliadas internas e externas e na célula nervosa do gânglio espiral. A perda auditiva neurossensorial (PANS) é um desafio comum em todo o mundo, inclui uma parte da população jovem. Já houve muitos relatos que associaram o GRM7 à PANS. Friedman et al. associaram o gene GRM7 com a susceptibilidade à PANS em indivíduos de países europeus.1 A presença de SNPs do gene GRM7 correlaciona‐se significantemente à PANS em homens idosos chineses da etnia Han e diferentes tipos de perda auditiva apresentam diferentes polimorfismos genéticos.2 Entretanto, os indivíduos com PANS nesses estudos tinham mais de 50 anos. Curiosamente, não há relato até a presente data sobre a associação dos polimorfismos do GRM7 com PANS em diferentes faixas etárias. Não está claro se os indivíduos mais jovens com PANS também apresentam uma associação com os SNPs do GRM7.
Aqui, selecionamos um grupo de pacientes com PANS com 30 a 50 e 51 a 70 anos e os grupos de controle correspondentes para uma análise genética do GRM7. Comparamos a suscetibilidade à PANS nos pacientes dessas diferentes faixas etárias com os SNPs do GRM7.
MétodoAmostraParticiparam deste estudo 1.661 voluntários chineses da etnia Han. Todos tinham de 30 a 70 anos e visitaram nosso hospital entre janeiro de 2013 e janeiro de 2017. O estudo foi aprovado pelo comitê de ética do hospital e o consentimento informado por escrito foi obtido de cada indivíduo; o número de aprovação do comitê de ética foi 2015003. Constituíram o grupo A 467 indivíduos, entre 30 e 50 anos, incluiu 236 homens e 231 mulheres com média de 40,54±5,32 anos, com PANS. Constituíram o grupo controle C 278 indivíduos, com entre 30 e 50 anos, incluiu 147 homens e 131 mulheres com média de 40,23±4,99 anos, sem PANS. Constituíram o grupo B 439 indivíduos, com entre 51 e 70 anos, incluiu 208 homens e 231 mulheres com média de 62,02±3,44 anos, com PANS. Finalmente, 477 indivíduos, com entre 51 e 70 anos, incluiu 257 homens e 220 mulheres com média de 61,08±4,31 anos, sem PANS, constituíram o grupo controle D.
Avaliação clínica e medidas audiológicasTodos os participantes foram submetidos a um exame anual de rotina que incluiu um breve questionário de dados demográficos, histórico de doença sistêmica, histórico de vida pessoal para hábitos como fumar e consumo de álcool, radiografia de tórax, eletrocardiograma e perfil bioquímico de amostras de sangue.
Todos os sujeitos foram analisados por meio de audiometria tonal, timpanometria e potencial evocado auditivo de tronco encefálico (Peate). A audiometria foi feita com um audiômetro de tom puro modelo GSI‐61 (Grason‐Stadler, Inc., Madison WI, EUA). A timpanometria usou o equipamento GSI‐Tymp star II (Grason‐Stadler, Inc.). A resposta auditiva do tronco encefálico foi medida através do Smart EP (Intelligent Hearing Systems, Miami, Flórida, EUA). A média do limiar do tom puro (LTP) da frequência aérea dos pacientes a 0,5kHz, 1kHz, 2kHz e 4kHz foi calculada para cada indivíduo e, em seguida, os indivíduos foram agrupados de acordo com o LTP das orelhas. A diminuição da audição no grupo experimental ultrapassou os 26dB de nível auditivo (NA) com duas ou mais quedas consecutivas na frequência. Os indivíduos foram examinados através de Peate. O pico de latência das ondas I, III e V e a latência interpicos das ondas I?V foram determinados e a diferença de latência interlateral do pico de latência e da latência interpico foi comparada. Aqueles que preencheram as seguintes condições: quando o pico de latência da onda V se estendia por mais de 6,1ms; ou a onda III e a onda V não puderam ser induzidas; ou o alongamento da latência interpico das ondas I?V foi maior ou igual a 4,0ms; ou a diferença de latência interlateral com a onda V foi maior do que 0,4ms e aqueles considerados positivos para lesões pós‐cocleares não foram incluídos no estudo. Os indivíduos foram excluídos se tivessem surdez condutiva, surdez induzida por ruído e surdez causada por outras causas, como como surdez induzida por drogas, surdez súbita, doença de Ménière, otosclerose, otite adesiva, neuroma acústico e surdez autoimune. Além disso, os indivíduos também foram excluídos se tivessem doenças sistêmicas, inclusive diabetes, hipertensão, doença cardíaca, hiperlipidemia, doença renal crônica, doença pulmonar obstrutiva crônica e abuso de álcool. Entre os candidatos que preencheram essas condições, os indivíduos que tiveram perda progressiva da audição após os 50 anos foram categorizados no grupo B, enquanto os indivíduos com perda auditiva progressiva após os 29 anos foram alocados para o grupo A.
Testes de análise Sequenom MassAPPAY SNPCom base em estudos anteriores, rs11928865 e rs11920109 foram selecionados como os SNPs de GRM7 relevantes para a PANS relacionada à idade.1,2 A genotipagem foi feita com amplificação por reação de polimerase em cadeia (PCR) e análises MassARRAY específicas para SNPs. O DNA genômico foi extraído de amostras de sangue total com o minikit QIAamp DNA Blood (Qiagen, Valencia, CA, EUA) de acordo com as instruções do fabricante. Os primers foram projetados com o software Assay Designer 3.1 e foram sintetizados pelo Instituto de Genômica de Pequim, na China. O método MassARRAY foi usado para analisar o genótipo dos dois loci de SNP selecionados. A amplificação por PCR foi feita com configuração de abertura de 384 na PCR (Applied Biosystems, Pequim, China). As condições do ciclo da PCR incluíram uma etapa de desnaturação inicial a 94°C por 5min, seguida por 45 ciclos de desnaturação a 94°C por 20s, anelamento a 56°C por 30s e uma extensão a 72°C por 1min e uma fase final de extensão a 72°C por 3min. O sequenciamento do produto da PCR foi feito com o analisador MassARRAY (Applied Beijing Genomics Institute, Pequim, China).
Análises estatísticasForam feitas com o software SPSS 20.0 (SPSS Inc., Chicago, IL, EUA). Aplicou‐se o equilíbrio de Hardy‐Weinberg e examinamos a representação grupal das frequências gênicas em cada grupo. Os dados de medição foram avaliados com o teste t e os dados categóricos foram avaliados com um teste de qui‐quadrado multicamada ou teste exato de Fisher. As comparações entre alelos intergrupos e frequência genotípica foram feitas com o teste do qui‐quadrado. Os riscos relativos dos genótipos são indicados pelo odds ratio (OR) e pelo intervalo de confiança de 95% (IC95%). A diferença foi estatisticamente significante para p <0,05.
ResultadosA faixa do teste de reconhecimento de fala do grupo A foi de 26‐120dB e o limiar auditivo médio foi de 50,91±19,34dB. Os respectivos valores para o grupo B foram 26‐120dB e 53,53±18,44dB. Os respectivos valores para o grupo C foram ‐5 dB‐25dB e 9,22±6,39dB. Os respectivos valores para o grupo D foram ‐5 dB‐25dB e 11,33±6,24dB. Os pacientes foram pareados por idade e sexo entre os grupos de perda auditiva e controle para as análises. Não houve diferenças significantes em relação à idade e ao sexo entre os grupos PANS e controle.
GenotipagemAs distribuições de frequência de alelos e genótipos de rs11928865 e rs11920109 estavam de acordo com o equilíbrio de Hardy‐Weinberg.
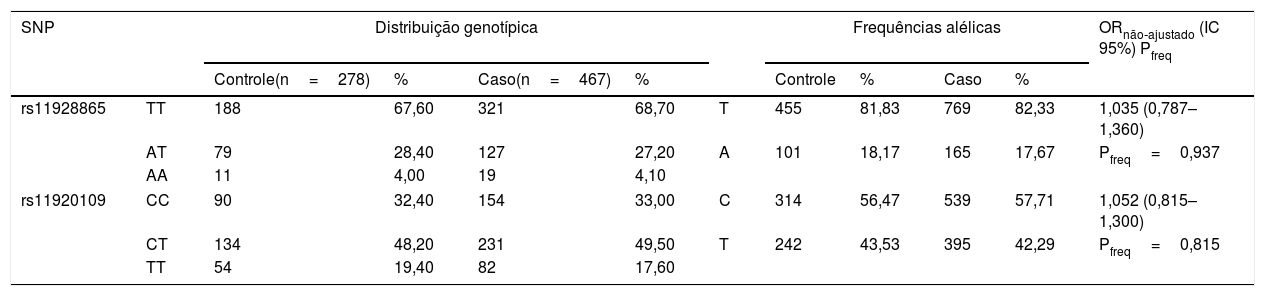
A tabela 1 mostra as diferenças nas frequências de alelos e genótipos dos polimorfismos rs11928865 (Pfreq=0,937, OR nãoajustado=1,035, IC95%=0,787–1,360) e rs11920109 (Pfreq=0,815, OR nãoajustado=1,052, IC95%=0,815–1,300) para indivíduos no grupo com de 30 a 50 anos com PANS e grupo controle, que não diferiram significantemente entre si (tabela 1).
Associação dos SNPs rs11928865 e rs11920109 no grupo com perda auditiva neurossensorial com de 30 a 50 anos e no grupo controle com de 30 a 50 anos
| SNP | Distribuição genotípica | Frequências alélicas | ORnão‐ajustado (IC 95%) Pfreq | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Controle(n=278) | % | Caso(n=467) | % | Controle | % | Caso | % | ||||
| rs11928865 | TT | 188 | 67,60 | 321 | 68,70 | T | 455 | 81,83 | 769 | 82,33 | 1,035 (0,787–1,360) |
| AT | 79 | 28,40 | 127 | 27,20 | A | 101 | 18,17 | 165 | 17,67 | Pfreq=0,937 | |
| AA | 11 | 4,00 | 19 | 4,10 | |||||||
| rs11920109 | CC | 90 | 32,40 | 154 | 33,00 | C | 314 | 56,47 | 539 | 57,71 | 1,052 (0,815–1,300) |
| CT | 134 | 48,20 | 231 | 49,50 | T | 242 | 43,53 | 395 | 42,29 | Pfreq=0,815 | |
| TT | 54 | 19,40 | 82 | 17,60 | |||||||
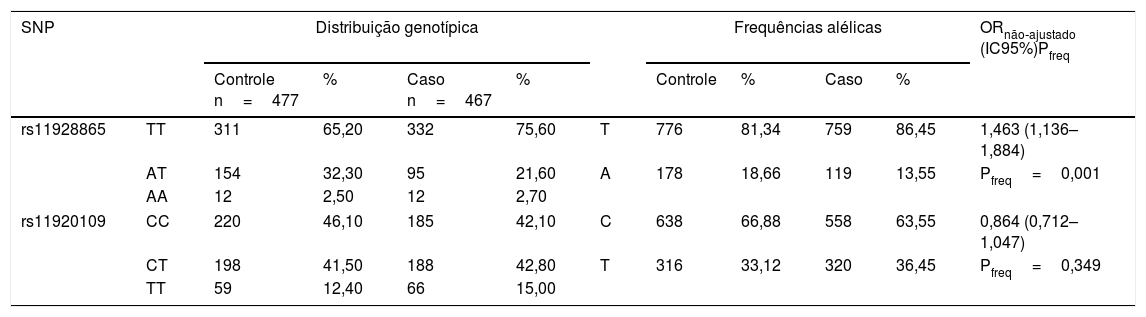
A tabela 2 mostra a distribuição dos genótipos do polimorfismo rs11928865 e frequências de alelos para os indivíduos dos grupos B e controle. As distribuições genotípicas do polimorfismo rs11928865 foram significantemente diferentes entre os grupos (Pfreq=0,001, OR nãoajustado=1,463, IC95%=1,136±1,884). No entanto, as distribuições genotípicas do SNP rs11920109 nesses grupos não foram significantemente diferentes (Pfreq=0,349, OR nãoajustado=0,846, IC95%=0,712±1,047) (tabela 2).
Associação dos SNPs rs11928865 e rs11920109 no grupo com perda auditiva neurossensorial com de 51 a 70 anos e no grupo controle com de 51 a 70 anos
| SNP | Distribuição genotípica | Frequências alélicas | ORnão‐ajustado (IC95%)Pfreq | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Controle n=477 | % | Caso n=467 | % | Controle | % | Caso | % | ||||
| rs11928865 | TT | 311 | 65,20 | 332 | 75,60 | T | 776 | 81,34 | 759 | 86,45 | 1,463 (1,136–1,884) |
| AT | 154 | 32,30 | 95 | 21,60 | A | 178 | 18,66 | 119 | 13,55 | Pfreq=0,001 | |
| AA | 12 | 2,50 | 12 | 2,70 | |||||||
| rs11920109 | CC | 220 | 46,10 | 185 | 42,10 | C | 638 | 66,88 | 558 | 63,55 | 0,864 (0,712–1,047) |
| CT | 198 | 41,50 | 188 | 42,80 | T | 316 | 33,12 | 320 | 36,45 | Pfreq=0,349 | |
| TT | 59 | 12,40 | 66 | 15,00 | |||||||
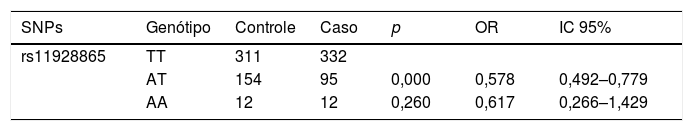
A tabela 3 mostra os resultados das análises logísticas após os dados terem sido ajustados para idade e sexo. Modelos de regressão logística foram construídos para controlar potenciais efeitos de confusão nos genótipos do GRM7, que mostraram uma diferença significante nos alelos AT versus TT do rs11928865 nos grupos PANS e controle de 51 a 70 anos (p=0,000, OR nãoajustado=0,578, IC95%=0,429–0,779), enquanto a diferença nos alelos TT vs. AA não foi estatisticamente significante (p=0,260, OR=0,617, IC95%=0,266–1,429) (tabela 3).
Modelo de regressão logística: análise dos efeitos dos genótipos GRS7 SNP rs11928865 nos grupos com perda auditiva neurossensorial com de 51–70 anos e nos grupos controle de 51–70 anos
| SNPs | Genótipo | Controle | Caso | p | OR | IC 95% |
|---|---|---|---|---|---|---|
| rs11928865 | TT | 311 | 332 | |||
| AT | 154 | 95 | 0,000 | 0,578 | 0,492–0,779 | |
| AA | 12 | 12 | 0,260 | 0,617 | 0,266–1,429 |
As distribuições genotípicas foram significantemente diferentes entre indivíduos com entre 51 e 70 anos com ou sem PANS, indicaram que o SNP rs11928865 em GRM7 está associado à susceptibilidade à PANS em indivíduos nessa faixa etária. No entanto, o SNP rs11928865 não foi significantemente diferente entre indivíduos com entre 30 e 50 anos com e sem PANS, o que sugere que rs11928865 não está relacionado à suscetibilidade a PANS nessa faixa etária. Além disso, nenhuma associação foi identificada entre rs11920109 e PANS neste estudo.
DiscussãoA incidência de PANS está intimamente relacionada à idade e essa incidência aumenta gradualmente com a idade. Fatores ambientais e genéticos são as duas principais causas de PANS. Os fatores genéticos representam 35% a 55% da deficiência auditiva relacionada à idade.3 Anormalidades genéticas, como a mutação no gene que codifica a conexina 26,4 mutação frameshift grainyhead‐like 25 e mutações no gene da caderina, foram associadas com PANS.6 No entanto, a maioria dos adultos com PANS não tem um histórico genético familiar típico.
Este estudo mostra que o rs11928865 do GRM7 foi associado à suscetibilidade à PANS, o que é consistente com os resultados de estudos anteriores.1,2 No entanto, os indivíduos dos estudos anteriores diferiram em relação aos critérios de inclusão e exclusão usados neste estudo, bem como outros fatores, como idade, sexo e condição geral. Luo et al. selecionaram homens chineses com entre 70 e 100 anos como sujeitos e o estudo da doença sistêmica também foi incluído na pesquisa.2 O polimorfismo rs11928865 mostrou uma associação significante com PANS em outro estudo com indivíduos europeus com 53 anos ou mais.1 Em outro estudo, os indivíduos americanos tinham uma média de 71,3 anos; foi relatada uma correlação significante entre os SNPs do GRM7 e percepção auditiva.7
Além disso, estudos anteriores também demonstraram que sexo e idade podem influenciar a PANS.8,9 O risco de PANS está diretamente correlacionado com a idade; os homens são mais suscetíveis a ela do que as mulheres e a perda auditiva tende a ser mais grave nos homens do que nas mulheres.10
Os resultados deste estudo não mostraram associação entre o locus rs11928865 do GRS7 e PANS no grupo A e nenhum resultado positivo foi observado para o locus rs11920109, refletiu a complexidade da PANS, devido ao envolvimento de múltiplos genes, fatores ambientais, drogas ototóxicas, doenças sistêmicas e hábitos de vida. Vários genes candidatos patogênicos, inclusive os genes que codificam a conexina 26 (GJB2),4,11,12 grainyhead‐like 2 (GRHL2),5 caderina (CDH23),6 o gene de canal de potássio dependente da voltagem 4 (KCNQ4),13 N‐acetiltransferase (NAT),14–16 Apolipoproteína E (APOE)17 e o gene da proteína desacopladora 2 (UCP2)18,19 já foram relacionados à suscetibilidade genética à PANS e é provável que esses genes interajam na patogênese dela.
ConclusãoO polimorfismo rs11928865 foi associado a suscetibilidade à PANS nos indivíduos do grupo B, mas não nos indivíduos do grupo A. Isso sugere que diferenças na idade de início da PANS nas duas faixas etárias, medidas pelo tempo e natureza da perda auditiva, podem ser explicadas por diferentes etiologias genéticas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Aos pacientes por sua participação. Este trabalho foi apoiado pela Natural Science Foundation of FuJian Province, subvenção n° 2015J01405.
Como citar este artigo: Xie S, Li J, Wang W, Chen X. Association of glutamate metabotropic receptor polymorphisms and sensorineural hearing loss in adults of different age groups. Braz J Otorhinolaryngol. 2019;85:560–4.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.