Burnt sugarcane harvesting requires intense physical exertion in an environment of high temperature and exposure to particulate matter.
ObjectiveTo evaluate the effects of burnt sugarcane harvesting on rhinitis symptoms and inflammatory markers in sugarcane workers.
MethodsA total of 32 male sugarcane workers were evaluated with questionnaire for rhinitis symptoms, and for inflammatory markers on peripheral blood and nasal lavage, in the non‐harvesting, and 3 and 6 months into the sugarcane harvesting period. Weather data and particulate matter fine concentrations were measured in the same day.
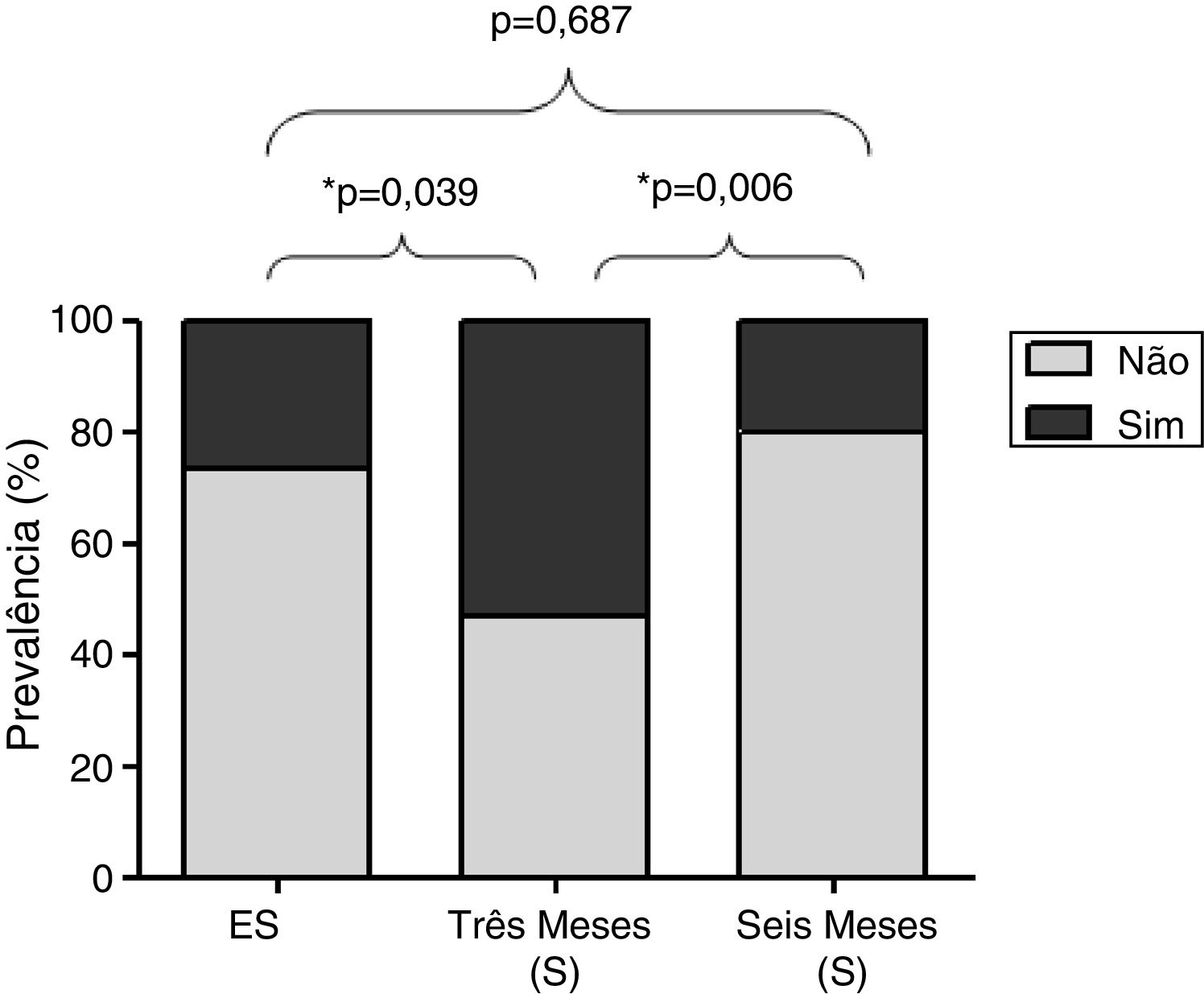
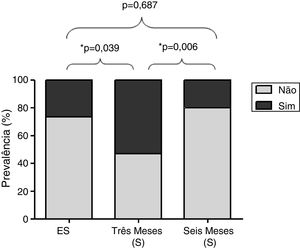
ResultsThe particulate matter concentrations in sugarcane harvesting were 27 (23–33μg/m3), 112 (96–122μg/m3), and 63 (17–263μg/m3); 24h temperatures were 32.6 (25.4–37.4°C), 32.3 (26.7–36.7°C) and 29.7 (24.1–34.0°C) and relative humidities were 45.4 (35.0–59.7%), 47.9 (39.1–63.0%), and 59.9 (34.7–63.2%) in the non‐harvesting period, three and 6 months of the harvesting period. The age was 37.4±10.9 years. The prevalence of rhinitis symptoms was significantly higher at 3 months of the harvesting period (53.4%), compared to non‐harvesting period (26.7%; p=0.039) and at 6 months into the harvesting period (20%; p=0.006). Concentrations of interleukin 6 (IL‐6) in nasal lavage increased after 3 months of the harvesting period compared to the non‐harvesting period (p=0.012). The presence of rhinitis symptoms, after 3 months of the harvesting period, was directly associated with blood eosinophils and inversely associated with neutrophils.
ConclusionsAfter 3 months of work in burnt sugarcane harvesting the prevalence of rhinitis symptoms and IL‐6 in nasal lavage increased. Furthermore, eosinophil counts were directly associated with the rhinitis symptoms in the period of higher concentration of particulate matter.
A colheita de cana‐de‐açúcar queimada requer esforço físico intenso em um ambiente com altas temperaturas e exposição a material particulado.
ObjetivoAvaliar os efeitos da colheita de cana-de-açúcar queimada nos sintomas de rinite e marcadores inflamatórios de cortadores de cana-de-açúcar.
MétodoForam avaliados 32 cortadores de cana-de-açúcar do sexo masculino por meio de um questionário para sintomas de rinite, e marcadores inflamatórios em sangue periférico e lavado nasal, no período de entressafra, e em 3 e 6 meses após o início da colheita da cana-de-açúcar. Os dados climáticos e as concentrações de material particulado fino foram medidos no mesmo dia.
ResultadosO material particulado fino na entressafra e em 3 e 6 meses de safra foi 27 (23-33 μg/m3), 112 (96-122 μg/m3) e 63 (17-263 μg/m3), respectivamente; a temperatura de 24 horas foi 32,6 (25,4°-37,4°C), 32,3 (26,7°-36,7°C) e 29,7 (24,1°-340°C) e a umidade relativa do ar foi 45,4 (35,0%-59,7%), 47,9 (39,1%-63,0%), e 59,9 (34,7%-63,2%), na entressafra, 3 e 6 meses após o início da colheita. A idade foi de 37,4 ± 10,9 anos. A prevalência de sintomas de rinite foi significativamente maior em 3 meses da S (53,4%), comparado com a entressafra (26,7%; p = 0,039) e 6 meses da safra (20%; p = 0,006). As concentrações de interleucina 6 (IL-6) no lavado nasal aumentaram após 3 meses do início da colheita comparado com a entressafra (p = 0,012). A presença de sintomas de rinite, após 3 meses do início da colheita, foi diretamente associada com eosinófilos e inversamente associada com neutrófilos.
ConclusõesApós 3 meses do início da colheita da cana-de-açúcar queimada, houve aumento na prevalência de sintomas de rinite e IL-6 em LN. Além disso, as contagens de eosinófilos foram diretamente associadas aos sintomas de rinite no período de maior concentração de material particulado.
O Brasil é o maior produtor de açúcar e etanol a partir do cultivo da cana‐de‐açúcar.1 Mais de 50% do cultivo está concentrado na região centro‐sul do país,2 com uma produção de 571,34 milhões de toneladas de cana na safra de 2014/2015.3
Apesar dos avanços tecnológicos da colheita mecanizada no Estado de São Paulo, a cana ainda é colhida manualmente em vários estados do Brasil.4 Para facilitar o corte manual e eliminar a incidência de acidentes causados por animais venenosos, no período da safra é feita a queima noturna da palha da cana‐de‐açúcar.5,6 Essa prática libera uma porcentagem considerável de matéria gasosa e particulada (MP) no meio ambiente, as quais são inaladas pelo trabalhador rural.7–11
O trabalho de corte manual da cana‐de‐açúcar exige um esforço físico intenso do trabalhador; além disso, os Padrões Regulatórios Brasileiros 3112 não incluem o uso de máscaras de proteção. Assim, alguns trabalhadores usam panos em seus rostos para evitar o desconforto respiratório, embora não haja evidência científica de que essa estratégia evite a inalação dos poluentes resultantes da queima. O trabalho também é feito sob alta temperatura ambiental e baixa umidade, o que provoca efeitos adversos, como estresse físico e psicológico e aumento do esforço respiratório.8–11
A primeira linha de defesa do sistema respiratório é o nariz, responsável pela umidificação, aquecimento e filtração do ar circulante, o qual é vulnerável aos efeitos da poluição do ar. Quando os indivíduos são expostos a um ambiente com a presença de poluentes, há um aumento o risco de desenvolvimento de sintomas de rinite, seja por fatores irritantes ou mecanismos imunomediados.13–15
A rinite é definida como a presença de congestão nasal, rinorreia, espirros e/ou coceira nasal.15,16 A patogênese da rinite não é bem compreendida, mas os estudos mostram um aumento das células inflamatórias, como eosinófilos, neutrófilos e linfócitos, e aumento de interleucinas pró‐inflamatórias na mucosa nasal.17–20 Entre as interleucinas pró‐inflamatórias, a IL‐6, após a sua exposição ao MP, aumenta na fase aguda da inflamação, neutraliza os agentes patogênicos e minimiza o dano tecidual.21 A IL‐4, por outro lado, tem ação anti‐inflamatória, bloqueia a síntese de várias interleucinas, inclusive a IL‐6, com o objetivo de produzir anticorpos e reações imunes contra alérgenos.22 Ambas estão presentes na rinite relacionada ao trabalho causada por fatores alérgicos ou não alérgicos (irritantes) presentes no local de trabalho.16
Apesar das evidências sobre os efeitos deletérios do trabalho no corte de cana‐de‐açúcar queimada, estudos dos transtornos causados nas vias aéreas superiores são escassos.23–26 Portanto, as avaliações feitas no terceiro e sexto mês após o início da colheita visaram a identificar se o tempo de exposição ao material particulado fino (MP2.5) e as variações climáticas durante a época da colheita poderiam ser responsáveis pelo aumento dos sintomas de rinite e dos marcadores inflamatórios e se essas alterações seriam persistentes até o fim da colheita, o que justifica e contribui para a implantação de possíveis medidas de prevenção nessa população. Portanto, o objetivo do presente estudo foi avaliar os efeitos da colheita de cana‐de‐açúcar queimada nos sintomas de rinite e em marcadores inflamatórios em trabalhadores de cana‐de‐açúcar.
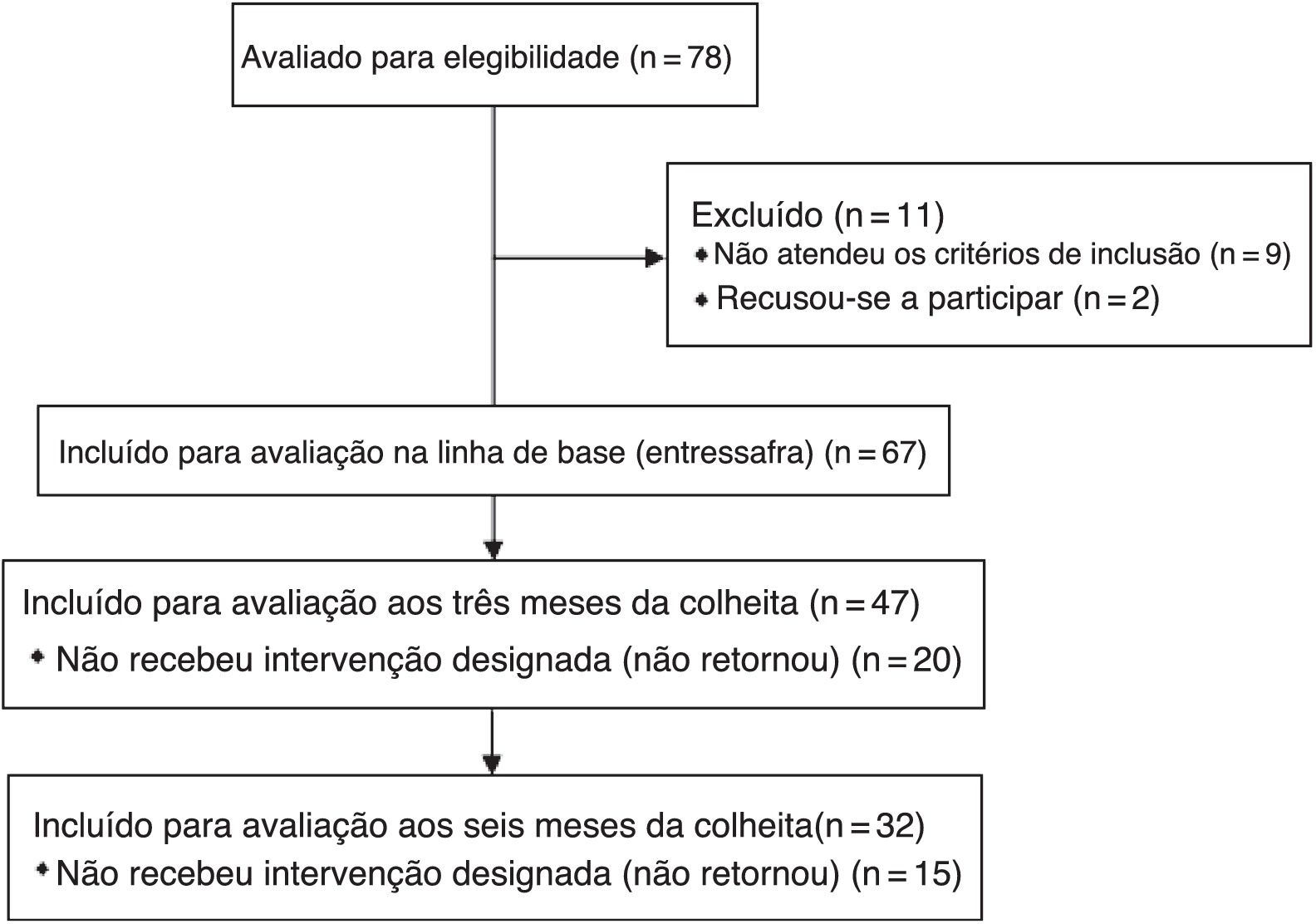
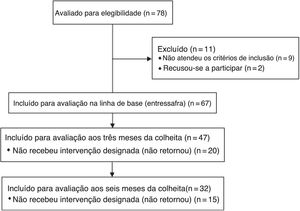
MétodoUm estudo longitudinal, de painel, com medidas repetidas, foi feito com trabalhadores de cana‐de‐açúcar em uma usina de açúcar e álcool. Inicialmente, 78 trabalhadores interessados foram considerados elegíveis para avaliação. Desses, 67 foram incluídos na linha de base (entressafra), porém apenas 32 completaram todas as avaliações (fig. 1).
Os critérios de exclusão foram doenças pulmonares crônicas pré‐existentes, infecção das vias aéreas superiores no momento da avaliação e uso regular de medicamentos anti‐inflamatórios.
Todos os indivíduos foram previamente informados sobre os objetivos e procedimentos do estudo e, após a concordância e a assinatura do termo de consentimento livre e esclarecido, conforme a Declaração de Helsinque, participaram do estudo de forma voluntária e efetiva. Todos os procedimentos foram aprovados pelo Comitê de Ética em Pesquisa (parecer n° 644.598).
Todos os procedimentos foram feitos no campo às 7h em três períodos: entressafra (ES – plantação de cana‐de‐açúcar, quando não há colheita de cana queimada, março‐abril/2014) e safra (S – três e seis meses após o início da colheita, quando há corte manual de cana queimada, julho‐outubro/2014). Esse processo de queima da cana‐de‐açúcar ocorre durante a noite no período de S e sua duração depende da extensão da área plantada entre maio e novembro. A colheita ocorre no dia seguinte à queima, e somente nesse período. No entanto, os trabalhadores de cana‐de‐açúcar também fazem o plantio no período de ES (janeiro a abril) e, portanto, trabalham durante o ano em ambos os períodos.
Os voluntários foram inicialmente entrevistados por meio de questionários, de onde foram obtidos dados gerais (dados pessoais, histórico de tabagismo) e da atividade ocupacional (período de trabalho, quantidade de cana‐de‐açúcar colhida por dia e tempo de trabalho no setor).
Durante os três períodos, os voluntários foram avaliados quanto à presença de sintomas de rinite por meio de um questionário que continha quatro perguntas sobre sintomas nasais (prurido nasal, espirros, congestão nasal e rinorreia). Quando dois ou mais sintomas foram relatados, o indivíduo foi diagnosticado como portador de rinite por um médico especialista. Para a análise de marcadores inflamatórios (IL‐6 e IL‐4), o LN foi coletado26 e analisado pelo método de ensaio imunoenzimático (Elisa, eBioscience, Affymetrix, Califórnia, Estados Unidos), com o kit Ready‐SET‐Go para a análise da IL‐6 e o kit de alta sensibilidade para a IL‐4, de acordo com as instruções do fabricante. Para a contagem total de eosinófilos e neutrófilos em amostras de sangue venoso, fez‐se a contagem automática com o equipamento XT‐1800, Sismex, modelo Ap.XT17476, Japão, a partir da coleta de quatro mililitros de sangue da veia antecubital em um tubo a vácuo.
O monitoramento do MP2.5 foi feito durante o dia útil (7h às 15h) dos trabalhadores da cana‐de‐açúcar por dois a três dias, em cada período especificado. A análise foi feita com um espectrofotômetro Dust Trak Aerosol Monitor, Modelo 8533 (TSI Inc., Mn. EUA), calibrado diariamente, com uma calibração de fluxo de 1,7 L/min, o que gerou um valor de MP expresso em μg/m3.24
Os dados de temperatura e umidade relativa foram registrados simultaneamente aos do MP2.5, através de um termo‐higrômetro DataLogger modelo DHT‐2261 Full Range. Esse dispositivo coleta os dados de temperatura e umidade relativa minuto a minuto. Ambos os equipamentos foram colocados a uma altura de aproximadamente um metro e a uma distância de dois a três metros dos trabalhadores, sem interferir no trabalho.
Os dados são expressos como média e desvio‐padrão (DP) para uma distribuição normal, ou mediana e intervalo interquartil (diferença entre o 1° e o 3° quartis, IIQ), com exceção dos dados categóricos, expressos em valores absolutos e porcentagem. Para as comparações entre a prevalência de sintomas de rinite nos períodos, foi feito o teste de McNemar. Os resultados dos dados contínuos obtidos durante a ES e após três e seis meses da S foram comparados através de medidas repetidas com teste post hoc de Bonferroni (esfericidade assumida ou correção de Greenhouse‐Geisser do teste de Mauchly). O teste de Friedman com post hoc de Dunn foi feito quando houve violação da esfericidade dos dados. A análise de modelos lineares generalizados (equações de estimação generalizadas – GEE) para dados dependentes com ajustes para idade, índice de massa corporal (IMC) e tabagismo, com o uso como referência da ES, foi feita para identificar possíveis relações entre os sintomas de rinite e os marcadores inflamatórios. A análise estatística foi feita com o pacote estatístico SPSS, versão 15 (SPSSInc., Chicago, IL, EUA), e os modelos GEE foram feitos com o programa R. Um valor de p< 0,05 foi considerado estatisticamente significativo para todos os testes.
ResultadosForam avaliados 67 trabalhadores de cana‐de‐açúcar do sexo masculino na ES e três e seis meses após o início da S. A média da idade foi de 37,4±10,9 anos. Entre os voluntários, 52,2% (n=35) nunca fumaram, 23,9% (n=16) eram fumantes leves a moderados, fumavam em média 9,3±7,0 cigarros/dia (8,5±8,7 pacotes‐ano) e 23,9% (n=16) eram ex‐fumantes (9,5±11,4 pacotes‐ano) (tabela 1).
Características gerais dos trabalhadores da cana na ES (n=67)
| Características demográficas e antropométricas | |
| Idade (anos) | 37,4±10,9 |
| Peso (kg) | 72,0±11,2 |
| Altura (cm) | 169,2±7,0 |
| IMC (Kg / m2) | 25,2±3,9 |
| Atividade ocupacional | |
| Anos trabalhados | 11,2±7,9 |
| Colheita de cana/dia (toneladas) | 9,4±2,6 |
Dados expressos em média (DP); IMC, índice de massa corporal (IMC).
A figura 2 mostra a prevalência de sintomas de rinite em 32 participantes avaliados nos três períodos. A prevalência foi significativamente maior três meses após o início da S (53,4%) em comparação com o período de ES (26,7%, p=0,039) e seis meses após o início da S (20%, p=0,0006).
Os dados da tabela 2 mostram os marcadores inflamatórios no LN, eosinófilos e neutrófilos circulantes. Observou‐se que houve aumento significante nas concentrações de IL‐6 no LN após três meses da S, em comparação com a ES (p=0,012). Os eosinófilos e os neutrófilos não apresentaram diferenças significantes entre os períodos.
Análise de medidas repetidas no perfil inflamatório nasal e sistêmico em 32 trabalhadores de cana‐de‐açúcar durante a ES e 3 e 6 meses da S
| ES | 3 meses da S | 6 meses da S | p‐valor | |
|---|---|---|---|---|
| Inflamação nasal | ||||
| IL‐6 (pg/mL) | 2,52 (1,77‐4,09) | 4,21 (2,82‐5,98)a | 3,14 (2,58‐6,18) | 0,046b |
| IL‐4 (pg/mL) | 2,50 (1,42‐5,55) | 2,43 (1,56‐5,37) | 3,29 (1,35‐8,21) | 0,688 |
| Inflamação sistêmica | ||||
| Eosinófilos (mm3) | 158 (84,08‐289,50) | 183,90 (122,73‐397,23) | 205,70 (152,48‐348,33) | 0,427 |
| Neutrófilos (mm3) | 2936,05 (2254,15‐3655,35) | 3289,55 (2310,93‐4012,63) | 2745,50 (2336,03‐4017,53) | 0,793 |
Dados expressos em mediana (IQR, 1° e 3° quartis).
A tabela 3 mostra os dados de regressão múltipla que demonstram que na S (após três meses) a presença dos sintomas de rinite foi diretamente associada a eosinófilos no sangue e inversamente associada a neutrófilos na análise por GEE.
Efeitos estimados da S, neutrófilos e eosinófilos nos sintomas de rinite (n=32)
| Efeito variávela | β | EP | p‐valorb | |
|---|---|---|---|---|
| Sintomas de rinite | Três meses (S) | 1,2541385314 | 1,307246 | 0,0056 |
| Neutrófilos | ‐0,4122999 | 0,167252 | 0,00568 | |
| Eosinófilos | 1,495592 | 0,611645 | 0,0141 |
β, coeficiente de regressão; EP, erro padrão.
As concentrações de MP2.5 foram de 27,0 (23,0‐33,0μg/m3, 111,5 (96,5‐122,3μg/m3) e 63,2 (17,1‐262,6μg/m3) na ES e aos três e seis meses da S, respectivamente (p< 0,0001). As medidas da temperatura média em 24 horas foram 32,6 (25,4°–37,4°C), 32,3 (26,7°–36,7°C) e 29,7 (24,1°–34,0°C) e da umidade relativa em 24 horas foram 45,4 (35,0%–59,7%), 47,9 (39,1%–63,0%) e 59,9 (34,7%–63,2%) na ES e no terceiro e sexto meses da S, respectivamente (p< 0,0001).
DiscussãoOs dados deste estudo revelaram que o período de três meses após a colheita é caracterizado pelas maiores concentrações de MP2.5 registradas no campo de cana‐de‐açúcar e por baixa temperatura ambiental média em 24 horas; quando os trabalhadores de cana‐de‐açúcar apresentam maior prevalência de sintomas de rinite e aumento das concentrações de IL‐6 no LN. Além disso, os sintomas de rinite foram diretamente associados aos eosinófilos e negativamente com neutrófilos.
A presença de sintomas de rinite pode ser influenciada por fatores endógenos (por exemplo, fatores genéticos, deficiências imunológicas, disfunção na clearance mucociliar), assim como pela idade e sexo.27 No entanto, desencadeadores exógenos (por exemplo, poluição do ar, vírus e bactérias, temperatura, umidade relativa e tabagismo), especialmente no local de trabalho, têm também sido objeto de pesquisa no desenvolvimento da rinite.28–30
Os efeitos sobre a saúde respiratória dos trabalhadores da cana‐de‐açúcar foram descritos na literatura9,11,23–25,31 e podem ser atribuídos principalmente à inalação de MP resultante da queima de cana‐de‐açúcar e à ressuspensão de partículas do solo pelo movimento e atividade dos trabalhadores e movimento dos caminhões. No entanto, nenhum estudo avaliou isoladamente os efeitos dos poluentes, da temperatura e do esforço físico, fatores esses que podem contribuir para influenciar os achados.
Estudos têm demonstrado que a frequência dos sintomas relacionados à rinite pode ser influenciada pela dose‐resposta à exposição a qual os indivíduos são submetidos, varia de acordo com os tipos de poluentes e suas condições de uso, além dos fatores de confusão, como a exposição a fumaça de cigarro.32 Assim, mudanças na concentração de poluentes liberados pela queima da cana‐de‐açúcar podem influenciar os relatos dos sintomas respiratórios.8,23,33,34 Isso pode explicar a maior prevalência de sintomas de rinite na avaliação após três meses da S em comparação com a ES e seis meses da S, o que explica que nível de exposição foi capaz de desencadear tais variações, além da atopia.
O estudo de Prado et al.,23 feito com trabalhadores de cana‐de‐açúcar e voluntários saudáveis de uma cidade vizinha ao campo da plantação, observou que os trabalhadores apresentavam aumento de sintomas como chiado, chiado com falta de ar, despertar com tosse, alergias nasais e febre alta durante o período de S em comparação com o de ES.
O estudo de Gascon et al.34 avaliou 104 trabalhadores em uma refinaria de cana‐de‐açúcar exposta a poeira, bagaço de cana e seus biocontaminantes e observaram que durante o período de colheita havia um aumento nos relatos de chiado, falta de ar, problemas oculares e rinite entre aqueles expostos ao bagaço e poeira. Outro estudo feito com crianças expostas à queima de biomassa observou uma prevalência de 11% para a asma e 33,2% para os sintomas de rinite, o que foi mais frequente de junho a outubro, coincidiu com o período da queima de cana‐de‐açúcar.35
Um dos possíveis mecanismos envolvidos no aumento da incidência de rinite pode envolver a exposição ao MP, que aumenta durante o trabalho que requer maior esforço físico, além da queima de cana‐de‐açúcar. Estudos sugerem que a inalação pode causar danos em diferentes níveis do sistema respiratório, causar doenças inflamatórias nas vias aéreas, inclusive rinite alérgica ou crônica.36–38 O estudo de Hong et al.,39 que avaliou o efeito tóxico do MP2.5 atmosférico sobre células epiteliais nasais humanas, observou alterações na morfologia e diminuição da viabilidade das células epiteliais nasais após a exposição. Além disso, a exposição aumentou os níveis de espécies reativas de oxigênio, reduziu a atividade enzimática antioxidante intracelular e induziu a expressão das citocinas inflamatórias IL‐13, IL‐6, IL‐8 e TNF‐α. Esses resultados mostraram que o MP2.5 induziu estresse oxidativo e resposta inflamatória, contribuiu para a disfunção da barreira epitelial nasal.
No presente estudo o fator “poluição atmosférica” pode ter sido decisivo para que a IL‐6 estivesse aumentada no lavado nasal. O estudo de Steenhof et al.40 feito com 31 voluntários em cinco locais (dois locais de tráfego, uma estação de trem subterrânea, uma fazenda e um local subterrâneo em área urbana) visava avaliar biomarcadores pró‐inflamatórios nasais e sanguíneos após cinco horas de exposição à MP2.5‐10, endotoxinas do MP10, poluentes gasosos (O3 e NO2), carbono elementar e orgânico, potencial oxidativo e vestígios metálicos e metais inorgânicos secundários. Após duas e 18 horas de exposição, eles observaram uma associação com IL‐6 e IL‐8 no LN, com endotoxinas do MP10, carbono orgânico e nitrato.
Outro achado do presente estudo foi a associação direta entre os sintomas de rinite e eosinófilos nos três meses da S. Acredita‐se que os eosinófilos sejam predominantes nesse tipo de inflamação, especialmente na fase tardia da resposta nasal a alérgenos ocupacionais.20,41 Esses são conhecidos como células efetoras primárias na patogênese da rinite alérgica e considera‐se que o processo de recrutamento para o epitélio nasal e a submucosa mostram resultados combinados em várias moléculas e células de sinalização.
O estudo de Castano et al.20 investigou o tipo e a cinética da resposta inflamatória nasal após exposição a alérgenos ocupacionais, observou um aumento significante na porcentagem de eosinófilos aos 30 minutos após exposição a alérgenos ocupacionais. Não foram observadas alterações significantes nos níveis de neutrófilos nasais. Os achados corroboram o estudo de Zuurbier et al.,42 que avaliou 34 indivíduos saudáveis expostos a duas horas de contato com tráfego veicular. Houve associação inversa entre o número de partículas e MP2.5 com neutrófilos. Isso pode explicar, pelo menos em parte, os achados de nosso estudo, no qual observamos uma associação direta com eosinófilos e inversa com neutrófilos aos três meses da S.
Portanto, este estudo espera contribuir para e incentivar procedimentos preventivos e intervencionistas na saúde dessa população, especialmente nos riscos de sintomas de rinite, os quais podem preceder o desenvolvimento de asma ocupacional. Como limitação deste estudo, é possível indicar a falta do uso de um questionário validado na língua portuguesa para sintomas de rinite em adultos.
ConclusãoEm resumo, os resultados mostraram que, aos três meses de trabalho da colheita de cana‐de‐açúcar queimada, houve aumento na prevalência de sintomas de rinite e maiores concentrações de IL‐6 em nível local; além disso, o aumento nas contagens de eosinófilos foi diretamente associado aos sintomas da rinite no período de maior concentração de matéria particulada.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), processo 2014/08029‐0.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Trevisan IB, Santos UP, Leite MR, Ferreira AD, Silva BS, Freire AP, et al. Burnt sugarcane harvesting is associated with rhinitis symptoms and inflammatory markers. Braz J Otorhinolaryngol. 2019;85:337–43.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.