A apneia obstrutiva do sono é consequência do colapso das vias aéreas superiores Qualquer região de obstrução nas vias aéreas superiores pode contribuir para o colapso da faringe. A obesidade e os distúrbios relacionados à obesidade desempenham um papel importante na apneia obstrutiva do sono e sua relação com o aumento da resistência das vias aéreas superiores.
ObjetivoAvaliar a relação entre a obesidade e as propriedades da cavidade nasal em pacientes com apneia obstrutiva do sono.
MétodoO estudo foi feito retrospectivamente através da revisão de prontuários médicos de pacientes adultos. O instrumento de avaliação NOSE, do inglês nasal obstruction symptom evaluation, foi usado para avaliar a obstrução nasal. Os distúrbios respiratórios do sono foram avaliados através de exames polissonográficos. O volume nasal foi obtido por tomografia computadorizada e a reconstrução volumétrica das vias aéreas nasais. As alterações anatômicas nasais foram avaliadas por endoscopia nasal.
ResultadosA análise dos prontuários de 83 pacientes, entre os quais 54 eram do sexo masculino e 29 do feminino, encontrou um índice de massa corporal médio de 28,69kg/m2. Os grupos obeso e não obeso foram determinados com o ponto de corte de 30kg/m2. Na comparação entre os grupos, o grupo obeso apresentou correlação positiva e significante com o índice de apneia/hipopneia (p=0,02), instrumento NOSE (p=0,033) e hipertrofia da concha inferior (p=0,036), com uma odds ratio de 1,983 (IC95%: 1,048 a 3,753). A avaliação do desvio do septo nasal (p=0,126) e do volume das vias aéreas nasais (p=0,177) não mostrou resultados significantes.
ConclusãoA obesidade correlacionou‐se significantemente com a obstrução nasal subjetiva pela escala NOSE e hipertrofia de concha inferior em pacientes com apneia obstrutiva do sono. Não houve correlação com a avaliação do volume nasal.
Nível de evidência3b. Estudo de caso‐controle individual.
O principal sítio fisiopatológico da apneia obstrutiva do sono (AOS) é a via aérea superior (VAS).1 A American Academy of Sleep Medicine define a AOS como um colapso recorrente das vias aéreas superiores durante o sono, resulta em uma redução total (apneia) ou parcial (hipopneia) do fluxo de ar.
A obesidade, um fator de risco isolado para AOS e sua progressão,2–5 e os distúrbios relacionados à obesidade desempenham um papel importante na AOS e sua relação com o aumento da resistência das vias aéreas superiores já foi demonstrada em vários estudos.6–8 Dois terços dos pacientes com AOS são obesos9 e um ganho de 10% no peso da linha basal foi associado a um risco seis vezes maior de AOS10 e um aumento de um desvio‐padrão no IMC foi associado a um aumento de 4 vezes no IAH.11 A desregulação metabólica em indivíduos com obesidade e AOS, como aumento dos níveis de leptina, pode levar ao aumento do apetite e à diminuição da atividade física. Privação do sono e ansiedade também estão associados a essa condição. Esse conjunto de fatores leva a um círculo vicioso que perpetua essa associação.4
Verificou‐se que pacientes com obesidade e AOS apresentam deposição de tecido adiposo ao redor das vias aéreas superiores, o que aumentando sua colapsibilidade. Schwab et al., em 2003, em um estudo que usou imagem por ressonância magnética volumétrica, encontraram um aumento de tecido adiposo na base da língua e na parede lateral da faringe. Esses sítios são mais obstrutivos e, portanto, um local importante de colapso das vias aéreas superiores em indivíduos com AOS.12
Para analisar a estabilidade das VAS, é importante considerar as forças externas que compõem a pressão do tecido, cujo principal fator é a obesidade.12 O aumento do tecido adiposo no pescoço pressiona a parede da faringe, causa mais pressão transmural negativa. Os músculos das vias aéreas superiores desses pacientes apresentam miopatia primária, o que os torna mais suscetíveis ao colapso por causa do acúmulo de músculo composto por fibras mais fatigáveis do tipo II.13
A presença de um ponto de obstrução das vias aéreas superiores (VAS) aumenta a pressão negativa intraluminal na seção localizada após o ponto de obstrução, o que desencadeia o estreitamento desse segmento. Pacientes com obstrução nasal estão mais expostos ao colapso das vias aéreas superiores, o que aumenta a pressão negativa no lúmen da faringe.14 O nariz contribui para a metade da resistência total das vias aéreas superiores.15
Existem vários métodos para avaliar o nariz e analisar como as alterações nasais afetam a resistência das VAS. Achados endoscópicos e de tomografia computadorizada (TC) são importantes para a identificação de locais obstrutivos. A escala NOSE (nasal obstruction symptom evaluation) é um teste subjetivo validado para avaliar os sintomas nasais.16 Neste estudo, o volume nasal foi medido por reconstrução volumétrica por TC dos espaços livres na cavidade nasal. Assim, o objetivo deste estudo foi avaliar se havia uma correlação entre obesidade e propriedades subjetivas/objetivas da cavidade nasal em pacientes com AOS.
MétodoEste estudo foi aprovado pelo comitê de ética em pesquisa, sob número 47794715.3.0000.5416, e todos os procedimentos seguidos estavam em conformidade com os padrões éticos do comitê responsável pela experimentação com seres humanos (institucional e nacional) e com a Declaração de Helsinque de 1975, revisada em 2008.
Foi feito retrospectivamente, através da revisão de prontuários de pacientes adultos da clínica de cirurgia oral e maxilofacial e da clínica de otorrinolaringologia. Os pacientes foram avaliados em uma clínica ambulatorial específica para pacientes com queixas e sintomas relacionados a distúrbios respiratórios do sono. Os seguintes dados foram obtidos dos prontuários médicos: exame otorrinolaringológico (ORL), endoscopia das vias aéreas superiores, variáveis antropométricas, índice de massa corpórea (IMC), polissonografia basal e tomografia computadorizada (TC) para definir o volume da cavidade nasal.
A escala NOSE foi usada para avaliar a obstrução nasal. A escala foi composta por 5 questões (congestão nasal, obstrução nasal, dificuldade de respirar, se exercitar e dormir), com escores de 0 a 4. Esses escores foram adicionados e multiplicados por 5. Assim, o escore na escala NOSE variou de 0 a 100.16 Esse instrumento é rotineiramente aplicado a todos os pacientes com suspeita de AOS. Todos os questionários foram validados pelo médico sênior da clínica ambulatorial (MMR).
A endoscopia das vias aéreas superiores foi feita para avaliar as alterações anatômicas no nariz e faringe, tais como desvios do septo nasal, hipertrofia da concha inferior, hipertrofia das tonsilas e locais instáveis da faringe e laringe. Desvios do septo nasal (DSN) foram considerados quando o septo bloqueava o trajeto do fibroscópio e/ou quando havia contato com a parede lateral do nariz. O tamanho das conchas inferiores foi classificado da seguinte forma: Grau 0 – sem conchas; Grau 1 – conchas inferiores ocupava <25% da cavidade nasal; Grau 2 – concha inferior ocupava 25% a 50% da cavidade nasal; Grau 3 – concha inferior ocupava 50%‐75% da cavidade; Grau 4 – concha inferior ocupavao quase a cavidade nasal e tocava o septo nasal.17–19 A hipertrofia da concha inferior (HCI) foi considerada quando bloqueava o trajeto do fibroscópio ou Graus 3 a 4. Todas as endoscopias foram feitas com um protocolo padronizado e foram validadas pelo médico sênior da clínica ambulatorial. Todos os procedimentos foram gravados em vídeo e descritos em um relatório.
O sono foi avaliado pela polissonografia (PSG) tipo I, em um período médio de seis horas. Os parâmetros eletrofisiológicos avaliados durante o sono foram: eletroencefalografia (EEG), eletro‐oculografia (EOG), eletromiografia (EMG), eletrocardiografia (ECG), fluxo aéreo (nasal e oral), esforço respiratório (torácico e abdominal), outros movimentos corporais (por meio da EMG), gasometria sanguínea (saturação de oxigênio, concentração de dióxido de carbono) e temperatura corporal. A técnica foi usada como definida pelas regras para escore de eventos respiratórios no sono, do manual da American Academy of Sleep Medicine, 2012.17 A gravidade da AOS foi classificada com o índice de apneia‐hipopneia, conforme definido pela AASM.18 Um especialista médico em sono calculou o índice de apneia‐hipopneia (IAH) dos pacientes, obtido pela soma dos eventos de apneia e hipopneia divididos pelas horas de sono. Esse índice foi usado para classificar a gravidade da AOS da seguinte forma: normal (IAH <5 eventos/hora), AOS leve (IAH entre 5 e 15 eventos/hora), AOS moderada (IAH entre 15 e 30 eventos/hora) e AOS grave (IAH> 30 eventos/hora).
As imagens da TC não eram uma rotina neste ambulatório. Os pacientes que tinham registro de TC em seus prontuários foram incluídos neste estudo. A TC foi obtida por tomografia de 128 canais com os pacientes na posição supina. Todos os indivíduos foram instruídos a não engolir durante a aquisição da imagem. Os cortes foram obtidos no plano axial e reconstruídos no plano coronal, da espinha nasal anterior até o limite anterior da nasofaringe. Todas as imagens foram armazenadas em um DVD para posterior análise por software específico.
As imagens tridimensionais das CTs foram importadas e reconstruídas com o software Osirix v.7.0 de 32 bits (Fundação OsiriX, Genebra, Suíça) para definir o volume nasal.19 As imagens foram fixadas no plano de Frankfurt, perpendicular ao plano horizontal, pelo software de imagem. Weissheimer et al. (2012) demonstraram que o software Osirix foi validado para avaliar o volume das vias aéreas superiores.
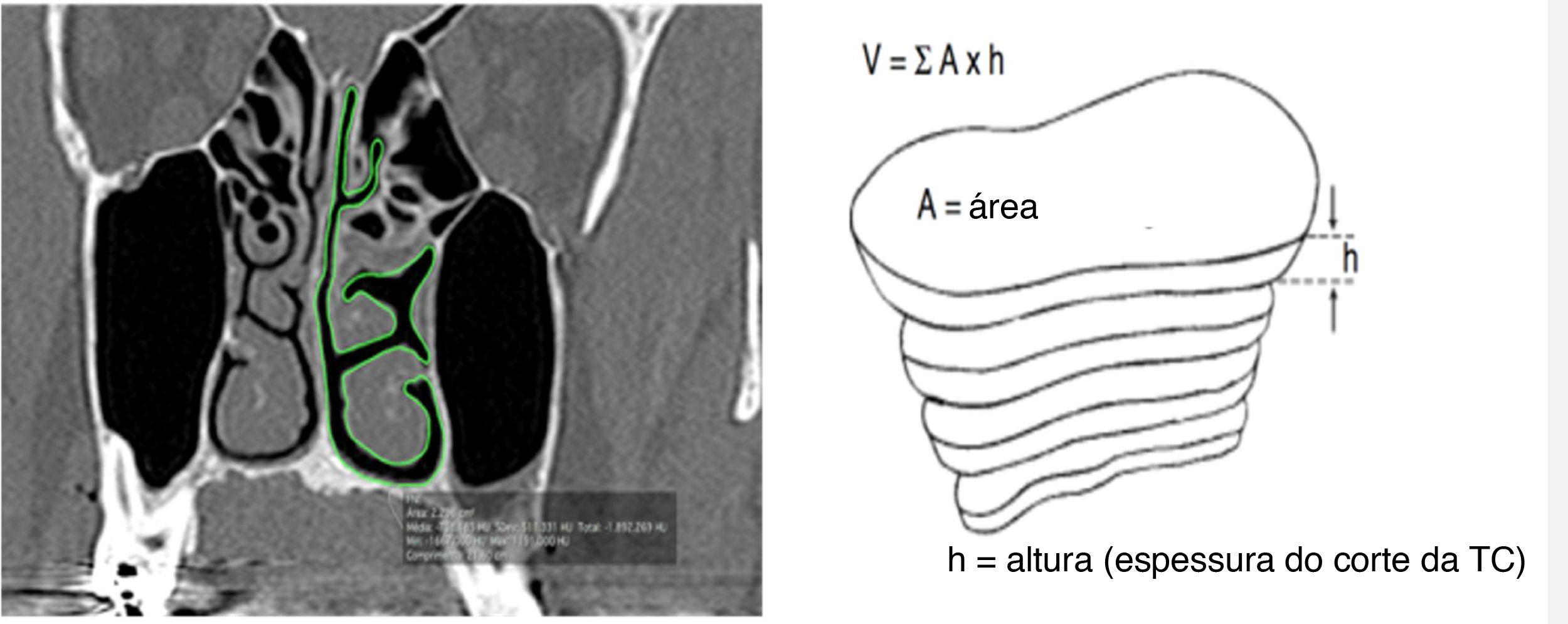
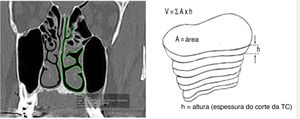
Assim, imagens seriam geradas, que corresponderiam a seções coronais consecutivas da região de interesse, com espaçamento de 4mm. Um observador cego treinado fez o processo de avaliação. A avaliação foi repetida em 30% (valor mínimo para validar o erro‐padrão) da amostra, pelo mesmo avaliador, após um período mínimo de 30 dias para estabelecer o erro do método. Os valores obtidos na reavaliação foram semelhantes aos das primeiras medidas. Todas as medidas foram feitas no plano coronal dos cortes da TC com espessura de 0,25mm e distância de 4mm entre os cortes. Para determinar o volume das vias aéreas nasais, a área foi medida em todas os cortes da TC. O contorno das vias aéreas nasais em cada corte foi traçado manualmente através do trackpad do computador, considerou‐se apenas o espaço livre da cavidade nasal; isto é, os desvios de septo não foram incluídos no cálculo da área (fig. 1). A ferramenta de software OsiriX calculou a área automaticamente. Então, para cada seção da TC, a área já fornecida, uma imagem TIFF foi gerada. Esse processo foi feito nas duas cavidades nasais no mesmo corte no plano coronal.
Delimitação de área de corte coronal e reconstrução de volume. (A, corte coronal por TC; B, técnica de reconstrução) (De Rodrigues et al., 2017).5.
O volume das vias aéreas nasais (VAN) medido em cada corte da TC foi calculado pela multiplicação da área pela altura, o que equivale à distância entre os cortes coronais. A ferramenta do software OsiriX calculou a área dos cortes perdidos espaçadas em 4mm. O volume de toda a via aérea livre do nariz foi a soma de todos os volumes medidos em cada corte. O volume das VAN foi a soma do volume obtido de ambos os lados da cavidade nasal. O volume das VAN obtido foi semelhante a uma estrutura piramidal composta pelo espaço livre das vias aéreas do nariz.
Critérios de inclusão/exclusãoForam incluídos pacientes avaliados de dezembro de 2014 a dezembro de 2015, com diagnóstico de AOS; de ambos os sexos, entre 18 e 70 anos.
Foram excluídos pacientes com as seguintes condições:
- •
Obesidade mórbida (IMC> 40), devido a limitações técnicas no equipamento de tomografia computadorizada.
- •
Anormalidades craniofaciais (craniodisostose, craniostenose e meningomielocele);
- •
Obstrução nasal devido a pólipos nasais;
- •
Presença de qualquer tumor craniofacial ou das vias aéreas;
- •
Paralisia laríngea e faríngea;
- •
Cirurgia prévia nas VAS;
- •
Ausência de registros de TC ou PSG.
Os dados foram analisados por testes estatísticos descritivos e frequência de resultados. O teste de normalidade de Kolmogorov‐Smirnov foi usado para estabelecer o teste adequado para as variáveis. Para analisar a correlação do volume nasal e a escala NOSE, foi escolhido o teste de Mann‐Whitney. O teste do qui‐quadrado foi escolhido para análise das variáveis nominais. O sistema SAS (Statistical Analysis System) for Windows, versão 9.3 (SAS Institute Inc, 2002‐2008, Cary, NY, EUA) foi usado para a análise.
ResultadosNoventa pacientes foram avaliados de dezembro de 2014 a dezembro de 2015. Sete foram excluídos da amostra: três porque tinham tomografia computadorizada com pouca definição, abaixo dos limites determinados na metodologia, e quatro porque tinham dados incompletos necessários para o protocolo de pesquisa. Portanto, 83 pacientes foram incluídos no estudo, 29 (34,9%) do sexo feminino e 54 (65,1%) do masculino. A análise descritiva das principais variáveis é apresentada na tabela 1.
O teste acima mencionado mostrou que a escala NOSE e o IAH não apresentavam distribuição normal nesta amostra. As variáveis amostrais foram avaliadas em grupos por sexo. A análise é mostrada na tabela 2.
Comparação média entre os grupos por sexo
Esses dados demonstram que o sexo não influenciou as variáveis nasais. A significância estatística foi encontrada apenas no IAH como reportado na literatura. Os indivíduos foram divididos nos grupos obeso e não obeso, com um ponto de corte de 30kg/m2 (tabela 3).
Estatísticas dos grupos por grupo de obesidade
| Grupo de Obesidade | n | Média | Desvio Padrão | Porcentagem | p | |
|---|---|---|---|---|---|---|
| Escala NOSE | Não obeso | 56 | 37,11 | 18,16 | − | 0,033a |
| Obeso | 27 | 44,52 | 21,99 | − | ||
| IAH | Não obeso | 56 | 22,47 | 23,59 | − | 0,020a |
| Obeso | 27 | 39,28 | 32,02 | − | ||
| Volume nasal | Não obeso | 56 | 16,78 | 3,85 | − | 0,177b |
| Obeso | 27 | 18,29 | 4,62 | − | ||
| HCIc | Não obeso | 56 | − | − | 13/56 (23%) | 0,036e |
| Obeso | 27 | − | − | 13/27(48%) | ||
| DSNd | Não obeso | 56 | − | − | 29/56 (51%) | 0,126e |
| Obeso | 27 | − | − | 18/27(66%) |
Os dados acima demonstraram que o grupo obeso apresentou correlação positiva e significante com a escala NOSE (p=0,033) e IAH (p=0,020). Não houve diferença na avaliação do volume nasal (p=0,177) entre os grupos. A tabulação cruzada entre hipertrofia de concha inferior (HCI) e obesidade mostrou uma correlação significante (p=0,036). A odds ratio para a HCI no grupo obeso foi de 1,983 com intervalo de confiança de 95% de 1,048 a 3.753. Não houve diferença significante para DSN.
O grupo HCI apresentou correlação positiva significante com a escala NOSE (p=0,041) e IMC (p=0,044). Não houve diferença na avaliação do volume nasal (p=0,198) e IAH (p=0,051) entre os grupos (tabela 4).
DiscussãoA apneia do sono é uma doença das vias aéreas superiores, na qual a faringe é o principal local afetado. A obstrução nasal deve ser considerada na análise do equilíbrio entre as forças de abertura e de colapso. Pacientes com obstrução nasal são mais expostos ao colapso das vias aéreas superiores, pelo aumento da pressão negativa no lúmen da faringe.14 Estudos demonstraram que a obstrução nasal é um fator de risco para AOS, mas não há uma associação linear entre obstrução e gravidade dos distúrbios respiratórios do sono.1 Cerca de 15% dos pacientes com distúrbios respiratórios do sono também apresentam obstrução nasal.20
Nesta amostra, foi demonstrado que os achados endoscópicos nasais (DSN/HCI) são mais importantes do que o volume das VAN na análise de pacientes com AOS. No cálculo do volume das VAN, considerou‐se toda a cavidade nasal, inclusive o segmento a seguir de um possível ponto de máxima obstrução; após o qual ocorre um ganho de fluxo de ar que diminui a pressão intraluminal nos segmentos cranianos das vias aéreas superiores, o que leva ao colapso das vias aéreas superiores na faringe.21
A correlação entre obstrução nasal e AOS é controversa. Haddad et al., em 2013, avaliaram a função nasal com nasofibroscopia, pico de fluxo inspiratório nasal e rinometria acústica na adesão ao CPAP. Os resultados demonstraram que a maioria dos parâmetros nasais avaliados neste estudo não influenciou a adesão ao CPAP.21
Em nossa amostra, os obesos apresentaram mais sintomas nasais, como mostra a escala NOSE. A hipertrofia da concha inferior também foi correlacionada com a obesidade. Pacientes obesos com AOS têm chance 1,983 vez maior de desenvolver HCI. Indivíduos com HCI apresentaram escores mais altos na escala NOSE, IMC mais alto e volume nasal semelhante quando comparados ao grupo não HCI. Esse resultado pode demonstrar que a HCI teve uma relação com a obesidade independentemente do volume nasal e do sexo. Martinho et al., em 2008, encontraram resultados semelhantes: 65,7% dos pacientes obesos com AOS tinham HCI (p <0,05).22 Essa correlação não foi significante quando o volume das VAN foi avaliado. O volume das VAN é uma variável que avalia todo o espaço livre das vias aéreas, mas não avalia o fluxo de ar nasal. Por exemplo, em um paciente com uma via aérea nasal bloqueada por HCI, o volume das VAN incluirá o volume após e acima do bloqueio das vias aéreas; isto é, um local com fluxo de ar comprometido.
O sexo não influenciou a relação entre obesidade e função nasal. Não há diferença nos escores da escala NOSE e volume nasal. Espera‐se que indivíduos do sexo feminino tenham cavidade nasal menor, mas essa associação não foi observada nesta amostra. A única diferença significante foi demonstrada no IAH, como prevista na literatura.11
Demir et al., em 2015, encontraram resultados semelhantes, mostraram uma correlação estatisticamente significante entre o aumento da massa corporal e o aumento do escore NOSE, mas não encontraram resultado significativo quando avaliaram a função nasal por rinometria acústica; entretanto, em seu estudo, eles não avaliaram pacientes com AOS.6
A obesidade e a AOS são condições associadas a níveis mais elevados de citocinas inflamatórias no tecido nasal, como proteína C‐reativa, fator de necrose tumoral alfa, interleucinas (4, 13, 5, 8, 9), fator estimulador de colônias de granulócitos e macrófagos. Pacientes obesos com AOS têm mais marcadores inflamatórios no tecido.23 A concha nasal inferior é contrátil e é o principal local exposto a alterações pelo status inflamatório do nariz. Marcador inflamatório e edema resultante de trauma respiratório e ronco podem explicar os achados de aumento das conchas inferiores em indivíduos obesos com AOS.22 A obesidade também foi apontada como causa de falha no tratamento das condições da concha inferior com radiofrequência.24 A obesidade é uma condição importante que contribui para o acúmulo de fluido nas pernas durante o dia, tais como insuficiência cardíaca e doença renal terminal.25,26 Uma correlação significante foi demonstrada entre OSA e LFA. Durante o decúbito, o fluido das pernas foi redistribuído rostralmente; aproximadamente 260 mL de fluido foram redistribuídos das pernas e associados a um aumento de 1cm na circunferência do pescoço, indicou acúmulo de fluido no pescoço.27 Esses estudos sugeriram que alterações na mucosa das vias aéreas superiores poderiam afetar diretamente a concha inferior em pacientes obesos com AOS através da maior redistribuição de fluidos e mais inflamação crônica na mucosa nasal.
Os principais tratamentos da AOS em pacientes obesos são terapia com CPAP e cirurgia bariátrica.28 O IAH aumenta à medida que o peso aumenta.29 A AOS é comum em pacientes submetidos à cirurgia de bypass gástrico. A cirurgia bariátrica pode reduzir o IMC e diminuir as camadas de gordura ao redor da faringe. Buchwald et al., 2004, em uma metanálise, mostraram que a AOS foi resolvida em 85,7% dos pacientes submetidos à cirurgia bariátrica.30
Entretanto, a cirurgia nasal parece aumentar de forma confiável a adesão ao CPAP quando a patência nasal é a questão limitante.31 Ao avaliar AOS em pacientes obesos, é importante não procurar alterações apenas na faringe. Os pacientes obesos com AOS apresentam mais sintomas nasais. Nossos resultados demonstraram a importância da avaliação completa dos pacientes com AOS. Os tratamentos de obstrução nasal não podem melhorar o IAH, mas esteroides nasais e a cirurgia nasal podem melhorar o sono e a qualidade de vida.32 O exame nasal é fundamental para a adequada adesão ao CPAP, principalmente em pacientes obesos com AOS, os quais, em nossa amostra, apresentaram 1,983 vez mais risco de obstrução nasal por HCI. Essa relação pode ser explicada pelo aumento de marcadores inflamatórios, vibração da mucosa e redistribuição de LFA em pacientes obesos.33,34
ConclusãoA obesidade foi correlacionada com obstrução nasal subjetiva (escala NOSE) e hipertrofia de concha inferior em pacientes com AOS. Não houve correlação com a avaliação do volume nasal. A avaliação nasal é importante em pacientes com AOS para criar um plano de tratamento adequado.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Rodrigues MM, Carvalho PH, Gabrielli MF, Lopes RN, Garcia Junior OA, Pereira Filho VA, et al. How obesity affects nasal function in obstructive sleep apnea: anatomic and volumetric parameters. Braz J Otorhinolaryngol. 2022;88:296–302.
Estudo vinculado à Divisão de Cirurgia Oral e Maxilofacial da Faculdade de Odontologia de Araraquara (Unesp) e Clínicas de Otorrinolaringologia da Faculdade de Medicina da Universidade de Araraquara (Uniara), SP, Brasil.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.