The use of diagnostic auditory brainstem response testing under sedation is currently the “gold standard” in infants and young children who are not developmentally capable of completing the test.
ObjectiveThe aim of the study is to compare a propofol‐ketamine regimen to an oral chloral hydrate regimen for sedating children undergoing auditory brainstem response testing.
MethodsPatients between 4 months and 6 years who required sedation for auditory brainstem response testing were included in this retrospective study. Drugs doses, adverse effects, sedation times, and the effectiveness of the sedative regimens were reviewed.
Results73 patients underwent oral chloral hydrate sedation, while 117 received propofol‐ketamine sedation. 12% of the patients in the chloral hydrate group failed to achieve desired sedation level. The average procedure, recovery and total nursing times were significantly lower in the propofol‐ketamine group. Propofol‐ketamine group experienced higher incidence of transient hypoxemia.
ConclusionBoth sedation regimens can be successfully used for sedating children undergoing auditory brainstem response testing. While deep sedation using propofol‐ketamine regimen offers more efficiency than moderate sedation using chloral hydrate, it does carry a higher incidence of transient hypoxemia, which warrants the use of a highly skilled team trained in pediatric cardio‐respiratory monitoring and airway management.
O uso de testes diagnósticos de potencial evocado auditivo de tronco encefálico sob sedação é atualmente o padrão‐ouro em lactentes e crianças pequenas que não têm desenvolvimento suficiente para realizar o exame.
ObjetivoO objetivo do estudo foi comparar a sedação de crianças submetidas a testes de potencial evocado auditivo de tronco encefálico com propofol‐quetamina e com hidrato de cloral por via oral.
MétodoPacientes entre 4 meses e 6 anos de idade que necessitaram de sedação para a realização do potencial evocado auditivo de tronco encefálico foram incluídos nesse estudo retrospectivo. Foram revisadas as doses dos medicamentos, os efeitos adversos, os tempos de sedação e a eficácia das formas de sedação.
Resultados73 pacientes foram submetidos à sedação oral com hidrato de cloral, enquanto 117 receberam sedação com propofol‐quetamina; 12% dos pacientes do grupo hidrato de cloral não alcançaram o nível desejado de sedação. Os tempos médios de procedimento, recuperação e o tempo total de cuidados de enfermagem foram significativamente menores no grupo propofol‐quetamina, entretanto este grupo experimentou maior incidência de hipoxemia transitória.
ConclusãoAmbos os regimes de sedação podem ser utilizados com sucesso para sedar crianças para realização do exame de potencial evocado de tronco encefálico. Embora a sedação profunda com propofol e quetamina ofereça mais eficiência do que a sedação moderada com hidrato de cloral, ela apresenta maior incidência de hipoxemia transitória, o que requer uma equipe altamente qualificada, treinada em monitoramento cardiorrespiratório pediátrico e manejo de vias aéreas.
A perda de audição pode levar ao comprometimento significativo do desenvolvimento e ao atraso na fala em lactentes e crianças pequenas, o que requer identificação e terapia precoces. O potencial evocado auditivo do tronco encefálico (Peate) é um método objetivo de teste da via auditiva.1 Ele tem sido usado como um valioso exame de triagem para perda de audição em bebês e crianças pequenas devido à sua pouca idade e desenvolvimento.2 Embora o Peate não seja doloroso, os pacientes pediátricos geralmente requerem sedação para a obtenção de resultados precisos. A sedação de pacientes pediátricos para o Peate pode ser feita por um anestesista, com anestesia geral ou com sedação moderada a profunda executada por uma equipe de sedação para procedimentos.3
Uma vez que as crianças rotineiramente recebem alta após a intervenção, o agente sedativo ideal deve ter um início rápido e um perfil favorável de efeitos secundários, enquanto produz um nível suficiente de sedação para conclusão do estudo, permite uma rápida recuperação do paciente e tem baixo custo.3 Diferentes agentes sedativos e vias de administração têm sido usados para testes de Peate, tais como hidrato de cloral por via oral, dexmedetomidina intranasal, pentobarbital por via retal, propofol intravenoso e anestesia geral.4 O hidrato de cloral (HC) tem sido um dos regimes mais amplamente usados.3–5 Embora seu mecanismo de ação ainda seja desconhecido, acredita‐se que seu efeito sedativo seja mediado pelos receptores de ácido gama‐aminobutírico (Gaba). Apesar do uso generalizado de HC, preocupações sérias foram levantadas sobre seu perfil de segurança.6 Além disso, o HC tem enfrentado problemas de fornecimento desde 2013, depois que sua fabricação foi descontinuada nos Estados Unidos devido à disponibilidade limitada e à baixa demanda do mercado.
O propofol é um agente sedativo‐hipnótico intravenoso que é usado para indução e manutenção de sedação profunda e anestesia geral.7 O propofol tem muitas propriedades, inclusive um início rápido, uma ação de duração curta com recuperação rápida e eventos adversos mínimos, o que o torna um agente ideal para a sedação pediátrica no ambiente ambulatorial. Foi relatado que a combinação de propofol e quetamina para sedação pediátrica tem estabilidade hemodinâmica ideal e efeitos adversos reduzidos em relação ao uso isolado do propofol.8 Além disso, a combinação de propofol e quetamina mostrou‐se benéfica em outras áreas médicas devido ao uso de doses mais baixas de propofol, resultou na redução de efeitos adversos indesejáveis. Muitos autores relataram as vantagens da combinação de propofol‐quetamina em termos de perfil hemodinâmico e controle da dor em pacientes com câncer submetidos a procedimentos dolorosos.9 Dados emergentes reforçam a segurança e a eficácia do uso de propofol fora da sala de cirurgia para procedimentos ambulatoriais pediátricos e intervenções feitas por médicos qualificados e treinados em sedação e manejo avançado das vias aéreas.10–12 Além disso, com o número crescente de pacientes pediátricos submetidos ao teste diagnóstico de Peate e à escassez relativa de anestesiologistas e disponibilidade de salas de cirurgia, outros subespecialistas pediátricos, como profissionais médicos de cuidados críticos em pediatria, entraram em campo para fornecer sedação pediátrica para procedimentos.13
O objetivo deste estudo foi comparar a eficácia, eficiência e segurança de uma infusão de propofol combinada com quetamina com o hidrato de cloral por via oral como formas de sedação para crianças submetidas ao Peate.
MétodoO Comitê de Ética de nossa instituição (n° 1204008435R003) aprovou este estudo retrospectivo. Todos os pacientes pediátricos entre quatro meses e seis anos submetidos à sedação para teste de Peate foram incluídos. Pacientes com menos de 5kg, que tinham histórico de insucesso na sedação em procedimento anterior e com doença cardíaca foram excluídos da análise. Um técnico em Peate fez todos os exames no nosso Hospital Infantil. Os membros técnicos da equipe foram os mesmos durante o período do estudo. O estudo foi concebido como uma revisão retrospectiva na qual os pacientes foram analisados com base no regime de sedação usado para o Peate.
O histórico e o exame físico foram feitos e documentados de acordo com as diretrizes da American Academy of Pediatrics (Academia Americana de Pediatria [AAP]) para sedação.14 O consentimento por escrito foi obtido de um dos pais ou responsáveis antes do procedimento. A sedação no grupo PC foi feita por uma equipe que consistiu em um intensivista pediátrico e uma enfermeira de sedação com experiência em cuidados críticos pediátricos que monitoraram o paciente durante e após cada procedimento, juntamente com o intensivista, em todos os casos. A sedação do grupo HC foi feita pela equipe de Peate que consistiu em uma enfermeira pediátrica com experiência na administração e monitoramento de pacientes durante a sedação moderada. As diretrizes para ambos os regimes de sedação foram estabelecidas pela AAP em relação ao monitoramento, manejo dos procedimentos durante a sedação e à alta das crianças.15 Todos os pacientes foram classificados como ASA‐OS I ou II pelo sistema de classificação de estado físico da American Society of Anesthesiologists. Os pacientes não tinham ingerido alimentos sólidos ou fórmula infantil por pelo menos seis horas e duas horas para líquidos claros antes do procedimento. Os pacientes do grupo PC tiveram um cateter intravenoso colocado pela equipe de sedação. Parâmetros fisiológicos como frequência cardíaca, frequência respiratória, saturação de oxigênio e pletismografia respiratória foram monitorados continuamente. A pressão arterial foi medida de maneira não invasiva a cada cinco minutos ao longo do procedimento e a cada 15 minutos após a conclusão até que o paciente estivesse completamente acordado.
Para o grupo PC, foi administrada uma pequena dose de quetamina intravenosa (0,5mg/kg para pacientes com peso inferior a 20kg e 0,25mg/kg para pacientes com peso superior a 20kg) seguida por propofol intravenoso. O propofol foi administrado em bólus inicial de 1‐2mg/kg, seguido por infusão de 83 mcg/kg/minuto até o fim do procedimento. Bóluses adicionais de 1mg/kg de propofol foram administrados conforme necessário para atingir o nível de sedação profunda (nível 4) com base na Escala de Sedação de Ramsay. Para aqueles no grupo HC, a sedação foi iniciada com 30mg/kg de hidrato de cloral oral e seguida de pequenas doses subsequentes (20mg/kg) em 20 minutos de intervalo até a dose máxima de 1 grama, se necessário, para atingir um nível de sedação moderado. Se a criança não estivesse sedada durante o exame apesar das doses adicionais do medicamento, considerou‐se como insucesso na sedação.
Os eventos adversos foram registrados, inclusive o desenvolvimento de hipoxemia transitória (saturação de oxigênio inferior a 90% durante 30 segundos), hipotensão (queda na pressão arterial sistólica abaixo da esperada para a idade ou queda de 20% da pressão arterial sistólica inicial), apneia que requereu ventilação com máscara e falha ao completar o procedimento. Eventos adversos graves, como intubação endotraqueal e parada cardíaca, também foram registrados. O tempo de procedimento (TP) foi definido como o tempo entre as primeiras doses de sedação até o Peate ser completado. O tempo de recuperação (TR) foi definido como o intervalo entre as conclusões do procedimento até o nível de consciência do paciente voltar para a linha basal. O tempo de enfermagem (TE) foi definido como o tempo total gasto pela enfermeira de sedação durante todo o processo, desde a chegada do paciente ao local da sedação até a alta para casa.
Análise estatísticaAs comparações entre os grupos PC e HC foram feitas com os testes de soma de postos de Wilcoxon para variáveis contínuas e qui‐quadrado para variáveis categóricas. Devido às diferenças de idade e peso entre os grupos, foram feitas análises adicionais para comparar os grupos ao ajustarem‐se a idade e o peso.
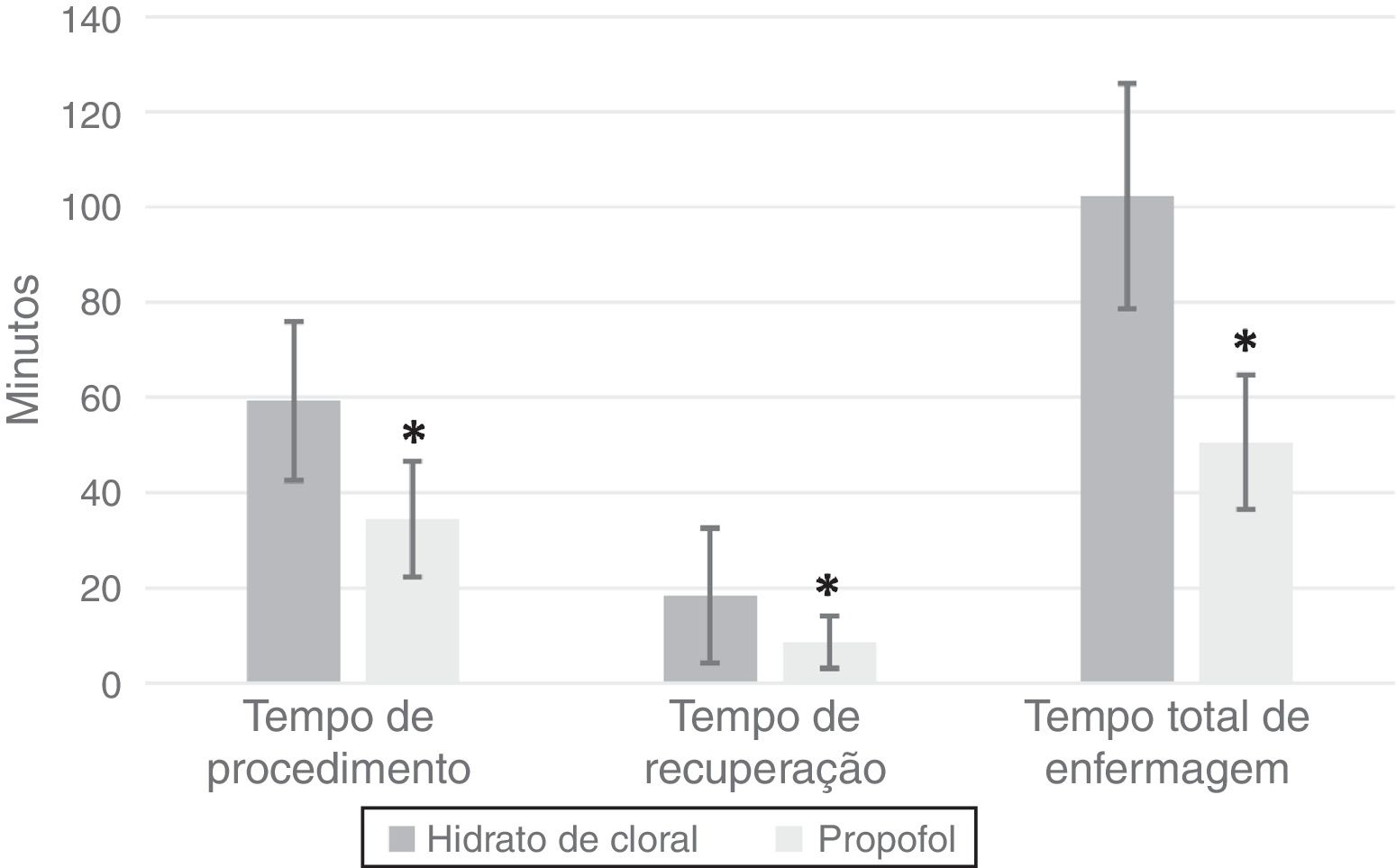
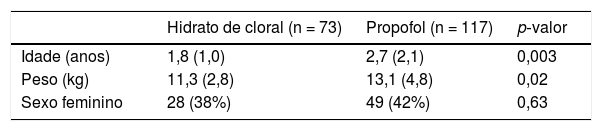
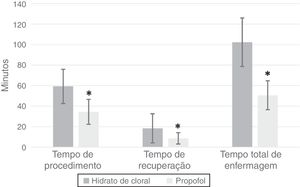
ResultadosEntre 2009 e 2012, 117 procedimentos de Peate foram feitos com PC, enquanto 73 foram feitos com HC. Os dados demográficos dos pacientes estão resumidos na tabela 1. Os pacientes do grupo PC eram mais velhos do que os pacientes do grupo HC (tabela 1). Os pacientes no grupo PC apresentaram menor frequência cardíaca na conclusão do procedimento em comparação com o grupo HC; eles também apresentaram uma porcentagem significativamente maior de hipoxemia transitória e uma maior porcentagem de pacientes que receberam oxigênio suplementar; entretanto, a apneia não foi estatisticamente diferente entre os grupos (tabela 2). Nenhum evento adverso grave aconteceu em nenhum dos dois grupos. No entanto, nove pacientes (12%) no grupo HC não alcançaram um nível moderado de sedação e 10 (14%) necessitaram de uma dose subsequente de HC para manter a sedação. Os pacientes do grupo PC apresentaram tempo de procedimento, tempo de recuperação e tempo total de enfermagem significativamente menores (figura 1). O ajuste por idade e peso não afetou as comparações entre grupos (p < 0,0001 para frequência cardíaca na conclusão do procedimento, tempo de procedimento, tempo de recuperação e tempo total de enfermagem; p = 0,0114 para dessaturação; p = 0,0021 para necessidade de oxigênio suplementar; p = 0,27 por apneia).
Dados demográficos de dois regimes de sedaçãoa
| Hidrato de cloral (n = 73) | Propofol (n = 117) | p‐valor | |
|---|---|---|---|
| Idade (anos) | 1,8 (1,0) | 2,7 (2,1) | 0,003 |
| Peso (kg) | 11,3 (2,8) | 13,1 (4,8) | 0,02 |
| Sexo feminino | 28 (38%) | 49 (42%) | 0,63 |
Comparação entre as doses dos regimes de sedação e efeitos adversosa
| Hidrato de cloral (n = 73) | Propofol (n = 117) | p‐valor | |
|---|---|---|---|
| Dose total de propofol (mg/kg) | n/a | 5,4 (1,9) | n/a |
| Dose de hidrato de cloral (mg/kg) | 33,4 (7,7) | n/a | n/a |
| Frequência cardíaca pré‐sedação | 131,4 (18,4) | 126,3 (22,7) | 0,12 |
| Frequência cardíaca após o término do procedimento | 115,8 (17,2) | 101,2 (15,4) | < 0,0001 |
| Hipoxemia | 1 (1%) | 12 (10%) | 0,0183 |
| Apneia | 0 (0%) | 1 (1%) | 0,43 |
| Oxigênio suplementar | 0 (0%) | 10 (9%) | 0,01 |
| Nível desejado de sedação alcançado | 64 (88%) | 117 (100%) | < 0,0001 |
| Uma segunda dose de medicação foi administrada | 10 (14%) | n/a |
A feitura de Peate sob algum tipo de sedação é atualmente o teste padrão‐ouro para diagnosticar a perda auditiva em lactentes e crianças que não estão preparadas em termos de desenvolvimento ou são incapazes de completar a audiometria comportamental. 16,17 Embora o hidrato de cloral tenha sido amplamente usado como medicamento sedativo hipnótico oral, questões relativas à sua eficácia e segurança continuam a surgir.2 Por outro lado, a combinação de propofol e quetamina foi avaliada em grandes estudos de caso e mostrou‐se segura e eficaz quando administrada por profissional especializado, o que resultou em uma recuperação mais rápida, menor permanência e despertar mais suave.18,19
Em nosso estudo, 88% das crianças no grupo HC conseguiram atingir um nível moderado de sedação com sucesso, com uma dose média de 33,4mg/kg. No entanto, 14% dos nossos pacientes exigiram mais de uma dose de HC devido à agitação ou ao despertar durante o teste. Nossos dados são semelhantes aos de Valenzueal et al.,5 que relataram que a maioria dos pacientes pediátricos foram sedados com sucesso com o uso de HC oral. Avolnitou et al. também concluíram que a grande maioria das crianças foi sedada com sucesso, enquanto 50% deles exigiam uma segunda dose de HC para induzir a sedação. Cerca de 12% das crianças no grupo HC não conseguiram atingir o nível desejado de sedação moderada. Todas as crianças do grupo PC foram sedadas com sucesso, o que é consistente com o estudo feito por Akin et al.3
Em termos de eficácia do tempo, o tempo médio do procedimento, o tempo de recuperação e o tempo total de enfermagem foram significativamente menores no grupo PC em comparação com o grupo HC. O tempo de procedimento no grupo HC foi consistente com os achados de Avlonitou et al.,2 nos quais o tempo médio para o procedimento foi de cerca de 50min. A explicação mais provável de nossos achados em termos de eficácia de tempo é o início extremamente rápido de ação do propofol e sua curta duração.20,21
Em termos de eventos adversos, os pacientes do grupo PC tiveram uma incidência de 10% de hipoxemia transitória corrigida com cânula nasal comum, em comparação com apenas 1% no grupo HC. Akin et al. relataram que a hipoxemia transitória ocorreu em 11% dos pacientes pediátricos que receberam propofol para feitura do Peate. O Pediatric Sedation Research Consortium (Consórcio de Pesquisa de Sedação Pediátrica) relatou uma taxa de hipóxia em torno de 5% em sedação para procedimentos quando o propofol foi usado.15 É possível explicar isso parcialmente devido à duração mais longa e menor estímulo durante o Peate em comparação com outros procedimentos curtos e mais dolorosos, como uma punção lombar ou uma aspiração da medula óssea.
Que seja de nosso conhecimento, este é o primeiro estudo que compara o uso de hidrato de cloral oral com propofol e quetamina intravenosos na sedação para feitura de Peate. Nosso estudo mostra que a sedação profunda em procedimentos com o uso de uma combinação de propofol e quetamina na feitura do Peate é um regime mais eficiente do que a sedação moderada com o uso de hidrato de cloral em relação ao tempo de procedimento, tempo de recuperação e tempo total de enfermagem. A abordagem de sedação profunda com o uso de propofol e quetamina apresentou maior incidência de hipoxemia transitória em comparação com a abordagem do hidrato de cloral.
Nosso estudo tem uma série de limitações; primeiro, é retrospectivo, unicêntrico, e não randomizado. Em segundo lugar, compara duas abordagens de sedação diferentes feitas por duas equipes diferentes, nas quais há uma série de variáveis impossíveis de controlar. A dose de hidrato de cloral foi usada para obter apenas sedação moderada em nosso estudo e pode ter sido o motivo de uma maior taxa de falha e menos eventos adversos.
ConclusãoEste estudo demonstra que tanto a propofol‐quetamina intravenosa quanto o hidrato de cloral oral são métodos efetivos para a sedação de crianças submetidas ao exame de Peate em ambiente ambulatorial. Entretanto, a abordagem de sedação profunda com o uso de propofol‐quetamina é superior em termos de eficiência e oferece algumas vantagens em relação à sedação moderada com hidrato de cloral. Dada a maior incidência de hipoxemia transitória em comparação com o hidrato de cloral, o uso dessa estratégia de sedação deve ser restrito a profissionais altamente treinados no manejo de vias aéreas pediátricas e monitoramento cardiorrespiratório.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Abulebda K, Patel VJ, Ahmed SS, Tori AJ, Lutfi R, Abu‐Sultaneh S. Comparison between chloral hydrate and propofol‐ketamine as sedation regimens for pediatric auditory brainstem response testing. Braz J Otorhinolaryngol. 2019;85:32–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.