As células ciliadas da cóclea e do vestíbulo estão intimamente ligadas e podem ser suscetíveis aos mesmos fatores nocivos. A relação entre suas funções tem sido um campo de investigação há muito tempo. As indicações para implante coclear foram ampliadas e agora incluem os pacientes com surdez parcial. Isso levanta a questão de sua condição vestibular.
ObjetivoInvestigar se existe alguma diferença entre a função vestibular de pacientes com audição residual de baixa frequência e aqueles com surdez total.
MétodoForam analisadas antes do implante coclear 360 orelhas com perda auditiva neurossensorial profunda. Os pacientes foram divididos em quatro grupos, de acordo com a audição residual de baixa frequência (Grupo 1 ‐ audição residual de baixa frequência normal ou levemente elevada; Grupo 2 ‐ limiar auditivo elevado, mas ainda usável em baixas frequências; Grupo 3 ‐ audição residual não funcional; Grupo 4 ‐ sem limiar auditivo detectável dentro dos limites do audiômetro). Os pacientes foram submetidos a testes vestibulares: potencial evocado miogênico vestibular cervical, potencial evocado miogênico vestibular ocular, prova calórica e teste do impulso cefálico com vídeo.
ResultadosAs taxas de respostas obtidas no potencial evocado miogênico vestibular cervical foram as seguintes: no Grupo 1 (59,3%); Grupo 2 (57,5%); Grupo 3 (35,2%); Grupo 4 (7,7%). Para o potencial evocado miogênico vestibular ocular, o percentual de resultados corretos foi: Grupo 1 (70,8%); Grupo 2 (56,0%); Grupo 3 (40,0%); Grupo 4 (14,3%). Para a prova calórica, contamos respostas normais em 88,9% do Grupo 1; 81,6% do grupo 2; 57,9% do Grupo 3; 53,3% do Grupo 4. Para o teste do impulso cefálico com vídeo, também encontramos resultados significativamente melhores no Grupo 1, seguidos pelo Grupo 2, e muito piores nos Grupos 3 e 4.
ConclusãoPacientes com surdez parcial não só apresentam uma função coclear melhor, mas também melhor função vestibular, que precisa ser protegida. Em resumo, quanto melhor for a audição residual de baixa frequência, melhor a condição vestibular.
As células ciliadas da cóclea e do órgão vestibular estão intimamente ligadas filogenética e anatomicamente, pois estão localizadas no labirinto membranoso e preenchidas com o mesmo fluido da orelha interna. De fato, a relação entre a função coclear e a vestibular tem sido um campo de investigação por muitos anos.1–8 A cóclea e o vestíbulo podem ser suscetíveis a fatores nocivos, como agentes infecciosos, drogas ototóxicas, trauma ou insuficiência no suprimento sanguíneo do ouvido interno. A coexistência de perda auditiva e função vestibular anormal tem sido bem descrita na literatura.1–8 Muitas mutações genéticas causam perda auditiva com comprometimento vestibular coexistente: mutação nos genes COCH, PAX3, MITF, SOX10 (síndrome de Waardenburg), MYO7A, USH1C, CDH23, PCDH15, USH1G, USH2A e USH3A (síndrome de Usher I, III). Dano vestibular parcial ou total também foi descrito nas mutações do gene GJB2,3,4 rubéola congênita5 e meningite bacteriana.6
A bateria de testes neurotológicos, atualmente em uso clínico, permite avaliar cada parte do vestíbulo separadamente:9 o sáculo com o cVEMP (potencial evocado miogênico vestibular cervical), que mede o reflexo vestíbulo‐cólico,10 utrículo – com o oVEMP (potencial evocado miogênico vestibular ocular), que mede o reflexo vestíbulo‐ocular,11 o canal semicircular lateral– com prova calórica para estímulo de baixa frequência e com cadeira rotatória ou vHIT (teste do impulso cefálico com vídeo) para estímulo de alta frequência, bem como canal semicircular superior e posterior com vHIT.12
De acordo com relatos anteriores baseados em provas calóricas e cadeiras rotatórias, a incidência geral de déficits vestibulares em pacientes com perda auditiva profunda varia de 20% a 40%.5,7 Pesquisas mais recentes com uma bateria extensa de testes neurotológicos (inclusive VEMPs) verificaram que esse percentual pode chegar a 85%.3,4,6,8
As indicações para implante coclear têm sido constantemente ampliadas e agora incluem pacientes com audição residual de baixa frequência como bons candidatos. Isso levanta a questão de seu status vestibular. O objetivo deste estudo foi investigar se havia alguma diferença entre a função vestibular de pacientes com audição residual de baixa frequência e aqueles com orelhas totalmente surdas e se havia alguma associação entre o grau de perda auditiva de baixa frequência e a função vestibular.
MétodoExatamente 225 pacientes com perda auditiva neurossensorial profunda em pelo menos uma orelha (com ou sem audição residual de baixa frequência) foram incluídos no estudo. Desses, 135 apresentavam perda auditiva bilateral profunda, portanto 360 orelhas foram analisadas.
Os pacientes foram submetidos aos seguintes testes vestibulares: cVEMP, oVEMP, prova calórica e vHIT, os quais fizeram parte de uma avaliação para implante coclear. O estudo foi aprovado pelo comitê do conselho de ética institucional KB/15/2014. No início do nosso estudo, em 2014‐2015, foram feitas apenas cVEMPs e avaliação da prova calórica; depois de 2015, incluímos também oVEMP e vHIT. Todos os pacientes assinaram o termo de consentimento livre e informado. Após o implante coclear, o status vestibular dos participantes foi verificado novamente com a mesma bateria de testes, de acordo com o seguinte esquema: cVEMP, oVEMP 1‐3 meses, vHIT e prova calórica 4‐6 meses no pós‐operatório. A preservação auditiva também foi medida 6 meses após o implante coclear com a seguinte fórmula:13 HP = [1‐(PTApós‐PTApré)/(PTAmax‐PTApré))*100%, onde PTApré é a média de tons puros medida no pré‐operatório, PTApós é a média de tons puros medida no pós‐operatório e PTAmax é o nível máximo gerado por um audiômetro padrão. Os valores de PA (preservação auditiva) foram divididos em: perda auditiva (sem audição detectável), PA mínima (variação de 1% a 25%), PA parcial (26% a 75%) e PA completa (> 75%).13 No entanto, para a finalidade desse artigo, a análise detalhada restringiu‐se aos resultados pré‐operatórios dos testes vestibulares e sua associação com a audição pré‐operatória.
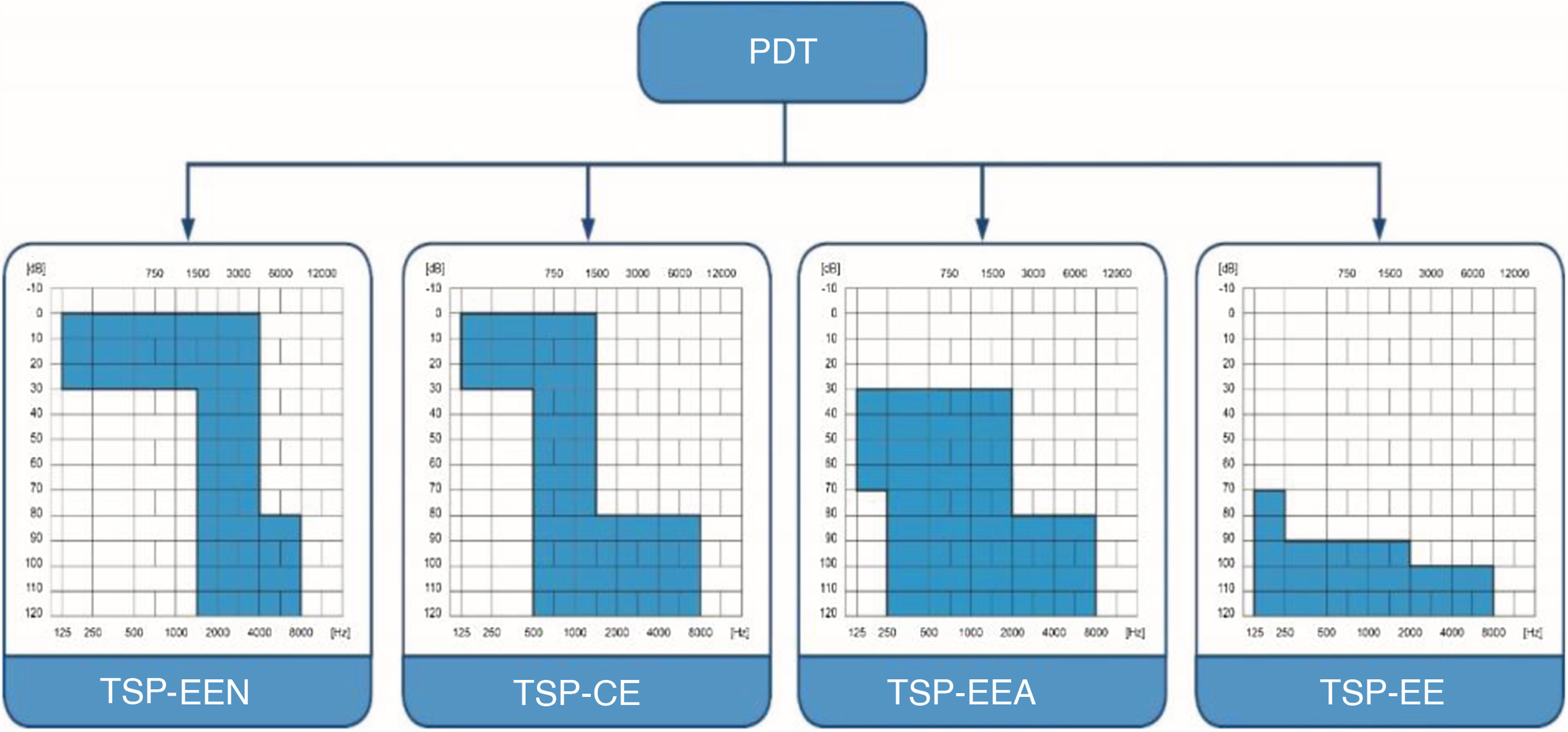
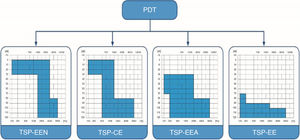
Os pacientes foram divididos em quatro grupos, de acordo com os limiares auditivos e da audição nas frequências baixas. Baseamos a divisão na classificação “Tratamento da surdez parcial” (TSP) (figs. 1 e 2).14–17 A classificação refere‐se aos pacientes que são parcialmente surdos, portanto apresentam limiares auditivos detectáveis dentro dos limites do audiômetro que precisam ser protegidos e resultam em diferentes estratégias cirúrgicas de implante coclear de acordo com o grau de preservação auditiva. A estimulação eletronatural (TSP‐EEN) refere‐se a pacientes com limiares normais ou apenas levemente elevados em faixas de baixa e média frequência, que precisam de complementação elétrica com um eletrodo muito curto;15,16 o complemento elétrico (TSP‐CE) ‐ pacientes com limiares normais ou apenas levemente elevados em baixas frequências, que necessitam de complementação elétrica com eletrodos curtos e sem amplificação na região apical;17 estimulação eletroacústica (TSP‐EEA) – pacientes com audição residual de baixa e média frequências, que precisam de amplificação de um aparelho auditivo para baixas frequências e estimulação elétrica do eletrodo implantado para frequências médias e altas18 e estimulação elétrica (TSP‐EE) – inclui os pacientes com audição residual não funcional que se beneficiarão somente da estimulação elétrica após a inserção do eletrodo longo.
Classificação do tratamento de surdez parcial. TSP‐EEN, Tratamento de surdez parcial ‐ estimulação eletro‐natural; TSP‐CE, Tratamento de surdez parcial ‐ complemento elétrico; TSP‐EEA, Tratamento de surdez parcial ‐ estimulação eletroacústica; TSP‐EE, Tratamento de surdez parcial ‐ estimulação elétrica.
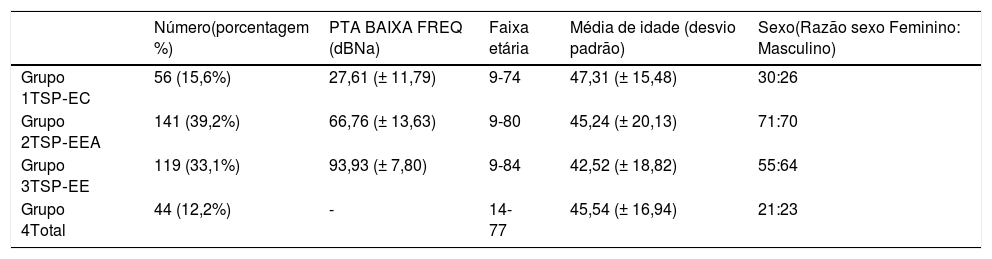
Em nosso estudo, o Grupo 1 preencheu os critérios audiológicos para o grupo TSP‐CE, o Grupo 2 para TSP‐EEA e Grupo 3 para TSP‐EE, enquanto o Grupo 4 incluiu pacientes sem limiares auditivos detectáveis dentro dos limites do audiômetro. As médias de tons puros para 125, 250, 500 e 1000Hz (PTA BAIXA FREQ) e as estatísticas descritivas de cada grupo são apresentadas na tabela 1.
Estatística descritiva de todos os grupos
| Número(porcentagem %) | PTA BAIXA FREQ (dBNa) | Faixa etária | Média de idade (desvio padrão) | Sexo(Razão sexo Feminino: Masculino) | |
|---|---|---|---|---|---|
| Grupo 1TSP‐EC | 56 (15,6%) | 27,61 (± 11,79) | 9-74 | 47,31 (± 15,48) | 30:26 |
| Grupo 2TSP‐EEA | 141 (39,2%) | 66,76 (± 13,63) | 9-80 | 45,24 (± 20,13) | 71:70 |
| Grupo 3TSP‐EE | 119 (33,1%) | 93,93 (± 7,80) | 9-84 | 42,52 (± 18,82) | 55:64 |
| Grupo 4Total | 44 (12,2%) | - | 14-77 | 45,54 (± 16,94) | 21:23 |
PTA BAIXA FREQ, média da Audiometria de Tom Puro para 125 Hz, 250 Hz, 500 Hz, 1000 Hz.
Os critérios de exclusão foram: orelha já implantada, doença de orelha média como história de otosclerose, lesão ou fixação ossicular, pós‐timpanoplastia, canal wall down, qualquer gap aéreo‐ósseo na audiometria de tons puros, perfuração timpânica, “síndrome da terceira janela” (síndrome da deiscência do canal superior), aquedutos vestibulares alargados, doença retrococlear conhecida ou doença neurológica que sabidamente afete as respostas do VEMP (doença do cerebelo, doença desmielinizante, doença neurodegenerativa), rigidez dos músculos do pescoço.
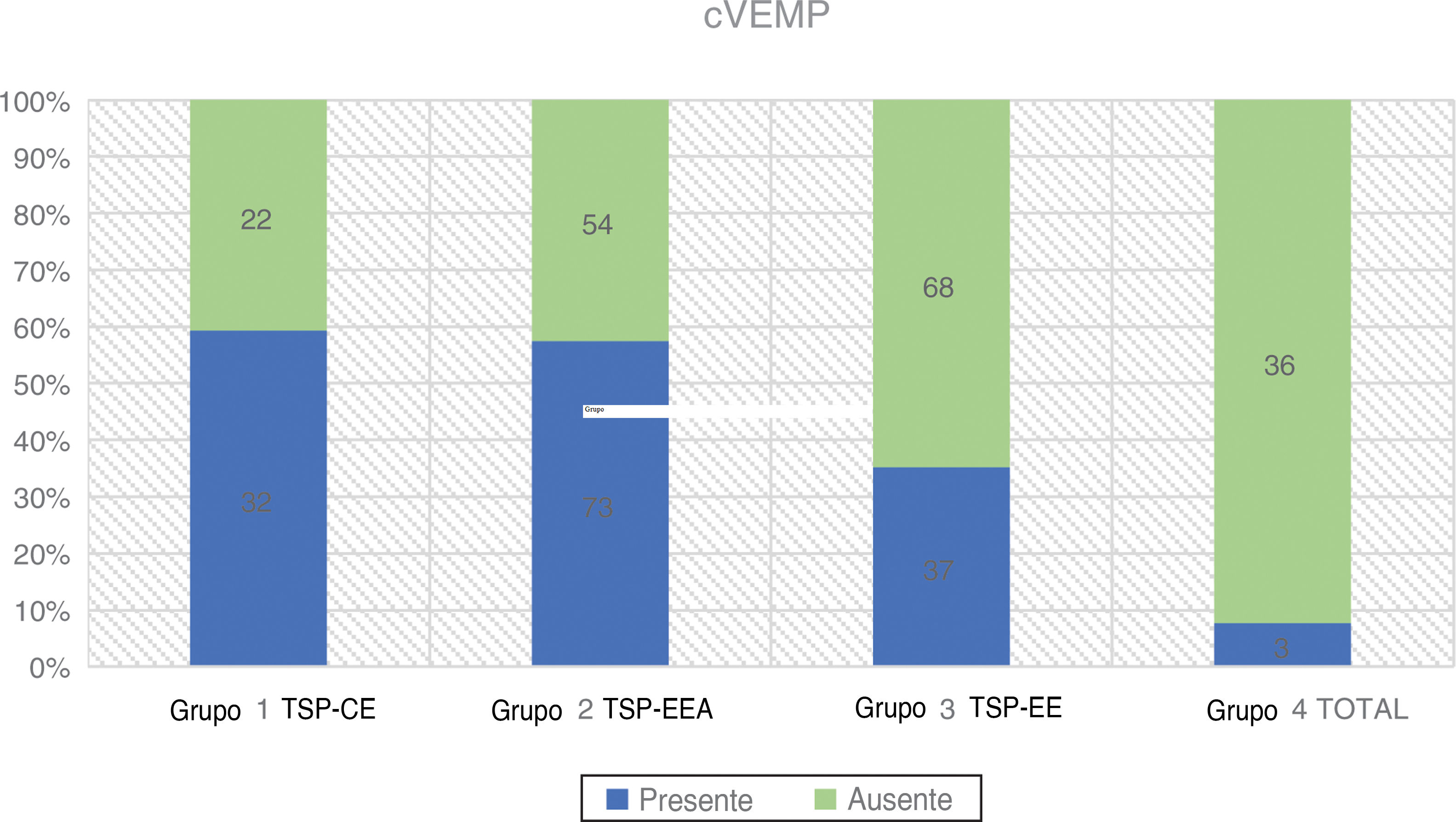
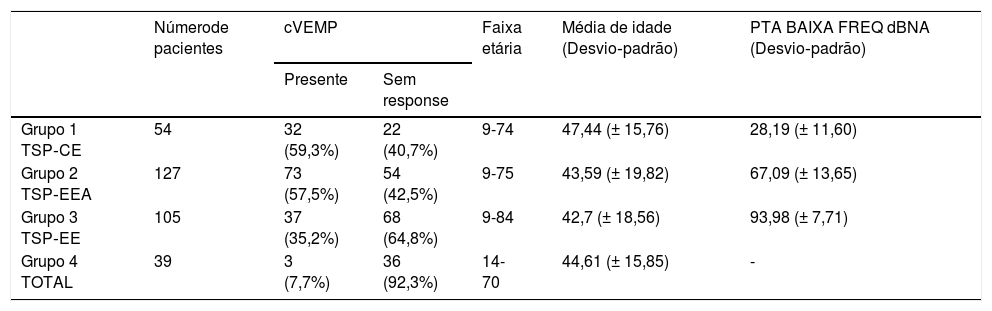
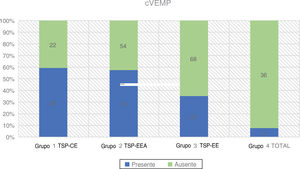
cVEMPsA estimulação foi fornecida monoauralmente através das pontas de inserção com um estímulo tone burst de 500Hz a 97 dBnNA e taxa de estimulação de 5,1Hz, gate de estimulação 2:2:2. Um conjunto de 200 estímulos foi medido e sua média obtida. O paciente ficava sentado e foi solicitado que girasse a cabeça a 45° de distância da orelha estimulada, a fim de obter constante contração tônica do músculo esternocleidomastóideo (ECM). Um nível de contração do ECM de 50–150μV foi mantido durante todo o exame com biofeedback visual derivado do software. Os dois eletrodos ativos foram colocados no ponto médio entre a inserção do músculo na mastoide e sua origem no esterno, enquanto o eletrodo invertido foi colocado entre as articulações esternoclaviculares e o eletrodo terra foi anexado à testa. A impedância dos eletrodos foi mantida abaixo de 2,5 kΩ. A resposta foi considerada presente se dois padrões eletromiográficos repetíveis fossem desencadeados com duas formas de onda reconhecíveis P1 e N1 (fig. 3 e tabela 2).
cVEMPs em surdez parcial
| Númerode pacientes | cVEMP | Faixa etária | Média de idade (Desvio‐padrão) | PTA BAIXA FREQ dBNA (Desvio‐padrão) | ||
|---|---|---|---|---|---|---|
| Presente | Sem response | |||||
| Grupo 1 TSP‐CE | 54 | 32 (59,3%) | 22 (40,7%) | 9-74 | 47,44 (± 15,76) | 28,19 (± 11,60) |
| Grupo 2 TSP‐EEA | 127 | 73 (57,5%) | 54 (42,5%) | 9-75 | 43,59 (± 19,82) | 67,09 (± 13,65) |
| Grupo 3 TSP‐EE | 105 | 37 (35,2%) | 68 (64,8%) | 9-84 | 42,7 (± 18,56) | 93,98 (± 7,71) |
| Grupo 4 TOTAL | 39 | 3 (7,7%) | 36 (92,3%) | 14-70 | 44,61 (± 15,85) | - |
PTA BAIXA FREQ, média da Audiometria de Tom Puro para 125 Hz, 250 Hz, 500 Hz, 1000 Hz.
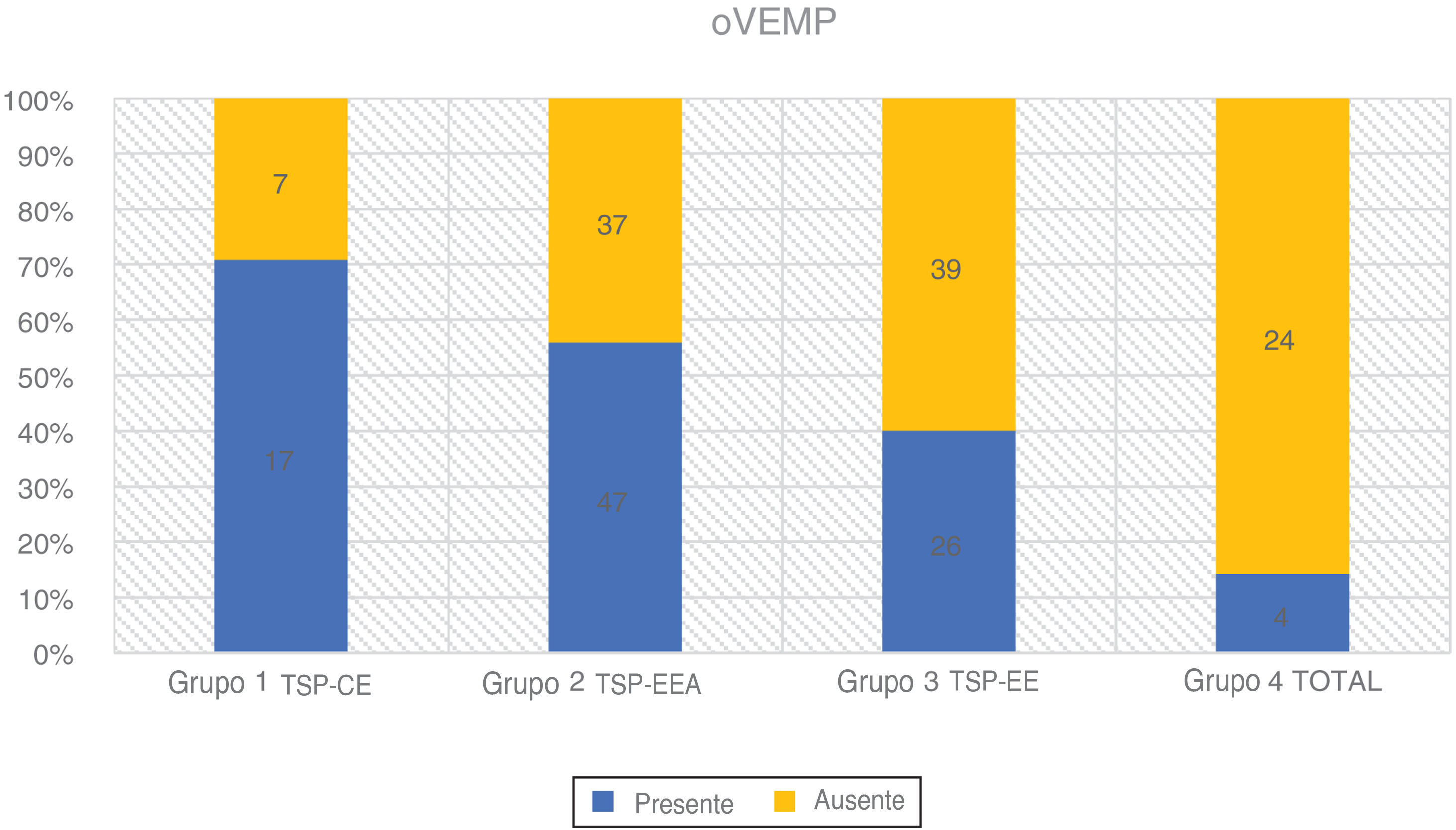
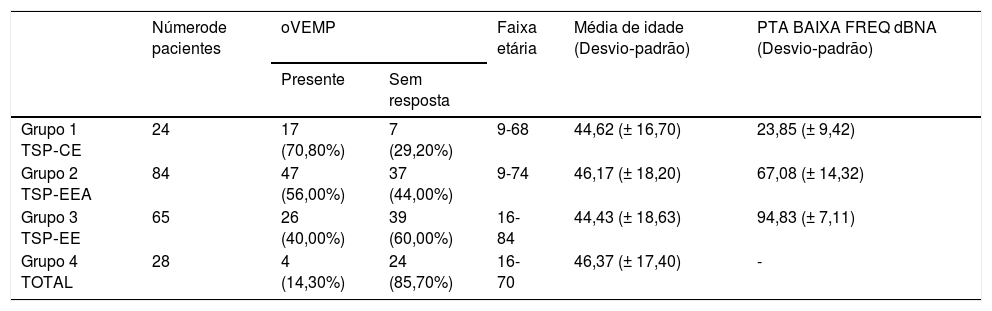
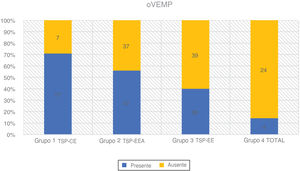
Os oVEMPs foram medidos com um estímulo tone burst de 500Hz a 97 dBnNA, gate de estimulação 2:2:2, taxa de estimulação de 5,1 s, média de sinal de 500 estímulos. Os eletrodos ativos foram colocados infraorbitalmente na linha média do olho, o eletrodo de referência foi colocado no queixo e o eletrodo terra, na testa. A resposta foi registrada contralateralmente e a impedância do eletrodo foi mantida abaixo de 2,5 kΩ. O paciente estava sentado e foi solicitado que direcionasse o olhar a 35° na vertical durante o registro. A resposta foi considerada presente se dois padrões repetíveis fossem registrados com duas formas de onda reconhecíveis N1 e P1 (fig. 4 e tabela 3).
oVEMPs em surdez parcial
| Númerode pacientes | oVEMP | Faixa etária | Média de idade (Desvio‐padrão) | PTA BAIXA FREQ dBNA (Desvio‐padrão) | ||
|---|---|---|---|---|---|---|
| Presente | Sem resposta | |||||
| Grupo 1 TSP‐CE | 24 | 17 (70,80%) | 7 (29,20%) | 9-68 | 44,62 (± 16,70) | 23,85 (± 9,42) |
| Grupo 2 TSP‐EEA | 84 | 47 (56,00%) | 37 (44,00%) | 9-74 | 46,17 (± 18,20) | 67,08 (± 14,32) |
| Grupo 3 TSP‐EE | 65 | 26 (40,00%) | 39 (60,00%) | 16-84 | 44,43 (± 18,63) | 94,83 (± 7,11) |
| Grupo 4 TOTAL | 28 | 4 (14,30%) | 24 (85,70%) | 16-70 | 46,37 (± 17,40) | - |
PTA BAIXA FREQ, média da Audiometria de Tom Puro para 125Hz, 250Hz, 500Hz, 1000Hz.
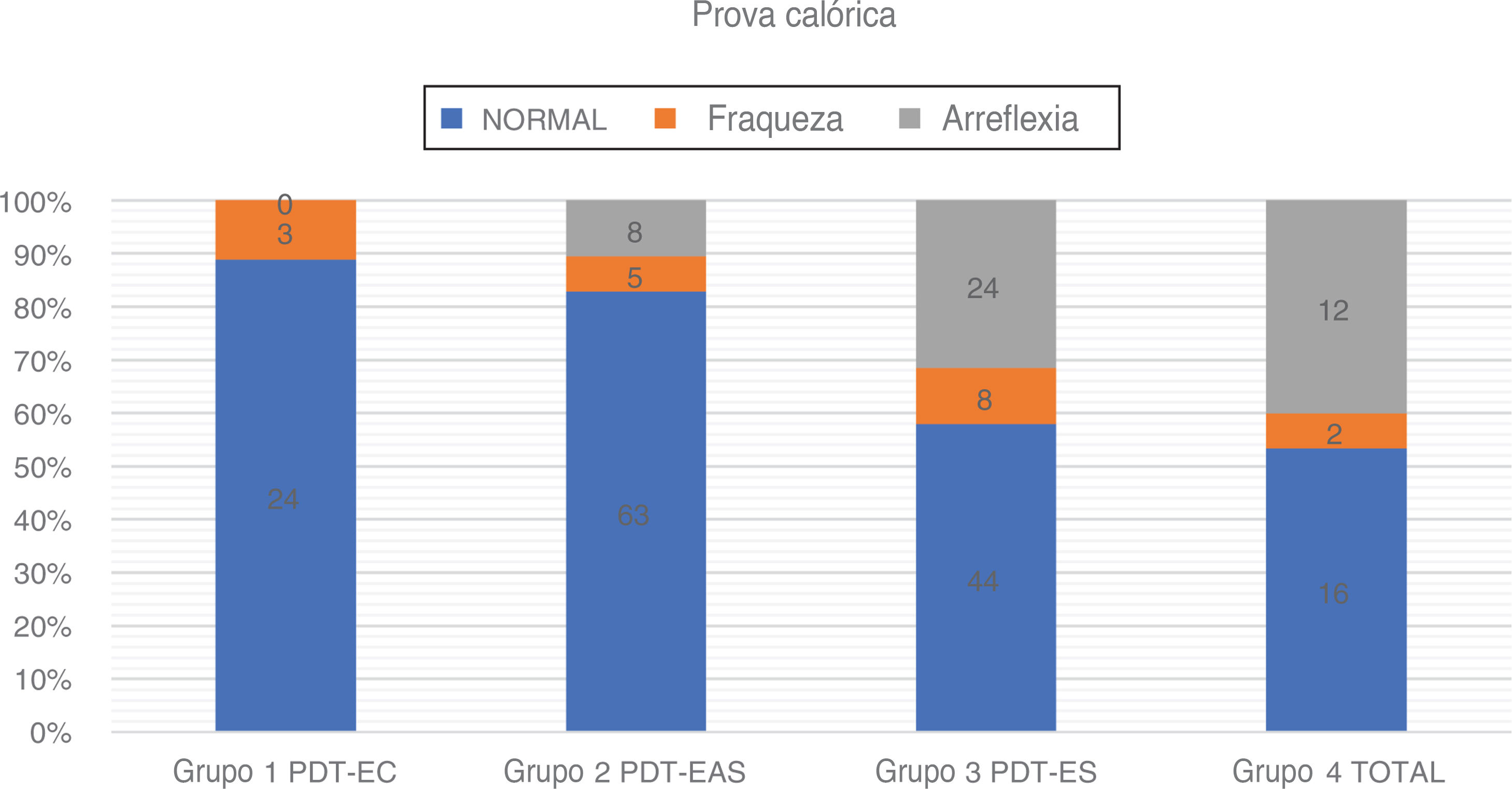
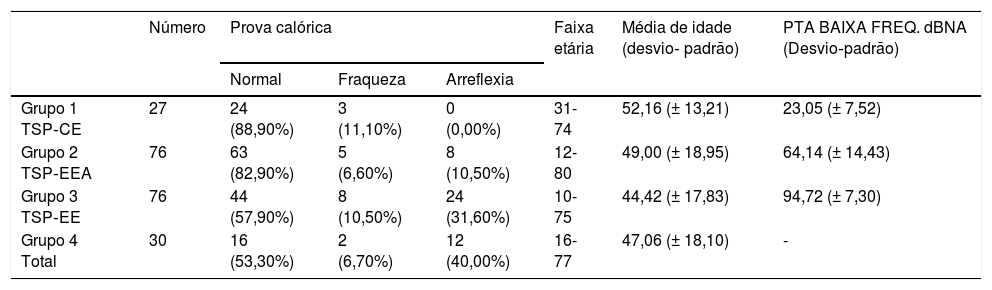
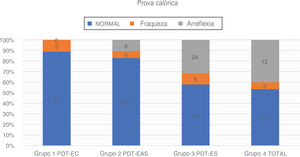
Usamos a estimulação calórica bitérmica de Fitzgerald‐Hallpike, com dois estímulos (44°C e 30°C) por 30 segundos. O segundo teste foi feito após um descanso de pelo menos 8 minutos do primeiro. Os pacientes estavam em posição supina com elevação de 30° da parte superior do corpo. Fraqueza unilateral (UW, do inglês unilateral weakness) e velocidade da componente lenta (SCV, do inglês slow componente velocity) foram registradas em ambos os lados. O grau de paresia do canal (UW) foi calculado com base na fórmula de Jongkees, com 75% > UW > 25% considerado como uma resposta enfraquecida e UW > 75% como arreflexia. No caso de respostas calóricas fracas bilateralmente, a arreflexia foi estabelecida se a resposta calórica total (a soma de SCV para água quente e fria) < 12°. Em caso de dúvida, fizemos teste adicional da cadeira rotatória ou confiamos no vHIT no plano dos canais semicirculares laterais para distinguir entre respostas calóricas fisiologicamente fracas e arreflexia (fig. 5 e tabela 4).
Resultados da prova calórica na surdez parcial
| Número | Prova calórica | Faixa etária | Média de idade (desvio‐ padrão) | PTA BAIXA FREQ. dBNA (Desvio‐padrão) | |||
|---|---|---|---|---|---|---|---|
| Normal | Fraqueza | Arreflexia | |||||
| Grupo 1 TSP‐CE | 27 | 24 (88,90%) | 3 (11,10%) | 0 (0,00%) | 31-74 | 52,16 (± 13,21) | 23,05 (± 7,52) |
| Grupo 2 TSP‐EEA | 76 | 63 (82,90%) | 5 (6,60%) | 8 (10,50%) | 12-80 | 49,00 (± 18,95) | 64,14 (± 14,43) |
| Grupo 3 TSP‐EE | 76 | 44 (57,90%) | 8 (10,50%) | 24 (31,60%) | 10-75 | 44,42 (± 17,83) | 94,72 (± 7,30) |
| Grupo 4 Total | 30 | 16 (53,30%) | 2 (6,70%) | 12 (40,00%) | 16-77 | 47,06 (± 18,10) | - |
PTA BAIXA FREQ, média da Audiometria de Tom Puro para 125 Hz, 250 Hz, 500 Hz, 1000 Hz.
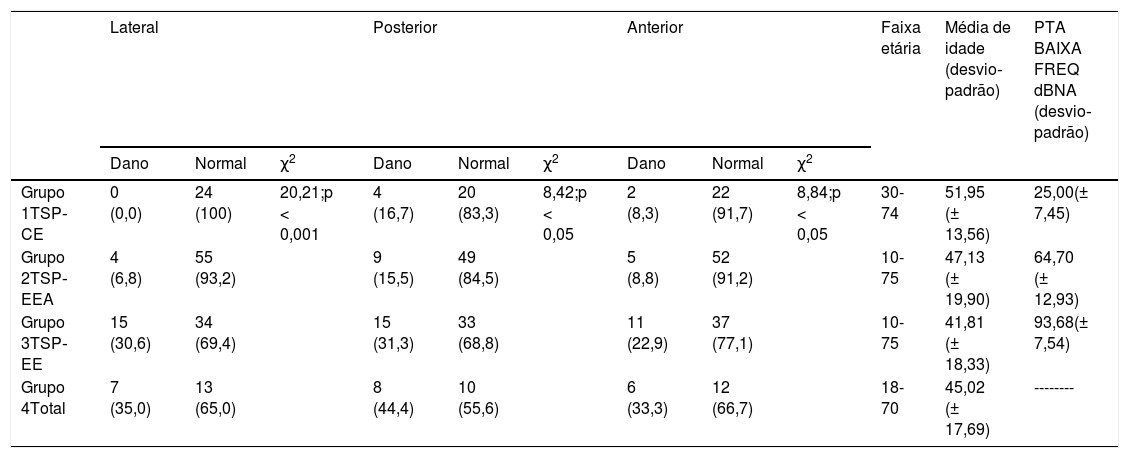
O paciente estava sentado e foi solicitado que continuasse olhando para um local. Então, um movimento da cabeça abrupto, imprevisível e com ângulo pequeno (cerca de 10°‐20°) foi feito em três planos: horizontal, anterior esquerdo‐posterior direito (AEPD) e anterior direito‐ posterior esquerdo (ADPE). Em todos os casos, foram fornecidos 20 impulsos com uma velocidade de pico mínima da cabeça de 150°/s. O ganho normal (quociente de velocidade de movimento da cabeça e velocidade de movimento dos olhos) variou de 0,6 a 1,2. Um ganho abaixo de 0,6 ou a presença de uma sacada encoberta ou descoberta foi tratada como evidência de dano ao canal semicircular específico (tabela 5).
Resultados do vHIT. Número (Porcentagem %)
| Lateral | Posterior | Anterior | Faixa etária | Média de idade (desvio‐padrão) | PTA BAIXA FREQ dBNA (desvio‐padrão) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dano | Normal | χ2 | Dano | Normal | χ2 | Dano | Normal | χ2 | ||||
| Grupo 1TSP‐CE | 0 (0,0) | 24 (100) | 20,21;p < 0,001 | 4 (16,7) | 20 (83,3) | 8,42;p < 0,05 | 2 (8,3) | 22 (91,7) | 8,84;p < 0,05 | 30-74 | 51,95 (± 13,56) | 25,00(± 7,45) |
| Grupo 2TSP‐EEA | 4 (6,8) | 55 (93,2) | 9 (15,5) | 49 (84,5) | 5 (8,8) | 52 (91,2) | 10-75 | 47,13 (± 19,90) | 64,70 (± 12,93) | |||
| Grupo 3TSP‐EE | 15 (30,6) | 34 (69,4) | 15 (31,3) | 33 (68,8) | 11 (22,9) | 37 (77,1) | 10-75 | 41,81 (± 18,33) | 93,68(± 7,54) | |||
| Grupo 4Total | 7 (35,0) | 13 (65,0) | 8 (44,4) | 10 (55,6) | 6 (33,3) | 12 (66,7) | 18-70 | 45,02 (± 17,69) | -------- | |||
PTA BAIXA FREQ, média da Audiometria de Tom Puro para 125Hz, 250Hz, 500Hz, 1000Hz.
O teste do qui‐quadrado para independência foi feito para determinar se existe uma associação significante entre afiliação a um grupo auditivo específico e os resultados de testes vestibulares e regressão logística para descrever a associação entre audição residual de baixa frequência (medida como PTA para 125 Hz, 250 Hz, 500 Hz, 1000 Hz; PTA LOW FREQ) e função vestibular.
Como os resultados do teste vestibular dependem da idade, especialmente para os testes VEMP,19–22 adicionalmente usamos o teste de Kruskal‐Wallis para comparar os quatro grupos em termos de idade. Para a análise estatística, foi usado o software IBM SPSS Statistics v. 24 e um valor de p < 0,05 foi estabelecido como estatisticamente significante.
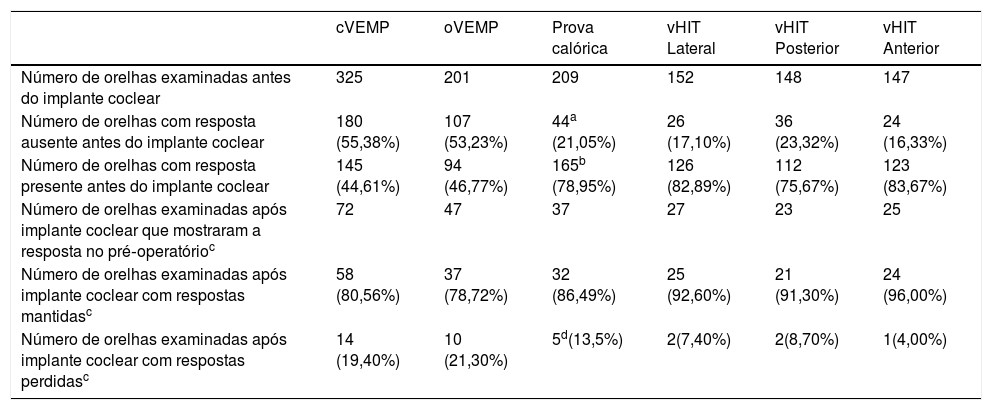
ResultadosEntre 360 orelhas de 225 pacientes incluídos no estudo, 325 orelhas foram avaliadas por cVEMP, 201 por oVEMP, 209 por prova calórica e 152 por vHIT. As discrepâncias entre o número de orelhas examinadas em cada teste foram causadas por: incapacidade de seguir adequadamente o protocolo do exame em particular, o que tornou seu resultado não confiável (manter a tensão adequada do músculo ECM para cVEMP, manter o olho fixo em um ponto durante os movimentos da cabeça ou atingir a velocidade adequada dos movimentos da cabeça no vHIT), desacordo dos pacientes em relação a toda a bateria de testes (principalmente prova calórica, como os que mais comumente causam vertigem), intolerância aos testes (por exemplo, estimulação calórica), introdução de oVEMP e vHIT posteriormente no protocolo. O resumo das orelhas examinadas antes e após o implante coclear é apresentado na tabela 6. Entre as 142 orelhas que tiveram alguma audição detectável antes do implante coclear (Grupos 1, 2 e 3) e foram analisadas após o implante coclear, 60 (42,25%) preservam completamente a audição, 73 preservaram parcialmente (51,40%), 6 minimamente (4,22%) e 3 (2,11%) não tiveram audição detectável nos 6 meses de seguimento.
Número de orelhas examinadas para cada teste vestibular
| cVEMP | oVEMP | Prova calórica | vHIT Lateral | vHIT Posterior | vHIT Anterior | |
|---|---|---|---|---|---|---|
| Número de orelhas examinadas antes do implante coclear | 325 | 201 | 209 | 152 | 148 | 147 |
| Número de orelhas com resposta ausente antes do implante coclear | 180 (55,38%) | 107 (53,23%) | 44a (21,05%) | 26 (17,10%) | 36 (23,32%) | 24 (16,33%) |
| Número de orelhas com resposta presente antes do implante coclear | 145 (44,61%) | 94 (46,77%) | 165b (78,95%) | 126 (82,89%) | 112 (75,67%) | 123 (83,67%) |
| Número de orelhas examinadas após implante coclear que mostraram a resposta no pré‐operatórioc | 72 | 47 | 37 | 27 | 23 | 25 |
| Número de orelhas examinadas após implante coclear com respostas mantidasc | 58 (80,56%) | 37 (78,72%) | 32 (86,49%) | 25 (92,60%) | 21 (91,30%) | 24 (96,00%) |
| Número de orelhas examinadas após implante coclear com respostas perdidasc | 14 (19,40%) | 10 (21,30%) | 5d(13,5%) | 2(7,40%) | 2(8,70%) | 1(4,00%) |
Foram avaliadas no pré‐operatório 325 orelhas. A maior taxa de respostas positivas foi relatada no Grupo 1 (59,3%), seguido pelo Grupo 2 (57,5%). No Grupo 3, apenas 35,2% dos pacientes apresentaram respostas presentes, enquanto no Grupo 4 a porcentagem de VEMPs registrados diminuiu para 7,7%. A relação entre afiliação a um grupo e a taxa de respostas cVEMP desencadeadas foi estatisticamente significante com o teste qui‐quadrado (χ2 = 38,45; p < 0,001).
A média de idade nos quatro grupos foi semelhante, a mais alta foi observada no Grupo 1, onde tivemos a maior taxa de respostas corretas aos cVEMPs. A diferença na média de idade entre os grupos não foi estatisticamente significante: χ2 = 2,21; p = 0,530 (p > 0,05). A regressão logística mostrou que a incidência de respostas ao cVEMP era dependente da idade e PTA BAIXA FREQ (p < 0,001 para os dois). Cada 10 dBNA a menos nos limiares auditivos medidos como PTA BAIXA FREQ aumentava as chances de ter resposta do cVEMP em 1,27 vezes. (OR = 1,27)
oVEMPsNovamente, a taxa de respostas positivas ao VEMP diminuiu proporcionalmente com a deterioração da audição residual de baixa frequência em 201 orelhas que examinamos. Observamos a maior taxa de respostas registradas no Grupo 1 (70,8%) e no Grupo 2 (56,0%). O grupo 3 teve 40,0% de respostas detectadas e o grupo 4 apenas 14,3%. De acordo com o teste qui‐quadrado, o grau de audição residual de baixa frequência teve um efeito significante na taxa de respostas desencadeadas (χ2 = 21,49; p < 0,001).
O teste de Kruskal‐Wallis mostrou que a diferença de idade entre os grupos era estatisticamente não significante: χ2 = 0,53; p = 0,913 (p > 0,05). A taxa de oVEMPs desencadeados mostrou ser dependente da idade (p < 0,001) e da PTA para audição residual de baixa frequência (p < 0,001). Cada queda de 10 dBNA na PTA BAIXA FREQ foi associada com uma chance 1,22 vez maior de desencadear oVEMP (OR = 1,22).
Prova calóricaA prova calórica foi feita em 209 orelhas. Uma associação entre o grau de audição residual de baixa frequência e a função do canal semicircular lateral também ficou aparente. A taxa de respostas normais à prova calórica foi maior no Grupo 1 (88,9%) e no Grupo 2 (81,6%). A função do canal semicircular lateral foi mais fraca no Grupo 3 (57,9%) e no Grupo 4 (53,3%). A análise estatística com o teste qui‐quadrado mostrou que a audição residual de baixa frequência teve impacto na taxa de respostas calóricas normais: χ2 = 25,75; p < 0,001
Entre todos os pacientes submetidos à prova calórica, a diferença de idade entre os grupos foi estatisticamente não significante: χ2 = 4,39; p = 0,222 (p > 0,05). A regressão logística comprovou a correlação estatisticamente significante entre o resultado da prova calórica e a audição residual de baixa frequência (p = 0,0001), enquanto a idade ficou no limite da significância estatística (p = 0,050). A redução de 10dB na PTA BAIXA FREQ implicava uma chance 1,46 vez maior de ter uma resposta calórica normal, em vez de uma resposta enfraquecida ou apresentar arreflexia (OR = 1,46).
vHITOs resultados do vHIT foram acentuadamente melhores no Grupo 1, seguidos pelo Grupo 2 e muito piores nos Grupos 3 e 4. Verificamos o reflexo vestibuloocular com vHIT em 152, 148, 147 orelhas nos planos lateral, anterior e posterior do canal semicircular, respectivamente. No grupo TSP‐CE, a função do canal semicircular foi totalmente preservada em 83,3%. No grupo TSP‐EEA, o percentual de casos com função preservada em todos os canais semicirculares não foi inferior a 84,5%. No grupo PDT‐EE, a taxa de resultados corretos no vHIT em todos os planos foi de 68,8%. O grupo total apresentou pelo menos 55,6% de respostas normais para todos os canais. As diferenças entre os grupos foram estatisticamente significantes para o canal semicircular anterior, posterior e lateral.
No caso do canal semicircular lateral, anterior e posterior, a incidência de resultados corretos do vHIT não foi associada à idade (correspondentemente, p = 0,760, p = 0,477, p = 0,674), mas foi dependente da média do limiar auditivo de baixa frequência (correspondentemente: p < 0,001, p = 0,004, p = 0,001). As chances de ter mantido o reflexo vestibuloocular no plano do canal semicircular lateral, posterior e anterior aumentaram, respectivamente, 1,71 (OR = 1,71), 1,24 (OR = 1,24) e 1,41 (OR = 1,41) vezes a cada 10 dBNA a menos na PTA BAIXA FREQ.
DiscussãoSurdez parcial (SP) é uma condição em que a perda auditiva ocorre em pelo menos uma frequência crítica para a compreensão da fala.14 Há vários anos, sabe‐se que pacientes com surdez parcial podem se beneficiar de um implante coclear (IC). No início, apenas aqueles com audição residual não funcional em baixas frequências recebiam um IC. Então, com o progresso da tecnologia, o conhecimento eletrofisiológico e técnicas cirúrgicas (técnicas de preservação auditiva: abordagem da janela redonda, eletrodos flexíveis, micropunctura da janela redonda, administração perioperatória de esteroides),14,18,23–25 tornou‐se possível para pacientes com audição usável em baixas frequências receber estimulação elétrica através de um IC e amplificação acústica de sua audição residual (Tratamento de surdez parcial ‐ estimulação eletroacústica; PDT‐EEA). Após anos de aprimoramento das técnicas cirúrgicas e de ganho de mais experiência, os pacientes com audição normal ou apenas levemente elevada nas frequências baixas, mas que necessitam de complemento elétrico – um IC com eletrodos mais curtos para frequências médias e altas – também foram incluídos e classificados como surdez parcial‐complemento elétrico.17 Recentemente, alguns poucos casos de indivíduos com IC com audição normal até 1500Hz foram descritos e classificados como tratamento de surdez parcial‐estimulação eletronatural (PDT‐EEN).15,16
O implante coclear na surdez parcial levanta o problema da preservação da audição residual. Na presente análise, fica claro que esse grupo de pacientes não apenas tem uma melhor cóclea, mas também boa função vestibular, que precisa ser protegida. É verdade que as consequências da perda vestibular não são tão graves quanto as da perda auditiva. Nos casos de lesão vestibular, os mecanismos de compensação no sistema nervoso central permitem um controle postural bastante normal e tornam transitória a grande maioria dos sintomas pós‐operatórios vestibulares. No entanto, à medida que recrutamos indivíduos mais velhos para tratamento com IC, ou aqueles com distúrbios vestibulares ou neurológicos pré‐existentes, o problema ganha importância, principalmente com implantes bilaterais. A literatura que aborda a questão da preservação vestibular após implante coclear relatou perda de respostas do cVEMP em 0% ‐76,47%26–31 e respostas calóricas significativamente reduzidas em 0% a 72,40%,26–32 mesmo quando técnicas de preservação auditiva foram adotadas. É por isso que os cuidados especiais e aconselhamento são recomendados ao selecionar um paciente para implante coclear.
Nossos desfechos podem não ser um indicador direto do status vestibular em orelhas surdas, mas mostram a tendência estatística. Vale ressaltar que pelo menos 53,3% dos pacientes sem audição residual detectável apresentaram função do canal semicircular posterior normal, o que pode piorar após o implante coclear. Eles podem ser potencialmente tratados como tendo orelhas totalmente danificadas, quando nada mais pode ser perdido após a operação, enquanto mais da metade deles ainda tem função vestibular relevante. Nossos resultados indicam que os órgãos otólitos são mais afetados em orelhas com surdez profunda (sáculo em 55,38% e utrículo em 53,23%) do que nos canais semicirculares (entre 16,33% a 23,32% de falta de resposta de acordo com a prova calórica ou vHIT). Isso pode ser esclarecido pela proximidade anatômica da cóclea, que torna o sáculo e o utrículo mais suscetíveis a fatores nocivos.
Há pouquíssimos dados comparáveis na literatura. Que seja de nosso conhecimento, nenhuma outra pesquisa usou essa gama de testes vestibulares para examinar tantos pacientes parcialmente surdos. Tribukait et al.1 mostraram que, se a audição era superior a 90dB (PTA de 0,5, 1,0 e 2,0kHz), a função vestibular era frequentemente normal, mas, para níveis auditivos de 100/120dB, a função dos órgãos otólitos diminuía significativamente. Os níveis auditivos correlacionaram‐se mais estreitamente com a função dos órgãos otólitos, especialmente a do utrículo, do que com a função do canal semicircular lateral.1 Lin et al.33 dividiram os pacientes com perda auditiva neurossensorial congênita não hereditária e não sindrômica em dois grupos de acordo com o grau da perda auditiva: > 90dB (PTA, para 500Hz, 1000Hz, 2000Hz, 3000Hz) e ≤ 90dB (PTA para 500Hz, 1000Hz, 2000Hz, 3000Hz). Eles descobriram que o pior grupo auditivo apresentou maior incidência de respostas ausentes do que o último: cVEMP (80% e 68%), oVEMP (70% vs. 20%) e provas calóricas (40% vs. 5%), respectivamente. A perda auditiva com ATP ≥ 65dB foi associada à função vestibular significativamente pior.33
Sandberg et al.7 encontraram uma correlação entre a gravidade da perda auditiva e os resultados das provas calóricas (80% das provas calóricas normais quando a PTA para 0,5, 1 e 2kHz foi < 90dB, mas apenas 20% das provas calóricas normais quando PTA > 98dB).
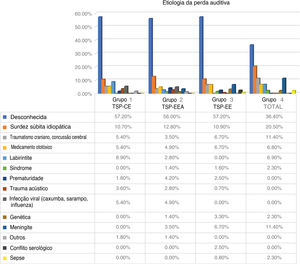
As limitações do nosso estudo decorrem do fato de o teste VEMP ter sido feito com estímulos conduzidos por ar. Para eliminar falsos negativos, foram excluídos todos os pacientes com perda auditiva condutora coexistente. Não introduzimos limitação de idade. Alguns de nossos pacientes podem ter tido respostas vestibulares ausentes ou fracas devido ao envelhecimento do órgão vestibular, principalmente no caso de VEMPs. A média da idade foi semelhante em cada grupo e não poderia ter afetado o resultado final. A etiologia específica da surdez em cada grupo pode ter tido algum impacto no status da função vestibular. Em todos os nossos grupos, a etiologia da perda auditiva foi considerada principalmente “desconhecida”, mas parecia não haver forte preponderância em qualquer grupo de uma causa específica de perda auditiva.
ConclusãoPacientes com surdez parcial têm melhor condição vestibular do que aqueles sem audição residual detectável nas frequências baixas. Em resumo, verificamos que quanto melhor a audição residual nas frequências baixas, melhor a condição vestibular. Se não houver critérios audiológicos ou anatômicos rígidos, a condição vestibular pré‐operatória parece ser um bom indicador para decidir em que lado a cirurgia deve ser feita.
FinanciamentoA pesquisa não recebeu subsídio específico de agências de fomento nos setores público ou comercial.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Elzbieta Gos pela análise estatística e Maria Matuszewska e Anna Mazur pela avaliação técnica.
Como citar este artigo: Sosna M, Tacikowska G, Pietrasik K, Skarzynski H, Skarzynski PH. Vestibular status in partial deafness. Braz J Otorhinolaryngol. 2021;87:379–88.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.