Introdução: A leishmaniose de mucosa (LM) é uma forma clínica grave da leishmaniose. Fatores complexos ligados ao parasita e ao hospedeiro são atribuídos ao desenvolvimento das lesões de mucosa. Leishmania RNA Vírus 1 (LRV1) pode subverter a resposta imune, podendo ser o principal determinante da gravidade da doença e deve ser pesquisado.
Objetivo: Estudar a existência de diferenças clínicas entre pacientes portadores de LM com endosimbiose por LRV1 e as que não possuem.
Métodos: Foi realizado um estudo de coorte histórica com corte transversal com avaliação clínica, detecção da Leishmania por técnica de PCR, classificação da espécie e pesquisa de LRV1. Foram incluídos na análise da pesquisa somente os pacientes com diagnóstico confirmado de LM com PCR positivo, com lesão de mucosa nasal.
Resultados: Dos 37 pacientes, 30 (81,1%) foram diagnosticados com L. braziliensis, 5 (13,5%) com L. guyanensis e 2 (5,4%) com infecção mista de L. braziliensis e L. guyanensis. O vírus LVR1 estava presente em 26 casos (70,3%).
Conclusão: A correlação entre o fenótipo clínico e a presença do LRV1 não foi constatada, porém a frequência do vírus é duas vezes maior em lesão de mucosa do que encontrado em trabalho, da mesma região, sobre lesão cutânea.
Introduction: Mucosal leishmaniosis (ML) is a severe clinical form of leishmaniosis. Complex factors related to the parasite and the host are attributed to the development of mucosal lesions. Leishmania RNA virus 1 (LRV1) can disrupt immune response, and may be the main determinant of severity of the disease; it should be investigated.
Objective: To study the existence of clinical differences between patients with ML with endosymbiosis by LRV1 and. those without it.
Methods: A cross-sectional cohort study with clinical evaluation, polymerase chain reaction (PCR) detection of Leishmania, species classification, and search of LRV1 was performed. Only patients with confirmed diagnosis of ML by positive PCR and with nasal mucosa injuries were included in this analysis.
Results: Out of 37 patients, 30 (81.1%) were diagnosed with Leishmania braziliensis, five (13.5%) with Leishmania guyanensis, and two (5.4%) with mixed infection of L. braziliensis and L.guyanensis. LVR1 virus was present in 26 (70.3%) of the cases.
Conclusion: Correlation between clinical phenotype and presence of LRV1 was not observed, although the frequency of the virus is two-fold higher in mucosal lesions than that found in the literature on skin lesions in the same geographical area.
Introdução
A leishmaniose é considerada uma doença tropical negligenciada, amplamente ignorada na discussão das prioridades de doenças tropicais. Este fato está associado a complexa epidemiologia, ecologia, falta de ferramentas simples de gestão e falta de dados.1 Em 2010, a OMS estimou 119.600 casos de leishmaniose tegumentar americana (LTA) no Brasil usando grau de subnotificação considerada leve de 2,8 a 4,6 vezes.1 Vega et al. (2012) calcularam o custo efetivo (gasto médico e não médico) de tratamento de LC, na Colômbia, como sendo de US$ 345 per capita. Se projetarmos o mesmo custo para o Brasil, o gasto médio com LTA será de US$ 7.586,490 por ano com casos novos. O custo dos anos de vida perdida pela patologia por paciente (DALY-WHO) estimado na Colômbia foi de US$ 15.000.2 Quando se consideram somente as LM, o custo de tratamento e o custo DALY, se apresentam bem maiores.
A leishmaniose de mucosa (LM) é uma importante forma clínica grave da leishmaniose pelo potencial destrutivo das suas lesões. É causada por um protozoário do gênero Leishmania, apresenta um DNA extranuclear e uma organela mitocondrial, o cinetoplasto. Apresenta duas formas evolutivas durante o seu ciclo biológico: amastigota, que é o parasita obrigatório intracelular em vertebrados, e promastigota, nos vetores invertebrados (flebotomídeos).3
Existem indícios de que a leishmaniose possa ser autóctone da região Amazônica. O cronista espanhol Pedro Pizarro (1571) relatou que os povos situados nos vales quentes do Peru eram dizimados por um mal do nariz na vertente amazônica. Teoria andina, formulada por Rabello (1925), foi conjecturada a partir do descobrimento dos huacos peruanos (peças de cerâmica pré-colombiana), retratando pessoas com deformidades no nariz. Com base em estudos epidemiológicos da L. braziliensis, Marzochi e Marzochi, em 1994, propõem que leishmaniose tenha origem na Amazônia ocidental.4,5
As leishmanias são divididas em subgêneros Viannia e Leishmania. No Brasil, são reconhecidas pelo menos sete espécies responsáveis por doenças, sendo a forma tegumentar causada principalmente pela L. (V.)braziliensis, L. (V.)gyanensis e L. (L.)amazonensis e, mais raramente, pela L. (V.)laisoni, L. (V.)naiffi e L.(V.)shawi, L. (V.)lindenbergi, todos de interesse para região Amazônica. As três primeiras espécies estão envolvidas na leishmaniose mucosa, enquanto a L. (L.)chagasi é a responsável pela doença visceral.3,6-8 A L. braziliensis é a principal causadora de LM, porém, pesquisa recente mostra relevante incidência da Leishmania guyanensis, principalmente ao norte do rio Amazonas.9L. amazonensis também pode causar LM3. Nenhum caso de LM por L. (V.) panamensis foi relatada no Brasil.
A LM pode manifestar-se com obstrução nasal, epistaxe associada à produção de crostas, rinorreia e dor leve. Na fase inicial há presença de edema e hiperemia de mucosa septal anterior, presença de nodulações e, posteriormente, formação de lesão granulomatosa que pode evoluir com perfuração septal, edema de nariz com espessamento da pele, queda do suporte nasal (nariz de tapir ou anta) e pirâmide nasal volumosa.8,10 Mais de 90% das lesões de mucosas afetam somente o septo nasal anterior.8,9,11 Podem comprometer gravemente o nariz, o palato, a gengiva, a faringe e a laringe, causando deformidades que comprometem a fonação, a respiração, a deglutição e a autoestima.8,10,11
Fatores relacionados ao parasita, ao hospedeiro e à magnitude da resposta imunológica são relevantes para a lesão de mucosa. As metástases do parasita, até a mucosa das vias aerodigestivas superiores, podem se dar por via linfática ou hematogênica.3,8,12 Fatores complexos e ainda mal compreendidos são atribuídos ao desenvolvimento das lesões de mucosa (socioeconômicos, ambientais, do hospedeiro e do parasita). Lesões de mucosa por contiguidade também podem ocorrer.3,8
Uma via comum para o desenvolvimento da LM está associada a uma duradoura resposta imune do hospedeiro frente ao parasita, com aumento dos mediadores inflamatórios como TNF-α, CXCL10, CCL4 e um aumento da atividade citotóxica mediada por célula T, maior quantidade de linfócitos CD4+ e CD8+, aumento de IFNγ, IL-2, IL-5, menor produção de IL-1013-15 e, também, o polimorfismo dos genes codificantes dos mediadores inflamatórios, como TNF-α e IL-6.3,13,14,16
Células T Helper 1 produzem linfocinas que ativam os macrófagos (IL-2, IFN-γ, TNF-α e IL-12) combatendo os parasitas. T Helper 2 produzem IL-4 e IL-10 que inibem os macrófagos, deixando-os susceptíveis à infecção. A Leishmania é capaz de direcionar a diferenciação de células T para uma resposta do tipo Th2, caracterizada pela persistência da infecção.14,15,17 O parasita deve adaptar seu metabolismo ao estresse oxidativo intracelular no fagolisossomo dos macrófagos.16 Paradoxalmente, a LM se caracteriza pelo exagero na resposta a antígenos da Leishmania e pela escassez de parasitas. O exagero na resposta Th1 causa destruição de tecido onde estão as partículas antigênicas.14,18,19
Recentemente, Ives et al. (2011) demonstraram que o parasitismo da Leishmania pelo Leishmania RNA Vírus 1 (LRV1), um vírus RNA de fita dupla da família Totviridae, eleva a concentração de citocinas e quimiocinas (TNF-α, CXCL10, CCL5, IL-6) em macrófagos mediados por TLR3 e TRIF em clones de L. guyanensis com alto potencial de metástases em cobaias, demonstrando que ácidos nucleicos dos vírus endossimbiótico atua como forte imunógeno, causando uma reação inflamatória destrutiva da mucosa.13,16 Pesquisas sobre o LRV1 têm sido realizadas desde sua primeira descrição, há 20 anos, mas o seu papel na leishmaniose permaneceu desconhecido. Não houve grandes estudos sobre o impacto do vírus até o trabalho de Ives et al.
No estudo filogenético da LRV, com exceção de uma cepa de L. major com Leishmania RNA Vírus 2 (LRV2) infectado de uma lesão cutânea na antiga União Soviética, todas as cepas LRV descritas originam-se da América do Sul. A avaliação da evolução genética entre os tipos de LRV e entre espécies de Leishmania infectadas com estes vírus são compatíveis com o paralelo da evolução de Leishmania e LRV.19,20
O modelo propõe que o reconhecimento inato de LRV1 ocorre nas primeiras horas de infecção. A liberação de dsRNA viral dos parasitas mortos que, então, se liga ao receptor Toll-like 3 (TLR3), aciona a cascata inflamatória que piora a doença, podendo ser o principal determinante da sua gravidade.21 Portanto, a detecção de LRV pode ter importância clínica e nortear a terapêutica e o prognóstico.13,16,19,21
Apesar do LRV1 ser encontrado em grandes linhagens metastáticas de L. braziliensis e L. guyanensis, as metástases podem ocorrer na ausência dele.19,22 A descoberta de LRV como imunógeno inata, alterando o curso da leishmaniose, deve motivar uma investigação mais aprofundada sobre tais hiperpatógenos virais em outras infecções.19
Os métodos rotineiramente empregados para o diagnóstico de leishmaniose cutânea são limitados para as lesões mucosas.8,9,11,12 A reação de Montenegro não é adequada pois, normalmente, as lesões mucosas são secundárias às cutâneas. A baixa parasitemia nestas lesões traz grande limitação à biopsia e à pesquisa direta por esfregaço das lesões.8,12,23 O baixo nível de anticorpos traz limitações aos testes sorológicos.11,23 A identificação ao microscópio, ou cultura, é raramente isolada a partir das lesões de mucosa.24 A reação em cadeia da polimerase (PCR) destaca-se como excelente exame (padrão ouro)12 pela sensibilidade e especificidade, principalmente para determinação da espécie do parasita24 e também para detecção do LRV1.22,25
Dada a relevante pesquisa sobre LRV1 por Ives13 na definição do fenótipo de leishmaniose de mucosa em camundongos e pela ausência de informações sobre a presença deste vírus e as manifestações clínicas nos pacientes, decidiu-se estudar a existência de diferenças clínicas em pacientes portadores de LM com presença ou não de endossimbiose por LRV1, trazendo uma contribuição no processo de educação permanente na saúde para os profissionais que atuam com esta doença tão desafiadora, que representa ainda um grande problema de saúde pública no Brasil. O melhor entendimento desta patologia pode nortear um protocolo mais pragmático e exequível para reduzir os efeitos destrutivos desta patologia.
Método
A pesquisa foi um estudo de coorte histórica com corte transversal em pacientes atendidos no ambulatório de otorrinolaringologia, referenciados com suspeita de LM para avaliação por um único médico otorrinolaringologista responsável por estes casos, a fim de obter uma padronização de informações clínicas no período de dezembro de 2012 a dezembro de 2013.
Após a confirmação da suspeita clínica de LM pelo especialista, os pacientes foram convidados a participar da pesquisa e, com consentimento, foram submetidos à biópsia para estudo histopatológico com instilação tópica, sobre a lesão, de lidocaína spray a 10% e condicionado em formol tamponado a 10%. Logo em seguida, foram coletados, sobre o leito da biópsia, com escova tipo cervical para exame de Papanicolaou, e material para exame de PCR em duas amostras, fazendo ligeira rotação sobre a ferida da biópsia com duas escovas. Foram coletadas uma amostra para pesquisa da Leishmania e sua espécie e outra para pesquisa do LVR1, mantidas em RNALater™ (Ambion®) até o momento das extrações de DNA e RNA, utilizando-se kits comerciais. Os pacientes sem lesões aparentes não foram submetidos à biópsia, mas foram coletadas amostras para pesquisa molecular instilando anestésico da mesma forma, realizando a rotação da escova sobre a mucosa septal até produzir discreta escoriação.
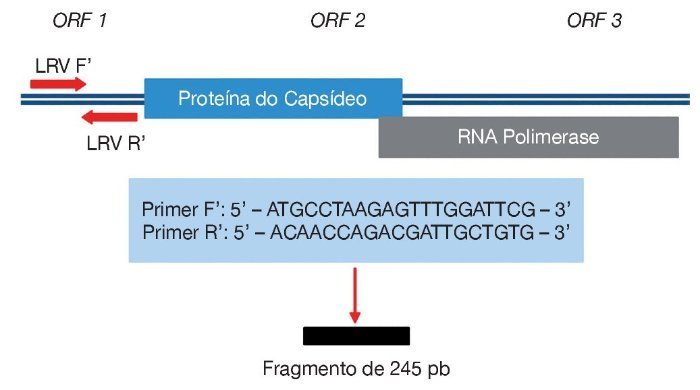
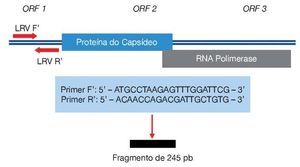
Para detecção de DNA de Leishmania foram utilizados três pares de iniciadores (ITS1, kDNA e hsp70) (tabela 1), e para o LRV1 foi utilizado um par de iniciadores que amplificam uma pequena região da ORF1 (fig. 1), todos com controles positivos. A pesquisa do LVR1 foi feita apenas nas amostras positivas para Leishmania por ser um vírus intracelular do parasita.
Figura 1 Região amplificada para detecção do LRV1 e sequências dos primers utilizados. Fonte: Cantanhêde.30
Foram incluídos somente os pacientes com diagnóstico confirmado de LM com PCR positivo e lesão de mucosa nasal, com objetivo de se obter uma padronização das lesões, e que assinaram o termo de consentimento livre e esclarecido. Foram excluídos casos não autóctones da região norte do Brasil.
Para comparar a gravidade das lesões associadas à presença do vírus, utilizou-se o estadiamento proposto por Lessa (2012)10 para leishmaniose de mucosa nasal. Foi incluído o estadio 0 (sem lesões aparentes), para pacientes com metástases latentes com parasita em mucosa aparentemente normal (tabela 2).12
As análises estatísticas foram realizadas através dos softwares SPSS V.,19 EpiData® V3.1 e EpiData Analysis V1.1. Foram elaboradas análises descritivas das frequências absolutas e relativas com intervalo de confiança de 95%, dos sinais clínicos encontrados e das espécies do parasito Leishmania. Foi determinado o Risco Relativo (RR) da presença do LRV1 em pacientes com lesão mucosa comparados com lesão cutânea, obtido em estudo de Catanhêde (2011).
As amostras coletadas obedeceram aos critérios da Resolução CNS 441/2011. O projeto de pesquisa foi aprovado pelo Comitê de Ética e Pesquisa sob o número CAAE 10215912.1.0000.5300.
Resultados
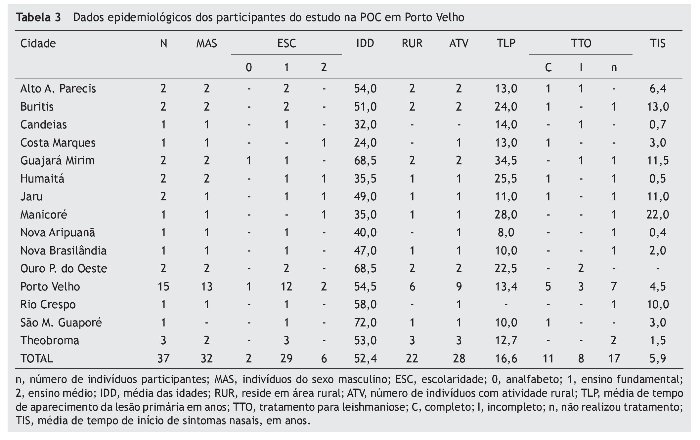
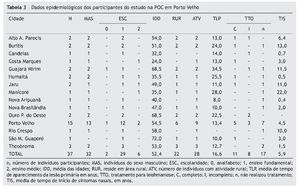
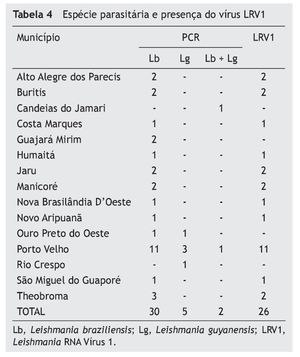
Nossa pesquisa avaliou 44 pacientes, e seis foram excluídos por não terem diagnósticos confirmados com PCR. Assim, 37 pacientes de 13 municípios de Rondônia e dois do Amazonas foram incluídos (tabela 3 e fig. 2).
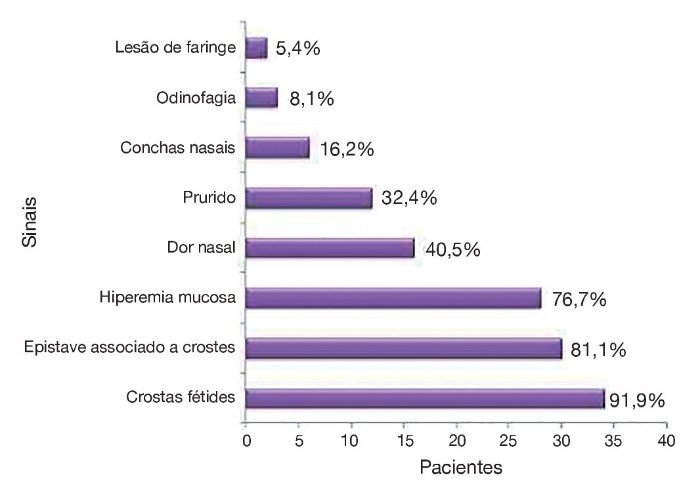
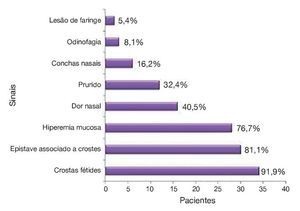
Figura 2 Principais sinais e sintomas apresentados pelos pacientes avaliados na pesquisa.
No total, 29 (78,3%) pacientes que relataram ter LC com presença de cicatriz compatível na pele 29, com história de LC e sem cicatriz compatível; três (8,1%) e cinco (13,5%) pacientes não apresentavam história prévia nem cicatriz de LC.
Conforme a tabela 4, os sintomas mais frequentes foram: produção de crostas fétidas, rinorreia crônica fétida, epistaxe discreta associada à retirada de crostas e obstrução nasal; e, no exame físico, úlcera granulomatosa, crostas, hiperemia de mucosa e perfuração septal.
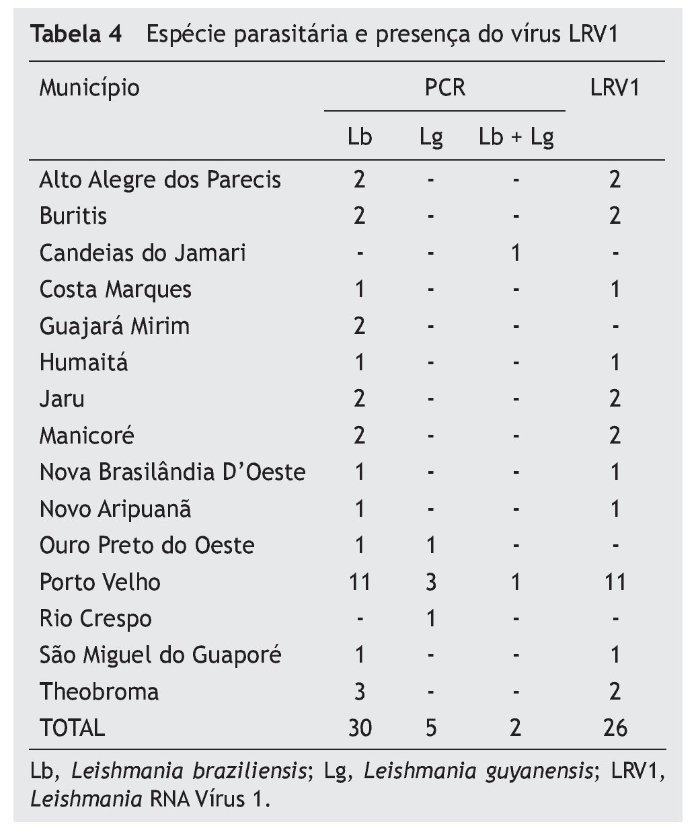
Dos 37 pacientes, 30 (81,1%) foram diagnosticados com L. braziliensis, cinco (13,5%) com L. guyanensis e dois (5,4%) com infecção mista de L. braziliensis e L. guyanensis. O vírus LVR1 estava presente em 26 casos (70,3%), sendo 23 associados a L. braziliensis, dois a L. guyanensis e um à infecção mista.
O tempo médio para o aparecimento de lesão primária foi de 16,6 anos (95% IC 11,1-22,1; DP = 16,4), variando de 0 a 66 anos. Quando comparados com a presença de vírus LRV1+: 16,2 anos (95% IC 10,2-22,2; DP = 14,9) e LRV1-: 17,7 anos (95% IC 4,0-31,4; DP = 20,4). Não houve diferença entre os grupos LRV1+ e LRV1– (p = 0,790) em relação ao tempo médio de aparecimento da lesão primária.
A média de tempo para o aparecimento de sintomas nasais foi de 5,9 anos (95% IC 3,5-8,3; DP = 7,3), variando de 0 a 22 anos. Quando comparados com a presença ou ausência do vírus (LRV1), obtivemos as seguintes médias de tempo, LRV1+: 5,7 anos (95% IC 2,88-8,50; DP = 6,95); LRV1-: 4,7 anos (95% IC 0,04-9,43; DP = 6,99). Não houve diferença entre os grupos LRV1+ e LRV1– (p = 0,351). Havia um paciente com HIV que desenvolveu LC e LM quase simultaneamente.
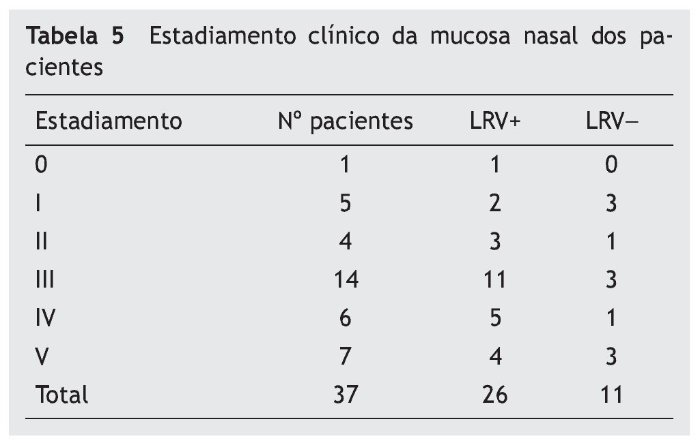
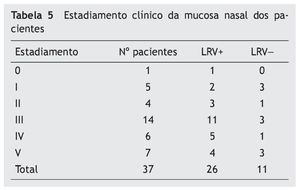
Para compararmos se os pacientes com LRV1 apresentam lesões mais graves do que os pacientes sem o vírus, utilizamos a tabela 5 de estadiamento das lesões para análise.
A tabela 5 mostra que a maioria das lesões se apresentava no estádios III, IV e V (73%). Dos pacientes com LRV1+, 20 (76,9%) estavam nos estádios mais avançados (III, IV e V); naqueles com LRV-, sete (63,6%) estavam nestes estádios. Não houve diferença significativa do estadiamento clínico entre paciente LRV1+/LRV1- (p = 0,09).
Por questões técnicas, somente 21 resultados do estudo histopatológico foram recebidos: seis com diagnóstico de leishmaniose, sete compatíveis (um destes com PCR negativo para leishmaniose), seis como inespecíficos, um como rinite crônica e um como paracoccidioidomicose.
Discussão
A leishmaniose é uma doença endêmica da região norte do Brasil que tem o maior coeficiente de detecção do país.9,26,27
Baseado no banco de dados do Sistema de Informação de Agravos de Notificação (SINAN)28 sobre a Leishmaniose Tegumentar Americana (LTA) no Brasil, até 2003⁄2004 houve uma crescente incidência de notificações de leishmaniose cutânea (LC) no Brasil, sustentada pela região norte, com pico próximo de 30.000 casos/ano, com posterior queda, mantendo-se estável a partir de 2006, com uma média de 21.000 notificações por ano. A LM segue tendência, caindo de 2.000 casos para 1.400, no mesmo período. Rondônia apresenta perfil de declínio mais acentuado da LC, caindo de 1.981 casos em 2004 para 859 casos em 2010. A LM segue curva semelhante, com pico de 196 casos em 2005 para 118 em 2010. Os coeficientes de detecção 10.0000 hab. para LC e LM são de 46,33 e 5,7, respectivamente, para o mesmo ano.
O perfil epidemiológico do grupo pesquisado foi de homens (86%) com idade média de 52 anos, residentes na zona rural, com história prévia de LC em torno de 18 anos, e que não trataram ou fizeram tratamento incompleto, com tempo de sintomas nasais, em média, de 5,4 anos. Este perfil é semelhante ao apresentado no trabalho de Guerra,9 realizado em Manaus com 47 pacientes com LM, com pouca diferença na média de idade (47 anos) e tempo de lesão nasal (8,3 anos). Neste estudo, o perfil epidemiológico, quando divididos em LRV1+ e LRV1–, não apresenta diferença significativa.
A espécie predominante na LM foi a L. braziliensis (81%) e, para corroborar com os achados de Guerra,9 contrariando as informações até então obtidas, encontramos cinco (13,5%) pacientes com L. guyanensis. Pela nossa averiguação, foi o primeiro relato da presença de dois (5,6%) casos com infecção mista de L. braziliensis e L. guyanensis de mucosa nasal, um deles com presença de vírus, e os dois casos com envolvimento da mucosa do palato e faringe, elevando as infecções por L. guyanensis para 19%, ratificando a considerável frequência desta espécie. Existem poucos estudos sobre a prevalência das espécies de Leishmania na região. Acreditamos que a espécie sempre esteve presente com a relevância detectada neste trabalho e no de Guerra.
A presença de infecção mista evidencia a ausência de proteção cruzada que uma espécie possa produzir em relação à outra. Em contrapartida, esta dupla infecção poderia oferecer uma grande oferta de antígenos, produzindo uma reação hiperimune Th1, causando um envolvimento mais extenso da mucosa da via aerodigestiva nestes dois pacientes.
LRV1 foi detectado em 26 dos 37 casos (70,3%). Foram detectados 23/30 casos de L. braziliensis, 2/5 de L. guyanensis e 1/2 de infecções mistas, mostrando grande frequência do vírus nas infecções de mucosa nas duas espécies; porém, um terço dos pacientes apresenta LM sem a presença do vírus, comprovando que as lesões metastáticas apresentam outros fatores associados a essa forma clínica. Pereira et al. (2013) encontraram LRV1 em dois de cinco casos (40%) de LC da região norte do Brasil, e nenhum LRV1 em 40 casos de LTA (9 com LM) no Rio de Janeiro (sudeste do Brasil); Ogg25 encontrou 25,5% de LRV1+ em 47 amostras de LTA (duas de LM). Hartley19 diz que LRV pode ter uma contribuição variável para LM, atuando sozinho ou em conjunto com outros fatores.
A ausência de LRV1 no Rio de Janeiro, no trabalho de Pereira, corrobora as teorias de que Leishmania é autóctone da região Amazônica, enquanto que as espécies que predominam no sul e sudeste do Brasil podem ter origens diferentes (teoria do mediterrâneo).4,5 A presença do LRV1 pode servir como marcador filogenético da origem dos parasitas. As Leishmanias da região Amazônica apresentam maior diversidade genética do que as da região sudeste do Brasil.29
Cantanhêde,30 em seu trabalho sobre detecção de LRV1 em LTA que compõe um grupo de pesquisa maior sobre a LTA, na mesma região, da qual este trabalho também faz parte, detectou 35,9% de positividade da LRV1 em 78 pacientes com LC (RR = 0,63; 95% IC 0,10-0,55). Na nossa avaliação, a detecção de LRV1 em LM foi de 70,3%, mostrando associação significativa do envolvimento do vírus com LM (RR = 2,67; 95% IC 1,82-9,81). Esta associação pode decorrer da alteração da resposta imune provocada pelo vírus.13,16,19,21
Pela primeira vez, foi realizado um estudo de correlação entre a presença de LRV1 e o fenótipo clínico da LM. Esta pesquisa não constatou diferença significativa entre os grupos com LRV1+ comparado com LRV1-, baseado no estadiamento das lesões de mucosa proposta,10 no que diz respeito à gravidade das lesões. Da mesma forma, não foram encontradas diferenças epidemiológicas entres os grupos, nem diferença entre os sinais e sintomas apresentados por eles.
Diante da possibilidade de o vírus determinar lesões mais precoces ou mais graves, o que faz com que o paciente procure assistência médica com mais rapidez, avaliamos o intervalo decorrido para cada grupo (LRV+/LRV–) iniciar os sintomas da lesão nasal após ter tido a lesão cutânea, e o tempo gasto por cada grupo para procurar o médico após o início dos sintomas nasais. Essas duas informações poderiam representar a precocidade do aparecimento das lesões e a gravidade do quadro clínico, respectivamente. Não houve significância no intervalo do início dos sintomas (p-0,13), nem para o tempo decorrido para o paciente procurar médico (p-0,35) entre os grupos.
Para comparar o grau de comprometimento da mucosa entre os dois grupos, foi realizado o estadiamento das lesões septais proposto por Lessa,10 com a inclusão do estádio 0 para casos nos quais a mucosa apresentasse aspecto normal, porém com presença de parasita.12 Esse estadiamento foi bastante oportuno, pois esta pesquisa incluiu somente lesão nasal que contemplasse mais de 90% das lesões de mucosa.8,9,11 Dos pacientes LRV1+, 4 (15,38%) apresentavam-se no estádio mais avançado e nos LRV– três (27,3%) deles. Não houve diferença no estadiamento dos grupos (p-0,09).
Pode ser que, pelo fato de os pacientes já chegarem com lesões muita antigas, estas já se encontrariam numa fase onde não era possível uma diferenciação entre os dois grupos em relação ao fenótipo clínico. Se existiam diferenças, isso não foi constatado, mas, sem dúvida, averiguamos que lesões fortemente destrutivas independem da presença do vírus.
O ideal seria o acompanhamento de pacientes com LC com LRV1 e sem, para comparar a evolução das lesões de mucosa nos dois grupos, mas na prática, isso parece inviável, pois o aparecimento destas lesões pode demorar muito e, conforme trabalho de Figueroa et al. (2009), o parasita pode estar presente em mucosa sadia sem significar doença. Ele ressalta que esta condição é mais regra do que exceção.
Os pacientes com LM são diagnosticados tardiamente. A maioria apresenta lesões avançadas, com grande potencial de sequelas pós-tratamento. Isso pode refletir dificuldade de acesso ao sistema,9,27 dificuldade de diagnóstico8,9,11,12 e/ou insuficiência de conhecimento da doença.
É comum que os profissionais que têm o primeiro contato com pacientes portadores de clínica sugestiva de LM (clínico geral, dermatologista e infectologista) não estejam familiarizados com a avaliação clínica de mucosa nasal, que é o sítio mais comum desta patologia, e terminam por encaminhar estes pacientes ao otorrinolaringologista, que também tem obstáculos no que diz respeito a doenças granulomatosas de mucosa, decorrentes da dificuldade de confirmação diagnóstica desta patologia. Os meios diagnósticos disponíveis nas unidades de saúde são insuficientes e inadequados para confirmação de LM, devido às dificuldades naturais da doença (baixa parasitemia nas lesões, infecção cutânea prévia), restando os exames mais complexos não disponíveis nas áreas endêmicas como o PCR.
LRV1 existe, no âmbito espécies de Leishmania, como uma infecção estável, e foi encontrado em toda América do Sul em leishmanioses cutâneas, que são muitas vezes complicadas pela ocorrência de metástase infecciosa com uma resposta subjacente hiperinflamatória.13 A detecção de LRV1 pode trazer benefícios clínicos, orientar tratamento, apresenatar prognóstico pela sua potencialidade em determinar as formas clínicas de leishmaniose, e pode servir de alvo para o desenvolvimento de novos tratamentos, como produção de vacinas ou outros medicamentos. A LRV1 parece não ser a última fronteira na elucidação da fisiopatologia da LM, mas outro forte fator envolvido na história natural da doença.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Conclusão
Apesar da associação da presença do vírus LRV1 com a alteração da resposta imune ter sido demonstrada, nosso trabalho não constatou correlação entre os aspectos clínicos e a presença do vírus nos pacientes com leishmaniose de mucosa, porém, a frequência do vírus é duas vezes maior em lesão de mucosa do que em cutânea, comprovando a necessidade do seu melhor entendimento.
Recebido em 21 de julho de 2014;
aceito em 23 de setembro de 2014
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.07.014
☆ Como citar este artigo: Ito MM, Catanhêde LM, Katsuragawa TH, da Silva Junior CF, Aranha Camargo LM, Mattos RG, et al. Correlation between presence of Leishmania RNA virus 1 and clinical characteristics of nasal mucosal leishmaniosis. Braz J Otorhinolaryngol. 2015;81:533-40.
☆☆ Instituição: Universidade Federal de Rondônia (UNIR), Porto Velho, RO, Brasil.
* Autor para correspondência.
E-mail:marcosmassayuki@uol.com.br (M.M. Ito).