Introdução: Lesões neurogênicas e musculares associadas à apneia obstrutiva do sono podem comprometer a força e a dinâmica das contrações faríngeas e esofágicas durante a deglutição.
Objetivo: Verificar se há alterações na manometria faringoesofágica de pacientes com apneia obstrutiva do sono com e sem disfagia orofaríngea.
Método: Foram avaliados, prospectivamente, 22 pacientes com apneia obstrutiva do sono sem queixa espontânea de disfagia, utilizando questionário, videoendoscopia da deglutição e manometria faringoesofágica, com medidas das pressões do esfíncter esofagiano inferior e superior e pressão média da faringe em três níveis durante a deglutição.
Resultados: 17 pacientes (77,3%) formaram o grupo com disfagia, por apresentarem alterações de deglutição na videoendoscopia da deglutição (n = 15; 68,2%) e/ou no questionário (n = 7; 31,8%). Os cinco restantes compuseram o grupo sem disfagia orofaríngea. Em todos os casos com alterações na videoendoscopia da deglutição houve escape precoce do bolo alimentar para a faringe. Não houve diferença significante entre os grupos com e sem disfagia em relação a todas as medidas de manometria, idade e gravidade da apneia obstrutiva do sono.
Conclusões: A manometria faringoesofágica não demonstrou diferença significante entre os grupos com e sem disfagia orofaríngea.
Introduction: Upper airway nerve and muscle damage associated with obstructive sleep apnea may impair the strength and dynamics of pharyngeal and esophageal contractions during swallowing.
Objective: To evaluate the presence of alterations in pharyngoesophageal manometry in patients with obstructive sleep apnea with and without oropharyngeal dysphagia.
Methods: This study prospectively evaluated 22 patients with obstructive sleep apnea without spontaneous complaints of dysphagia, using a questionnaire, fiber optic endoscopic evaluation of swallowing, and pharyngoesophageal manometry, including measurement of the upper and lower esophageal sphincter pressures and mean pharyngeal pressures at three levels during swallowing.
Results: The dysphagia group consisted of 17 patients (77.3%) in whom swallowing abnormalities were detected on fiber optic endoscopic evaluation of swallowing (n = 15; 68.2%) and/or in the questionnaire (n = 7; 31.8%). The five remaining cases comprised a control group without oropharyngeal dysphagia. In all cases of abnormalities on fiber optic endoscopic evaluation of swallowing, there was premature bolus leakage into the pharynx. There was no statistically significant difference between the groups regarding any of the pharyngoesophageal manometry measurements, age, or severity of obstructive sleep apnea.
Conclusion: Pharyngoesophageal manometry detected no statistically significant difference between the groups with and without oropharyngeal dysphagia.
Introdução
Lesões neurais no palato mole e na orofaringe são uma das alterações encontradas em pacientes com apneia obstrutiva do sono (AOS) e em roncadores primários.1-3 Alguns autores acreditam que estas lesões sejam desencadeadas ou por vibrações de baixa frequência produzidas pelo ronco ou por hipóxia intermitente relacionada à AOS.4-6 A mucosa do palato mole de pacientes roncadores primários e com AOS apresenta um número aumentado de terminações nervosas anômalas.1 Já o músculo palatofaríngeo, tanto em roncadores primários quanto em pacientes com AOS, possui alterações morfológicas típicas de lesão neural periférica, tais como agrupamentos por tipo de fibra, agrupamentos de áreas de atrofia e atrofia fascicular.2
O acúmulo de alterações neurológicas na faringe de pacientes com AOS pode causar disfunção no processo de deglutição, uma vez que a evocação do reflexo da deglutição e a propagação do bolo alimentar são dependentes de adequada sensibilidade (aferência) e função faríngeas. Além disto, acredita-se que a perpetuação da AOS prejudique a aferência neuromuscular da via aérea superior e a integração central entre as funções de deglutição e respiração.7-12
A avaliação da deglutição, através da videofluoroscopia ou da nasofibroscopia, revela uma elevada prevalência de alterações em pacientes roncadores primários ou com AOS. Tais alterações podem ser sintomáticas ou assintomáticas e consistem, em sua maioria, no escape precoce do bolo alimentar (da cavidade oral para a faringe) e em resíduo de alimento na faringe após o término da deglutição.9,10,13,14
A manometria faringoesofágica avalia a força de compressão da musculatura faríngea e esofágica durante a deglutição, auxiliando na compreensão da fisiopatologia da disfagia orofaríngea.15-17 Hipoteticamente, as alterações neurológicas e musculares da via aérea superior associadas à AOS18 podem prejudicar a força e a dinâmica das contrações faringoesofágicas durante a deglutição, contribuindo para a disfagia observada em muitos casos de AOS. Segundo o nosso conhecimento, não existem estudos com avaliações manométricas da fase faríngea da deglutição em pacientes com AOS.
O objetivo deste estudo é avaliar se, entre pacientes com AOS, as pressões de deglutição na faringe e no esôfago são menores naqueles com disfagia orofaríngea em relação àqueles sem disfagia orofaríngea.
Método
Casuística
Nós avaliamos, prospectivamente, 22 pacientes adultos (maiores de 18 anos) roncadores portadores de AOS, consecutivamente selecionados para cirurgia faríngea para tratamento da AOS em nossa instituição. Não houve nenhuma perda de paciente. Todos os pacientes recusaram um tratamento clínico para a AOS e apresentavam condições para expansão cirúrgica da faringe através do reposicionamento de retalhos musculares da parede lateral da faringe.19 Nós excluímos pacientes que tivessem realizado qualquer cirurgia faríngea prévia, tratamento prévio para AOS ou que apresentassem disfagia clinicamente conhecida. Também excluímos pacientes com doença neuromuscular ou reumatológica, síndrome de Down, evidentes deformidades faciais adquiridas ou sindrômicas, uso de drogas que interfiram com o tônus muscular, cirurgia esofágica prévia e com sintomas de doença do refluxo gastroesofágico. Este estudo é parte de um protocolo de pesquisa para avaliar os efeitos da cirurgia faríngea sobre a deglutição e foi aprovado pela comissão de ética da nossa instituição (protocolo 003.0.388.000-10), registrado no Clinical Trials (NCT01335594) e todos os pacientes assinaram o termo de consentimento informado.
O diagnóstico de AOS foi baseado na presença de sintomas característicos e nos achados de polissonografia de noite inteira supervisionada feita em laboratório do sono. O grupo de pacientes foi formado por 17 homens e 5 mulheres, com idade média de 48,4 anos (variando de 27-62 anos), índice de massa corpórea (IMC) médio de 29,0 kg/m² (variando de 25-35,1 kg/m²) e circunferência cervical média de 41,5 cm (variando de 36-48 cm). Seis pacientes (27,3%) possuíam hipertensão arterial sistêmica e 3 eram tabagistas (13,6%). Em relação à anatomia faríngea, 19 apresentavam tonsilas palatinas grau I ou II (8,4%) e 3 tonsilas grau III ou IV (13.6%).20
Quanto à gravidade do índice de apneia e hipoapneia (IAH), o IAH médio foi 40,7 (variando de 7,2-89,4), com 16 pacientes (72,7%) apresentando IAH grave (IAH > 30), 3 (13,6%) com IAH moderado (15 ≤ IAH ≤ 30) e 3 (13,6%) com IAH leve (5 ≤ IAH < 15). A média da saturação mínima da oxi-hemoglobina foi 77,6% (variando de 51%-88%). A escala de sonolência de Epworth apresentou nota média de 15 em nossa casuística, variando de 4-19, com 9 casos (40.9%) com sonolência excessiva (Epworth > 10).
Os pacientes foram divididos em dois grupos, com disfagia e sem disfagia, baseando-se na avaliação com questionário de deglutição e videoendoscopia da deglutição (VED). Foram considerados portadores de disfagia aqueles que apresentaram alteração no questionário e/ou na VED. Em contraste, os pacientes com questionário e VED normais formaram o grupo sem disfagia.
Questionário
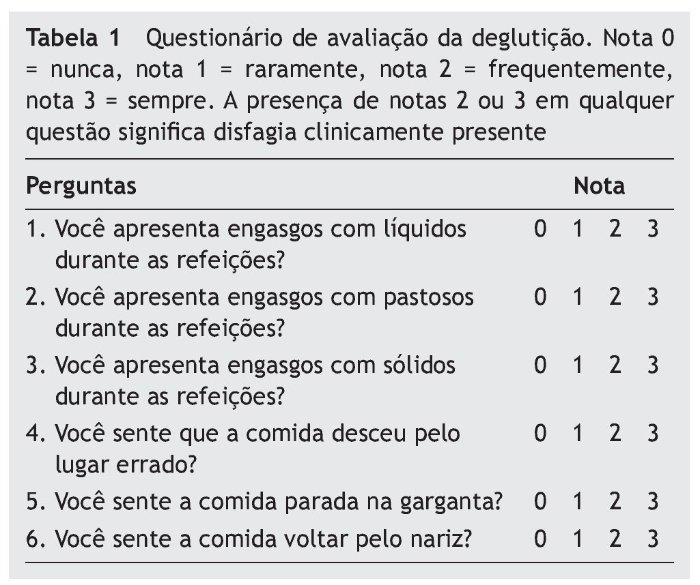
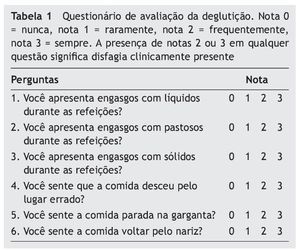
Todos os pacientes responderam a um questionário13 com seis perguntas sobre sintomas de disfagia (percebidos pelo paciente no último mês), exibidas na tabela 1. As respostas foram graduadas em uma escala de 0 a 3, em que 0 significava “nunca”, 1 “raramente”, 2 “frequentemente” e 3 “sempre”. Consideramos a presença de notas 2 ou 3 em pelo menos uma das questões como disfagia clinicamente presente.
Videoendoscopia da deglutição
Realizamos a VED21 em todos os pacientes, utilizando um nasofibrolaringoscópio flexível de 3,2 mm (Pentax®, Japão), introduzido pela fossa nasal mais ampla, sem a utilização de anestésico tópico, a fim de não alterar a sensibilidade da mucosa da via aérea superior. O paciente permaneceu em posição sentada confortável, com leve ventroflexão, simulando posição de refeição, enquanto observamos a faringe e a laringe.
Na avaliação basal, verificamos além da anatomia do trato aerodigestivo superior, a presença de estase salivar, a sensibilidade laríngea (teste da adução glótica ao toque do fibroscópio), a mobilidade e o aspecto das pregas vocais e o fechamento velofaríngeo à fonação e à deglutição de saliva.
Na avaliação dinâmica, analisamos, sob visão direta do fibroscópio, cada paciente durante a deglutição de alimentos corados em azul, em temperatura ambiente, administrados separadamente em três consistências (líquido, pastoso e sólido). Avaliamos a deglutição completa de cada consistência por três vezes, totalizando nove séries de deglutição analisadas. Para os líquidos, administramos 5, 10 e 15 mL de refresco de morango (refresco em pó sabor morango Clight, Kraft Foods Brasil S.A., Curitiba, PR, Brasil) em cada vez.
O alimento pastoso consistiu em refresco de morango misturado a espessante (BioSen NutriSenior®, Taboão da Serra, SP, Brasil), administrado três vezes em colher de sopa. Para o alimento sólido, utilizamos três pedaços de 2,5 × 2,5 cm de biscoito salgado.
Os exames foram gravados em DVD para reanálise. Classificamos os seguintes parâmetros como presente ou ausente: a) escape precoce: o bolo alimentar deixa a cavidade oral e atinge a faringe antes do reflexo da deglutição ser deflagrado; b) disfunção velofaríngea: o palato mole não oclui totalmente a nasofaringe durante a deglutição, permitindo escape do alimento; c) penetração laríngea: o alimento penetra na laringe, mas não atravessa a glote; d) aspiração traqueal: o alimento penetra na laringe e atravessa a glote; e) resíduos após a deglutição: presença de algum alimento na faringe após três movimentos completos de deglutição. Consideramos o escape precoce presente quando este ocorreu em pelo menos duas das nove séries de deglutições; já para as demais alterações, bastou ocorrerem em uma série para serem classificadas como presentes.
Adicionalmente, avaliamos se houve reflexo de tosse associado aos eventos de penetração e/ou aspiração e se este foi eficaz em eliminar o conteúdo penetrado e/ou aspirado, além do número de deglutições espontâneas ou solicitadas necessárias para clareamento total do bolo alimentar (sendo considerado anormal quando superior a três).
A presença de qualquer alteração na avaliação dinâmica colocou o paciente no grupo portador de disfagia. A gravidade da disfagia não foi graduada.
Manometria faringoesofágica
Realizamos manometria faringoesofágica em todos os pacientes pelo mesmo examinador, que não tinha acesso a que grupo pertencia cada um dos pacientes. Utilizamos um polígrafo computadorizado de oito canais (Alacer®, Brasil) ligado a um cateter (diâmetro de 4 mm) com quatro canais longitudinais e quatro radiais, sob infusão capilar pneumo-hidráulica pelo método de perfusão em sistema de baixa complacência, com fluxo contínuo de 0,6 mL/min/canal. Todos os exames foram feitos com os pacientes em posição supina. Antes dos exames, os pacientes foram orientados a permanecer seis horas em jejum. Avaliamos as pressões basais (sem deglutição) dos esfíncteres esofagianos inferior (EEI) e superior (EES) e as pressões intrafaríngeas durante a deglutição.
Introduzimos o cateter por via nasal até o estômago, o qual é localizado através das pressões medidas no aparelho. Em seguida, estudamos o EEI com a técnica de retirada lenta, ou seja, tracionando-se a sonda 1 cm por vez, tendo como ponto de referência a narina. A referência zero do exame é a pressão intragástrica, a qual constitui a linha gástrica de base. As pressões elevam-se no EEI e voltam a cair no corpo do esôfago (linha esofágica de base), voltando a elevar-se no EES. As pressões no EEI são maiores na inspiração e menores na expiração.
A pressão do EEI, obtida no trecho com pressões mais elevadas ao longo de três a cinco ciclos respiratórios estáveis, foi calculada como a diferença entre a pressão intragástrica e a pressão máxima do EEI durante a expiração, e considerada pela média aritmética simples das pressões de cada um dos quatro canais na extremidade do cateter, obtendo-se o valor da pressão expiratória máxima (PEM). A média da pressão do EEI entre a expiração e a inspiração corresponde à pressão respiratória média (PRM). Valores abaixo da normalidade da PEM e/ou da PRM indicam hipotonia do EEI. O relaxamento do EEI foi avaliado durante deglutições úmidas.22,23
Para o estudo do EES, também utilizamos as quatro aberturas radiais mais distais do cateter, e a mesma técnica de retirada lenta. Analisamos a pressão de repouso do EES, que consiste na diferença entre a linha esofágica de base e o traçado manométrico. Esta é medida no trecho de pressão mais elevado e mais estável. O relaxamento do EES foi avaliado no ponto de maior pressão deste, com três deglutições de 5 mL de água.24
A faringe foi avaliada com os canais radiais em três pontos, localizados a 2, 4 e 6 cm acima da borda superior do EES. Avaliamos a amplitude de contração da faringe, que corresponde à distância entre a linha de base da faringe e o pico máximo da onda estudada. Para isso, as pressões de deglutição foram medidas três vezes em cada ponto, com a ingestão de 5 mL de água, sendo que consideramos o valor médio das três deglutições em cada ponto (pressão média faríngea – PMF).
Análise estatística
Para estudar a relação entre as variáveis quantitativas, utilizamos a correlação de Spearman’s. Na relação das variáveis qualitativas, utilizamos o teste exato de Fisher para verificar se há associação entre elas. Já para estudar a relação entre variável qualitativa e variável quantitativa, foi usado o teste da soma de postos de Wilcoxon. Nas variáveis qualitativas, foi calculado o intervalo de confiança de 95% para as proporções. O nível de significância aplicado nos testes foi de 5%, sempre considerando hipóteses alternativas bicaudais.
Resultados
Dos 22 pacientes analisados, 17 (77,3%) apresentaram disfagia, sendo 2 (9,1%) devido a alterações somente no questionário de deglutição, 10 (45,5%) devido a alterações somente na VED e 5 casos (22,7%) com alterações na VED e no questionário. O grupo disfágico tinha idade média de 48,6 anos, com 12 homens (70,6%), IAH médio de 41,7/h, índice de massa corpórea (IMC) médio de 28,6 Kg/m² e circunferência cervical média de 40,9 cm. Já o grupo não disfágico (5 casos; 22,7%) tinha idade média de 47,6 anos (p = 0,70), com 5 homens (100%) (p = 0,29), IAH médio de 37/h (p = 1,00), IMC médio de 30,4 Kg/m² (p = 0,32) e circunferência cervical média de 43,5 cm (p = 0,10).
Dentre os sete casos com queixa de disfagia (31,8%), encontramos as seguintes alterações no questionário de deglutição: dois referiram engasgos com líquidos, um com pastosos e três com sólidos; três referiram a sensação do alimento “descendo pelo lugar errado” e seis referiram a sensação de “comida parada na garganta”. Não houve queixa de refluxo nasal de alimento.
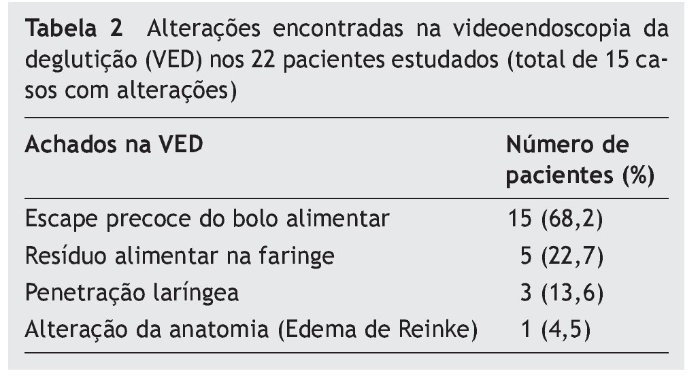
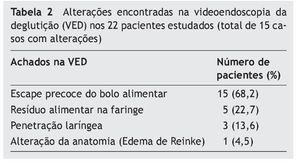
Na VED (tabela 2), houve alterações em 15 dos 22 pacientes (68,2%). Ao analisar a anatomia da via aerodigestiva superior, detectou-se 1 caso de edema de Reinke leve. O achado mais frequente foi o escape precoce do bolo alimentar para a faringe antes de deflagrar o reflexo da deglutição, o que ocorreu em todos os casos com VED alterada. Não ocorreram casos de aspiração traqueal ou insuficiência velofaríngea.
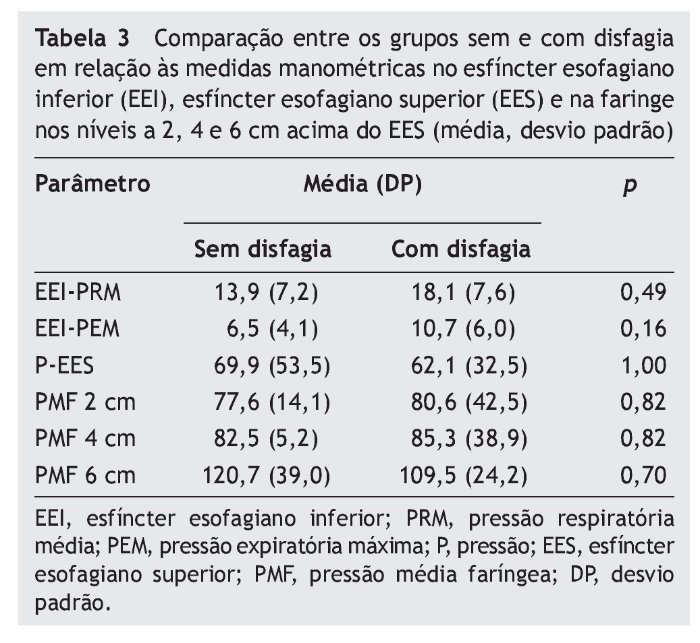
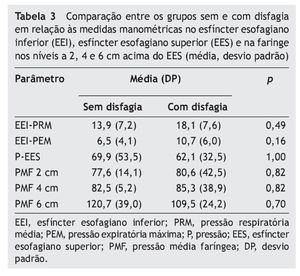
Não houve diferença entre os grupos com e sem disfagia orofaríngea em relação a todas as medidas de manometria faringoesofágica (tabela 3). O grupo disfágico apresentou oito casos (47,1%) de hipotonia do EEI, dois casos (11,8%) de hipertonia do EES e um caso (5,9%) de hipotonia do EES, mas com relaxamento do EES normal e coordenado com a faringe em todos os casos. No grupo não disfágico, houve quatro casos (80%) de hipotonia do EEI (p = 0,32) e um caso (20%) de hipertonia do EES (p = 1,00), também com relaxamento do EES normal e coordenado com a faringe em todos os casos.
Foi estudada a correlação entre as variáveis EES, EEI, pressão média da faringe, questionário e achados da VED, entre si e com as variáveis: idade e IAH. O único achado estatisticamente significativo foi a correlação entre penetração laríngea e idade. Os pacientes com penetração laríngea tiveram idade maior (idade média de 60 anos, DP = 0,00) comparados àqueles sem penetração laríngea (idade média de 46,5 anos, DP = 9,7) (p = 0,01).
Discussão
Nós pudemos observar, nesta série de casos consecutivos, uma elevada frequência de disfagia no grupo estudado de pacientes adultos roncadores portadores de AOS, com 31,8% dos pacientes referindo sintomas de disfagia e outros 45,5% apresentando VED alterado sem sintomatologia clínica. Em todos os 68,2% dos casos com VED alterado, ocorreu escape precoce do bolo alimentar entre a cavidade oral e a faringe. Isto pode sugerir um comprometimento na função sensorial aferente da mucosa orofaríngea ou problema na fase oral, na aproximação da parte posterior da língua com o palato mole.
Quando o escape precoce ocorre, a mastigação e a respiração não estão inibidas, havendo risco de penetração ou aspiração traqueal.25 A manometria faríngea e esofágica não mostrou diferenças entre os grupos com e sem disfagia, assim como os dados demográficos, antropométricos e polissonográficos. Estes achados parecem favorecer o papel das alterações neurogênicas como causa de disfagia orofaríngea na AOS, em detrimento do papel das alterações na musculatura faríngea.1,2 Segundo o nosso conhecimento, este é o primeiro estudo com medição da pressão faríngea de deglutição em pacientes com AOS.
Embora não tenhamos achado diferença na idade dos pacientes com e sem alterações na VED, aqueles que apresentaram penetração laríngea eram mais velhos do que os sem penetração laríngea. A avaliação da deglutição com video-fluoroscopia com bário mostra que, entre pacientes com ronco e AOS, a disfagia aparece naqueles de maior idade, independentemente da gravidade da AOS.10 Estudos em indivíduos saudáveis demonstram que o envelhecimento está associado a uma maior frequência de penetração e aspiração, comparados a adultos jovens, mas sem excluir pacientes com ronco e apneia.26,27 Uma hipótese que poderíamos supor é que os pacientes mais velhos tiveram um maior tempo de exposição ao trauma vibratório causado pelos roncos, provocando alterações mais graves da deglutição.
Embora nosso estudo favoreça a hipótese de uma causa periférica para a disfagia na AOS, o tema é controverso na literatura. Teramoto et al. demonstram que a latência do reflexo faríngeo de deglutição está aumentada, com a necessidade de haver um maior volume de alimento na faringe para desencadeá-lo, em pacientes com AOS.7 Já Jobin et al. encontram uma redução significativa na latência do reflexo da deglutição na AOS, sugerindo haver um comprometimento da modulação inibitória do reflexo e do controle central da deglutição.8
Roncadores sem9,10 e com AOS9,10,14 apresentam alterações subclínicas da deglutição entre 52% e 64% dos casos, comparável ao achado de 45,5% em nosso estudo. Aparentemente, o risco de disfagia nos roncadores não se correlaciona com a presença ou gravidade da AOS,10 indicando um danoso papel da vibração tecidual causada pelos roncos, levando a lesões nervosas na via aérea superior que contribuiriam para a disfagia.28 Não houve correlação entre a gravidade da AOS e a presença de disfagia em nosso estudo.
Verificamos que, normalmente, a queixa de disfagia não é referida espontaneamente pelos portadores de AOS, mas a sua percepção desperta o paciente para outros potenciais impactos da AOS na sua qualidade de vida, sendo um motivador adicional para a busca e adesão ao tratamento. Este aspecto costuma ser ignorado no manejo da AOS e tratamentos específicos para a deglutição, como a orientação de manobras, ajustes posturais, terapias facilitadoras e modificações na consistência da dieta, também podem ter um impacto positivo na qualidade de vida destes pacientes, à semelhança do que ocorre em pacientes com disfagia secundária à doença de Parkinson.29,30
Dentre os 31,8% de casos com queixas de disfagia, a maioria (27,3%) referiu sensação de comida parada na garganta. Na prática clínica, este sintoma é usualmente atribuído a quadros de refluxo faringolaríngeo. Entretanto, a disfagia faríngea é, frequentemente, uma desordem lentamente progressiva, em que o indivíduo desenvolve mecanismos compensatórios, como modificações na dieta ou na velocidade da mastigação. Dessa forma, os sintomas podem aparecer somente quando as estratégias compensatórias forem superadas pela intensidade do distúrbio. Antes disso, uma intervenção médica ativa pode já detectar o comprometimento da deglutição.31 Assim, o tratamento adequado e precoce dos roncos e da AOS poderia prevenir a evolução da disfagia faríngea. Na literatura, encontramos um relato de dois casos de AOS grave que melhoraram da disfagia após um ano de tratamento com CPAP nasal e perda de peso.32
Não encontramos diferenças nas pressões de deglutição faríngeas entre os grupos estudados. Mesmo assim, 22,7% dos pacientes apresentaram resíduo alimentar na faringe após o fim da deglutição e retorno da respiração, indicando possivelmente alterações no peristaltismo ou na elevação da faringe, uma vez que o relaxamento do EES não foi diferente entre os grupos. Segundo o nosso conhecimento, os valores de normalidade para a pressão faríngea na nossa população são desconhecidos, embora existam estudos iniciais com a população japonesa.33 Uma vez que grande parte da pressão faríngea da deglutição é exercida pela língua, cuja atividade eletromiográfica encontra-se aumentada durante a vigília em pacientes com AOS,34 consideramos pouco provável que a manometria faríngea demonstre alterações em futuros estudos de casos de AOS, ao contrário de estudos já realizados com miastenia grave e doença de Huntington, que cursam com grandes alterações da força muscular.35,36
As medidas da pressão esofágica também não diferiram entre os grupos com e sem disfagia. O achado de hipotonia do EEI, que pode estar relacionado à doença do refluxo gastroesofágico (DRGE),37 esteve presente em ambos os grupos (p = 0,32), mas os pacientes não apresentaram sintomas sugestivos disto (foi um critério de exclusão). A associação entre DRGE e AOS já é descrita na literatura,38,39 mas não foi avaliada neste estudo.
Nós reconhecemos que o nosso estudo possui algumas limitações. Um grupo sem disfagia mais numeroso poderia, talvez, apontar alguma diferença estatística não revelada nesta análise. Além disto, a inclusão de um grupo de roncadores primários e de um grupo controle sem roncos ou AOS ajudaria a esclarecer os respectivos papéis da AOS e dos roncos na disfagia destes pacientes, talvez demonstrando diferenças nas pressões de deglutição faríngea entre os grupos. A utilização de um questionário validado seria o mais indicado, mas nos baseamos em questionário utilizado em outro estudo com os mesmos moldes, pois era mais simplificado, já que nossos pacientes não manifestavam queixas maiores de disfagia. Outra limitação é o fato de não termos disponível a manometria esofágica do tipo estado sólido, superior na avaliação dos eventos rápidos de alta pressão que ocorrem na faringe.15,33 No entanto, o método de perfusão foi aplicado por gastroenterologista experiente, que conseguiu realizar o exame adequadamente em todos os pacientes.
Conclusão
Este estudo conclui que, entre pacientes com AOS, não há diferença significante nas pressões de deglutição da faringe e do esôfago, entre aqueles com e aqueles sem disfagia orofaríngea.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 16 de fevereiro de 2014;
aceito em 29 de junho de 2014
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.03.006
☆ Como citar este artigo: Oliveira LA, Fontes LH, Cahali MB. Swallowing and pharyngo-esophageal manometry in obstructive sleep apnea. Braz J Otorhinolaryngol. 2015;81:294-300.
☆☆ Instituição: Hospital do Servidor Público Estadual de São Paulo, São Paulo, SP, Brasil.
* Autor para correspondência.
E-mail: lu21moreira@hotmail.com (L.A.M.d.P. Oliveira).