As células reguladoras T, ou Treg, equilibram a resposta imune periférica aos alérgenos na rinite alérgica. Tradicionalmente, a célula Treg (CD25 + Treg) é identificada pela coexpressão de Foxp3 e CD25, mas essa estratégia não representa a verdadeira função inibitória das células Treg. O fator de transcrição Helios foi considerado um novo marcador de Tregs ativadas, com uma importante função inibidora. Consequentemente, o Helios foi proposto como um marcador de Treg. Artigos recentes mostraram que a coexpressão de Foxp3 e Helios (Helios + Tregs) é um importante estágio funcional do Treg.
ObjetivoComparar a prevalência de CD25 + Tregs e Helios+ Tregs com um modelo em camundongos modelo de rinite alérgica.
MétodoVinte camundongos foram randomizados em dois grupos. O grupo de teste compreendeu 10 camundongos modelo de rinite alérgica expostos à ovalbumina; o grupo controle foi exposto à solução salina. As frações de CD25 + Tregs, Helios + Tregs, Helios + CD25 e Helios + Foxp3 + CD25 + Tregs presentes nos dois grupos foram determinadas por citometria de fluxo.
ResultadosCD25 + Tregs e Helios + Tregs foram menos abundantes no baço e nas células da mucosa nasal do modelo de rinite alérgica em comparação com o controle. Também observamos menos Helios + Tregs do que CD25 + Tregs na mucosa nasal e nas células esplênicas dos grupos controle e teste. Além disso, observamos menos Helios + Foxp3, Helios + CD25 e Helios + Foxp3 + CD25 + Tregs na mucosa nasal no modelo de rinite alérgica. Hélio foi mais expresso em células CD4 + CD25 + Foxp3 + células T, seguidas por CD4 + CD25 ‐ Foxp3 ‐ células T. Aproximadamente 75% das células CD25 + Tregs eram Helios no baço de camundongos modelo de rinite alérgica e dos controles.
ConclusãoEste é o primeiro relato das proporções de Helios + Tregs na mucosa nasal e no baço de camundongos com rinite alérgica. A identificação de Tregs inibitórias verdadeiras com a coexpressão de Foxp3 e Helios pode ser mais útil do que depender da expressão de CD25. Este estudo fornece uma nova visão para os estudos de Treg em rinite alérgica e a potencial utilidade do marcador como alvo terapêutico.
No sistema imunológico, as células‐T reguladoras, ou Tregs, equilibram a resposta imune periférica aos alérgenos.1 Elas inibem as células T efetoras em uma reação inflamatória do fenótipo Th1 ou Th2 e desempenham uma função importante na rinite alérgica. As técnicas usadas para avaliar a atividade das células Tregs têm sido modificadas. Os estudos iniciais mediam a expressão de CD25 para quantificar as células Tregs.2 O papel inibitório das células Tregs é mediado através da expressão de Foxp3, considerado o marcador mais específico.3,4 Tradicionalmente, Treg (CD25 + Treg) é identificado através da coexpressão de Foxp3 e CD25. No entanto, Foxp3 e CD25 são up‐regulados de maneira transitória em algumas outras condições,5–8 portanto sua coexpressão pode não representar verdadeiramente Tregs supressores. Alguns acreditam que as células CD4 + Foxp3 + Treg naturais derivadas do timo expressam especificamente o membro da família de transcrição Ikaros, Helios.9 Artigos recentes mostraram que a coexpressão de Foxp3 e Helios é uma fase funcional crítica de Tregs e recentemente foi levantada a hipótese de que Helios pode ser um ativador de células Tregs10 e que Helios + FoxP3 + Treg (Helios + Treg) pode realmente ser mais inibitório do que Helios ‐ FoxP3 + Treg.11,12 Não identificamos pesquisas relacionadas à RA.
Este estudo comparou células CD25 + Treg e Helios + Treg com citometria de fluxo em um modelo murino de RA.
MétodoO modelo de camundongoCamundongos fêmeas BALB/c de 8 semanas de idade foram expostos a um ciclo claro/escuro de 12 horas com acesso a comida e água ad libitum. Além disso, não havia ovalbumina (OVA) nos alimentos. Este experimento foi aprovado pelo comitê de ética do Shengjing Hospital (2018PS96K), China Medical University.
Modelo murino de RA induzida por OVAOs animais foram divididos em dois grupos de 10 ratos cada. Nos dias 0, 7 e 14, o grupo OVA foi imunizado com 100μg de OVA e 2mg de hidróxido de alumínio através de injeção intraperitoneal. Em seguida, 100μg de OVA foram introduzidos nasalmente diariamente por 7 dias consecutivos a partir do dia 21. O grupo controle foi tratado com solução salina.
Avaliação dos sintomas de RAEspirros e fricção nasal foram registrados no dia 27, 15 minutos após a introdução intranasal final de OVA. A média das contagens foi analisada estatisticamente entre o grupo OVA e o grupo controle.
Avaliação do tecido da mucosa nasalTodos os animais foram sacrificados e decapitados 2 horas após a provocação nasal final com OVA. As cabeças dos cinco animais de cada grupo foram fixadas em paraformaldeído a 4%. As amostras foram descalcificadas em 10% de ácido etilenodiaminotetraacético. Amostras embebidas em parafina foram seccionadas a uma espessura de 4μm e coradas com hematoxilina e eosina para visualização dos eosinófilos.
Isolamento de células da mucosa nasal e do baçoAs células da mucosa nasal e do baço foram isoladas dos ratos restantes, trituradas em um moedor de vidro com RPMI 1640 e depois filtradas com um filtro para células. Após a centrifugação da suspensão celular, foram determinadas as proporções de células Tregs nos grânulos.
Contagem das proporções de células Tregs com citometria de fluxoAs células foram coradas com anti‐CD4 Abs marcado com Isotiocianato de Fluoresceína (FITC) e anti‐CD25 Abs marcado com PerCP‐Cy5.5 (BD Biosciences) e depois fixadas e permeabilizadas com uma solução de fixação/permanente. As células foram então incubadas com anti‐Foxp3 Abs marcado com PE e anti‐Helios marcados com aloficocianina (APC) (BD Biosciences). Os dados foram obtidos com um citômetro de fluxo BD FACSCanto II.
Análise estatísticaOs resultados são expressos como média±EMP. O software GraphPad Prism foi usado para as análises estatísticas. As diferenças entre os dois grupos foram analisadas pelo teste U de Mann‐Whitney; considerou‐se p <0,05 como significância estatística.
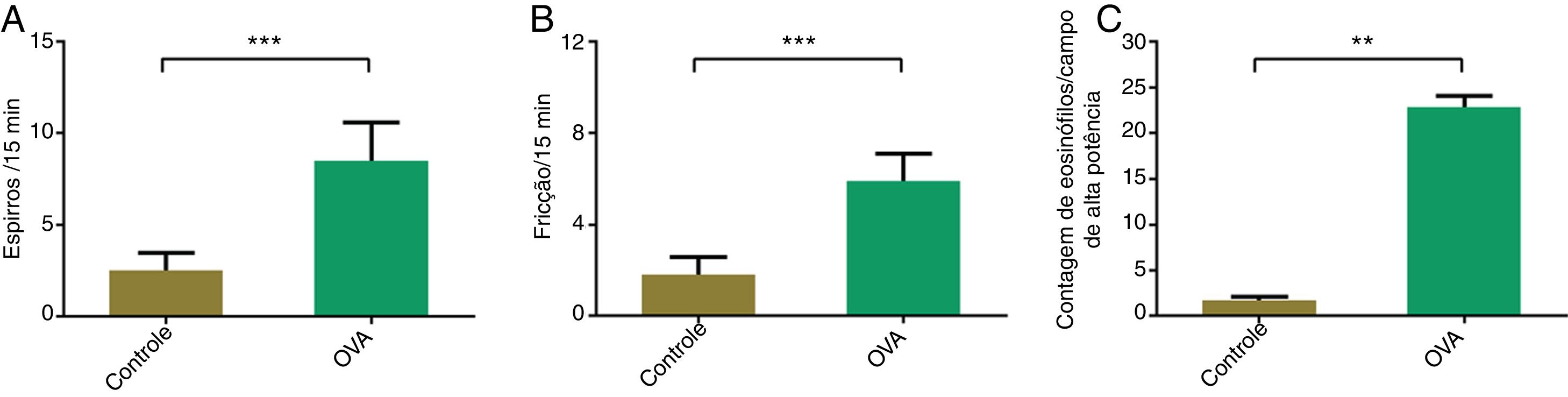
ResultadosEscore de sintomas no modelo murino de RANo dia 27 do experimento, a fricção nasal e os espirros foram contabilizados por 15 minutos após a provocação nasal final com OVA (fig. 1A e B). Os camundongos induzidos por OVA espirraram significantemente mais vezes do que os animais controle (8,5±2,1 vs. 2,5±1,0, p <0,05). A frequência de fricção também foi significantemente maior no grupo OVA (5,9±1,2 vs. 1,8±0,8, p <0,05).
Maior infiltração de eosinófilos na mucosa nasal de camundongos com RAA infiltração de eosinófilos na mucosa nasal foi avaliada após a coloração por H&E e foi significantemente maior no grupo OVA (p <0,05) (fig. 1C).
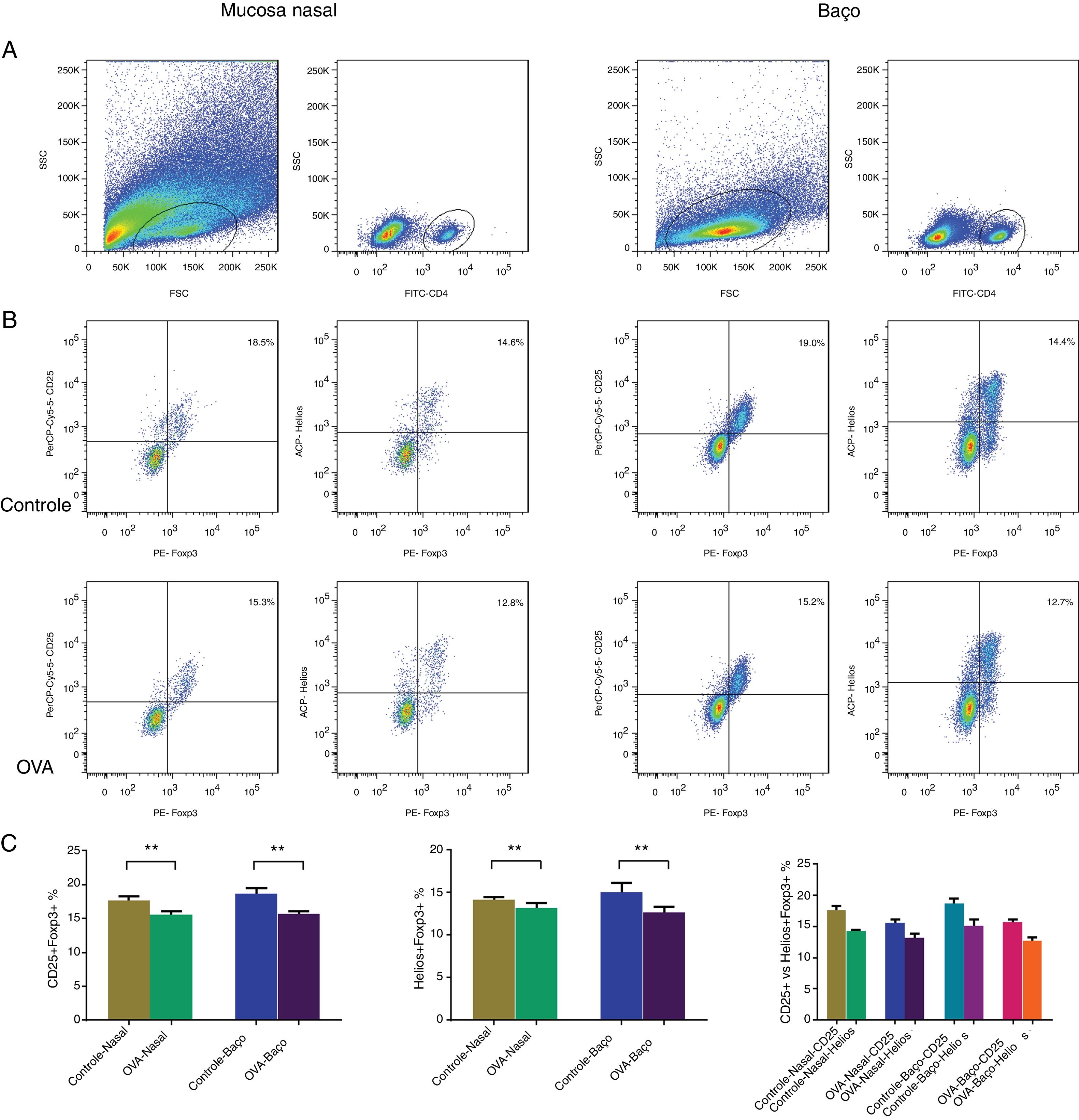
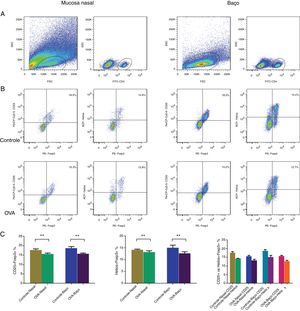
Número reduzido de CD25 + Tregs no baço e na mucosa nasal do modelo de RAA mucosa nasal e o baço de cinco camundongos do grupo RA e cinco camundongos do grupo controle foram examinados através de análise imuno‐histoquímica, com anticorpos fluorescentes CD4, CD25 e Foxp3. As CD25 + Tregs nas células CD4 foram analisadas por citometria de fluxo (fig. 2A‐B) e foram significantemente menos abundantes na mucosa nasal e no baço de camundongos com RA (fig. 2C).
CD25 + Tregs e Helios + Tregs foram contadas com citometria de fluxo na mucosa nasal e baço de um modelo murino de RA. A identificação de populações de células CD4 + T (A). Identificando CD25 + Tregs e Helios + Tregs nos grupos controle e OVA. As estatísticas são mostradas em (C). **p <0,01.
Acredita‐se que a coexpressão do Foxp3 com o Helios represente uma fase funcional chave das células Tregs. Para identificar esse grupo funcional de células Tregs, as células da mucosa nasal e do baço foram coradas com anticorpos CD4, Helios e Foxp3. A porcentagem de Helios + Tregs foi analisada com citometria de fluxo (fig. 2A‐B). Havia menos células Helios + Tregs na mucosa nasal e no baço do modelo de RA (fig. 2C).
Menos células Helios + Tregs do que CD25 + Tregs na mucosa nasal e no baço dos ratos do modelo de RA e controleA coexpressão do Foxp3 foi analisada com o marcador tradicional CD25 e Helios na camada mucosa nasal e nos esplenócitos dos camundongos com RA e controle para comparar as porcentagens de CD25 + Tregs e Helios + Tregs. Nas células da mucosa nasal e células esplênicas de ratos com RA e normais, havia menos Helios + Tregs do que CD25 + Tregs (fig. 2C). Portanto, havia menos Tregs ao usar o Foxp3 coexpresso com Helios do que com CD25.
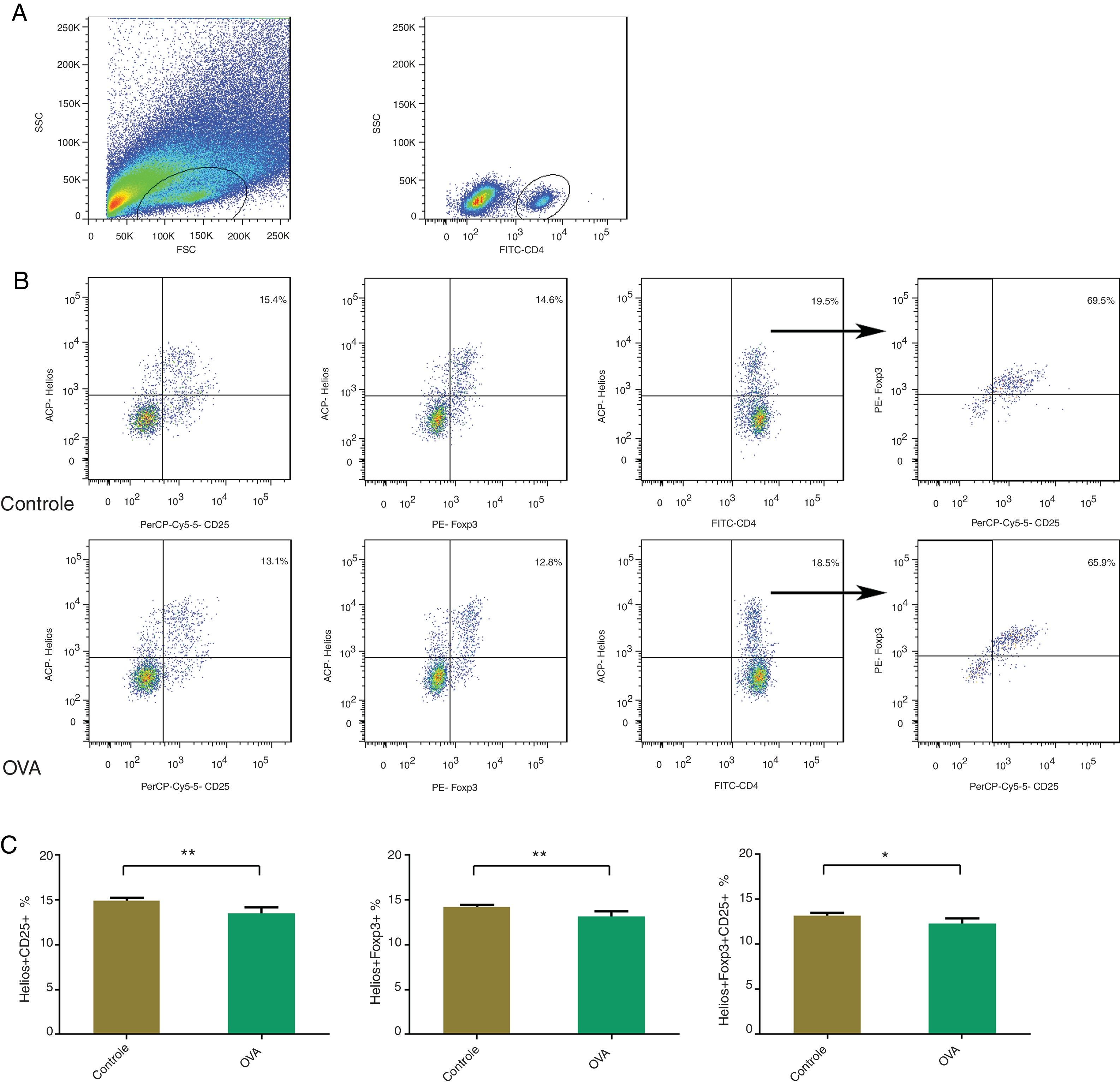
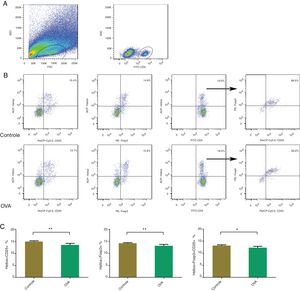
Menos células Helios + Foxp3, Helios + CD25 e Helios + Foxp3 + CD25 + Tregs na mucosa nasal do modelo de RA; Helios pode não ser um marcador específico de células TregsHelios é expresso em um subconjunto de células Foxp3 + Tregs e foi considerada a possibilidade de que ele fosse um marcador de Tregs. Para comparar as proporções de células Helios + Foxp3, Helios + CD25 e Helios + Foxp3 + CD25 na mucosa nasal entre os camundongos controle e RA, foram identificadas células Helios‐positivas, células CD25‐positivas e células duplas Helios‐ e CD25‐positivas após a ativação de CD4 + T. Havia menos células Helios + Tregs, Helios + CD25 e Helios + Foxp3 + CD25 + Tregs na mucosa nasal de camundongos com RA (fig. 3). Helios foi mais fortemente expresso em células CD4 + Foxp3 + CD25 + T, seguidas por células CD4 + Foxp3 ‐ CD25 ‐T, o que sugere que Helios não é um marcador específico das células Tregs.
Com citometria de fluxo, Helios + Foxp3, Helios + CD25 e Helios + Foxp3 + CD25 foram contados na mucosa nasal de um modelo murino de RA. A identificação de populações de células CD4+ T (A). Identificando Helios + Foxp3, Helios + CD25 e Helios + Foxp3 + CD25 nos grupos controle e OVA. As estatísticas são mostradas em (C). **p <0,01, *p <0,05.
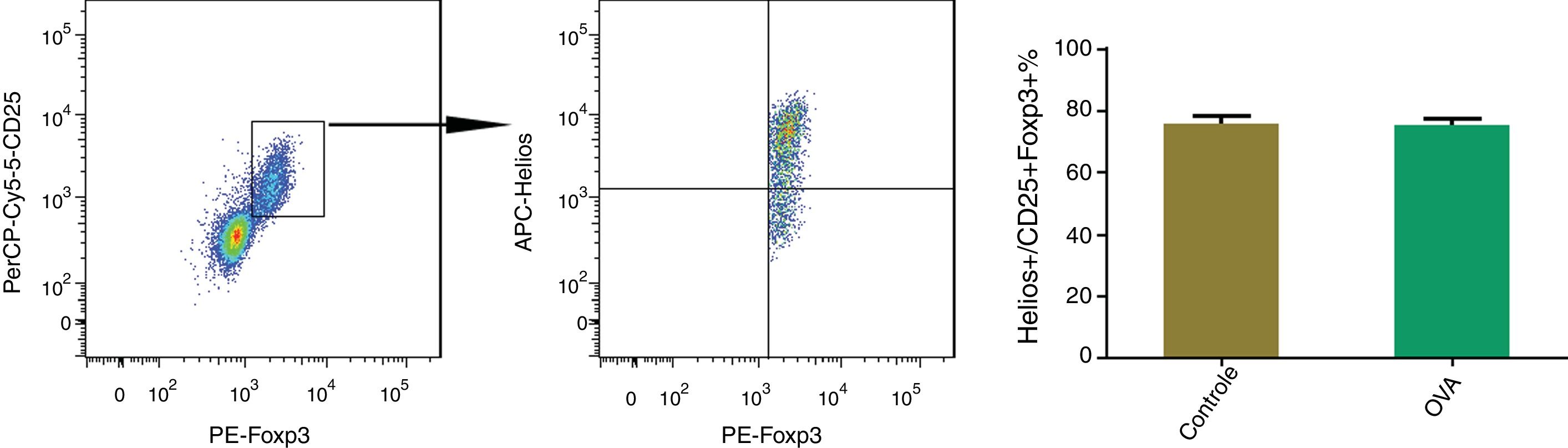
Aproximadamente 75% das células CD25 + Tregs eram Helios nos baços do camundongos RA e controle. Para determinar a proporção de células Helios nas células CD25 + Tregs, as células CD25 + Tregs nos baços de ratos com RA e controle foram identificadas primeiro, seguidas da identificação das células Helios‐positivas. Aproximadamente 75% das células CD25 + Tregs eram Helios‐positivas nos esplenócitos dos camundongos dos grupos RA e controle (fig. 4).
DiscussãoEste é o primeiro trabalho a explorar células Helios + Tregs na mucosa nasal e baço em um modelo murino de RA. Encontramos menos células Helios + Tregs no grupo com RA do que nos controles, tanto nas células da mucosa nasal quanto nos esplenócitos. Comparando as estratégias de ativação de CD25 + Tregs e Helios + Tregs, encontramos menos Helios + Tregs do que CD25 + Tregs nos grupos RA e controle, tanto para a mucosa nasal quanto para as células esplênicas.
A rinite alérgica resulta da interferência imunológica no corpo, que culmina com a desregulação de diversos agentes inflamatórios. As Tregs impedem respostas imunes e desempenham um papel crucial na hipossensibilização alérgica. As Tregs inibem as células T efetoras durante a resposta inflamatória do fenótipo Th1/Th2 e são, portanto, essenciais para evitar respostas imunes graves potencialmente prejudiciais direcionadas contra antígenos estranhos.13,14
Tradicionalmente, CD25 + Foxp3 tem sido inativada como uma célula Treg. Este trabalho encontrou menos CD25 + Tregs em camundongos RA, consistente com estudos anteriores.15–17 Entretanto, estudos verificaram que essa estratégia não representa a verdadeira função inibidora das células Tregs, mesmo em cenários específicos de indução de células T, porque CD25 e Foxp3 (dois importantes marcadores de Tregs) também estão presentes em células não Tregs ativadas.18,19
Em 2006, Sugimoto et al. sugeriram pela primeira vez que Helios, um membro da família Ikaros de proteínas dedos de zinco, era um marcador de Tregs naturais. 20 Naquela época, era considerado que o Helios era expresso exclusivamente em células Foxp3 + Tregs. No entanto, foi demonstrado que os marcadores Helios‐positivos e Helios‐negativos existem nos compartimentos nTreg após alguns anos.21,22 Então, a expressão do Helios foi observada em 65% a 75% das células Tregs e identificada como um novo marcador de nTregs ativadas, com uma importante função de supressão; foi proposto que o Helios é um marcador de Tregs derivadas do timo.23–25
Foxp3 é o marcador mais específico de Tregs e a avaliação de Helios pode ajudar a identificar subconjuntos de células Tregs com atividade supressora consistente.10,11,23,26
No trabalho atual, a expressão de Helios não se restringiu às células CD4‐positivas, mas também foi vista nas células CD4‐negativas (dados não mostrados). Além disso, Helios não foi expresso em células Foxp3 + Tregs, o que sugeriu que Helios não é um marcador específico de células Tregs. Portanto, a ativação/supressão de células CD4 + Helios somente não representa todas as células Tregs.
Identificamos Helios + Tregs nas células da mucosa nasal e do baço de um modelo murino de RA e encontramos níveis mais baixos de Helios + Tregs no grupo RA comparado com o controle. Isso indica que a atividade supressora das Tregs foi inibida na RA, levou ao aumento da ativação das células T auxiliares, como Th2, e ao desenvolvimento da doença.
O Helios pode ser um marcador útil para identificar Tregs verdadeiras em condições que induzem a ativação imune porque, diferentemente das células CD25, sua expressão permanece estável durante a ativação das células T.22 No presente estudo, o subconjunto Foxp3 + Helios identificou Tregs marcadamente com menor frequência do que a coexpressão Foxp3 e CD25, nos grupos controle e de RA e cerca de 75% das células CD25 + Foxp3 + Tregs eram Helios‐positivas.
Na RA, um subgrupo de células Tregs tem efeitos inibitórios. Este estudo mostrou que o uso de CD25 poderia aumentar artificialmente a proporção de Tregs identificadas e pode não refletir completamente sua capacidade inibitória, enquanto a avaliação da coexpressão de Foxp3 e Helios é um método de identificação muito mais preciso.
O presente estudo teve várias limitações. Primeiro, relativamente poucos animais foram estudados. Segundo, não considerou as relações entre os subgrupos Treg e Th. No entanto, este estudo foi informativo porque, até onde sabemos, é o primeiro a comparar as proporções de Helios + Tregs e CD25 + Tregs na mucosa nasal e no baço de um modelo murino de RA.
São necessários mais estudos para definir em detalhes a importância funcional e biológica do Helios + Tregs na RA e o potencial uso do marcador como alvo terapêutico. No entanto, como Foxp3 e Helios são proteínas intracelulares, atualmente é impossível isolar as Helios + Tregs funcionais vivas e fazer um teste de função de supressão para analisar o mecanismo mais detalhadamente; a pesquisa está em andamento.
ConclusãoEsta pesquisa é a primeira a identificar Helios + Tregs em RA. Os resultados sugerem que o processo de ativação/supressão de Tregs inibitórias verdadeiras com a coexpressão de Foxp3 e Helios pode ser mais útil do que depender da expressão de CD25. Nossos resultados fornecem uma nova visão para os estudos de Tregs na RA e o uso potencial do marcador como alvo terapêutico.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Esta pesquisa recebeu apoio do Liaoning Province Ministry of Education Scientific Study Project (LK201601), China.
Como citar este artigo: Wang Y‐X, Gu Z‐W, Cao Z‐W. Difference between CD25+Tregs and Helios+Tregs in a murine model of allergic rhinitis. Braz J Otorhinolaryngol. 2021;87:550–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.