A previsão do impacto do comprometimento olfativo no declínio cognitivo em idosos tem sido distinta entre diferentes faixas etárias.
ObjetivoEsta metanálise buscou estimar o poder preditivo do comprometimento olfativo no declínio cognitivo durante o seguimento em idosos de diferentes idades.
Material e métodosFoi feita uma pesquisa na literatura médica nos seguintes bancos de dados para estudos elegíveis: Medline, Cochrane e Embase. Os estudos que registraram olfação e detecção de cognição no início e no fim do seguimento foram incluídos na triagem preliminar. Os prontuários médicos de idosos sem comprometimento cognitivo no início do seguimento foram considerados nessa análise. Os dados brutos foram extraídos para estimar o risco relativo e o intervalo de confiança de 95% (IC95%) correspondente. A análise de subgrupos da idade foi feita para eliminar o efeito da idade nos resultados. A heterogeneidade estatística foi medida utilizando o índice I2 e o teste Q de Cochran.
ResultadosOito estudos foram incluídos nesta análise (3.237 eventos e 13.165 participantes) e o risco relativo combinado para o subgrupo de 70 a 80 anos foi de 2,00 (IC95% = 1,79‐2,23).
ConclusãoRelativamente, existe um risco maior de comprometimento cognitivo no fim do seguimento em adultos mais jovens que se se apresentam com comprometimento olfativo no início do seguimento. A duração do seguimento tem um pequeno efeito no risco relativo.
O declínio cognitivo geralmente aparece com o envelhecimento e tem um grande impacto na vida diária, aumenta a mortalidade dos idosos e imputa uma enorme carga na sociedade.1–4 Dado o início insidioso do declínio cognitivo e seu lento progresso na transição para demência e o fato de que não há tratamento eficaz para esse distúrbio, a prevenção primária é essencial por meio da triagem de grupos de alto risco.5 O comprometimento olfativo, especialmente o comprometimento da identificação olfativa, é considerado um sinal potencial de alerta precoce de distúrbios neurodegenerativos, como a doença de Parkinson (DP) e a doença de Alzheimer (DA).6–10 Estudos anatômicos sugerem que emaranhados neurofibrilares no bulbo olfatório e nas vias de projeção do bulbo olfatório para as regiões cerebrais olfativas secundárias são as características patológicas iniciais da DA que danificam a olfação.6,11 A deposição de proteínas patogênicas, α‐sinucleína e proteína tau hiperfosforilada, no bulbo e trato olfatório (OBT, Olfactory Bulb and Tract) enfraquece a função sináptica.12–16
A atrofia do OBT na ressonância magnética (RM) na DA e o comprometimento cognitivo leve são outras provas de comprometimento olfativo.6,17 Vários estudos confirmaram o fato de que idosos com disfunção olfativa apresentam um risco aumentado de transição para demência.18–23
Estudos anteriores demonstraram que o declínio cognitivo em adultos mais velhos se apresenta com olfação ou identificação olfativa prejudicada.24,25 O declínio cognitivo torna‐se evidente na meia‐idade (45 a 49 anos); 26 entretanto, só é percebido por alguns indivíduos. Uma revisão sistemática relatou o valor preditivo do comprometimento olfativo para o declínio cognitivo em adultos cognitivamente normais.27 Não foram feitas análises adicionais dos subgrupos etários devido a dados limitados. Nesta revisão, o autor tem como objetivo estimar o risco relativo (RR) de cada subgrupo etário para explicar o poder preditivo do comprometimento olfativo para o declínio cognitivo e demência em diferentes faixas etárias.
MétodoEstratégia de buscaOs autores fizeram essa análise seguindo os critérios das diretrizes Meta‐analyses of Observational Studies in Epidemiology (MOOSE).28 Uma extensa pesquisa bibliográfica foi feita para identificar estudos que registraram a avaliação do olfato e da cognição no início e fim dos períodos de seguimento. Os participantes eram residentes locais e a média de idade em cada estudo era superior a 50 anos. Os participantes com declínio cognitivo foram excluídos no início do seguimento. Estudos muito curtos para um período de seguimento foram excluídos, dado o longo período de latência da doença. As bases de dados Medline, Cochrane e Embase foram usadas para obter os estudos identificados. Para a busca sobre o desfecho, identificamos os artigos com as palavras‐chave médicas ([cognitive OR cognition OR dementia OR Alzheimer's disease OR mild cognitive impairment OR Parkinson's disease] AND [olfactory OR olfaction OR odor OR odorant OR smelling OR hyposmia]). As referências bibliográficas dos artigos recuperados foram pesquisadas em busca de estudos relevantes adicionais.
Os dados exigiram resultados suficientes para construir a tabela de contingência 2×2 de desempenho diagnóstico para o teste de olfação. O comprometimento olfativo no início do seguimento foi definido como o fator de exposição. O declínio cognitivo no fim do seguimento foi definido como resultado positivo. Os participantes foram divididos em quatro grupos com base nas funções olfativas e cognitivas e o RR de cada grupo foi calculado.
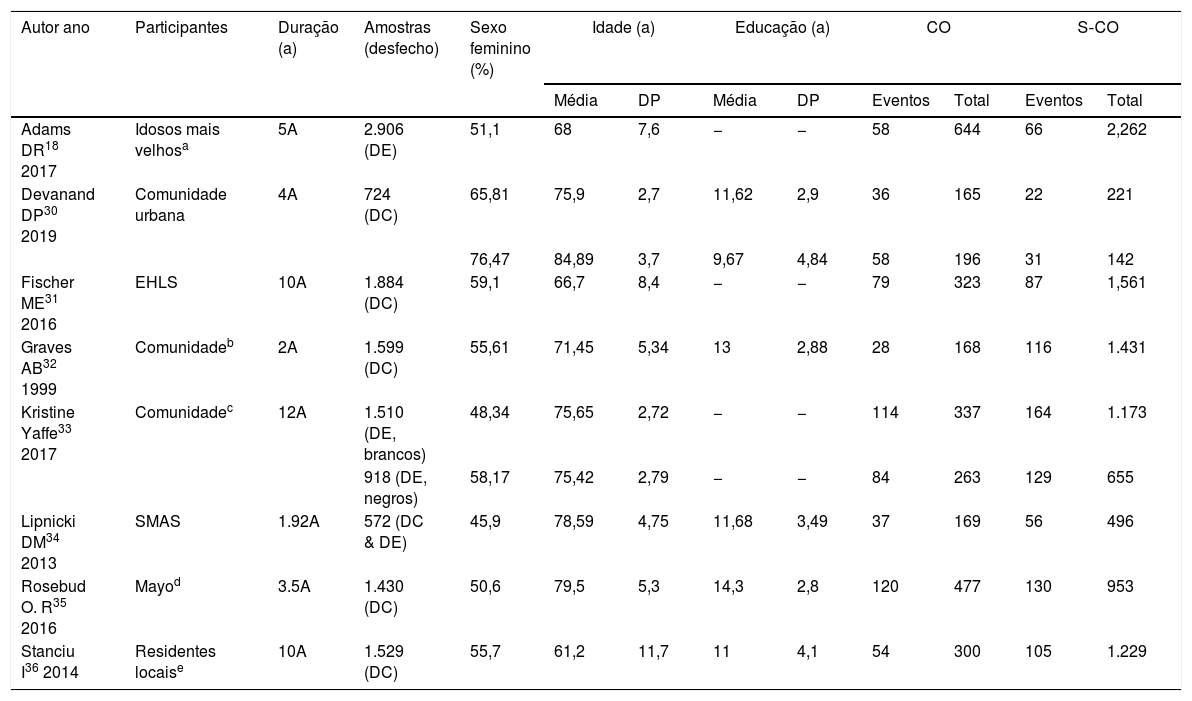
Os estudos selecionados forneceram informações estatísticas que permitiram o uso de métodos metanalíticos. Esse procedimento de busca resultou em oito artigos. Os detalhes dos participantes em cada estudo incluído estão descritos na tabela 1.
Características basais de cada população estudada
| Autor ano | Participantes | Duração (a) | Amostras (desfecho) | Sexo feminino (%) | Idade (a) | Educação (a) | CO | S‐CO | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Média | DP | Média | DP | Eventos | Total | Eventos | Total | |||||
| Adams DR18 2017 | Idosos mais velhosa | 5A | 2.906 (DE) | 51,1 | 68 | 7,6 | − | − | 58 | 644 | 66 | 2,262 |
| Devanand DP30 2019 | Comunidade urbana | 4A | 724 (DC) | 65,81 | 75,9 | 2,7 | 11,62 | 2,9 | 36 | 165 | 22 | 221 |
| 76,47 | 84,89 | 3,7 | 9,67 | 4,84 | 58 | 196 | 31 | 142 | ||||
| Fischer ME31 2016 | EHLS | 10A | 1.884 (DC) | 59,1 | 66,7 | 8,4 | − | − | 79 | 323 | 87 | 1,561 |
| Graves AB32 1999 | Comunidadeb | 2A | 1.599 (DC) | 55,61 | 71,45 | 5,34 | 13 | 2,88 | 28 | 168 | 116 | 1.431 |
| Kristine Yaffe33 2017 | Comunidadec | 12A | 1.510 (DE, brancos) | 48,34 | 75,65 | 2,72 | − | − | 114 | 337 | 164 | 1.173 |
| 918 (DE, negros) | 58,17 | 75,42 | 2,79 | − | − | 84 | 263 | 129 | 655 | |||
| Lipnicki DM34 2013 | SMAS | 1.92A | 572 (DC & DE) | 45,9 | 78,59 | 4,75 | 11,68 | 3,49 | 37 | 169 | 56 | 496 |
| Rosebud O. R35 2016 | Mayod | 3.5A | 1.430 (DC) | 50,6 | 79,5 | 5,3 | 14,3 | 2,8 | 120 | 477 | 130 | 953 |
| Stanciu I36 2014 | Residentes locaise | 10A | 1.529 (DC) | 55,7 | 61,2 | 11,7 | 11 | 4,1 | 54 | 300 | 105 | 1.229 |
Esta tabela demonstra os dados básicos dos participantes incluídos nos estudos inscritos, consistem no número total de participantes, o tempo de duração do seguimento, média de idade, proporção de gêneros, anos de escolaridade, número de pessoas expostas (que sofrem de comprometimento olfativo) e número de eventos finais (declínio cognitivo ou demência).
DC, declínio cognitivo; DE, demência; CO, comprometimento olfativo; S‐CO, sem comprometimento olfativo; EHLS, Participantes do estudo The Epidemiology of Hearing Loss Study; SMAS, Sydney Memory and Aging Study.
A qualidade metodológica dos estudos incluídos foi avaliada por dois revisores de forma independente, com a Escala de Newcastle‐Ottawa (NOS).29 As discordâncias foram resolvidas em reuniões de consenso. Os detalhes são mostrados na figura 1.
Extração de dadosDois autores avaliaram independentemente a elegibilidade de todos os estudos recuperados nas bases de dados de acordo com os critérios de seleção acima; as duas listas foram então comparadas e as divergências entre avaliadores foram resolvidas por discussão. Extraímos os seguintes dados de cada publicação, com um formulário padronizado: nome do estudo (juntamente com o nome do primeiro autor e o ano da publicação), desenho, população, país, tamanho da amostra, período, resultados (população do caso, RRs ou ORs ajustados com seus correspondentes ICs de 95%), instrumento de medida da função olfativa, método de avaliação cognitiva e ajustes para fatores de confusão na análise (tabela 1).
Análise estatísticaO comprometimento olfativo foi considerado como fator de exposição, enquanto declínio cognitivo e demência foram definidos como resultados positivos. Uma tabela 2 × 2 do desempenho diagnóstico para o teste olfativo foi construída para estimar o RR de cada estudo e calcular um RR combinado com IC de 95%.
A heterogeneidade estatística foi medida com o índice I2 e o teste Q de Cochran. Os graus de heterogeneidade “nenhum”, “baixo”, “moderado” e “alto” foram definidos como < 25%, 25% ≥ 50%, 50% ≥ 75% e ≥75%, respectivamente. A hipótese nula de que os estudos eram homogêneos foi rejeitada caso o valor de p fosse menor que 0,05. O modelo de efeito fixo foi usado para estimar o RR combinado, assumiu‐se que os estudos incluídos na metanálise tinham o mesmo tamanho de efeito. Dada a existência de heterogeneidade estatisticamente significativa, o modelo de efeito aleatório foi usado para combinar os resultados, assumiu‐se que os estudos incluídos na metanálise apresentavam tamanhos de efeito variados nos estudos. Nesta metanálise, a hazard ratio (HR) e a odds ratio (OR) foram consideradas equivalentes ao RR como medidas gerais de risco.
Duas análises de sensibilidade foram feitas para testar a estabilidade dos resultados: 1) Substituiu‐se um modelo de efeitos aleatórios por um modelo de efeitos fixos e 2) Removeu‐se um estudo primário da análise agrupada de cada vez. Entretanto, os resultados da avaliação da assimetria têm poder relativamente baixo para refletir um verdadeiro viés de publicação quando o número total de estudos incluídos na metanálise é pequeno (25 ou menos), como é o caso nesta revisão. Todas as análises foram feitas com o software estatístico Review Manager (versão 5.3). Foi considerado estatisticamente significante um valor de p bilateral ≤ 0,05.
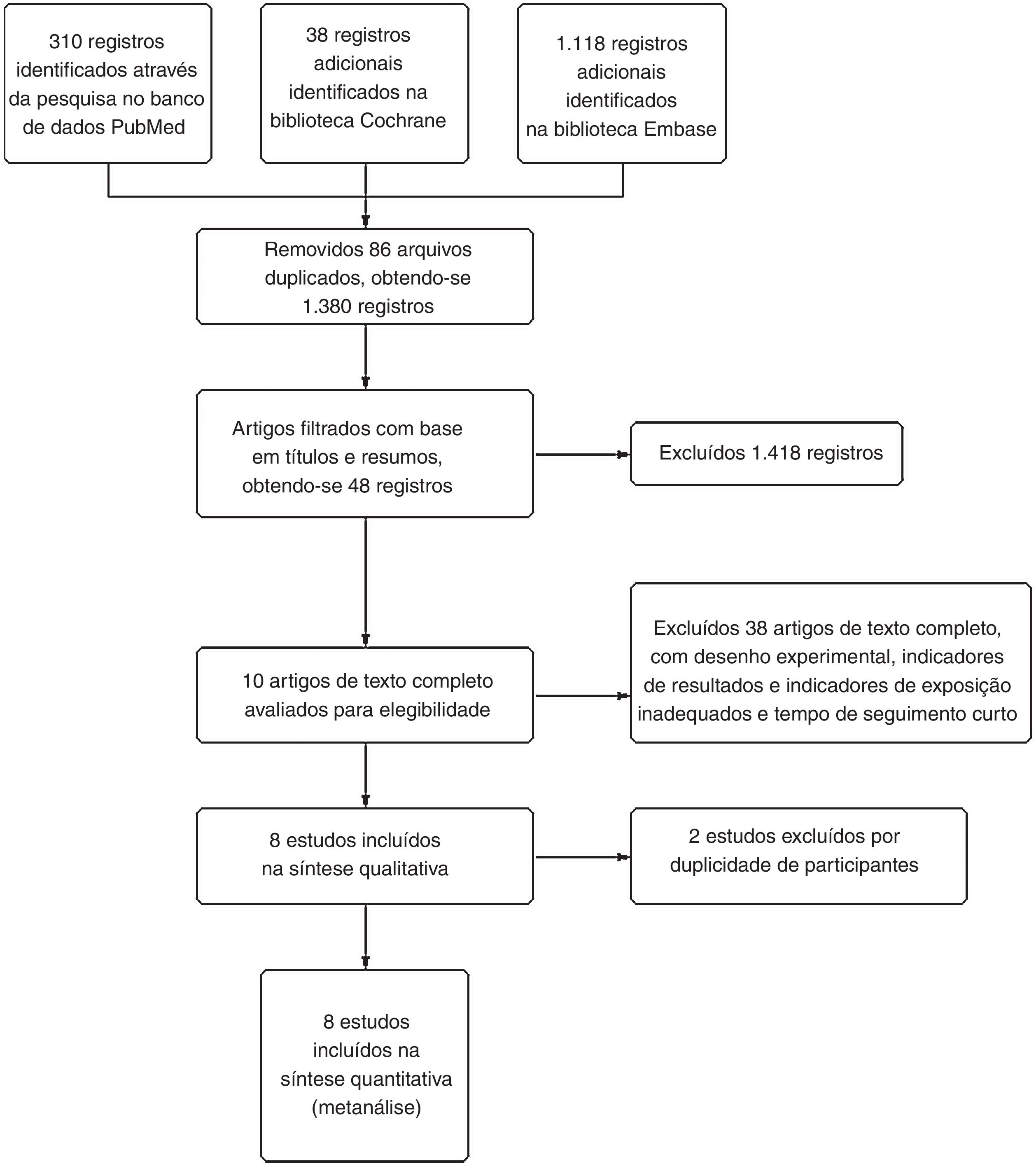
ResultadosCaracterísticas do estudoApós a revisão de 1.466 títulos e resumos e 43 artigos completos, oito artigos foram incluídos nesta metanálise.18,30–36 O processo de busca na literatura é mostrado na figura 2. Entre esses estudos, 6 foram feitos nos Estados Unidos,18,30–33,35 enquanto o restante foi feito na Austrália e na Suécia.34,36 O tamanho da amostra variou de 57234 a 2.90618 e o período de seguimento variou de 23 meses34 a 12 anos.33 Todos incluíram OR, RR ou HR ajustados e IC 95%. Os detalhes de cada estudo podem ser vistos na tabela 1.
Dos 8 estudos com dados sobre declínio cognitivo e demência, que incluíram 13.165 participantes e 1.574 eventos, 5 relataram resultados sobre declínio cognitivo,20–32,35,36 2 sobre demência18,33 e um sobre ambos.34
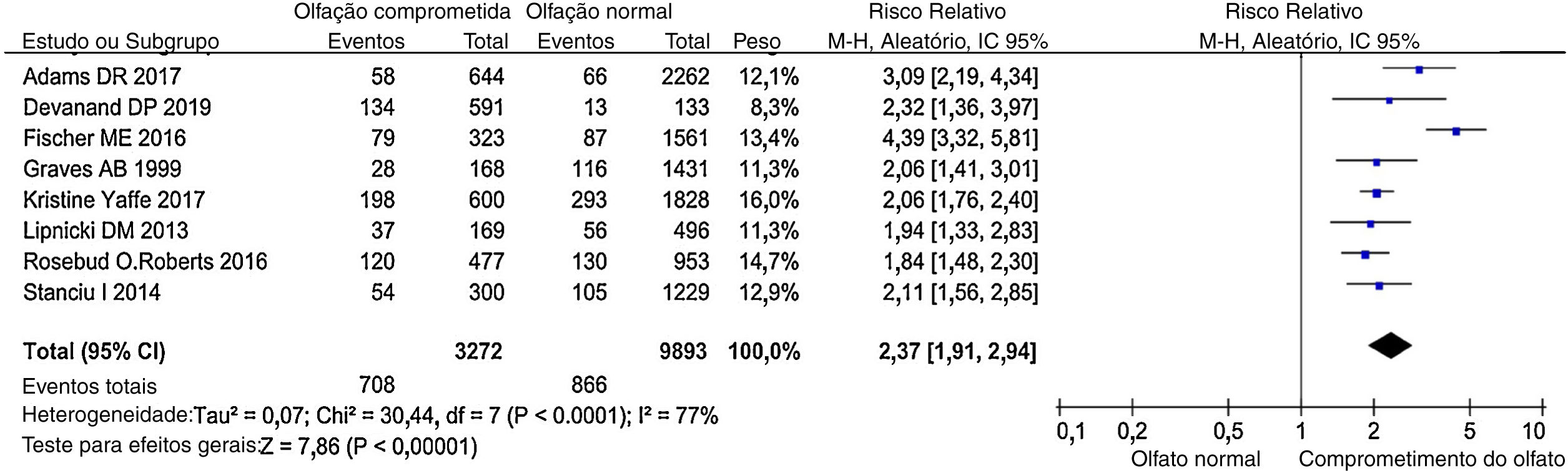
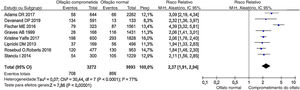
Risco relativo (RR)O comprometimento olfativo foi associado positivamente a um risco de declínio cognitivo. Comparando o olfato normal com o comprometido, o risco de declínio cognitivo aumentou 137% (RR combinado = 2,37; IC95% = 1,91‐2,94); (fig. 3), o que é basicamente consistente com a revisão de Windon et al.27 Entretanto, foi observada uma heterogeneidade estatisticamente significativa entre esses estudos (I2 = 77%, p < 0,00001). Considerando que a variabilidade nos tamanhos de efeito entre as populações com comprometimento olfativo e as populações com olfato normal diferiu mais do que seria esperado apenas com o erro de amostragem, faz‐se necessária a análise de possíveis variáveis moderadoras.
Obtivemos estimativas combinadas com um modelo de efeito aleatório. Os pontos indicam os RRs ajustados e comparam o olfato comprometido com o normal. O tamanho do quadrado sombreado é proporcional à porcentagem do peso de cada estudo. As linhas horizontais representam ICs de 95%.
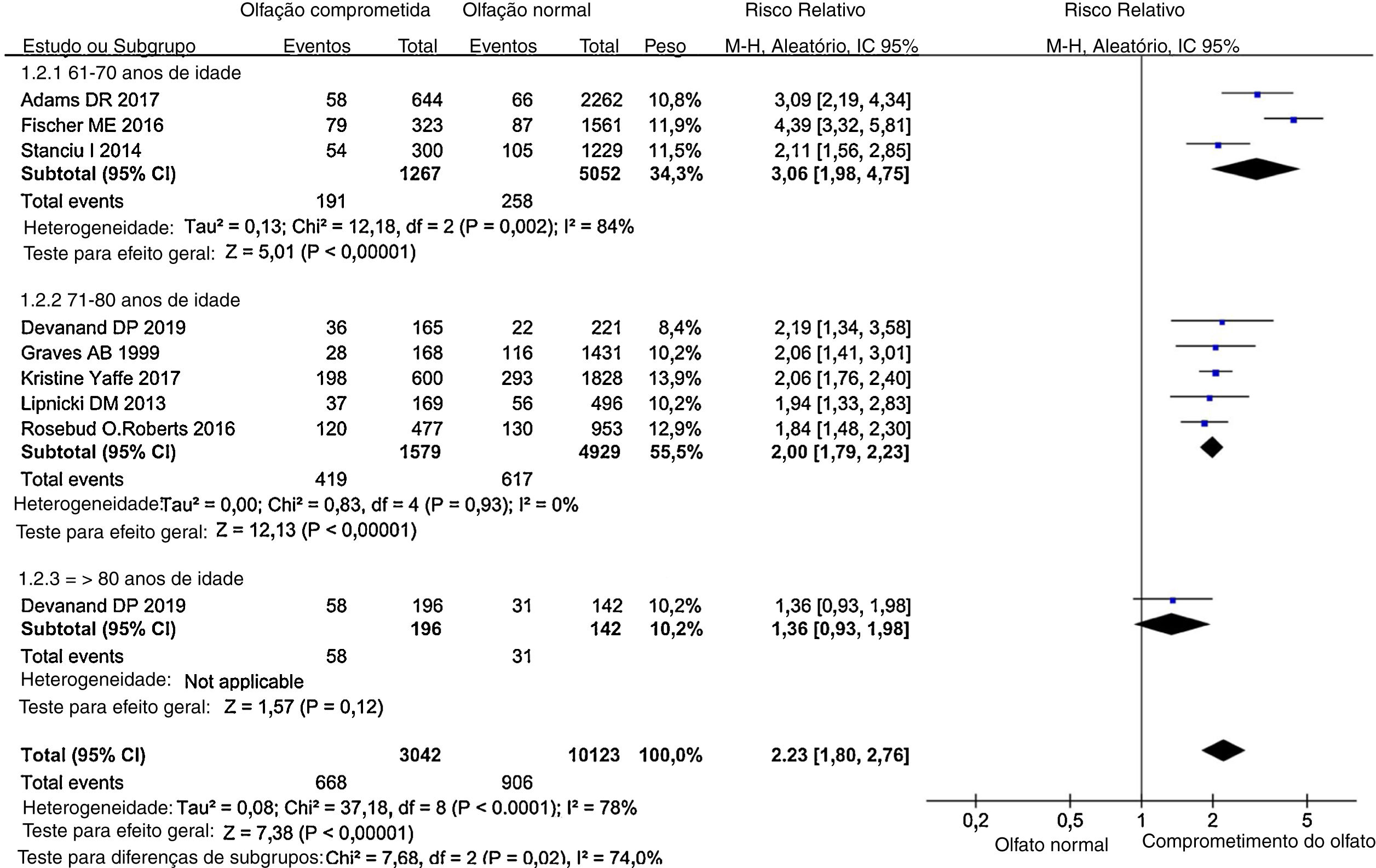
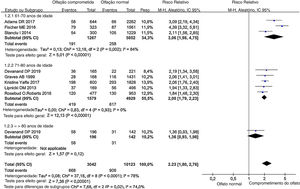
Análise de subgruposNa análise de subgrupos por idade, os RR de diferentes subgrupos foram obviamente diferentes (fig. 4). No subgrupo de 60 anos,18,31,36 a associação entre comprometimento olfativo e subsequente declínio cognitivo foi persistente (RR = 3,06, IC95% = 1,98–4,75). Devido à limitação das amostras, uma heterogeneidade substancial foi observada no grupo de 60 anos (I2 = 84%, p = 0,002). Essa associação também foi significativa no subgrupo de 70 anos (RR = 2,00, IC95% = 1,79‐2,23), mas foi mais fraca do que a do subgrupo de 60 anos, sem graus de heterogeneidade (I2 = 0%, p = 0,93).30,32–33 Os participantes do estudo de Devanand30 foram divididos em subgrupos etários. Os participantes com mais de 80 anos foram incluídos no subgrupo de 80 anos e a correlação entre comprometimento olfativo e subsequente declínio cognitivo nesse grupo foi mais leve do que a de outros grupos (RR = 1,36, IC95% = 0,93–1,98).30
Todos os estudos incluídos foram divididos em três subgrupos com base na média de idade da população incluída em cada um deles. O RR da análise de subgrupo para o faixa de 61 a 70 anos foi de 3,06, o RR para o grupo de 71 a 80 anos foi de 2,00 e o RR para o grupo acima de 80 anos foi de 1,36.
Análises de sensibilidadeO modelo de efeito fixo foi usado para testar a robustez do resultado da análise. Para verificar o impacto de cada estudo no RR combinado, fizemos análises de sensibilidade, removemos um estudo primário da análise de cada vez. As análises de subgrupos mostraram que nenhum estudo isolado apresentou uma interferência substancial nas estimativas gerais.
DiscussãoEste estudo descreveu a associação entre o comprometimento olfativo e subsequente declínio cognitivo e demência em idosos com cognição normal e sugeriu que o valor preditivo é diferente para diferentes subgrupos etários. Adultos mais velhos com comprometimento olfativo apresentaram um risco quase duplicado de desenvolver declínio cognitivo ou demência. Essas associações estáveis aparentemente persistiram em diferentes áreas geográficas, períodos de seguimento, tamanho da amostra, métodos de avaliação da função cognitiva e qualidades dos estudos primários. Estudos transversais e longitudinais anteriores corroboram essa opinião e uma revisão confirmou o valor preditivo do comprometimento olfativo para declínio cognitivo ou demência.8,35,37,38 Este estudo mostrou que adultos mais jovens com comprometimento olfativo eram mais propensos a desenvolver comprometimento da cognição ou demência no fim do seguimento.
Os pontos fortes dessa análise são os seguintes: todos os estudos incluídos eram de coorte longitudinal, com valor mais confiável, e o período de seguimento foi superior a 20 meses, o que elimina o viés de memória.
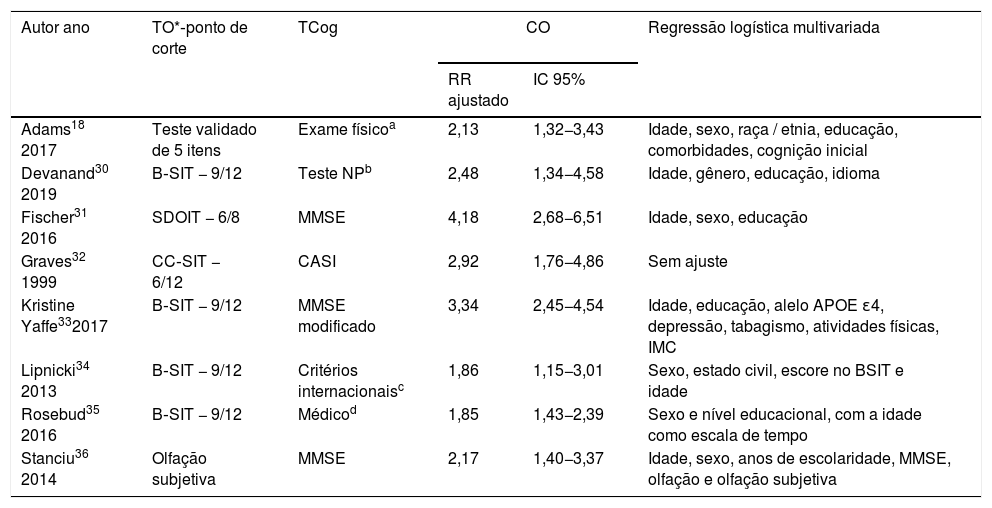
Houve algumas limitações nesta análise que criaram a heterogeneidade estatística. Diferentes métodos de detecção olfativa foram usados nos estudos inscritos. O Brief Smell Identification Test (B‐SIT),39 também denominado Cross‐Cultural Smell Identification Test (CC‐SIT), foi amplamente usado em todo o mundo. O Validated 5‐item Test, o Subjective Olfactory Complaint e o San Diego Odor Identification Test (SDOIT)40 também foram usados nos estudos incluídos.31 Já foi provado que esses métodos de detecção são comprovadamente eficazes. Alguns desses testes são adaptados do Pennsylvania Smell Identification Test (UPSIT).41 Existem diferenças sutis nos pontos de corte, o que contribuiu para a heterogeneidade estatística. Padrões rigorosos e precisos foram usados em cada estudo para avaliar as funções cognitivas. O Mini‐Mental State Examination (MMSE) foi o mais usado entre os estudos incluídos. Todos os métodos de avaliação de cada estudo são demonstrados na tabela características dos estudos (tabela 1).
O subgrupo com idade média mais jovem mostrou um fator RR mais alto de comprometimento olfativo no declínio cognitivo ou na transição para demência. Os participantes com comprometimento olfativo no subgrupo de 60 a 70 anos apresentaram uma probabilidade 2,64 a 5,27 maior de declínio cognitivo ou transição para demência em comparação com aqueles com olfação normal. Em um estudo de 10 anos de seguimento, ocorreu declínio cognitivo na meia idade (idade basal de 45 a 50 anos) e o grupo com idade basal de 64 a 70 anos experimentou um maior declínio na função cognitiva após dez anos, com uma redução de 9,6% em comparação com a linha de base.26 A prevalência estimada de comprometimento cognitivo leve em estudos de base populacional varia de 10% a 20% em pessoas com mais de 65 anos.42,43 A idade pode contribuir principalmente para o maior RR deste subgrupo em comparação com outros subgrupos. O tamanho limitado da amostra também contribuiu para a heterogeneidade.
A duração do seguimento para o subgrupo de 70 a 80 anos variou entre 23 meses e 12 anos, com RR estável de 1,84 a 2,11. Isso mostrou que não houve correlação linear entre o tempo de seguimento e o RR de comprometimento olfativo na função cognitiva. Particularmente, o RR não aumentou significativamente com a extensão do tempo de seguimento, o que é inconsistente com os resultados de revisões sistemáticas anteriores.27 Em estudos com uma duração de seguimento superior a dez anos,33,36 tanto o RR calculado a partir dos dados originais quanto o RR ajustado não foram significativamente diferentes daqueles de estudos com seguimento de curta duração.32,34
Estudos anteriores sugeriram que o comprometimento olfativo está associado ao declínio cognitivo e ao comprometimento do OBT. As vias de projeção do bulbo olfativo para as regiões cerebrais olfativas secundárias foram igualmente e significativamente correlacionadas com os emaranhados neurofibrilares e proteínas patogênicas como a α‐sinucleína e a proteína tau hiperfosforilada nessas áreas, as quais danificam a olfação e contribuem para o processo patogênico precoce de doenças neurodegenerativas, como DA e DP. Consequentemente, o olfato é considerado uma ferramenta eficaz e valiosa para a detecção precoce de doenças neurodegenerativas e pode ser um indicador da função cognitiva futura.
Devido à limitação dos métodos de detecção de demência e declínio cognitivo nos desenhos dos estudos incluídos, é um método inconveniente para diferenciar pessoas com alto risco de comprometimento cognitivo daquelas sem risco. No entanto, as alterações patológicas no OBT e em outras áreas relacionadas à olfação são sinais de alerta para o declínio cognitivo. A olfação é um resultado das alterações patológicas nessas áreas, o que pode contribuir para a prevenção de doenças neurodegenerativas. O treinamento olfativo oferece um futuro positivo para a melhoria da cognição. A triagem precoce e o tratamento preventivo podem retardar a progressão da doença (tabela 2).
Métodos de detecção
| Autor ano | TO*‐ponto de corte | TCog | CO | Regressão logística multivariada | |
|---|---|---|---|---|---|
| RR ajustado | IC 95% | ||||
| Adams18 2017 | Teste validado de 5 itens | Exame físicoa | 2,13 | 1,32−3,43 | Idade, sexo, raça / etnia, educação, comorbidades, cognição inicial |
| Devanand30 2019 | B‐SIT − 9/12 | Teste NPb | 2,48 | 1,34−4,58 | Idade, gênero, educação, idioma |
| Fischer31 2016 | SDOIT − 6/8 | MMSE | 4,18 | 2,68−6,51 | Idade, sexo, educação |
| Graves32 1999 | CC‐SIT − 6/12 | CASI | 2,92 | 1,76−4,86 | Sem ajuste |
| Kristine Yaffe332017 | B‐SIT − 9/12 | MMSE modificado | 3,34 | 2,45−4,54 | Idade, educação, alelo APOE ɛ4, depressão, tabagismo, atividades físicas, IMC |
| Lipnicki34 2013 | B‐SIT − 9/12 | Critérios internacionaisc | 1,86 | 1,15−3,01 | Sexo, estado civil, escore no BSIT e idade |
| Rosebud35 2016 | B‐SIT − 9/12 | Médicod | 1,85 | 1,43−2,39 | Sexo e nível educacional, com a idade como escala de tempo |
| Stanciu36 2014 | Olfação subjetiva | MMSE | 2,17 | 1,40−3,37 | Idade, sexo, anos de escolaridade, MMSE, olfação e olfação subjetiva |
Esta tabela mostra os métodos de detecção usados em cada estudo para detectar a função olfativa e cognitiva. O valor do ponto de corte de diferentes métodos de detecção olfativa é mostrado na tabela. Também são mostrados o coeficiente de risco relativo ajustado e o intervalo de confiança de 95% em cada estudo, bem como as variáveis incluídas na análise de regressão múltipla.
TO, teste de olfação; TCog, teste de cognição; B‐SIT, Brief Smell Identification Test (B‐SIT); 39 SDOIT, San Diego Odor Identification Test; 40 CC‐SIT, Cross‐Cultural Smell Identification Test; UPSIT, University of Pennsylvania Smell Identification Test; 41 IMC, índice de massa corporal; MMSE, Mini‐mental State Examination; CASI, Cognitive abilities screening instrument.
Este estudo reuniu evidências que apoiam o fato de que o comprometimento da função olfativa está significativamente associado aos riscos de declínio cognitivo e demência em idosos. É necessário prestar mais atenção às pessoas de 60 a 70 anos com distúrbios olfativos, devido ao maior fator de risco associado. A duração do seguimento não afeta significativamente os RRs. Considerando suas vantagens de segurança, relação custo‐benefício e facilidade de teste e interpretação, os testes olfativos podem ser indicadores efetivos do desenvolvimento de declínio cognitivo e demência em idosos.
LimitaçõesMais estudos de coorte em larga escala são necessários para determinar idade, gênero e pontos de corte dos testes olfativos para aumentar a eficácia e a eficiência de um indicador precoce de comprometimento cognitivo e demência no futuro. O comprometimento olfativo está moderadamente associado ao declínio cognitivo e mais métodos auxiliares de detecção são necessários para melhorar a previsão de declínio cognitivo. A análise do RR combinado foi limitada, uma vez que foi calculada a partir de dados originais sem ajuste.
FinanciamentoEste trabalho recebeu apoio financeiro do Beijing Municipal Hospital Scientific Research Training Program (PX2019023).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Please cite this article as: Chen Z, Xie H, Yao L, Wei Y. Olfactory impairment and the risk of cognitive decline and dementia in older adults: a meta‐analysis. Braz J Otorhinolaryngol. 2021;87:94–102.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.