Oral verrucous carcinoma is a special form of well‐differentiated squamous cell carcinoma which possesses specific clinical, morphologic and cytokinetic features that differ from other types of oral cancers and hence diagnosis requires immense experience in histopathology. Hence it is certainly important to distinguish such a lesion from other oral tumors as treatment strategies vary widely between them.
ObjectiveIn search of a critical diagnostic marker in distinguishing oral verrucous carcinoma from oral squamous cell carcinoma, Notch4 receptor, one of the key regulatory molecules of the Notch signaling family has been aberrantly activated in the progression of several types of tumors. However its function in oral verrucous carcinoma remains unexplored. Thus the present study aims in determining the differential expression pattern of Notch4 in oral verrucous carcinoma and oral squamous cell carcinoma.
MethodsTen patients reported positive for oral cancer (5 patients with oral verrucous carcinoma and 5 patients with oral squamous cell carcinoma). Five normal tissue samples were also obtained and evaluated for clinicopathological parameters and immunohistochemistry, western blotting and real time polymerase chain reaction for Notch4 expression.
ResultsOur results reveal that the expression of Notch4 was considerably high in oral squamous cell carcinoma lesions compared to normal tissue, whereas in oral verrucous carcinoma, irrespective of the clinicopathological features, complete regulação descendente of Notch4 was observed.
ConclusionsThese preliminary findings strongly support the fact that Notch4 is downregulated in oral verrucous carcinoma and could be considered as a suitable prognostic marker in distinguishing oral verrucous carcinoma from oral squamous cell carcinoma. This distinguishing marker can help in improving therapeutic options in patients diagnosed with oral verrucous carcinoma.
O carcinoma verrucoso de cavidade oral é uma forma especial de carcinoma de células escamosas bem diferenciada que tem características clínicas, morfológicas e citocinéticas específicas que diferem de outros tipos de cânceres orais. Por essa razão, o diagnóstico requer grande experiência em histopatologia. Portanto, é certamente importante distingui‐lo de outros tumores orais, pois as respectivas estratégias de tratamento variam muito.
ObjetivoEm busca de um marcador de diagnóstico crítico na distinção entre o carcinoma verrucoso e o carcinoma de células escamosas de cavidade oral, o receptor Notch4, uma das principais moléculas reguladoras da família de sinalizadores Notch, foi ativado de maneira anormal na progressão de vários tipos de tumores. No entanto, sua função no carcinoma verrucoso permanece inexplorada. Assim, o presente estudo tem como objetivo determinar o padrão de expressão diferencial de Notch4 no carcinoma verrucoso e de células escamosas de cavidade oral.
MétodoDez pacientes tiveram resultado positivo para câncer oral (cinco pacientes com carcinoma verrucoso e cinco pacientes com carcinoma de células escamosas) e cinco amostras normais foram também obtidas. Além da avaliação dos parâmetros clínico‐patológicos, foram feitos análise imuno‐histoquímica, Western Blot e reação de polimerase em cadeia em tempo real para a expressão de Notch4.
ResultadosNossos resultados revelam que a expressão de Notch4 foi consideravelmente alta em carcinomas de células escamosas em comparação com os tecidos normais, enquanto que no carcinoma verrucoso, independentemente das características clínico‐patológicas, observou‐se regulação descendente completa de Notch4.
ConclusãoEsses achados preliminares apoiam fortemente o fato de que Notch4 estava regulado para baixo no carcinoma verrucoso oral e poderia ser considerado um marcador prognóstico adequado para distinguir entre carcinoma verrucoso e carcinoma de células escamosas de cavidade oral. Esse marcador distintivo pode ajudar a melhorar as opções terapêuticas em pacientes com diagnóstico de carcinoma verrucoso oral.
O carcinoma verrucoso oral (CVO), que tipicamente representa uma variante rara de carcinoma de células escamosas bem diferenciado, é considerado uma forma não invasiva de tumor com características clínicas, morfológicas e citocinéticas específicas.1,2 Em geral, nódulos linfáticos e metástases distantes são raras no CVO, mas seu grande tamanho e o envolvimento das estruturas ósseas tornam‐no localmente agressivo se não for tratado corretamente.3 Embora o CVO tenha características histopatológicas únicas, é um desafio para o patologista diferenciar entre os subtipos de câncer oral, porque o diagnóstico preciso requer amostras adequadas de tumor, bem como profissionais experientes.4 O tratamento do CVO continua a ser controverso em decorrência de sua natureza extensa, mimetiza um câncer invasivo; portanto, a identificação de um marcador diagnóstico crítico que possa diferenciar os componentes do carcinoma de células escamosas oral (CCEO) do CVO é crucial para avaliar o significado clínico do CVO.5 Portanto, a necessidade atual é identificar um marcador definitivo para o CVO que possa ser usado efetivamente para diagnosticá‐lo e tratá‐lo.
A via de sinalização de Notch é uma das vias de sinalização de comunicação célula a célula que tem uma vasta gama de funções reguladoras, como proliferação, diferenciação e apoptose celular.6 A expressão elevada das moléculas de sinalização de Notch (receptores Notch 1‐4, ligantes Delta‐like 1, Delta‐like 3, Delta‐like 4, Jagged 1 e Jagged 2) foi considerada um dos eventos críticos em várias malignidades.7–9 Notavelmente, a evidência cumulativa mostrou que a ativação constitutiva do receptor Notch4, uma das principais moléculas receptoras da família de sinalização Notch, tem sido associada a várias formas de patogênese do câncer. No entanto, sua função como oncogene ou gene supressor de tumor é específico do contexto celular.10,11
Em nosso estudo anterior, verificamos que Notch4 desempenha um papel importante na patobiologia do CEE oral e, portanto, este estudo tem como objetivo analisar a expressão de Notch4 entre o CVO e o CEE.12 Para tanto, a expressão de Notch4 foi analisada em secções tumorais de CVO e CEE oral com variados parâmetros clinico‐patológicos. O objetivo do estudo foi determinar o padrão de expressão diferencial de Notch4 entre os principais subtipos de câncer oral, de modo que pudesse ser estabelecido um marcador diagnóstico confiável para o melhor tratamento de pacientes com CVO.
Material e métodosAmostra de pacientes com parâmetros clínico‐patológicosForam coletadas 15 amostras pós‐cirúrgicas de câncer bucal, as quais incluíram cinco positivas para CCEO e cinco com CVO, juntamente com cinco amostras de mucosa oral normal de indivíduos submetidos a cirurgia para condições orais benignas e maxilofaciais do Departamento de Cirurgia Oral e Maxilofacial, do Karpaga Vinayaga Institute of Dental Sciences, Índia. Todas as amostras foram divididas em duas partes: uma parte foi fixada em solução tampão a 10% de formaldeído e a outra parte foi congelada imediatamente e armazenada a ‐80°C até o seu uso. As informações sobre os vários parâmetros clínicos (sexo, idade, local do tumor e estadiamento TNM) foram obtidas dos registros médicos. O estudo foi aprovado pelo Comitê de Ética Institucional (490/IEC/2013).
Análise imuno‐histoquímicaA análise imuno‐histoquímica para as secções do tumor foi feita como descrito anteriormente.12 Os anticorpos primários usados foram os seguintes: Notch4 (sc‐8646), GAPDH (sc‐47724). Após a incubação das amostras com anticorpos secundários conjugados com HRP, as lâminas foram examinadas sob microscópio óptico e os resultados foram categorizados como expressão alta, moderada, leve e negativa, baseado na expressão de antígeno alto versus baixo. Todos os anticorpos foram adquiridos de Santa Cruz Biotechnology, EUA.
ImmunoblottingA análise das proteínas totais colhidas a partir das secções de tecido com o uso de tampão de lise foi feita pela técnica de Western Blot. Resumidamente, as proteínas separadas foram transferidas para a membrana de nitrocelulose (Amersham Protran, GE Healthcare Life Sciences, Alemanha) e neutralizadas com BSA a 3% em solução salina tamponada com Tris com Tween 20 a 0,1% (TBST) seguido por incubação durante a noite com anti‐Notch4 (sc‐ 8646) ou anti‐GAPDH (sc‐47724) a 4°C. A membrana foi incubada com anticorpos secundários adequados marcados com peroxidase de raiz forte, a 37°C durante uma hora. Os blots se evidenciaram com o uso de diaminobenzidina (DAB‐ Sigma) conforme o protocolo do fabricante, permitiu sua análise densitométrica.
Análise de reação de polimerase em cadeia em tempo real (RT‐PCR)O RNA total foi isolado de amostras de tecido congelado com o uso de Trizol (Merck) e quantificado com o sistema Nanodrop (espectrofotômetro Nanodrop lite, Thermo Scientific). O cDNA foi preparado a partir de 1μg de RNA total com o uso de transcriptase reversa M‐MuLV (New England Biolabs Inc). O cDNA preparado foi subsequentemente submetido à amplificação por PCR com o uso dos seguintes primers: Notch4: direto: 5’‐CCACTAGGCGAGGACAGCATT‐3’; reverso: 5’‐CAACTCCATCCTCATCAACTTCTG‐3’, β actina: direto: 5’‐AGAGCTACGAGCTGCCTGAC‐3’; reverso: 5’‐GGATGCCACAGGACTCCA‐3’. Os produtos de PCR amplificados foram visualizados com o uso de eletroforese em gel de agarose e coloração com brometo de etídio. Todas as amostras foram normalizadas com β‐actina com o uso de análise densitométrica.
Análise estatísticaA análise estatística da expressão de Notch4 entre pacientes com CVO e CCEO foi analisada pelo teste t de Student com o uso do software online GraphPad (www.graphpad.com/quickcalcs/ttest1). Todos os experimentos foram repetidos três vezes e os testes estatísticos foram feitos com nível de significância de p < 0,05.
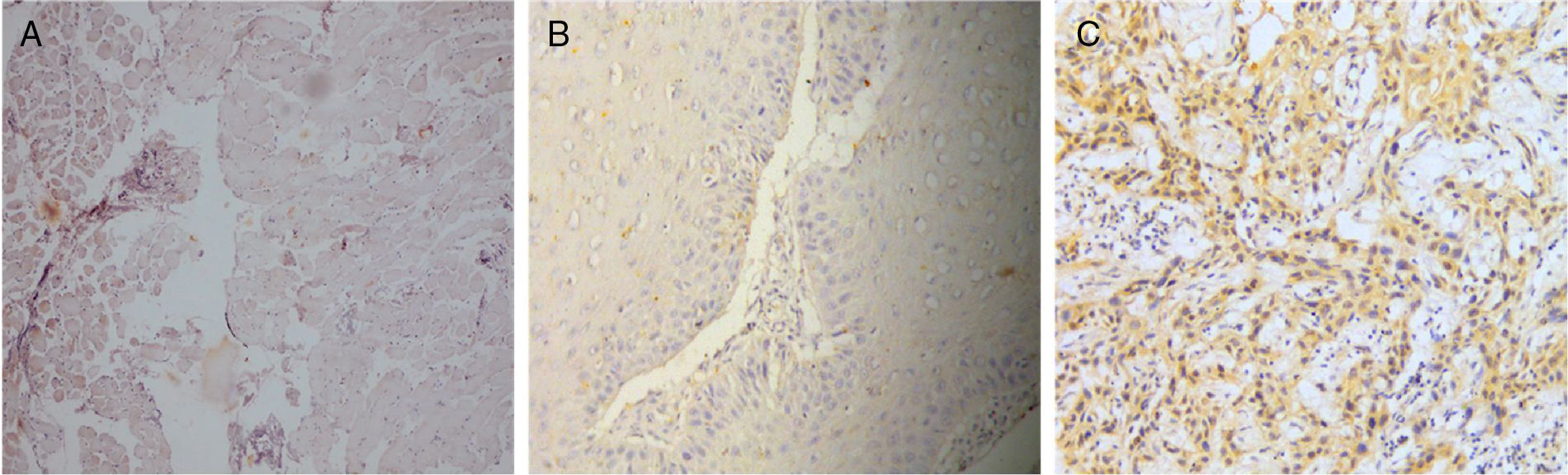
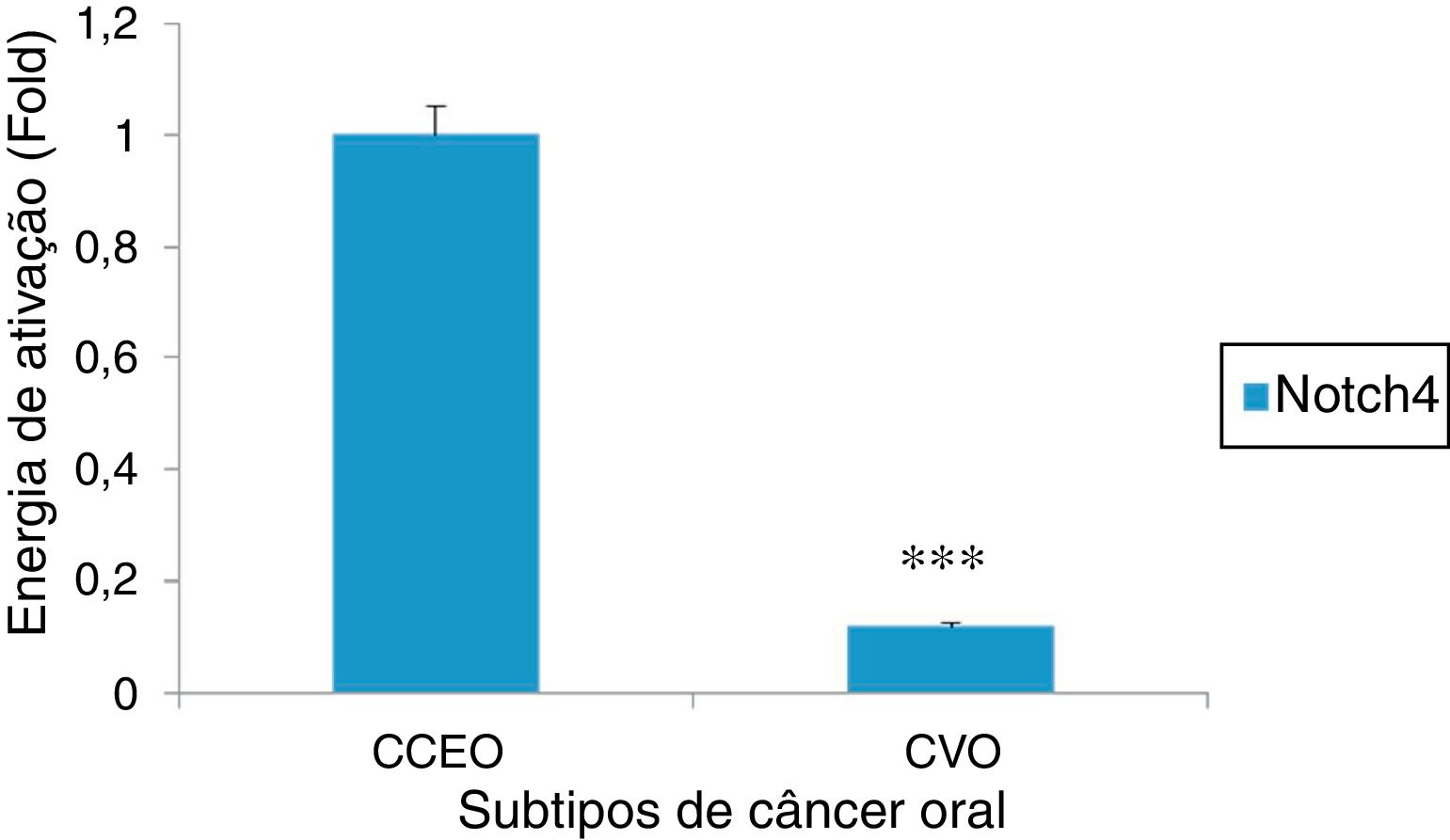
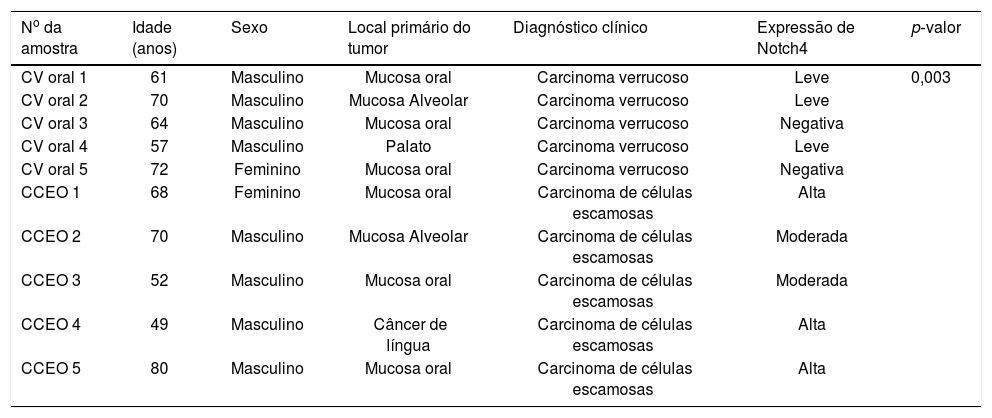
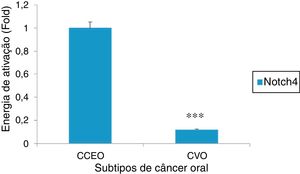
ResultadosAs características clínicas dos pacientes com CVO e CCEO estão resumidas na tabela 1. A idade média dos grupos CVO e CCEO foi de 65,2 ± 3,05 anos e 63,8 ± 5,19 anos, respectivamente. A proporção entre homens e mulheres para ambos os grupos foi de 4:1 e o local primário dos tumores estava restrito à mucosa oral (3/5 em ambos os grupos). Assim, todos os principais parâmetros clínicos para ambos os grupos selecionados para o estudo foram praticamente idênticos. Embora os fatores etiológicos do CVO ainda permaneçam controversos, em nosso estudo todos os pacientes tinham histórico de uso do tabaco (dados não apresentados). Ao fazer a imunolocalização para Notch4 em seções tumorais, foi observado que a proteína se encontrava na membrana e citoplasma e sua expressão era alta em tumores de CCEO em comparação com a da mucosa normal, enquanto que uma expressão muito baixa foi observada em todas as amostras de CVO, independentemente dos parâmetros clínicos (figura 1). Além disso, os dados de Western Blot e RT‐PCR também mostraram que Notch4 estava abundantemente presente no CCEO, enquanto uma expressão muito fraca foi observada em casos de CVO (figura 2). Além disso, a análise densitométrica dos blots confirmou que Notch4 estava significativamente regulado para baixo no CVO, sugeriu sua importância no prognóstico dos subtipos tumorais (figura 3).
Parâmetros clínicos de subtipos de câncer oral (CVO e CCEO) com a expressão de Notch4 representada como alta, moderada, leve e negativa, com base na intensidade das proteínas visualizadas nos ensaios de imunolocalização (p < 0,05 foi considerado estatisticamente significante)
| No da amostra | Idade (anos) | Sexo | Local primário do tumor | Diagnóstico clínico | Expressão de Notch4 | p‐valor |
|---|---|---|---|---|---|---|
| CV oral 1 | 61 | Masculino | Mucosa oral | Carcinoma verrucoso | Leve | 0,003 |
| CV oral 2 | 70 | Masculino | Mucosa Alveolar | Carcinoma verrucoso | Leve | |
| CV oral 3 | 64 | Masculino | Mucosa oral | Carcinoma verrucoso | Negativa | |
| CV oral 4 | 57 | Masculino | Palato | Carcinoma verrucoso | Leve | |
| CV oral 5 | 72 | Feminino | Mucosa oral | Carcinoma verrucoso | Negativa | |
| CCEO 1 | 68 | Feminino | Mucosa oral | Carcinoma de células escamosas | Alta | |
| CCEO 2 | 70 | Masculino | Mucosa Alveolar | Carcinoma de células escamosas | Moderada | |
| CCEO 3 | 52 | Masculino | Mucosa oral | Carcinoma de células escamosas | Moderada | |
| CCEO 4 | 49 | Masculino | Câncer de língua | Carcinoma de células escamosas | Alta | |
| CCEO 5 | 80 | Masculino | Mucosa oral | Carcinoma de células escamosas | Alta |
Expressão imuno‐histoquímica da proteína Notch4 em espécimes de mucosa normal e subtipos de câncer oral (CVO e CCEO) (ampliação de 20X). A, Imunorreatividade de Notch4 em mucosa normal da cavidade oral; B, Imunorreatividade de Notch4 em CVO; C, Imunorreatividade de Notch4 em CCEO.
Proteínas totais isoladas das amostras de tecido de CVO e CCEO foram analisadas por Western Blot com o uso do anticorpo anti‐Notch4. Os blots se evidenciaram com o uso de DAB, revelaram uma alta expressão de Notch4 em amostras de CCEO, enquanto uma expressão muito fraca foi observada em amostras de CVO. Todos os experimentos foram feitos em triplicata e os dados foram analisados adicionalmente por densitometria, GAPDH serviu como normalizador.
Análise de RT‐PCR de Notch4 em diferentes subtipos de câncer oral (CCEO e CVO) mostra uma regulação descendente de Notch4 em amostras de CVO. A análise densitométrica foi feita com o software ImageJ 1.47v e os valores foram normalizados para β Actina (*** p < 0,001, teste t de Student).
Os carcinomas verrucosos orais são lesões hiperqueratóticas de crescimento lento, exofíticas e bem demarcadas, consideradas uma variante rara de carcinomas de células escamosas com uma taxa de ocorrência de 2% a 12% entre todos os tipos de câncer oral.13 No entanto, o CCEO é uma neoplasia muito comum da cavidade oral, representa quase 90% dos tumores nessa região.14 Em geral, o CCEO é considerado uma forma mais agressiva de tumor, muitas vezes leva a metástases, o que é altamente incomum no CVO. Além disso, a característica histopatológica do CVO permanece distinta de outros carcinomas convencionais.15 Embora distinto, um diagnóstico histopatológico preciso requer um patologista hábil e uma amostra de biópsia suficiente que contenha porções de infiltração profunda das lesões.16 Portanto, o tratamento ideal para CVO continua a ser controverso, devido às dificuldades na classificação apropriada de lesões e também sua capacidade de simular o CCEO invasivo em seu comportamento biológico.17 No entanto, uma identificação clara dos subtipos de tumor é de grande importância, uma vez que as estratégias de tratamento variam muito entre os dois grupos.
Vários estudos no passado foram feitos para identificar a molécula ativa envolvida na patogênese do CVO. Mohtasham et al. (2013) fizeram análise histoquímica de p53, Ki‐67, MMP‐2 e MMP‐9 e mostraram que essas proteínas poderiam ser usadas na identificação da característica invasiva do tumor, que distingue o CCEO do CVO.18 Do mesmo modo, várias proteínas, como o oncogene Retinoblastoma (Rb) Bcl‐X e a Ciclina D1, também demonstraram uma expressão diferencial no CVO.19,20 No entanto, Ogawa et al. (2004) não observaram diferenças óbvias na expressão da proteína p53 entre o CV e o CCEO bem diferenciado na atividade proliferativa de células tumorais.16 Portanto, a confiabilidade desses marcadores de proteínas é questionável devido à falta de uniformidade em seu padrão de expressão entre os indivíduos.21 Assim, o diagnóstico diferencial de CVO permanece difícil e requer exame cuidadoso dos tumores.
A via de sinalização de Notch, uma das principais vias de comunicação celular, tem um papel importante na manutenção do equilíbrio entre proliferação, diferenciação e apoptose celular.22 Além de seu papel na regulação do comportamento biológico de células normais, foi relatado que membros da família Notch (receptores Notch1, Notch2, Notch3 e Notch4) induzem vários tipos de câncer e podem ser considerados como um alvo terapêutico potencial em oncologia.23,24 Em nosso estudo anterior, demonstramos que Notch4 era regulado para cima nos estágios tardios do CCEO, sugeriu sua ação como um potencial marcador metastático.12 No entanto, a sua função biológica como oncogene ou gene supressor de tumor é baseada puramente no contexto celular. Por exemplo, Clementz et al. (2011) e Nagamatsu et al. (2014) demonstraram independentemente o papel oncogênico de Notch4 na ocorrência de câncer de mama e sugeriram que ele fosse uma opção terapêutica potencial no tratamento de pacientes com metástase.10,25 Além disso, Ding et al. (2010) relataram a regulação ascendente de Notch4 no carcinoma adenoide cístico salivar (CACS) e seu papel chave na indução de metástases do CACS.11 Da mesma forma, Notch4 foi considerado um marcador histoquímico candidato na identificação do carcinoma hepatocelular.26 Observa‐se que, em alguns tipos de câncer, como o carcinoma de células renais, a regulação descendente de Notch4 foi relatada.27 Assim, é impossível generalizar o papel de Notch4 na progressão do câncer. Até agora, não conhecemos relatos que elucidem a expressão específica de tecido de Notch4 no CVO e, portanto, o estudo atual foi desenhado para identificar seu papel potencial na patogênese do CVO. Os resultados do presente estudo correlacionaram‐se com o nosso estudo anterior sobre o fato de que a expressão de Notch4 era alta em amostras de CCEO. É interessante o fato de que foi observada regulação descendente completa de Notch4 em amostras de pacientes com CVO, confirmaram o papel específico de Notch4 no contexto de células e doenças, entre os subtipos de câncer oral que apresentam relação estreita entre si. Em conjunto, este estudo fornece uma nova informação para traçar uma abordagem molecular na diferenciação de CVO e CCEO.
ConclusõesEm resumo, este estudo foi focado principalmente na obtenção de um marcador diagnóstico chave que poderia ser mais específico para o CVO. Assim, nossas descobertas confirmam que a fadiga da expressão de Notch4 em amostras de tecido de CVO pode ser considerada um valioso marcador prognóstico na diferenciação entre CVO e CCEO, pois as lesões do CCEO podem não ser distintas clinicamente ou podem coexistir com o CVO. Embora nossos resultados apoiem fortemente a importância de Notch4 como um marcador prognóstico confiável para CVO, estudos mais complexos devem ser feitos para obter os fatores regulatórios que desencadeiam a regulação descendente de Notch4, de modo que uma nova abordagem terapêutica para o CVO possa ser obtida.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Harishankar MK, Mohan AM, Krishnan AV, Devi A. Downregulation of Notch4 – a prognostic marker in distinguishing oral verrucous carcinoma from oral squamous cell carcinoma. Braz J Otorhinolaryngol. 2019;85:11–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.