Considerando que estudos anteriores sugerem que pesticidas podem causar distúrbios auditivos em humanos, além da falta de estudos que comprovem os mecanismos específicos de lesão e a dificuldade em separar fatores etiológicos concomitantes dos danos auditivos, como ruído e vibração, é importante desenvolver estudos que usem modelos animais para elucidar os efeitos da exposição a substâncias isoladas de outras etiologias de danos auditivos.
ObjetivoAvaliar se a exposição a um inseticida organofosforado baseado em diclorvos pode induzir ototoxicidade.
MétodoForam divididos em 3 grupos 36 ratos Wistar machos (12 ratos/grupo): controle (exposto à água), controle positivo (tratado com cisplatina para induzir dano auditivo) e experimental (exposto ao inseticida). A amplitude das emissões otoacústicas por produto de distorção nas frequências de 4, 6, 8, 10 e 12kHz foi avaliada antes e após a exposição, bem como sinais de toxicidade sistêmica, ganho de massa corporal e colinesterase plasmática. Os testes Open Field e Plus Maze foram feitos em 24 ratos: experimental (n=8), controle (n=8) e grupo controle positivo (n=8, introduziu novos ratos para induzir atividade ansiolítica) para avaliar a atividade locomotora e a ansiedade, respectivamente.
ResultadosNão houve alteração significativa no ganho de massa corporal e colinesterase plasmática no grupo experimental; entretanto, os animais apresentaram piloereção transitória, depressão e dispneia durante a exposição. O comportamento não foi afetado em qualquer grupo. As frequências de 8 e 10kHz foram significativamente afetadas bilateralmente no grupo exposto ao inseticida, o qual também mostrou uma diferença significativa do controle em 10kHz na orelha direita e 8 e 10kHz na orelha esquerda.
ConclusãoA exposição subcrônica inalatória de inseticida organofosforado baseado em diclorvos induziu ototoxicidade na função coclear de ratos sem toxicidade sistêmica relevante.
De acordo com a literatura, a exposição a pesticidas pode causar alterações na audição humana.1–6 A lesão auditiva geralmente ocorre devido a vários fatores7 e, quando ocorre no âmbito ocupacional no setor primário da economia, pode estar relacionada principalmente a dois fatores: exposição a produtos químicos ototóxicos, como solventes e pesticidas, e também ruídos de máquinas agrícolas. A perda auditiva decorrente da exposição a medicamentos ototóxicos é semelhante à que ocorre em altos níveis de pressão sonora, é neurossensorial, bilateral, simétrica, irreversível em altas frequências e causa danos às células ciliadas da cóclea.8
Os agroquímicos pertencentes à classe dos organofosfatos (OFs) são amplamente usados na agricultura como inseticidas. Entre eles, destaca‐se o diclorvos (2,2‐diclorovinil‐dimetil fosfato – DDVP), usado em campanhas de saúde pública para controle de vetores e como recurso na medicina veterinária no combate aos ectoparasitas9 no setor primário da economia brasileira (agricultura). Os OFs atuam como inibidores da colinesterase e são responsáveis por muitos envenenamentos intencionais ou acidentais.10
Os OFs são importantes para controlar vetores, se considerarmos que o Brasil tem um grande número de casos relatados de dengue, chikungunya e zica. Atualmente o país pode ser considerado o mais afetado pelo mosquito Aedes aegypti.11 Portanto, inseticidas, como os organofosforados, são amplamente usados na saúde pública para controle de vetores. O diclorvos, um OF, também é usado em desinfestações domésticas. Além disso, existe uma preocupação com o seu uso em ambientes internos que pode estar relacionada a fases críticas do desenvolvimento humano. As crianças podem ser expostas a pesticidas, pois tendem a explorar seu ambiente quando brincam, tocam superfícies como o chão,12 e a ter um comportamento “mão à boca”, absorvem mais pesticidas do que os adultos.13
Devido à existência de vários agentes etiológicos que causam perda auditiva ocupacional, como ruído de máquinas e exposição a agentes químicos, há uma dificuldade na correlação dessa patologia auditiva. Além disso, mesmo aqueles que não trabalham diretamente com essas substâncias são expostos a elas e a perda auditiva pode ser multifatorial.7
O estudo em animais expostos somente a pesticidas, isentos de vieses como ruído e vibração, permite a caracterização da perda auditiva e o estudo de seus mecanismos. Na literatura, existem poucos estudos que avaliam a ototoxicidade devido à exposição a agroquímicos em modelos animais e esses costumam usar vias não correlacionadas com a exposição ocupacional, como a injeção intraperitoneal.14–16 Portanto, o presente estudo teve como objetivo avaliar os efeitos ototóxicos baseados na função coclear da exposição subcrônica inalatória a um inseticida organofosforado à base de diclorvós (DBOI) em ratos através de emissões otoacústicas por produto de distorção.
MétodoAgentes químicosUma formulação concentrada emulsificável comercialmente disponível (55%) de inseticida organofosforado com diclorvos como ingrediente ativo foi diluída em água destilada na concentração de 0,0015mg/mL, correspondeu a 1/10da CL50 de inalação do rato, que é de 15mg/L17 (a CL50 refere‐se à concentração que causa a morte de 50% dos animais expostos). O produto comercial foi escolhido de forma a usar as substâncias às quais a população, em geral, está de fato exposta.
Como controle positivo da ototoxicidade, foi usada a droga antineoplásica cisplatina. Os ratos foram tratados com 8mg/kg por via intraperitoneal, uma vez ao dia, por 3 dias consecutivos. A cisplatina foi diluída em solução fisiológica (10mL de solução/kg).
Animais experimentaisNo presente estudo, foram usados 36 ratos Wistar machos (Rattus norvegicus) com 60 dias e peso aproximado de 300±50g. Os animais foram mantidos em condições controladas no biotério, ciclo claro/escuro de 12h, receberam água e comida ad libitum, exceto durante a exposição.
ExperimentoO protocolo experimental foi adaptado do teste de toxicidade subcrônica inalatória (exposição repetida), número 413, das diretrizes da Organization for Economic Cooperation and Development (OECD) para o teste de produtos químicos18 e aprovado pelo Comitê de Ética em Uso Animal da Universidade Federal de Ciências da Saúde de Porto Alegre sob o n° 321/15. Todos os procedimentos de atenção à saúde (segundo o Conselho Nacional de Controle da Experimentação Animal [Concea]) foram seguidos a fim de evitar dor ou angústia nos animais. Apenas animais sem sinais de patologia auditiva externa (verificada por otoscopia feita por um veterinário) e emissões otoacústicas por produtos de distorção (EOAPD) presentes em todas as frequências testadas (4, 6, 8, 10 e 12kHz) foram selecionados para o experimento.
As câmaras de exposição à inalação eram à prova de som, com volume de 56 litros, e foram acopladas a nebulizadores ultrassônicos (evitavam ruídos) como corrente de entrada e a um aspirador como sistema de exaustão. Havia 4 animais por câmara, considerando o volume estabelecido pela OCDE.
O tamanho da amostra foi baseado em estudos anteriores, usou a variabilidade nas respostas aos parâmetros auditivos avaliados em ratos expostos ao agente ototóxico cisplatina como controle positivo.19
Durante o período de adaptação (5 dias), os animais foram treinados para se habituar com os instrumentos de avaliação auditiva, bem como adaptação ao período na câmara de exposição, inicialmente por 1h (dia 1), 2° dia por 2h, 3° dia por 3h e no 4° dia por 4h (com uso apenas do fluxo de ar). No dia 5, o fluxo de ar foi usado com vapor de água por 4 horas.
Os ratos (n=36) foram divididos aleatoriamente em três grupos: controle negativo, controle positivo (para dano auditivo – cisplatina) e experimental. O grupo de controle negativo consistiu em 12 ratos expostos à água (veículo para diluição da formulação) por inalação por 4h, 5 vezes por semana, durante 6 semanas. O grupo de controle positivo incluiu 12 ratos tratados com 8mg/kg de cisplatina por via intraperitoneal, uma vez ao dia, por 3 dias consecutivos (total de 24mg/kg). O grupo experimental foi constituído por 12 ratos expostos a DBOI inalado, na concentração de 0,0015mg/mL, por 4h, 5 vezes por semana, por 6 semanas.
AvaliaçõesSinais clínicos e massa corporalOs animais foram avaliados em relação à massa corporal e sinais clínicos (depressão ou excitação; tremor; piloereção; dispneia) durante todo o período experimental (uma vez ao dia nos dias de exposição).
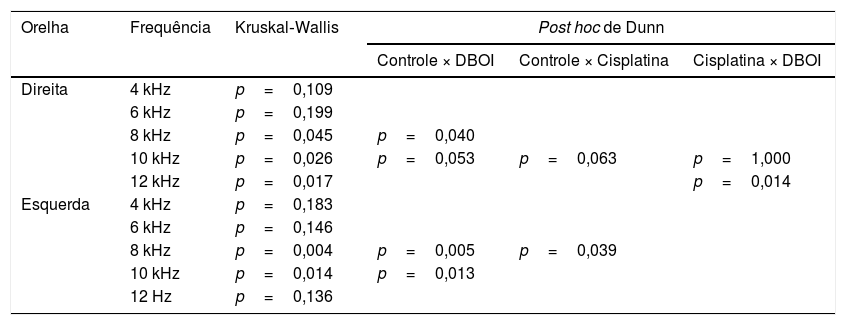
Emissões otoacústicas por produto de distorção (EOAPD)As emissões otoacústicas por produto de distorção foram feitas nos grupos controle e experimental antes (pré‐exposição) e após (pós‐exposição) o período de exposição (0 e 42 dias) e no controle positivo para induzir dano auditivo (cisplatina) imediatamente antes da 1ª administração e 24 horas após a 3ª administração nas frequências de 4, 6, 8, 10 e 12kHz. Essa avaliação foi feita sem anestésico, apenas com habituação prévia dos animais aos instrumentos de avaliação auditiva. As EOAPD foram registradas com dois tons (f1 e f2) como estímulos acústicos (f1/f2, razão f2: f1 fixa em 1,22). Os tons f1 e f2 foram apresentados nos níveis de estímulo de 65 e 55db NPS (nível de pressão sonora). Os testes de EOAPD foram feitos com uma sonda auditiva para uso infantil, colocada no meatoacústico externo do rato e testada nas frequências de 4, 6, 8, 10 e 12kHz sem uso de anestesia. As emissões otoacústicas por produtos de distorção foram feitas nos grupos controle e experimental antes (pré‐exposição) e após (pós‐exposição) o período de exposição (0 e 42 dias) e no controle positivo antes da 1ª administração e 24 horas após a 3ª administração. Embora o critério de normalidade para as emissões otoacústicas frequentemente considerado seja de pelo menos 6dB de razão sinal/ruído, nesta pesquisa as EOAPD foram analisadas pela amplitude da resposta antes e após a exposição, que foram comparadas entre os grupos (controle, controle positivo para dano auditivo e DBOI). Isso ocorreu, uma vez que os termos “normal” e “alterado” são mais adequados para emissões transitórias. Nesta pesquisa, as EOAPD (e a avaliação da amplitude da resposta pré e pós‐exposição) tornaram‐se uma opção melhor, pois mostram uma redução na amplitude da resposta, mesmo que, de acordo com o critério de 6dB, haja normalidade.
Testes comportamentaisTrinta dias após o início do experimento, oito ratos de cada grupo (grupo controle e experimental) foram selecionados aleatoriamente e, além disso, oito novos ratos foram incluídos em um grupo controle positivo (ansiolítico) (ratos extras selecionados além daqueles grupos pré‐definidos) tratados com diazepam intraperitoneal (1mg/kg) 30 minutos antes do teste comportamental (Plus Maze) para induzir atividade ansiolítica.
Teste Open FieldA arena do teste Open Field destina‐se a quantificar a atividade locomotora espontânea geral. Para tanto, foi usada uma arena preta (60×60×30cm) dividida em 16 quadrados. Os animais foram posicionados no canto posterior esquerdo e monitorados para analisar o perfil exploratório por cinco minutos. Os seguintes parâmetros foram avaliados: número de deslocamentos (quando o animal coloca as quatro patas em qualquer um dos quadrados, quantificados como cruzamentos externos os quadrantes próximos às bordas da caixa e os quadrantes internos posicionados no centro do aparelho; esse parâmetro está associado à atividade locomotora); latência para deixar o primeiro quadrante (associado à ansiedade); número de elevações (o número de vezes em que o animal se levanta apoiado nas patas traseiras); tempo de limpeza (tempo gasto na limpeza). A cada troca de animais, a arena era limpa.20,21
Plus MazeEste teste é usado para avaliar a ansiedade. O equipamento usado é um labirinto de madeira, em forma de cruz, com um quadrado central (12 × 12cm) e cada um dos quatro braços mede 50cm de comprimento por 10cm de largura. Os animais foram colocados no centro do labirinto com a cabeça voltada para o braço fechado. Os comportamentos foram registrados durante os 5 minutos de exposição e os parâmetros avaliados foram: tempo de permanência nos braços abertos e fechados, número de entradas nos braços abertos e fechados, número de movimentos de inclinação da cabeça (quando o animal faz um movimento semelhante ao mergulho para observar a superfície) e o tempo gasto no centro do aparelho.22,23
EutanásiaNo fim do protocolo experimental (24 horas após a última exposição por inalação ou tratamento com cisplatina), a eutanásia foi feita com anestesia prévia com tiopental de sódio administrado por via intraperitoneal (40mg /kg) associado à lidocaína (10mg/mL). Sob anestesia, o rato recebeu uma incisão no abdômen e o sangue foi coletado da veia cava caudal e transferido para um tubo contendo EDTA, centrifugado e o plasma colocado em tubo Eppendorf e congelado até a análise. Os animais tiveram seus órgãos (fígado, rins, baço, coração e pulmões) removidos e inspecionados em relação a alterações macroscópicas. O plasma dos ratos foi usado para a determinação da atividade da colinesterase plasmática por um ensaio enzimático cinético.
EstatísticaOs dados das EOAPD foram apresentados como mediana e intervalo interquartil e a comparação entre os grupos foi feita com os testes de Mann‐Whitney (avaliação pós‐exposição em relação à pré‐exposição de cada grupo) e Kruskal‐Wallis (comparação das variações entre os grupos), seguido pelo teste post hoc de Dunn. Os dados paramétricos foram apresentados como média e erro‐padrão da média e as variáveis com distribuição normal foram avaliadas pelo teste t de Student (massa corporal relativa e atividade da colinesterase). Todos os testes consideraram um intervalo de confiança de 95%. As análises estatísticas foram feitas pelo Statistics Software Package (SPSS versão 25.0 para Windows, SPSS Inc., Chicago, IL, EUA).
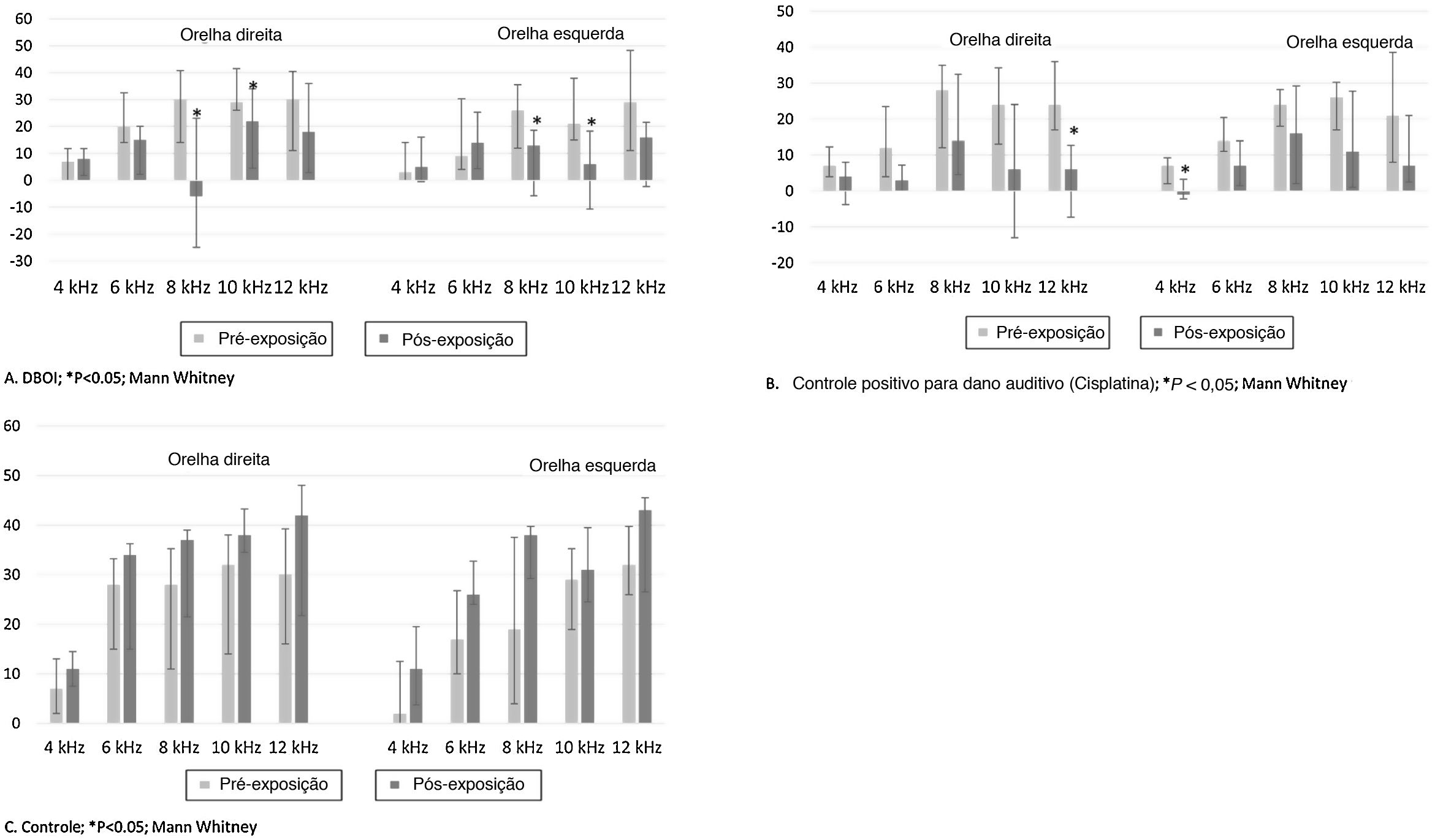
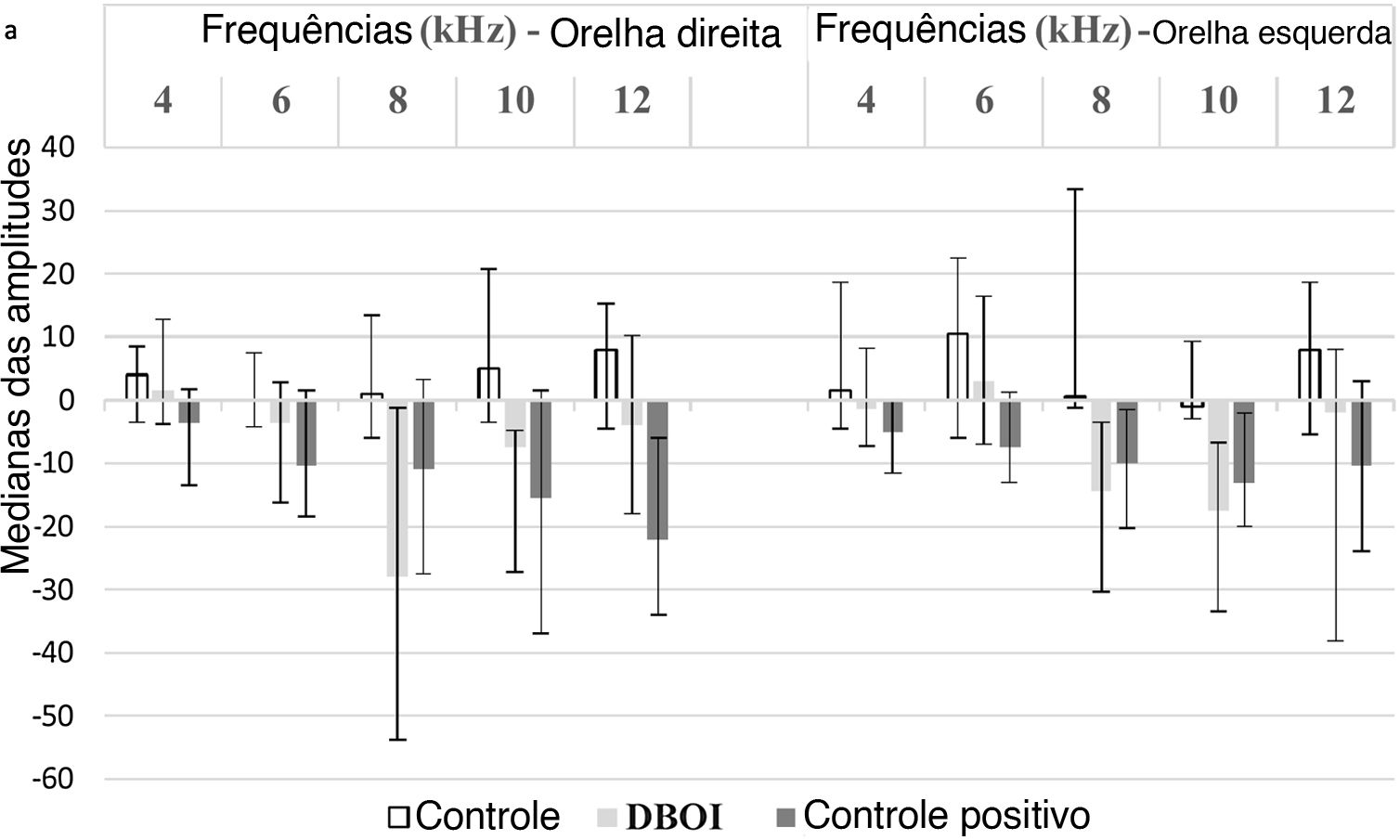
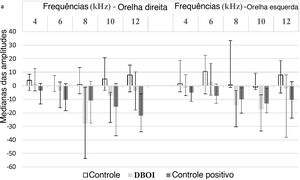
ResultadosA exposição ao DBOI reduziu significativamente as EOAPD pós‐exposição (p <0,05; teste de Mann‐Whitney) em comparação com as medidas pré‐exposição (fig. 1) nas frequências 8 e 10kHz em ambas as orelhas (p=0,034 e 0,045 na orelha direita e p=0,015 e 0,013 na orelha esquerda, respectivamente). Além disso, o tratamento com cisplatina reduziu significativamente as EOAPD (fig. 1) nas frequências de 12kHz (p=0,006) na orelha direita e 4kHz na orelha esquerda (p=0,032). O grupo controle não apresentou diferença significativa (p> 0,05; teste de Mann‐Whitney) nas avaliações pós‐exposição em relação à pré‐exposição (fig. 1), confirmou‐se a padronização do modelo experimental. Houve diferença estatisticamente significante entre os grupos (p <0,05; Kruskal‐Wallis) em relação à variação das medianas pós e pré‐exposição (fig. 2).
De acordo com o valor de p apresentado na tabela 1, o grupo DBOI apresentou diferença significativa (p <0,05) do grupo controle na frequência de 8kHz na orelha direita e nas frequências de 8kHz e 10kHz na orelha esquerda. Embora na frequência de 10kHz na orelha direita a análise tenha demonstrado diferença entre os grupos (p=0,026, Kruskal‐Wallis), a comparação das médias não identificou quais grupos diferiram dos demais. O grupo cisplatina apresentou diferença significante em relação ao grupo controle na frequência de 8kHz na orelha esquerda e em relação ao grupo DBOI na frequência de 12kHz na orelha direita (tabela 1).
Testes de Kruskal‐Wallis e post hoc de Dunn
| Orelha | Frequência | Kruskal‐Wallis | Post hoc de Dunn | ||
|---|---|---|---|---|---|
| Controle × DBOI | Controle × Cisplatina | Cisplatina × DBOI | |||
| Direita | 4 kHz | p=0,109 | |||
| 6 kHz | p=0,199 | ||||
| 8 kHz | p=0,045 | p=0,040 | |||
| 10 kHz | p=0,026 | p=0,053 | p=0,063 | p=1,000 | |
| 12 kHz | p=0,017 | p=0,014 | |||
| Esquerda | 4 kHz | p=0,183 | |||
| 6 kHz | p=0,146 | ||||
| 8 kHz | p=0,004 | p=0,005 | p=0,039 | ||
| 10 kHz | p=0,014 | p=0,013 | |||
| 12 Hz | p=0,136 | ||||
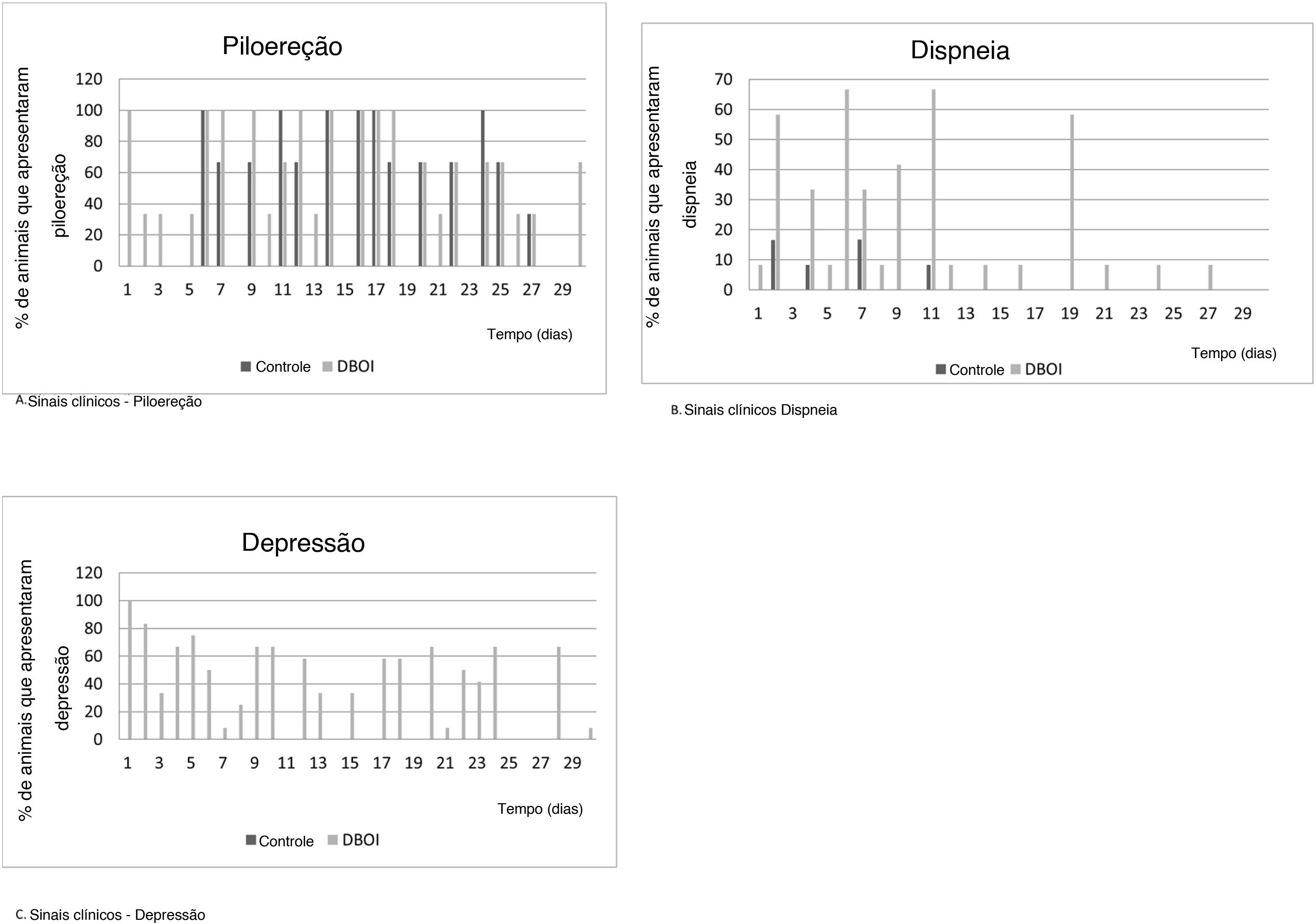
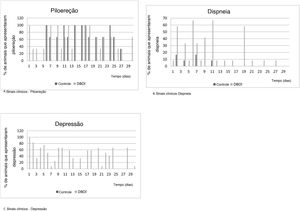
O ganho de massa corporal relativo (média±erro‐padrão) no período foi semelhante (p=0,328; teste t de Student) entre os grupos controle (145,3±5,93%) e o DBOI (154,1±5,91%). Entretanto, os animais de ambos os grupos apresentaram sinais clínicos transitórios, como piloereção e dispneia. Os sinais clínicos (fig. 3) foram mais evidentes no início da exposição (entre 30 e 240 minutos) e nas duas primeiras semanas, mas apenas os animais expostos ao DBOI apresentaram depressão transitória (evidenciada por sonolência e diminuição da resposta a estímulos) que durou até a quarta semana.
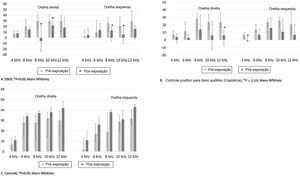
Ao analisar os comportamentos no teste Open Field, os animais expostos ao com DBOI não diferiram do controle em nenhuma das características analisadas (latência para se mover do primeiro quadrante (p=0,765; teste T de amostras independentes), cruzamento externo (p=0,299; teste T de amostras independentes), cruzamentos internos (p=0,569; teste T de amostras independentes), elevação nas patas traseiras (p=0,370; teste T de amostras independentes), limpeza (p=0,145; teste T de amostras independentes) Esses resultados explicam que a atividade locomotora espontânea foi normal e que o tratamento não causou danos aos animais.
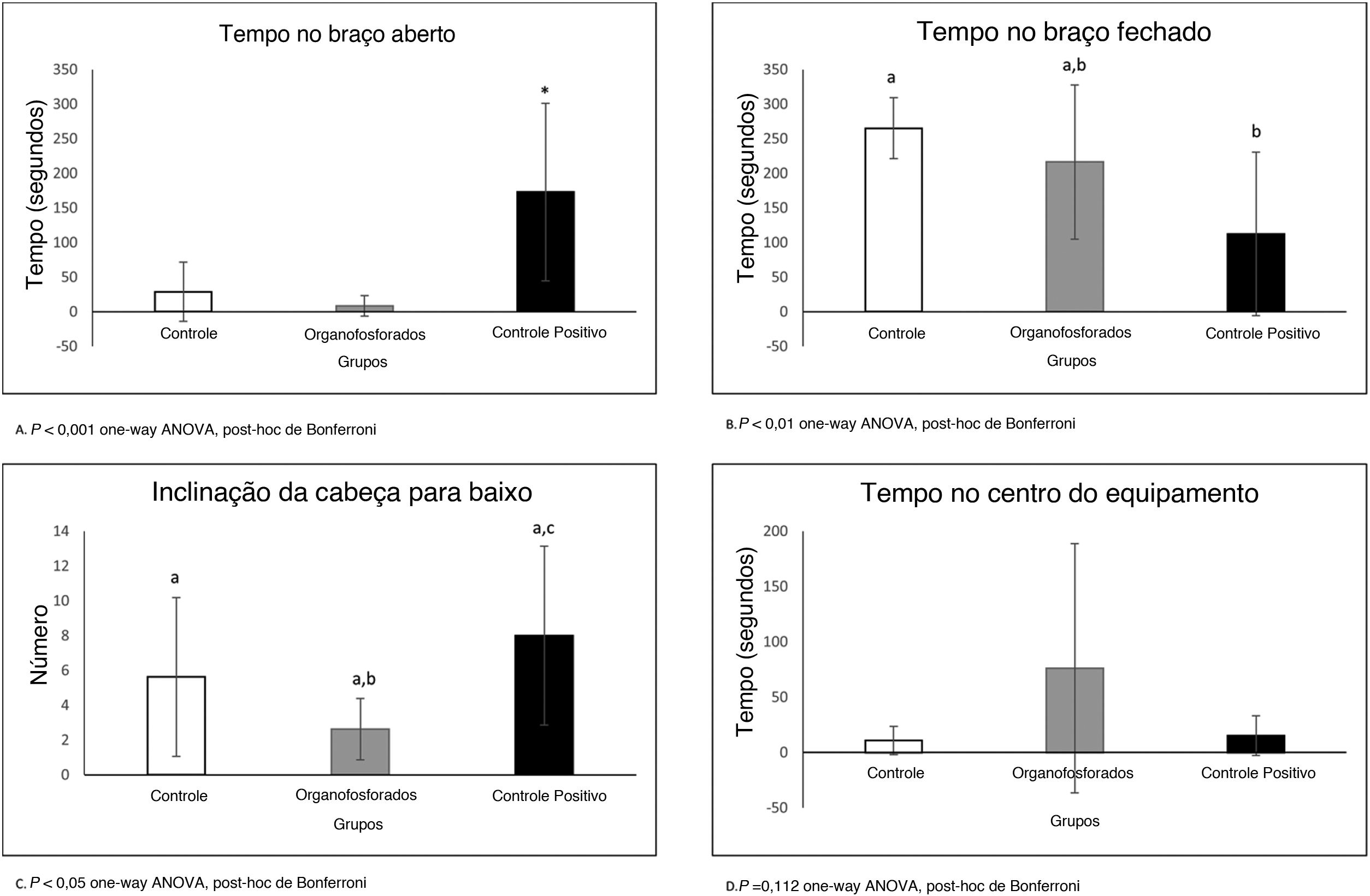
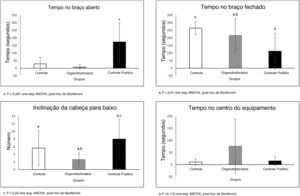
O teste Plus Maze (fig. 4) mostra que os animais tratados com controle positivo (Diazepam) passaram mais tempo no braço aberto (p <0,001 Anova one‐way, post‐hoc de Bonferroni). Os animais tratados com controle positivo ficaram menos tempo no braço fechado, mas os animais tratados com DBOI não diferiram do controle positivo (p <0,01 Anova one‐way, post‐hoc de Bonferroni). O tempo gasto no centro do aparelho não mostrou diferença entre os grupos (p=0,112; Anova one‐way, post hoc de Bonferroni). A inclinação da cabeça demonstra novamente a ação ansiolítica do controle positivo (p <0,05; Anova one‐way, post hoc de Bonferroni) e nenhuma diferença entre os grupos DBOI e controle positivo (p>0,05; Anova one‐way, post hoc de Bonferroni).
Os valores da colinesterase plasmática foram semelhantes (média±erro‐padrão: controle=5958,0±145,0 U/L; DBOI=5886,0±112,9 U/L, respectivamente, p=0,735; teste t de Student). Não foram encontradas alterações macroscópicas nos órgãos dos animais usados no protocolo experimental.
DiscussãoO presente estudo demonstrou a ototoxicidade induzida pela exposição subcrônica inalatória do produto organofosforado DBOI em ratos, que foi comparável ao dano coclear induzido por cisplatina. O protocolo de avaliação da ototoxicidade usado neste estudo foi consistente, se considerarmos que todos os grupos controle (positivos e negativos) demonstraram os comportamentos esperados. A escolha dos ratos como modelo experimental para o teste de EOAPD do protocolo é consistente com dados da literature, na qual se verificou que a EOAPD foi a avaliação auditiva mais frequentemente usada nos estudos analisados que usaram modelos animais, como ratos.24
O uso de um modelo animal no presente estudo permitiu identificar o desfecho investigado (ototoxicidade resultante da exposição a pesticidas por inalação), controlar possíveis vieses (exposição concomitante ao ruído). Além disso, a via de inalação em uma câmara acusticamente isolada, com uma frequência de exposição alternada que imita o dia útil (5: 2 dias), nos permitiu considerar que os efeitos observados aqui em ratos podem ser comparáveis aos relatados na literatura que envolveram agricultores.3,4,6
Além disso, estudos que avaliaram a função coclear por emissões otoacústicas frequentemente usavam anestésicos, o que foi relatado como uma causa provável de alterações nas respostas das EOAPD.25–27 No presente estudo, foi possível fazer as avaliações sem anestesia, devido à aclimatação prévia dos animais aos instrumentos usados nas avaliações auditivas. Além disso, o achado de ototoxicidade secundária após a exposição dos ratos ao DBOI corrobora estudos anteriores que avaliaram a audição de indivíduos que tiveram contato com pesticidas.6,28 No entanto, estudos em humanos podem apresentar algum viés, devido à dificuldade de isolar completamente o ruído e outros fatores de confusão inerentes à história clínica, como exposição a vibrações, ocorrência de doenças congênitas como toxoplasmose, herpes e rubéola ou até presbiacusia, já que os danos à audição podem ser multifatoriais.7
Os resultados pós‐exposição indicaram que, embora o diclorvos tenha sido um inibidor irreversível da colinesterase, a concentração da enzima no grupo experimental foi semelhante à do grupo controle. Esse fato sugere que níveis de exposição ao DBOI que não causam inibição enzimática significativa têm efeito ototóxico. Embora estudos tenham sugerido a associação entre dano auditivo e exposição a pesticidas,1,2,5,6,15,16 a norma regulatória atual no Brasil29 (NR7) não especifica exames auditivos de referência e sequenciais para trabalhadores expostos a agentes químicos e a exposição a pesticidas é avaliada por testes como o nível de colinesterase. Entretanto, nossos resultados indicam que – mesmo sem alteração nos níveis de colinesterase – houve ototoxicidade devido à exposição ao DBOI.
Em relação aos efeitos do tratamento subcrônico inalatório com DBOI nos testes de comportamento Open Field e Plus Maze, nesta pesquisa demonstramos que o DBOI administrado em ratos Wistar não foi uma droga ansiogênica e não teve impacto na atividade locomotora. No entanto, com outra via de administração (oral), Silva et al. (2017) obtiveram resultados diferentes em seu estudo,30 no qual ratos Wistar foram tratados com clorpirifós (0,01; 0,1; 1; e 10mg/kg/dia) nos dias gestacionais (14‐20). O comportamento da prole masculina foi avaliado nos dias 21 e 70 pós‐natal pelo teste Plus Maze elevado e Open Field. Os resultados demonstraram que a exposição a 0,1; 1; ou 10mg/kg/dia de clorpirifós podia induzir um comportamento ansiogênico, mas esse sinal foi revertido no dia pós‐natal 70.
Os poucos sinais clínicos manifestados pelos animais indicaram que a toxicidade sobre a função coclear, após a exposição ao DBOI, estava presente em um nível no qual os ratos não exibiam toxicidade sistêmica relevante – como no sistema nervoso central (baseado em testes de comportamento) – mas apenas transitório. Os sinais clínicos foram mais frequentes nas primeiras horas de exposição, bem como nas primeiras semanas de exposição, sem aparecimento nas últimas duas semanas, o que sugere uma possível tolerância progressiva à mesma concentração da substância. Além disso, as alterações transitórias foram reforçadas por resultados semelhantes entre os grupos quanto ao desenvolvimento do peso.
A diferença estatisticamente significante entre o grupo controle e o controle positivo para lesão era esperada, uma vez que a ototoxicidade da cisplatina está bem estabelecida na literatura.19,31–36 Além disso, a redução da amplitude das EOAPD entre o grupo experimental e o grupo controle indicou que a exposição à substância OF realmente pode danificar a função coclear dos animais. A alteração dos valores da função coclear antes e após a exposição ao DBOI corrobora a literatura anterior, na qual foram verificadas alterações na morfologia coclear de porquinhos da índia devido à exposição a uma substância OF (0,3mg/kg/dia ou 3mg/kg/dia durante sete dias consecutivos, por via intraperitoneal), com alteração na citoarquitetura das células ciliadas externas.16 Essa hipótese é reforçada pela literatura anterior.37,38 Ela indicou que a exposição a inseticidas pode interagir ao nível coclear.
Embora o teste de EOAPD não avalie a perda auditiva em si, a atividade das células ciliadas externas pode ser referida aqui. Destacamos que a bilateralidade dos danos em 8 e 10kHz no grupo experimental é uma das características da perda auditiva neurossensorial secundária à exposição a substâncias ototóxicas. Além disso, as frequências afetadas em animais expostos ao DBOI são consideradas altas, o que também se assemelha à perda auditiva induzida por agente tóxico. Por outro lado, a ocorrência de perdas nas altas frequências de 8 e 10kHz bilateralmente, mas não em 12kHz, é intrigante e nenhum resultado semelhante foi encontrado na literatura consultada. Isso pode ser justificado pelo fato de que geralmente os estudos com EOAPD1,39 não consideram a frequência de 12kHz e isso pode ocorrer devido à limitação do equipamento utilizado.
O mecanismo da perda auditiva após a exposição aos organofosfatos ainda não foi totalmente elucidado.2 A ototoxicidade secundária a algumas substâncias, como gentamicina e cisplatina, tem sido relacionada a possíveis alterações nas funções antioxidantes nas células sensoriais do órgão de Corti, especialmente nas células ciliadas externas, devido à peroxidação lipídica.40
Este estudo tem potenciais limitações. Embora o teste de potencial evocado auditivo do tronco encefálico (PEATE) seja um melhor indicador da função coclear e presença de deficiência auditiva do que as EOAPD, o teste PEATE não foi feito, uma vez que o equipamento estava em um edifício inacessível aos animais. As EOAPD puderam ser feitas, uma vez que o equipamento é portátil e pode ser levado até o local onde os animais estavam alojados. Além disso, o equipamento da instituição não tinha a função de triagem do PEATE (PEATE‐a). A segunda limitação é a falta de pesquisas anteriores analisando frequências como 10kHz e 12kHz, o que dificulta a comparação de nossos resultados com outros achados (como a diferença estatística em 8kHz e 10kHz no grupo DBOI, mas não a 12kHz). Outra limitação é que a avaliação das EOAPD sem a mensuração de enzimas antioxidantes no sistema auditivo não permite afirmar que a ototoxicidade relacionada ao DBOI poderia ser causada por disfunção nas enzimas antioxidantes; entretanto, sugere que isso possa estar relacionado, pois a diminuição ou ausência de EOAPD pode indicar danos na função das células ciliadas. Para esclarecer completamente esse mecanismo, serão necessários novos estudos de pesquisa funcional, associados a métodos que avaliem as enzimas antioxidantes e a morfologia das células ciliadas, como microscopia eletrônica de varredura ou até microscopia de fluorescência.
ConclusãoO DBOI, inseticida organofosforado à base de diclorvos, causou ototoxicidade nos animais avaliados, comparável ao dano induzido pela cisplatina nas EOAPD, sem efeitos sistêmicos significativos, com perda nas frequências de 8 e 10kHz bilateralmente.
FinanciamentoO presente estudo foi financiado em parte pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Código Financeiro 001.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Thiago Andrei Wenzel pelos esforços e contribuições na revisão deste artigo.
Como citar este artigo: Reis A, Cunha EO, Valle MT, Machado MS, Dallegrave E. Effects of subchronic inhalation exposure to an organophosphorus insecticide compound containing dichlorvos on wistar rats’ otoacoustic emissions. Braz J Otorhinolaryngol. 2022;88:28–35.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.