A lesão do nervo facial é uma condição que causa problemas funcionais, psicológicos e cosméticos e os métodos de tratamento precisam ser melhorados.
ObjetivoInvestigamos a eficácia da fibrina rica em plaquetas preparada com titânio como um intensificador de cura na transecção do nervo facial.
MétodoVinte e sete coelhos machos da raça New Zealand foram usados neste estudo, divididos em três grupos experimentais. Grupo 1, o grupo simulado (n=7); Grupo 2, o grupo de sutura (n=10); e Grupo 3, o grupo sutura+fibrina rica em plaquetas preparada com titânio (n=10). No Grupo 1, o tronco do nervo facial foi dissecado e nenhuma intervenção cirúrgica adicional foi feita. No Grupo 2, uma secção transversal foi feita no tronco do nervo facial e as terminações nervosas foram suturadas. No Grupo 3, as terminações nervosas foram suturadas após a transecção e uma membrana de fibrina rica em plaquetas preparada com titânio foi envolvida em um tubo ao redor da área danificada. Todos os animais foram acompanhados semanalmente quanto à presença do reflexo corneal, movimento dos bigodes e orelhas baixas. A eletromiografia facial bilateral foi feita no pré e pós‐operatório na 1ª, 3ª, 5ª, 7ª e 10ª semanas. Amostras de tecido obtidas na 10ª semana foram examinadas histopatologicamente e comparações intra‐ e intergrupos foram feitas.
ResultadosOs animais do Grupo 1 apresentaram melhoria no movimento dos bigodes e orelhas baixas uma semana antes do Grupo 2. No Grupo 3, o limiar de estimulação do nervo necessário para acionar o potencial de ação muscular composta retornou a valores semelhantes aos valores de controle pré‐operatório (11,31± 2,16 volts) em 5 semanas de pós‐operatório (12,51±3,97 volts), (p=0,249).
ConclusãoA administração de fibrina rica em plaquetas preparada com titânio contribuiu para a cicatrização parcial do nervo ao nível funcional e eletrofisiológico.
O nervo facial é um nervo periférico importante devido ao seu papel em várias funções. Danos ao nervo facial podem causar problemas funcionais, estéticos e psicológicos. Nos últimos anos, não houve desenvolvimento significativo no tratamento cirúrgico de reparo de nervos periféricos e os resultados funcionais desse reparo ainda não são perfeitos.1 Portanto, tratamentos opcionais que melhorem a cicatrização do nervo são necessários, além do tratamento cirúrgico.2
Nos últimos anos, o uso de produtos ricos em plaquetas tornou‐se generalizado nos campos da medicina e odontologia. A fibrina rica em plaquetas (FRP) foi originalmente desenvolvida por Choukroun em 2001, chamou a atenção para o potencial dos produtos ricos em plaquetas.3 Fatores de crescimento e citocinas resultantes da ativação de plaquetas são aprisionados na rede de FRP durante a centrifugação. Durante a cicatrização da ferida, esses fatores são liberados lentamente ao longo do tempo,4,5 aceleram a cicatrização óssea e da ferida e melhoram a qualidade da cicatrização.6 Entretanto, os estudos que mostram os efeitos da FRP na regeneração de nervos são limitados. Além disso, alguns autores argumentam que os leucócitos são protegidos na membrana de FRP e esses leucócitos são eficazes na prevenção de infecções e contribuem para a regulação do sistema imunológico.7
A FRP foi modificada por Tunalı et al., que usaram tubos de titânio com alta biocompatibilidade para evitar problemas relacionados à sílica durante a coleta de sangue.8 Embora a FRP obtida com o tubo de titânio seja semelhante à FRP clássica descrita por Choukroun, a estrutura da rede de fibrina é mais espessa e altamente organizada.9
Este estudo tem como objetivo avaliar em um modelo de coelho os efeitos funcionais, eletrofisiológicos e histopatológicos da fibrina rica em plaquetas preparada em titânio (T‐FRP) que inclui vários fatores de crescimento na regeneração do nervo facial.
MétodoProcedimento cirúrgicoA pesquisa foi feita no Surgery Research and Application Center com aprovação do comitê de ética local de experimentação animal sob o número de protocolo 2017/23. Vinte e sete coelhos machos da Nova Zelândia com nervos faciais bilaterais normais, cada um com peso entre 2.000‐3.000g, foram mantidos em condições padrão (21‐22° C, ciclo claro/escuro de 12 horas) sem restrições de alimentação ou água. Os animais experimentais foram divididos aleatoriamente em três grupos: Grupo 1, o grupo simulação (n=7); Grupo 2, o grupo de sutura (n=10); e Grupo 3, o grupo sutura+T‐FRP (n=10).
Profilaticamente, 20–40mg/kg de cefazolina sódica foram administrados por via intramuscular aos animais uma hora antes e uma hora após o procedimento. A anestesia geral foi fornecida com cloridrato de cetamina 35mg/kg e cloridrato de xilazina 5mg/kg por via intramuscular.
O procedimento experimental foi feito no nervo facial direito de cada animal. Após limpeza da área cirúrgica com solução de iodopovidona a 10%, foi feita uma incisão pré‐auricular direita de aproximadamente 5cm através da pele e do tecido subcutâneo. A parte massetérica do músculo esfíncter superficial do pescoço foi cruzada e o ramo bucal do nervo facial tornou‐se visível acima do músculo masseter. O ramo bucal foi seguido em direção à parte proximal. O tronco do nervo facial foi identificado entre o ponto de saída do forame estilomastóideo e a região de bifurcação.
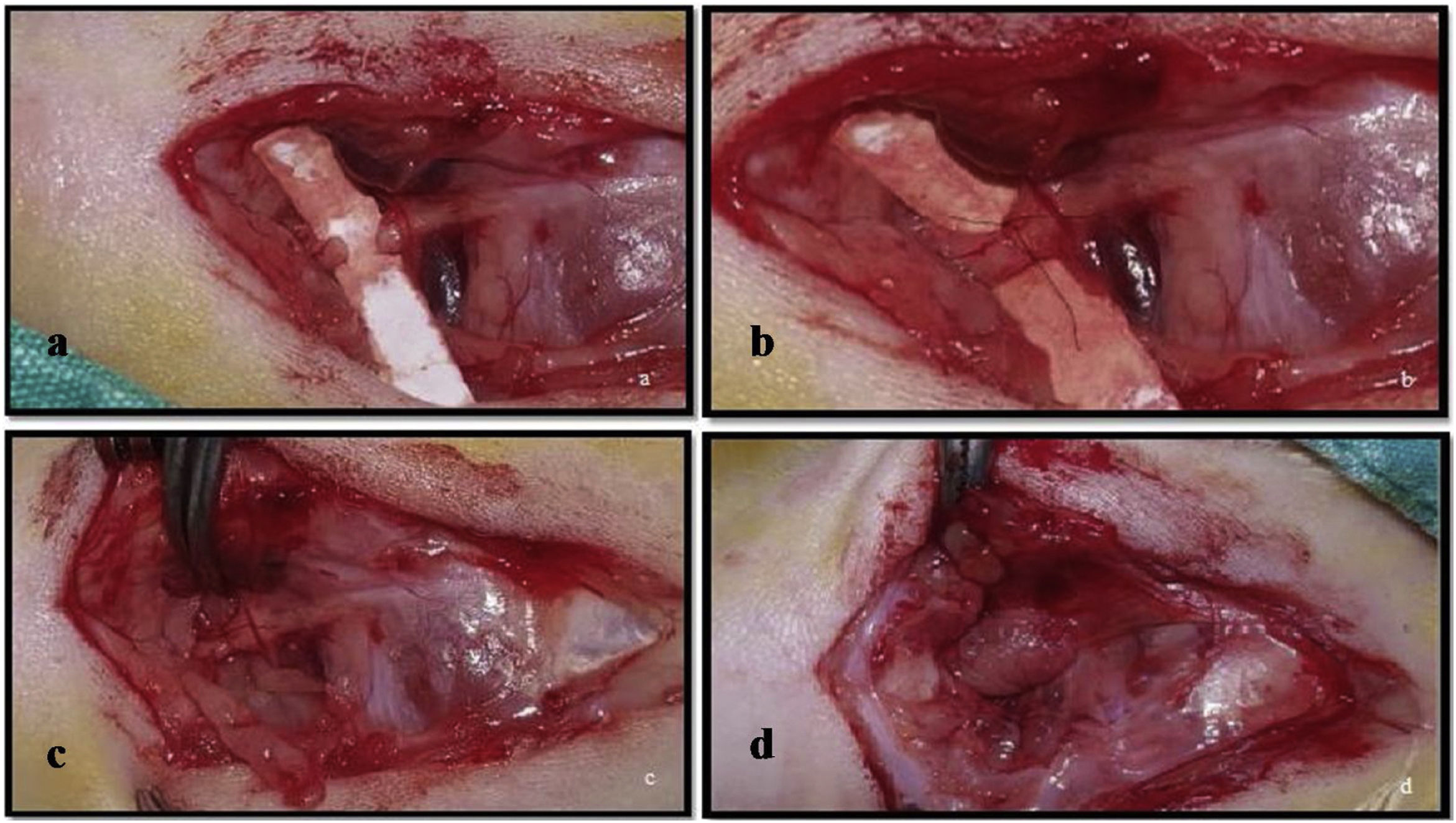
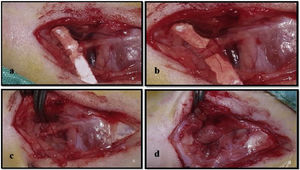
Após a exposição e dissecção do nervo no Grupo 1, a pele foi suturada com fio de seda 4.0 (ipek/seda USP 4/0, Doğpa Tıbbi Malzeme Tic. A.Ş., Turquia) sem qualquer tratamento. No Grupo 2, foi feita uma secção transversal do tronco nervoso com microscópio cirúrgico e instrumental microcirúrgico (fig. 1a). O tronco nervoso foi então suturado com microsutura 9.0 (Daylon® USP 9/0, Doğpa Tıbbi Malzeme Tic. A.Ş., Turquia) e duas suturas epineurais foram feitas a 0 e 180 graus (fig. 1b). No Grupo 3, após a transecção e sutura do nervo com microssutura 9.0, como feitas no Grupo 2, o T‐FRP foi envolvido em torno do nervo de cada animal em formato de tubo acima da área suturada (fig. 1c‐d).
Preparação da T‐PRFPara cada animal do Grupo 3, 10mL de sangue foram removidos da artéria marginal direita ou esquerda da orelha. O sangue coletado foi rapidamente transferido para dois tubos de titânio de 5mL e centrifugado a 3.500rpm por 15 minutos em temperatura ambiente com uma centrífuga de mesa (NF 400, Nuve, Turquia).10 Após a centrifugação, o coágulo (T‐FRP) obtido foi retirado dos tubos de titânio com pinça estéril. O coágulo resultante foi separado dos glóbulos vermelhos, esmagado entre compressas de gaze e transformado em uma membrana.
Avaliação funcionalApós a cirurgia, o movimento dos bigode, a queda da orelha e o reflexo da córnea de cada animal foram registrados semanalmente pelo mesmo observador. A avaliação do reflexo da córnea usou a escala de classificação de 5 pontos identificada por Borin et al.:11 0, nenhum movimento de fechamento visível; 1, estreitamento da fenda palpebral menor do que 1/3; 2, estreitamento da fenda palpebral entre 1/3 e 2/3; 3, estreitamento da fenda palpebral superior a 2/3; 4, fechamento do olho completamente ao tocar a córnea.
O movimento do bigode e a queda da orelha foram avaliados semanalmente como presentes ou não.
Avaliação eletrofisiológicaForam feitos seis exames de eletromiografia (EMG) facial bilaterais, antes da cirurgia e na 1ª, 3ª, 5ª, 7ª e 10ª semanas de pós‐operatório pela mesma pessoa. Anestesia foi aplicada a todos os animais durante o procedimento. Um estímulo foi dado com um módulo estimulador BSLSTM (BIOPAC® Systems Inc., EUA) na linha do tronco do nervo facial abaixo do forame estilomastoideo com um eletrodo de duas sondas. O nível de limiar de alerta supramáximo foi determinado aumentando‐se a intensidade de alerta em unidades de 1 volt. As amostras foram obtidas com eletrodos de agulha de três pontos de músculos mímicos na área dos bigodes. O software Biopack Student Lab Pro 3.7.7. e o hardware Biopack MP36 (BIOPAC® Systems Inc., EUA) foram usados para o registro.
A quantidade de estímulo dada para determinar o nível de limiar de alerta do nervo facial, valores de amplitude máxima do potencial de ação muscular composto (PAMC) e velocidade de condução nervosa foram medidos.
Avaliação histopatológicaTodo o tronco do nervo facial direito do animal foi dissecado dos tecidos circundantes sob anestesia para avaliação histopatológica. O tronco foi removido a 5mm proximal e 5mm distal à região da incisão. O tronco do nervo facial esquerdo (isto é, que não foi submetido ao procedimento cirúrgico) foi exposto e uma parte que media 1cm foi excisada. Em seguida, a eutanásia de todos os animais foi feita por exsanguinação através de uma incisão na artéria carótida direita ou esquerda.
Os tecidos foram fixados em formaldeído a 10% por 48 horas para análise por microscópico óptico. Após a fixação, os tecidos foram lavados em água corrente por 24 horas. Após serem submetidos a soluções de álcool de grau crescente (70%, 90%, 96%, 100%) para desidratação, foram submetidos a clarificação com solvente xileno e embebidos em blocos de parafina. Com a ajuda de um micrótomo totalmente automatizado (LEICA RM 2255, Tóquio, Japão), os blocos de parafina foram aparados em lâminas de 10μm até que o tecido fosse alcançado e seções de 5μm foram retiradas do tecido. A coloração com hematoxilina e eosina foi usada para observar a estrutura histológica geral.
Congestão vascular, edema, vacuolização, acúmulo de colágeno, degeneração de mielina e axônio, continuidade axonal, células inflamatórias, fibrose e proliferação de células de Schwann foram avaliadas semiquantitativamente (para continuidade axonal 1: contínua, 2: moderada, 3: fraca; para proliferação de células de Schwann 0: nenhuma, 1: grave, 2: moderada, 3: leve; para outros parâmetros 0: nenhum, 1: leve, 2: moderado, 3: grave). Um microscópio óptico (Olympus® BX 51, Japão) com câmera digital acoplada (Olympus® DP 71, Japão) foi usado para tirar fotos e fazer medidas com aumento de 40x. A espessura da bainha de mielina foi medida com o program Olympus Database Manual cellSens Life Science Imaging Software, versão 510_UMA _Database_cellSens19‐Krishna‐en‐00.
Análise estatísticaTodos os dados foram analisados com o programa estatístico SPSS 22.0. O teste de Wilcoxon e a análise de variância de Kruskal‐Wallis foram usados na avaliação histopatológica. A análise post hoc foi feita com o teste U de Mann‐Whitney e os valores de p obtidos na análise post hoc foram interpretados com a correção de Bonferroni. O teste t de Student, a análise de variância bidirecional e a análise de variância de medidas repetidas foram usados na avaliação fisiológica. O teste de Dunnett foi usado para o cálculo post hoc da análise de variância bidirecional; o valor de p <0,05 foi considerado estatisticamente significante.
ResultadosQuatro dos animais (2 no Grupo 1 e 2 no Grupo 2) morreram durante os procedimentos. Nenhuma outra complicação foi observada. Os resultados do estudo desses animais foram incluídos na análise até a semana de sua morte.
Achados funcionaisNo Grupo 1, os reflexos da córnea não diferiram entre antes e depois da cirurgia. Nas semanas seguintes à cirurgia nos Grupos 2 e 3, observou‐se melhoria do reflexo corneal. Nos seguimentos semanais, não houve diferença estatisticamente significativa no reflexo da córnea entre esses dois grupos.
No Grupo 2, houve queda na orelha direita em todos os animais nas primeiras três semanas. A queda da orelha começou a apresentar melhoria na semana 4 e melhorou todos os animais na semana 7. No Grupo 3, a queda da orelha direita começou a melhorar na semana 3 e apresentou melhoria completa na semana 5.
No Grupo 2, movimento perceptível do bigode foi registrado a partir da semana 9. Por outro lado, isso foi observado a partir da semana 8 no Grupo 3. Na semana 10, o movimento dos bigodes foi verificado em sete dos oito animais do Grupo 2 e em 8 dos dez indivíduos do Grupo 3.
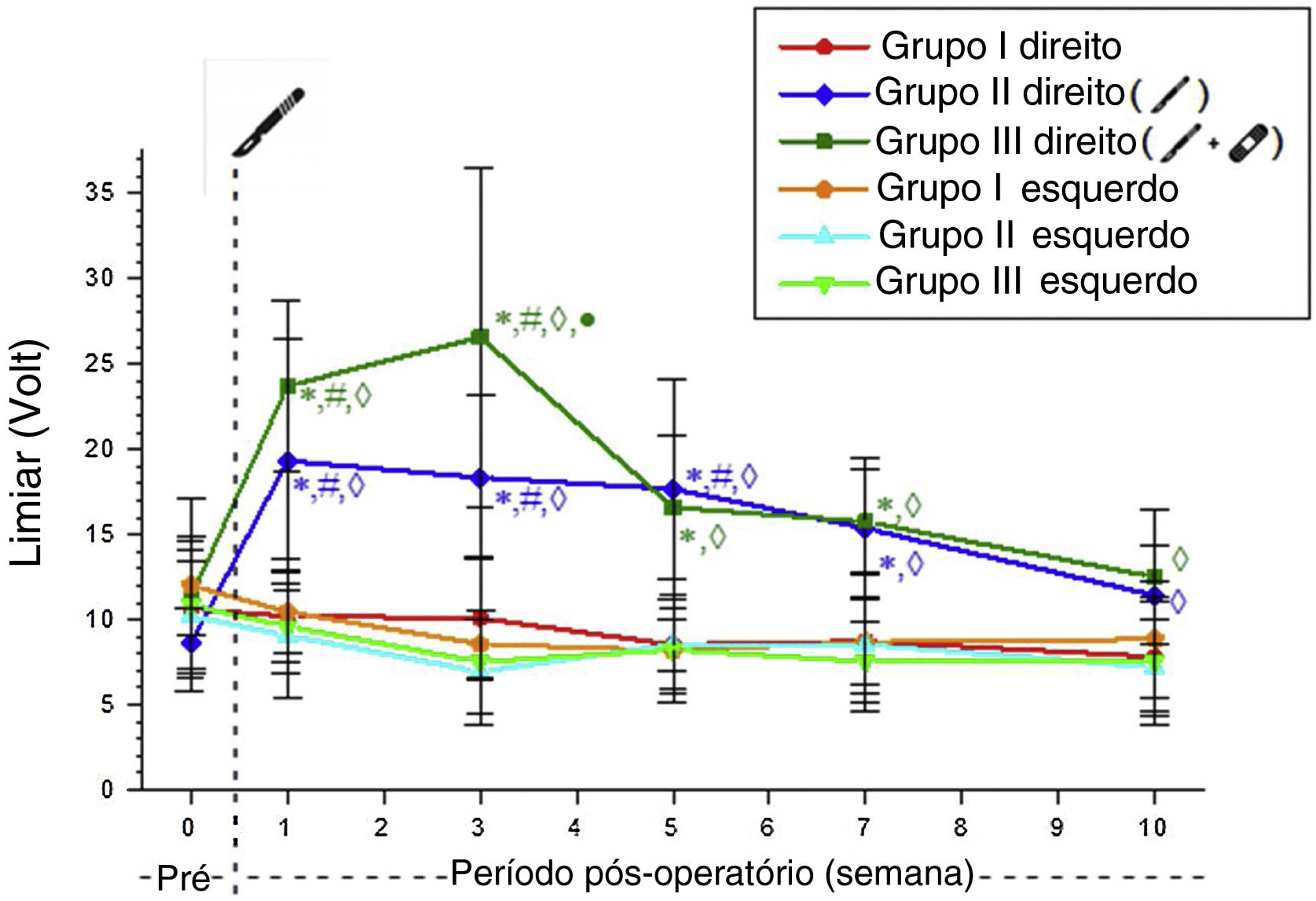
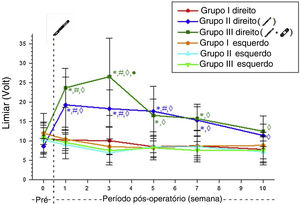
Achados eletrofisiológicosOs limiares de alerta do lado direito foram significativamente maiores nos Grupos 2 e 3 em comparação com o Grupo 1 até a semana 10. Esses valores não diferiram significantemente entre o Grupo 2 e o Grupo 3, exceto na 3ª semana de pós‐operatório (tabela 1).
Valores do limiar de alerta do lado direito dos grupos experimentais (média±DP, volt)
| Grupo 1 | Grupo 2 | Grupo 3 | ||||
|---|---|---|---|---|---|---|
| Direito | Esquerdo | Direito | Esquerdo | Direito | Esquerdo | |
| Pré‐operatório | 10,64±3,47 | 12,02±5,13 | 8,64±2,04 | 10,21±4,39 | 11,31±2,16 | 10,85±3,96 |
| 1a semana | 10,21±3,34 | 10,46±2,46 | 19,32±7,02 | 9,07±3,70 | 23,72±4,99 | 9,61±2,10 |
| 3a semana | 10,09±3,58 | 8,57±1,93 | 18,34±4,76 | 6,94±3,08 | 26,57±9,92 | 7,52±3,07 |
| 5a semana | 8,53±1,50 | 8,20±3,01 | 17,68±6,45 | 8,56±2,95 | 16,59±4,19 | 8,24±2,36 |
| 7a semana | 8,74±2,52 | 8,67±4,03 | 15,36±4,14 | 8,53±2,82 | 15,75±3,06 | 7,55±2,37 |
| 10a semana | 7,82±3,25 | 8,86±3,43 | 11,43±2,88 | 7,21±2,80 | 12,51±3,97 | 7,54±3,73 |
Após a incisão no lado direito do Grupo 2, o limiar de alerta aumentou substancialmente. O valor aumentado do limiar após a incisão não foi diferente dos valores de controle na 7ª semana de pós‐operatório nesse grupo. No Grupo 3, o valor aumentado do limiar após a incisão não diferiu dos valores de controle na 5ª semana de pós‐operatório. O limiar de alerta do Grupo 3 foi recuperado duas semanas antes do que no Grupo 2 (tabela 2, fig. 2).
Comparação dos valores do limiar de alerta pós‐operatório do lado direito com os valores pré‐operatórios dentro dos grupos (p‐valor)
Médias dos valores do limiar de alerta dos grupos experimentais. * Significantemente diferente comparado ao Grupo 1 (p <0,05). # Significantemente diferente comparado com a semana pré‐operatória (p <0,05). ◊ Significantemente diferente comparado ao lado esquerdo (p <0,05); • Significantemente diferente comparado ao Grupo 2 (p <0,05).
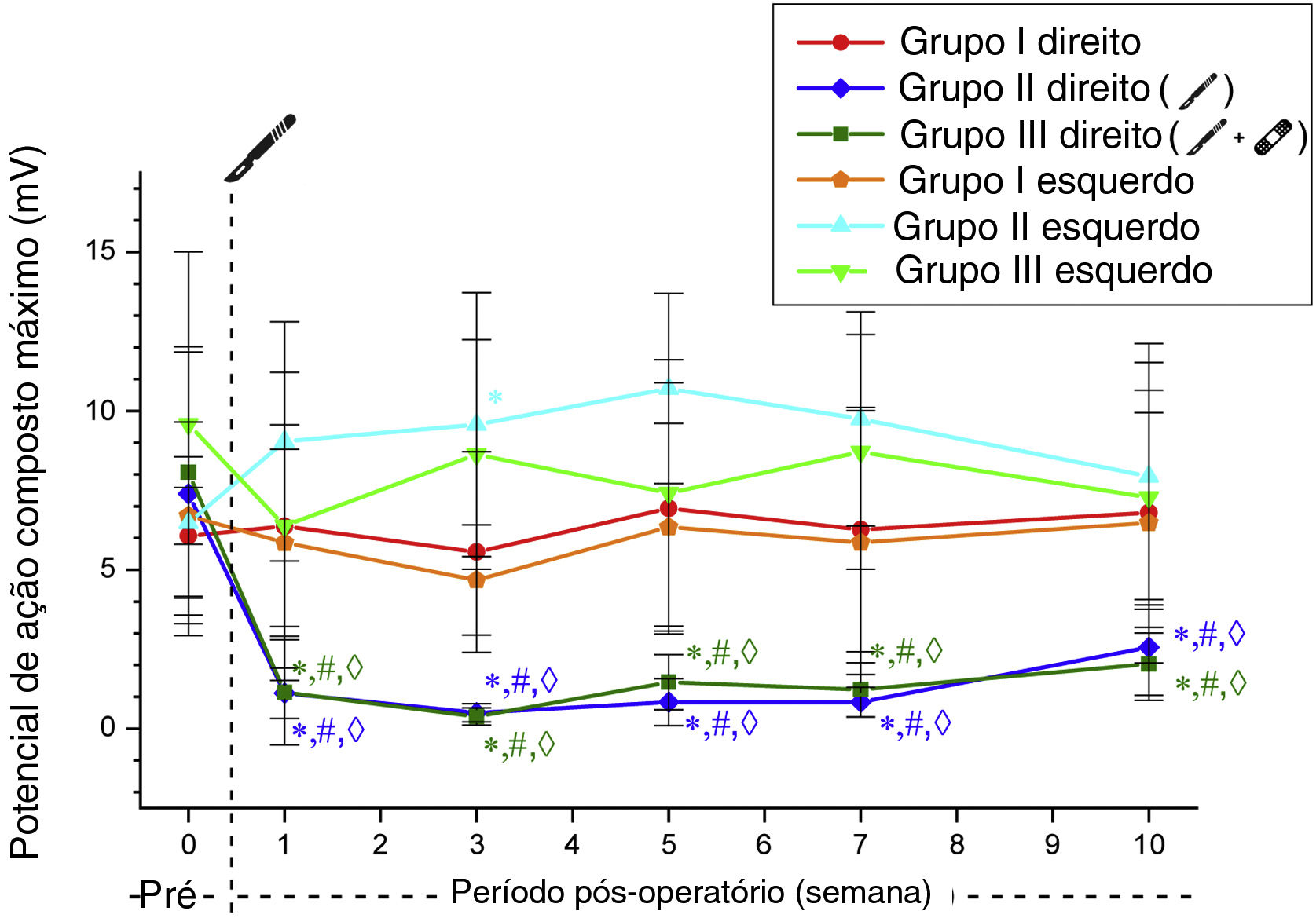
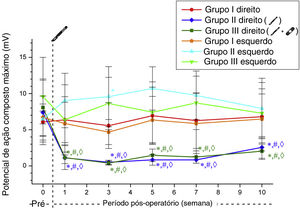
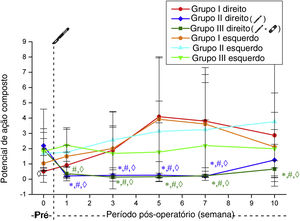
Os valores de amplitude máxima de PAMC obtidos no lado direito diminuíram após a cirurgia nos Grupos 2 e 3. Esses valores foram significantemente menores do que no grupo simulação e seus valores de controle do pré‐operatório em todas as semanas (p <0,05). Os valores de amplitude máxima de PAMC no lado direito nos Grupos 2 e 3 não diferiram significantemente no seguimento semanal pós‐operatório (tabela 3, fig. 3).
Valores de amplitude máxima do PAMC dos grupos (média±DP) (milivolt)
| Grupo 1 | Grupo 2 | Grupo 3 | ||||
|---|---|---|---|---|---|---|
| Direita | Esquerda | Direita | Esquerda | Direita | Esquerda | |
| Pré‐operatório | 6,06±2,48 | 6,69±0,89 | 7,39±4,46 | 6,47±3,16 | 8,06±3,95 | 9,58±5,42 |
| 1a semana | 6,36±4,84 | 5,84±2,94 | 1,11±0,79 | 9,04±3,76 | 1,14±1,65 | 6,38±3,17 |
| 3a semana | 5,55±3,16 | 4,67±1,73 | 0,49±0,29 | 9,56±4,15 | 0,37±0,27 | 8,62±3,61 |
| 5a semana | 6,93±3,95 | 6,33±3,26 | 0,83±0,73 | 10,70±2,99 | 1,4±0,86 | 7,41±4,19 |
| 7a semana | 6,26±3,84 | 5,85±4,15 | 0,83±0,46 | 9,74±3,36 | 1,22±0,85 | 8,70±3,69 |
| 10a semana | 6,79±4,73 | 6,47±3,46 | 2,55±1,50 | 7,93±4,17 | 2,03±1,14 | 7,27±3,37 |
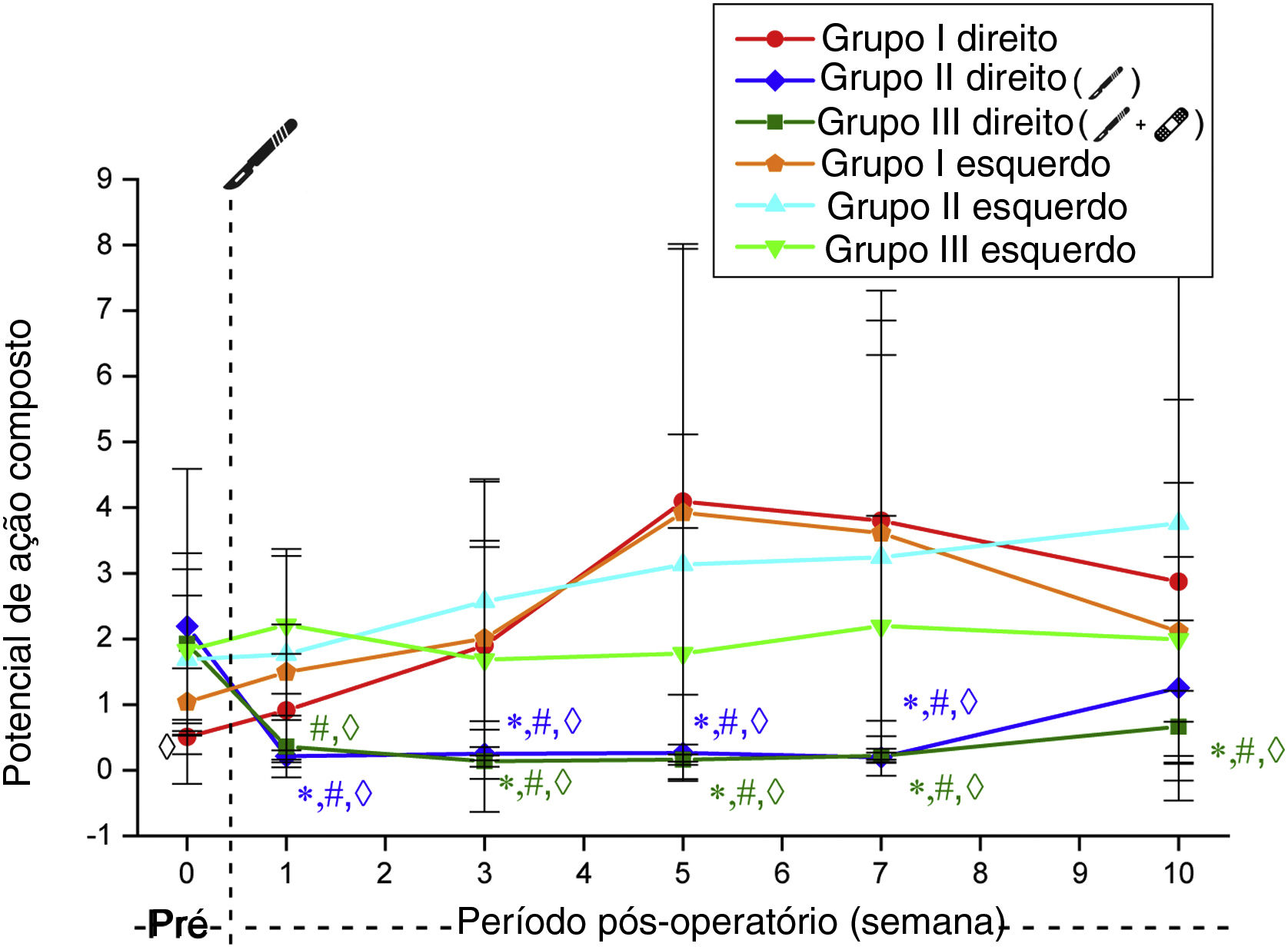
Da mesma forma, os valores de amplitude de PAMC no lado direito obtidos por estimulação supralimiar diminuíram após a cirurgia nos Grupos 2 e 3. No Grupo 2, esse valor não foi significantemente diferente de seus valores pré‐operatórios na semana 10 (p=0,478). No grupo 3, essa diminuição significativa do estado pré‐operatório persistiu ao longo de todas as semanas (p <0,05). Esses valores não diferiram significantemente nos seguimentos semanais pós‐operatórios nos Grupos 2 e 3 (tabela 4, fig. 4).
Valores de amplitude de PAMC desencadeados por estimulação acima do limiar (média±DP) (milivolt)
| Grupo 1 | Grupo 2 | Grupo 3 | ||||
|---|---|---|---|---|---|---|
| Direita | Esquerda | Direita | Esquerda | Direita | Esquerda | |
| Pré‐operatório | 0,50±0,27 | 1,04±0,51 | 2,19±2,39 | 1,68±0,97 | 1,92±1,38 | 1,82±1,23 |
| 1a semana | 0,91±0,86 | 1,49±0,72 | 0,21±0,09 | 1,76±1,60 | 0,36±0,47 | 2,21±1,04 |
| 3a semana | 1,90±2,53 | 2,00±1,39 | 0,25±0,10 | 2,57±1,82 | 0,13±0,08 | 1,68±1,81 |
| 5a semana | 4,09±3,85 | 3,92±4,08 | 0,26±0,13 | 3,13±1,98 | 0,16±0,77 | 1,77±1,91 |
| 7a semana | 3,80±3,04 | 3,61±3,69 | 0,19±0,07 | 3,24±3,08 | 0,22±0,10 | 2,19±1,67 |
| 10a semana | 2,87±2,77 | 2,11±2,26 | 1,25±1,03 | 3,76±4,22 | 0,66±0,54 | 1,99±1,25 |
Valores da amplitude de potencial de ação muscular composto desencadeados por estimulação acima do limiar. *Significantemente diferente comparado ao Grupo 1 (p <0,05). # Significantemente diferente comparado com a semana pré‐operatória (p <0,05). ◊ Significantemente diferente comparado ao lado esquerdo (p <0,05).
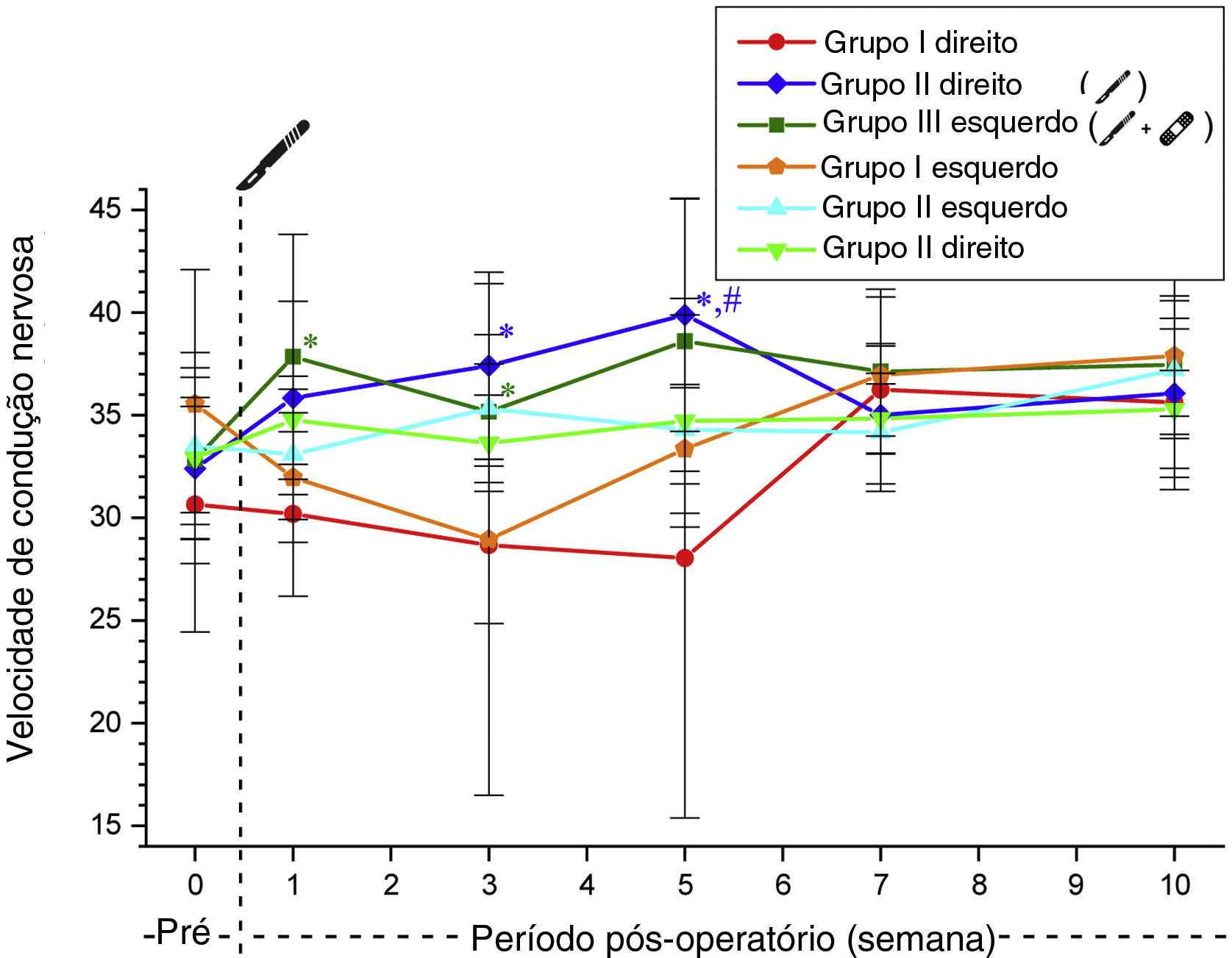
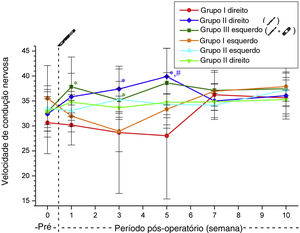
Não foi observada diferença significativa entre os Grupos 2 e 3 em relação aos valores da velocidade de condução nervosa antes e após a cirurgia (tabela 5, fig. 5).
Valores da velocidade de condução nervosa dos grupos (média±DP) (m/s)
| Grupo 1 | Grupo 2 | Grupo 3 | ||||
|---|---|---|---|---|---|---|
| Direita | Esquerda | Direita | Esquerda | Direita | Esquerda | |
| Pré‐operatório | 30,64±6,20 | 35,54±6,55 | 32,40±3,46 | 33,49±3,81 | 32,84±2,57 | 32,91±5,14 |
| 1a semana | 30,19±4,00 | 31,96±3,15 | 35,83±4,71 | 33,09±3,19 | 37,84±5,96 | 34,75±2,14 |
| 3a semana | 28,67±3,83 | 28,94±12,45 | 37,41±4,54 | 35,32±3,60 | 35,17±2,32 | 33,63±2,34 |
| 5a semana | 28,03±12,64 | 33,35±3,12 | 39,88±5,67 | 34,29±2,03 | 38,59±6,93 | 34,71±5,16 |
| 7a semana | 36,23±2,24 | 36,95±3,80 | 35,01±3,35 | 34,16±2,87 | 37,12±4,01 | 34,83±1,69 |
| 10a semana | 35,62±1,55 | 37,88±2,93 | 36,06±3,65 | 37,21±3,35 | 37,45±5,48 | 35,28±3,90 |
Menos vacuolização e edema foram observados semiquantitativamente no Grupo 3 do que no Grupo 2, mas essa diferença não foi estatisticamente significante. Nos Grupos 2 e 3, os achados de congestão vascular, infiltração de colágeno, células inflamatórias, vacuolização, edema, fibrose, proliferação de células de Schwann, degeneração da mielina e degeneração axonal foram significativamente maiores do que no Grupo 1; a continuidade axonal e a espessura da bainha de mielina foram nitidamente menores (tabela 6). Não houve diferença significante entre o lado direito do Grupo 2 e do Grupo 3 em relação a esses parâmetros.
Espessura da bainha de mielina dos grupos (média±DP)
| Grupo 1 (n=5) | Grupo 2 (n=8) | Grupo 3 (n=10) | ||||
|---|---|---|---|---|---|---|
| Direita | Esquerda | Direita | Esquerda | Direita | Esquerda | |
| Espessura da bainha de mielina (μm) | 2,88±0,31 | 3,040±0,48 | 1,08±0,29 | 2,61±0,32 | 1,03±0,27 | 2,50±0,28 |
| Análise post hoc dos resultados da espessura da bainha de mielina do lado direito entre os grupos | p‐valor | |||||
| Grupo 1 – Grupo 2 | 0,035a | |||||
| Grupo 1 – Grupo 3 | 0,002a | |||||
| Grupo 2 – Grupo 3 | 0,983 | |||||
A lesão do nervo facial pode se desenvolver como consequência de trauma ou cirurgia.12 No caso de lesão nervosa, o prognóstico é bastante ruim sem a ajuda de intervenção cirúrgica e outros agentes biológicos e a qualidade de vida é significativamente afetada devido a problemas funcionais.12,13
Os produtos ricos em plaquetas são classificados de diferentes maneiras de acordo com seus conteúdos e métodos de preparação; o primeiro deles é o plasma rico em plaquetas (PRP). Esse material, preparado com o uso de tubos que continham anticoagulantes, é amplamente usado em vários campos devido aos seus ricos fatores de crescimento.14 Muitos estudos usaram esse produto como um agente de cicatrização em lesões nervosas.15–17
A FRP, a segunda geração de produtos ricos em plaquetas, é frequentemente preferida porque, ao contrário do PRP, não requer anticoagulantes e é fácil de preparar e usar. São necessários pelo menos 8–10mL de sangue para obter uma membrana de FRP autógena de alta qualidade. A principal razão pela qual os modelos de coelhos foram selecionados para este estudo foi a facilidade de obtenção de uma quantidade suficiente de sangue para preparar o material T‐FRP apropriado. Além disso, a FRP foi preferida porque a membrana obtida tem uma estrutura forte e pode ser aplicada localmente na forma de um tubo.
A literatura mostra vários estudos clínicos e experimentais feitos com a T‐FRP. No estudo de Uzun et al., a T‐FRP demonstrou ser um método de tratamento eficaz e seguro em vários defeitos gengivais.18 Um estudo que comparou os usos da FRP clássica e do T‐FRP demonstrou que esses dois materiais têm efeitos clínicos e radiológicos positivos na recuperação de defeitos intraósseos.19 Também foi relatado que a T‐FRP aumenta a epitelização e reduz o sangramento na cicatrização de feridas na mucosa do palato.20
Embora existam muitos estudos que mostram que a FRP tem contribuições positivas para a cicatrização de ossos e feridas, um número limitado de estudos avaliou seu efeito na cicatrização de nervos. Nosso estudo documenta pela primeira vez na literatura que a T‐FRP demonstrou regeneração nervosa no nervo facial. Esse achado será benéfico para os pacientes na clínica, como um meio de baixo custo e de fácil acesso para reduzir complicações após traumas e cirurgias e proporcionar um melhor processo de recuperação.
Roth et al., em seus estudos que avaliaram a eficácia do enxerto de nervo autólogo versus o enxerto venoso revestido com FRP, não observaram diferença significante entre os dois grupos nos escores funcionais em um modelo de lesão por incisão do nervo ciático em ratos.21 Lichtenfels et al. encontraram uma relação com melhoria dos resultados de cicatrização em enxertos de nervo autólogo em ambos os grupos PRP e FRP em um modelo de lesão por incisão do nervo ciático em ratos.22 Torul et al. mostraram que os escores funcionais foram semelhantes nos grupos FRP e plasma rico em fatores de crescimento (PRGF) em um modelo de lesão do tipo compressão do nervo ciático em ratos.23 Senses et al. relataram que a aplicação local de FRP não demonstrou efeito positivo na avaliação funcional em um modelo de lesão por incisão do nervo ciático em ratos.1 Neste estudo, demonstramos que o uso da T‐FRP além das suturas acelera a cicatrização em termos de movimentos do bigode e queda da orelha.
Os testes eletrofisiológicos permitiram a avaliação da regeneração axonal em diferentes estágios da cicatrização e são um dos melhores métodos usados para avaliar a cicatrização de nervos periféricos.24 O prolongamento da latência é o aumento da intensidade de estimulação mínima necessária para desencadear um potencial de ação no músculo. Em outras palavras, o aumento do limiar do estímulo e a diminuição da amplitude da resposta ao estímulo de mesma intensidade refletem a deterioração da função neuromuscular. Após o dano ao nervo, espera‐se que a latência aumente, o limiar de alerta aumente e a amplitude diminua. Esses valores são prejudicados com a lesão do nervo e a aproximação desses valores em direção aos valores de controle com o tempo de recuperação são sinais de melhoria. Neste estudo, os EMGs repetidos foram feitos após a cirurgia com o objetivo de demonstrar eletrofisiologicamente o curso da recuperação.
Em suas medidas eletrofisiológicas, Torul et al. mostraram que a amplitude foi melhor no grupo FRP e que a FRP não contribuiu para o parâmetro da latência.23 No estudo de Bayram et al., o efeito positivo da aplicação local de FRP na amplitude e velocidade de condução não pôde ser demonstrado no modelo de lesão por compressão do nervo ciático em coelhos.25 De maneira similar, Senses et al. observaram que a FRP não contribuiu para a velocidade de condução nervosa e latência distal.1 Nesse estudo observou‐se que a aplicação local de FRP não contribuiu para a velocidade de condução nervosa, como nos estudos de Bayram e Senses. Além disso, o valor do limiar de estimulação do nervo necessário para desencadear o PAMC tornou‐se semelhante aos valores pré‐operatórios de controle na aplicação local de FRP na 5ª semana de pós‐operatório, uma melhoria de 2 semanas. Essa situação mostra que a T‐FRP contribui para a recuperação precoce do valor do limiar de alerta necessário para desencadear o PAMC. Em um estudo feito em ratos, foi demonstrado que o diâmetro do axônio e a espessura da bainha de mielina aumentam até 50 semanas após o reparo do nervo ciático.26 Contrariamente a isso, Farrag et al. expressaram que um período de recuperação de 8 semanas foi suficiente para observar resultados bem‐sucedidos no modelo de incisão do nervo facial em seu estudo em ratos.15
No estudo de Lichtenfels et al., a aplicação de FRP não contribuiu para o diâmetro do axônio, espessura da mielina ou a densidade das fibras nervosas.22 Roth et al. relataram que o uso de enxerto venoso revestido com FRP e enxerto de nervo autólogo tiveram resultados histopatológicos semelhantes,21 enquanto Torul et al. mostraram que a FRP não contribuiu para a espessura da bainha de mielina.23 Bayram et al. observaram remielinização, criação de formação vascular, dano aos axônios em grande escala e criação de formação de colágeno na avaliação histológica e relataram que esses achados foram mais aparentes no grupo de FRP.25 Senses et al. relataram que o uso de membrana de FRP após a incisão do nervo não contribuiu para a cura histológica.1 No presente estudo, determinou‐se que o uso de T‐FRP em adição às suturas não contribuiu para a cura histológica ou espessura da bainha de mielina. Esse resultado pode ser explicado pela hipótese de que a membrana do T‐FRP não impede a infiltração de colágeno, apesar de estimular a cicatrização de feridas na região, causa inflamação pelos leucócitos que contém e aumenta o tempo necessário para a conclusão da mielinização e regeneração axonal.
ConclusãoNeste estudo, a aplicação local da membrana de T‐FRP contribuiu positivamente para uma melhoria observável nos movimentos faciais relacionados ao nervo facial. Eletrofisiologicamente, foi observado que os achados do limite de alerta se recuperaram mais precocemente. Estudos com um período de seguimento mais longo com métodos padrão, nos quais os protocolos cirúrgicos e de tratamento podem ser refinados, podem ser benéficos para esclarecer os efeitos da FRP na cicatrização de nervos.
FinanciamentoEsta pesquisa recebeu suporte financeiro da Karadeniz Technical University Scientific Research Project Coordination Unit (Código do projeto: TTU‐2018‐6999).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Şentürk F, Bahadır O, Aktaş O, Bıyık AF, Ercan E. Effects of titanium prepared platelet rich fibrin on facial nerve regeneration: an experimental study. Braz J Otorhinolaryngol. 2022;88:867–74.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.