Os quimioterápicos à base de cisplatina desempenham papel importante no tratamento do câncer em diversos níveis e são os agentes ototóxicos mais citados quando analisadas evidências científicas.
ObjetivoApresentar evidências científicas com base em revisão sistemática da literatura (PRISMA), com o intuito de sistematizar informações sobre os efeitos ototóxicos do uso de medicamentos antineoplásicos.
MétodoPara a seleção dos estudos foi usada a combinação baseada no Medical Subject Heading Terms (MeSH). Foram usadas as bases de dados Medline (Pubmed), Lilacs, SciELO, Scopus, Web of Science e Bireme, sem restrição de idioma, período e localização. Foi feita avaliação da qualidade dos artigos, na qual se incluíam artigos com nota mínima 6 na escala modificada da literatura. Os desenhos dos estudos selecionados foram do tipo descritivo, coorte e transversal, os quais estavam relacionados com o objetivo da pesquisa.
ResultadosTrês artigos foram admitidos para esta revisão sistemática. A ototoxicidade causada pela cisplatina isoladamente variou de 45% a 83,3%, enquanto a causada pelo uso associado com a carboplatina variou de 16,6% a 75%. Verificou‐se uma variação significativa nas doses cumulativas desses antineoplásicos, tanto no uso isolado quanto em combinação. Alterações auditivas, principalmente em altas frequências, foram evidenciadas após finalização do tratamento.
ConclusãoAlterações auditivas após o uso de medicamentos antineoplásicos à base de platina foram constatadas, porém verificou‐se uma importante heterogeneidade quanto à frequência da ototoxicidade e a dose cumulativa das drogas usadas.
O câncer se configura em um problema de saúde pública e estimativas apontam que ocorrerão 625 mil novos casos de câncer no Brasil para cada ano do triênio 2020–2022.1 Mundialmente, segundo projeção da Agência Internacional de Pesquisa sobre o Câncer (IARC), filiada à Organização Mundial da Saúde (OMS), a incidência do câncer deve aumentar em até 63% nos próximos 20 anos, acometendo mais de 29 milhões de novas pessoas em 2040.2
A quimioterapia antineoplásica é um dos tratamentos sistêmicos do câncer que visa tratar neoplasias malignas e consiste no emprego de substâncias químicas isoladas ou em combinação, destacando‐se como o tratamento preferencial tanto para o sistema hematopoiético quanto para os tumores sólidos, que podem apresentar metástases regionais ou a distância. Os fármacos antineoplásicos ou quimioterápicos interferem nos mecanismos de sobrevivência, proliferação e migração celular, no entanto, atuam de forma não específica, podem lesar tanto células malignas quanto benignas.3 A quimioterapia, bem como as demais modalidades de tratamento oncológico, pode gerar efeitos colaterais aos pacientes e destaca‐se a ototoxicidade.4–8
A ototoxicidade é definida como um distúrbio transitório ou permanente da função auditiva e/ou
vestibular induzida por substâncias terapêuticas9 e manifesta‐se com perda auditiva, zumbido e/ou vertigem. No paciente oncológico está associada a um subgrupo de terapias antineoplásicas que incluem quimioterapia com platina, radiação ou cirurgia que envolvem a orelha e o nervo vestibulococlear, além de agentes de cuidados de suporte, como antibióticos aminoglicosídeos e diuréticos de alça, que também podem contribuir para a ototoxicidade.10
Os quimioterápicos à base de platina desempenham papel importante no tratamento do câncer em diversos níveis e são os agentes ototóxicos mais citados quando analisadas evidências científicas (as células ciliadas externas da cóclea são as estruturas mais afetadas),11 levam à perda auditiva e prejuízos na comunicação social.5 Fazem parte da lista de medicamentos antineoplásicos ototóxicos a vinscristina, doxorrubicina, gencitabina, ciclofosfamida, farmorrubicina, oxaliplatina,12,13 carboplatina14,15 e cisplatina.15–23 Esses medicamentos são geralmente usados em combinação de dois a quatro fármacos.
Entre as referidas drogas, a cisplatina é a mais usada. Os efeitos na cóclea podem incluir perda auditiva sensorioneural, bilateral, simétrica e irreversível.18,19,23 A incidência de perda auditiva em indivíduos tratados com quimioterápicos apresenta importante variação na literatura e esse fato se deve a fatores como frequências avaliadas, faixa etária dos pacientes, dosagem do medicamento, plano de administração da droga e critério adotado para análise da perda auditiva.23 Outros fatores que podem influenciar diretamente na ototoxicidade em função da quimioterapia consistem na suscetibilidade do tecido à droga, acúmulo da droga no órgão, inibição de funções fisiológicas normais, efeitos tóxicos diretos nos órgãos terminais sensoriais, sinergismo ototóxico, uso de outros medicamentos ototóxicos concomitantes e tratamento com radiação.24 A alteração auditiva decorrente dos tratamentos antineoplásicos por meio de medicamentos ototóxicos acomete pacientes de diferentes idades. Portanto, é importante que esses pacientes sejam submetidos a um monitoramento com testes audiológicos antes, durante e depois do tratamento.11,16,17
A partir do exposto, o presente estudo teve como objetivo apresentar evidências científicas, com base em revisão sistemática da literatura (PRISMA), sobre os efeitos ototóxicos de medicamentos antineoplásicos, visando responder às seguintes perguntas norteadoras da pesquisa: quais os efeitos e qual é a dose necessária para a ototoxicidade do uso de medicamentos antineoplásicos?
MétodoProtocolo e registroA presente revisão sistemática foi conduzida conforme as recomendações PRISMA (Preferred Reporting Items for Systematic reviews and Meta‐Analyses).25
As buscas por artigos científicos foram conduzidas por dois pesquisadores independentes nas bases de dados eletrônicas Medline (Pubmed), Lilacs, SciELO, Scopus, Web of Science, Scopus e Bireme, sem restrição de idioma, período e localização. Para complementar, foi feita uma busca manual nas referências dos artigos incluídos na pesquisa e busca por literatura cinzenta no Google Scholar.
A pesquisa foi estruturada e organizada na forma PICOS, que representa um acrônimo para população alvo, intervenção, comparação e outcomes (desfechos). População de interesse ou problema de saúde (P) corresponde a pacientes; intervenção (I) diz respeito aos antineoplásicos; comparação (C) corresponde aos medicamentos; outcome (O) refere‐se à ototoxicidade; e os tipos de estudos admitidos (S) foram: estudo descritivo, estudo transversal, estudo observacional, relatos de caso, estudos de caso‐controle, ensaios clínicos controlados e estudos de coorte (tabela 1).
Estratégia de pesquisaOs descritores foram selecionados a partir do dicionário Descritores em Ciências da Saúde (DeCS) e Medical Subject Heading Terms (MeSH), considerando o grande uso desses pela comunidade científica para a indexação de artigos na base de dados PubMed. Diante da busca dos descritores, foi feita a adequação para as outras bases usadas.
Em um primeiro momento foram propostas para as buscas os seguintes operadores booleanos e combinação de termos: (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]). A busca ocorreu de forma concentrada em outubro de 2020.
Critérios de elegibilidadeOs desenhos dos estudos com potencial de seleção foram dos tipos descritivo, transversal, observacional, de caso‐controle, de coorte, relatos de caso e ensaios clínicos controlados. Foram incluídos estudos sem restrição de idioma, período e localização. A tabela 2 representa os critérios de inclusão e exclusão desenvolvidos nesta pesquisa. Os estudos obtiveram pontuação maior do que 6 no protocolo modificado de Pithon et al.26 para avaliação da qualidade.
Síntese dos critérios de inclusão/exclusão
| Critérios de inclusão | |
|---|---|
| Delineamento | Estudo transversal |
| Estudos de caso‐controle | |
| Estudos de coorte | |
| Relatos de caso | |
| Estudos de intervenção | |
| Ensaios clínicos controlados | |
| Localização | Sem restrição |
| Idioma | Sem restrição |
| Critérios de exclusão | |
|---|---|
| Delineamento | Cartas ao editor |
| Diretrizes | |
| Revisões de literatura | |
| Revisões sistemáticas | |
| Revisão narrativa | |
| Metanálises | |
| Estudos | Estudos pouco claros |
| Mal descritos ou inadequados | |
| Forma de publicação | Apenas resumo |
Fonte: Desenvolvido pelos autores.
A qualidade dos métodos usados nos estudos incluídos foi avaliada pelos revisores de forma independente (PH e LFG), de acordo com a recomendação PRISMA.25 A avaliação priorizou a descrição clara das informações. Nesse ponto, a revisão foi feita às cegas, mascarou os nomes dos autores e revistas, evitou qualquer viés potencial e conflito de interesses.
Critérios de exclusãoForam excluídos estudos publicados no formato de cartas ao editor, diretrizes, revisões de literatura, revisões narrativas, revisões sistemáticas, metanálises e resumos. Estudos que não tenham descrito as especificidades que os pesquisadores elegeram como objetivo para esta pesquisa ou que foram pouco claros (tabela 2).
Análise dos dadosA extração dos dados para o processo de elegibilidade dos estudos foi feita com uma ficha própria para revisão sistemática elaborada por dois pesquisadores em programa Excel®, na qual os dados extraídos foram adicionados inicialmente por um dos pesquisadores e, então, conferidos pelo outro pesquisador. Inicialmente foram selecionados de acordo com o título; em seguida, os resumos foram analisados e apenas os que fossem potencialmente elegíveis foram selecionados. Com base nos resumos, os artigos foram selecionados para leitura integral e admitidos os que atendiam a todos os critérios pré‐determinados. Em caso de desacordo entre avaliadores, um terceiro avaliador tomou a decisão sobre a elegibilidade do estudo em questão.
Forma de seleção dos estudosInicialmente os revisores de elegibilidade (PH e LFG) foram calibrados para a revisão sistemática por FSAP e KMP. Após a calibração e os esclarecimentos de dúvidas, os títulos e resumos foram examinados por dois revisores de elegibilidade (PH e LFG), de forma independente, os quais não estavam cegos para o nome dos autores e das revistas. Aqueles que apresentaram um título dentro do âmbito, mas os resumos não estavam disponíveis, também foram obtidos e analisados na íntegra. Posteriormente, os estudos elegíveis tiveram o texto completo obtido e avaliado. Na inexistência de acordo entre os revisores, um terceiro (FSAP) foi envolvido para a decisão final.
Dados coletadosApós a triagem, os textos dos artigos selecionados foram revisados e extraídos de forma padronizada por dois autores (PH e LFG) sob a supervisão de KMP e FSAP, identificaram‐se ano de publicação, local da pesquisa, idioma de publicação, tipo de estudo, objetivo, amostra, método, resultado e conclusão do estudo, frequência de ototoxicidade, doses cumulativas, idade no diagnóstico, tempo médio entre a última dose de cisplatina e a avaliação auditiva, tempo de monitoramento audiológico.
Resultado clínicoO resultado clínico de interesse foi sistematizar informações sobre os efeitos ototóxicos do uso de medicamentos antineoplásicos e observar a dose efetiva para tais efeitos. Aqueles que não usaram essa abordagem não fizeram parte da amostra da revisão de literatura.
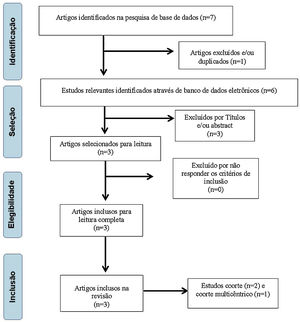
ResultadosInicialmente foram selecionados sete artigos com potencial de inclusão neste estudo, restaram seis após exclusão por repetição; em seguida, os títulos foram analisados e dois trabalhos foram excluídos por não responderem os critérios propostos por esses autores, restaram quatro artigos. Posteriormente, um artigo foi excluído por abstract, restaram três27–29 para serem lidos na íntegra, todos admitidos para a pesquisa (fig. 1).
A partir dos descritores eleitos, os bancos de dados foram consultados e foram obtidos os resultados mostrados na tabela 3.
Classificação das referências obtidas nas bases de dados Pubmed, SciELO, Lilacs, Web Of Science e Scopus
| Descritores | N° | Referências excluídas | Motivo | Selecionado | Banco de dados |
|---|---|---|---|---|---|
| (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]) | 7 | 4 | Excluídos por título (2); excluídos por abstracts (1); excluídos por repetição (1). | 3 | Pubmed |
| (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]) | 0 | 0 | – | 0 | Lilacs |
| (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]) | 0 | 0 | – | 0 | SciELO |
| (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]) | 0 | 0 | – | 0 | Web of Science |
| (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up Studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]) | 0 | 0 | – | 0 | Bireme |
| (ototoxicity) AND (antineoplasic) AND (adults) AND (Childhood) AND (adolescent) AND (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized controlled trials[mh] OR random allocation[mh] OR double‐blind method[mh] OR singleblind method[mh] OR clinical trial[pt] OR clinical trials[mh] OR (“clinical trial”[tw]) OR ((singl*[tw] OR doubl*[tw] OR trebl*[tw] OR tripl*[tw]) AND (mask*[tw] OR blind*[tw])) OR (“latin square”[tw]) OR placebos[mh] OR placebo*[tw] OR random*[tw] OR research design[mh:noexp] OR follow‐up studies[mh] OR prospective studies[mh] OR cross‐over studies[mh] OR control*[tw] OR prospectiv*[tw] OR volunteer*[tw]) NOT (animal[mh] NOT human[mh]) | 0 | 0 | – | 0 | Scopus |
| Total | 7 | 4 | 3 | Pubmed |
Fonte: Desenvolvido pelos autores.
Os estudos selecionados27–29 foram dois do tipo coorte e uma coorte multicêntrica. As análises foram categorizadas segundo o tema investigado que indicava a ingestão de antineoplásicos, a dosagem usada pelos pacientes, bem como os efeitos ototóxicos causados pelos medicamentos. Em relação à avaliação de qualidade, os estudos atingiram a pontuação 11 de Pithon et al.,26 portanto, apresentam alta qualidade para inclusão e análise. A descrição das pesquisas incluídas nesta revisão sistemática, bem como as dosagens das medicações administradas no tratamento oncológico dos sujeitos inclusos nos três estudos, encontra‐se nas tabelas 4 e 5, respectivamente.
Síntese dos artigos selecionados
| Autor/ Ano/ Local de publicação | Objetivo | n | Exames | Classificação das perdas auditivas | Resultados | Conclusão |
|---|---|---|---|---|---|---|
| Einarsson et al.27, 2010,Suécia | Investigar o comprometimento auditivo em longo prazo em indivíduos que receberam quimioterapia à base de platina na infância ou adolescência. | 15 | ATL (0.125, 0.25, 0.5, 1, 2, 3, 4, 6 e 8 kHz) | Brock et al. (1991) | Os resultados mostram que a perda auditiva, em indivíduos com ototoxicidade, aumentou após o fim do tratamento, incluindo também as frequências mais baixas. A maior deterioração dos limiares auditivos, até 55dB NA, foi encontrada em frequências acima de 2kHz. | A conclusão deste estudo é que crianças e adolescentes tratados com quimioterapia à base de platina devem fazer exames audiométricos regulares de acompanhamento, também muitos anos após o término do tratamento. Além disso, avaliações da deficiência auditiva autorreferida devem ser feitas durante e após a quimioterapia |
| TimpanometriaAudiometria de fala | ||||||
| Mensuração do nível de handcap (Escala de medida auditiva – HMS) | ||||||
| Clemens et al.28, 2016,Países Baixos | Determinar a frequência e os determinantes da ototoxicidade em uma grande coorte multicêntrica de sobreviventes de câncer infantil que receberam platina, mas não irradiação craniana como tratamento. | 451 | ATL (0.25, 0.5, 1, 2, 4 e 8 kHz) | Münster (Schmidt et al., 2007) | A frequência geral de ototoxicidade foi de 42%, foi observada em 45% dos tratados com cisplatina, em 17% dos tratados com carboplatina e em 75% dos que receberam os dois medicamentos. A menor idade na época do diagnóstico, a dose cumulativa total de cisplatina mais alta e o tratamento concomitante com furosemida estavam associados à ototoxicidade. | O tratamento com dose cumulativa total mais alta de cisplatina, menor idade na época do diagnóstico e uso concomitante de furosemida, de forma independente, está associado a um risco aumentado de ototoxicidade em sujeitos tratados com platina na infância. |
| Clemens et al.29, 2017,Países Baixos | Estudar a reversibilidade da ototoxicidade a partir da descontinuação do tratamento em uma coorte de sujeitos tratados com platina com perda auditiva ao final do tratamento do câncer. | 168 | ATL (0.25, 0.5, 1, 2, 4 e 8 kHz): idade ≥5 anos | Münster (Schmidt et al., 2007) | Dos 168 participantes, 61 (36,3%)apresentaram deficiência auditiva após finalização o tratamento quimioterápico, nenhum desses sujeitos revelou melhoria da função auditiva até 28,8 anos após a descontinuação do tratamento. | A ototoxicidade após o tratamento com platina pode ser irreversível e o monitoramento, bem como cuidados audiológicos clínicos longitudinais, é necessário. |
| Audiometria lúdica condicionada: idade entre 2 e 5 anos. | ||||||
| VRA em crianças de 6 meses a 2 anos. |
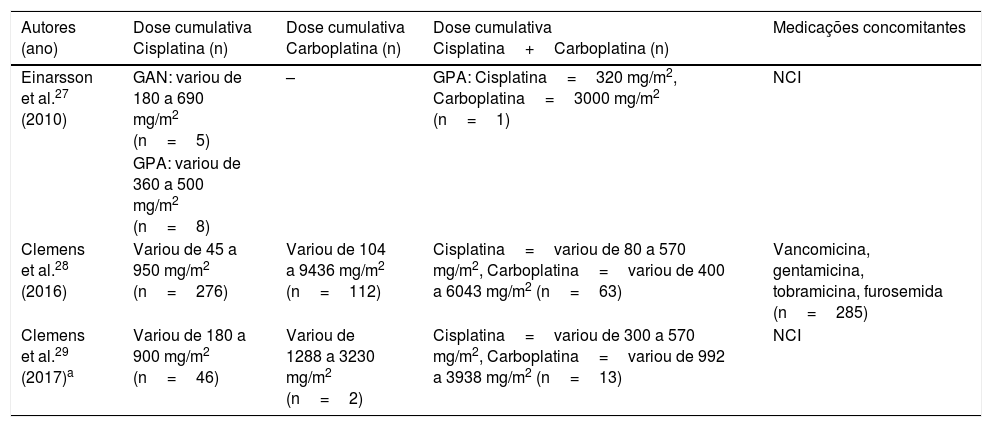
Doses cumulativas de cisplatina e carboplatina e medicações usadas concomitantemente aos quimioterápicos
| Autores (ano) | Dose cumulativa Cisplatina (n) | Dose cumulativa Carboplatina (n) | Dose cumulativa Cisplatina+Carboplatina (n) | Medicações concomitantes |
|---|---|---|---|---|
| Einarsson et al.27 (2010) | GAN: variou de 180 a 690 mg/m2 (n=5) | – | GPA: Cisplatina=320 mg/m2, Carboplatina=3000 mg/m2 (n=1) | NCI |
| GPA: variou de 360 a 500 mg/m2 (n=8) | ||||
| Clemens et al.28 (2016) | Variou de 45 a 950 mg/m2 (n=276) | Variou de 104 a 9436 mg/m2 (n=112) | Cisplatina=variou de 80 a 570 mg/m2, Carboplatina=variou de 400 a 6043 mg/m2 (n=63) | Vancomicina, gentamicina, tobramicina, furosemida (n=285) |
| Clemens et al.29 (2017)a | Variou de 180 a 900 mg/m2 (n=46) | Variou de 1288 a 3230 mg/m2 (n=2) | Cisplatina=variou de 300 a 570 mg/m2, Carboplatina=variou de 992 a 3938 mg/m2 (n=13) | NCI |
O tamanho amostral dos estudos foi bastante heterogêneo, envolveu 15,27 45128 e 16829 pacientes oncológicos avaliados, todos diagnosticados na infância, atendidos entre 1985 e 2000. No primeiro estudo e nos dois últimos, foram usados os dados da coorte (Long‐term Effects after Childhood Cancer – LATER – group) entre 1980 e 2012 (tabela 4).
A idade do diagnóstico variou de 0 a 18,9 anos. No estudo de Einarsson et al.,27 os pacientes foram divididos em grupos e a idade média foi de 15,7 anos entre os sujeitos com audição normal (n=6) e 10,3 no grupo com perda auditiva (n=9). Nos demais estudos a idade média no diagnóstico foi de 4,928 e de 9,4 anos.29 O tempo médio entre a última dose de cisplatina e a avaliação auditiva pós‐tratamento foram claramente expostos em apenas um dos estudos. O tempo médio variou de 0,3 a 57,3 semanas, de 12,1 semanas no grupo com perda auditiva e 10,8 semanas entre os sujeitos com audição normal.27
Em todos os estudos admitidos os indivíduos foram tratados com cisplatina e carboplatina, isolados ou em combinação, sem radiação craniana. As doses cumulativas de cisplatina, quando administradas isoladamente, variaram de 45 a 950 mg/m2, as de carboplatina, também administradas isoladamente, ficaram entre 104 a 9436 mg/m2 e quando usadas em combinação as doses cumulativas de cisplatina variaram de 80 a 570 mg/m2 e a de carboplatina de 400 a 6043 mg/m2 (tabela 5).
No estudo de Einarsson et al.,27 percebeu‐se que no grupo com deficiência auditiva quatro dos seis indivíduos receberam uma dose cumulativa de cisplatina superior a 400 mg/m2, enquanto no grupo com audição normal apenas três dos nove indivíduos receberam essa mesma dose. Entretanto, o sujeito que recebeu a maior dose cumulativa do estudo (690 mg/m2) pertencia ao grupo com audição normal. Ao analisar as doses cumulativas dos antineoplásicos administrados aos 61 sujeitos com perda auditiva do estudo mais recente29 verificou‐se uma heterogeneidade nas quantidades. A dose cumulativa de ciscisplatina variou de 180 a 900 mg/m2 e, quando associada a carbocisplatina, variou de 300 a 570 mg/m2. Já o estudo de Clemens et al.28 constatou que a dose cumulativa total de cisplatina mais elevada (OR=1,3; 95% IC: 1,2–1,5 por aumento de 100 mg/m2) associou‐se à ototoxicidade.
A avaliação audiológica de consenso nos três estudos foi a audiometria tonal liminar (ATL), embora a faixa de frequências tenha apresentado sensíveis diferenças, nenhuma delas objetivou avaliar altas frequências (tabela 4). Quanto ao critério adotado para análise da perda auditiva, um estudo usou a classificação de Brock30 e os outros dois o sistema de classificação Münster.31
No que diz respeito ao tempo de monitoramento audiológico, foi exposto apenas nos dois últimos estudos, com média de 5,9 (min.: 1,1 e máx.: 27,2) anos após a conclusão do tratamento em um dos estudos29 e média de 8,5 (min.: 0 e máx.: 32,1) anos no outro estudo.28 A frequência geral de ototoxicidade evidenciada nos três estudos variou de 36,3%29 a 42%,28 o primeiro valor é referente a alterações auditivas constatadas após a finalização do tratamento. A ototoxicidade causada pela cisplatina usada isoladamente foi de 83,3%,27 45%28 e 75,4%29 e a causada pelo tratamento isolado com carboplatina foi de 17%28 e 3,3%,29 enquanto a ototoxicidade causada pelo uso associado dos dois medicamentos foi de 16,6%,27 75%28 e 21,3%.29 Uma das pesquisas evidenciou que menor idade ao diagnóstico, dose cumulativa total mais alta de cisplatina, bem como tratamento combinado com furosemida, estão associados a um risco aumentado de ototoxicidade.28 Constatou‐se uma deterioração auditiva após o fim do tratamento quimioterápico
Um dos estudos27 demonstrou que as alterações auditivas ocorreram até 22,3 anos após a conclusão do tratamento e envolveu frequências altas e baixas. No outro estudo,29 36,3% dos indivíduos tratados para câncer apresentaram deficiência auditiva na descontinuação do tratamento (Grau 2b de Münster> 40 – ≤60 dB). Em 39,3% (n=24) dos sujeitos com perda auditiva ocorreu um aumento no grau de Münster após um tempo médio de 3,5 anos (intervalo de 1,1 a 21,3 anos). Mudanças nos limiares auditivos foram observadas até após um tempo médio de 12,4 anos (intervalo de 5,2 a 19,6 anos) (n=2), embora o escore de Münster tenha permanecido inalterado ao longo do tempo, após um tempo médio de 5,1 anos (intervalo de 1,1 a 21,3 anos) em 52,5% (n=32) dos indivíduos com perda auditiva.
Quanto aos resultados da ATL, apenas o estudo que usou a classificação de Brock30 descreveu a média de alguns limiares auditivos e constatou, entre os sujeitos com perda auditiva, média de tons puros para 3, 4, 6 e 8 kHz da melhor orelha de 66,9 dB e da pior orelha de 74,8 dB NA. Já dentre os sujeitos com audição normal a média do tom puro nas mesmas frequências foi de 1,9 dB NA na melhor orelha e, 9,2 dB NA na pior.27
DiscussãoA presente pesquisa objetivou apresentar evidências científicas sobre os efeitos ototóxicos dos medicamentos antineoplásicos, considerando que a pergunta norteadora foi baseada em verificar quais os efeitos e dose necessária para a ototoxicidade do uso de medicamentos antineoplásicos. Cabe destacar que medicamentos ototóxicos usados no tratamento do câncer e os danos causados no sistema auditivo dos indivíduos têm apresentado cada vez mais interesse aos pesquisadores. A seleção e a aplicação de procedimentos adequados para monitorar a audição poderão contribuir na adoção de medidas apropriadas no que tange às doses ideais, à frequência de uso, à combinação ou não de medicamentos, minimizar os riscos e danos, proporcionar melhor qualidade de vida a esses pacientes.
Em todos os estudos admitidos para esta pesquisa foi constatado o relato de ototoxicidade devido ao uso de antineoplásicos no tratamento dos pacientes, a ototoxicidade causada pela cisplatina foi a mais evidente, variou de 45%28 a 83,3%,27 quando usada isoladamente. Esses valores são superiores aos constatados em estudos anteriores, nos quais a incidência de ototoxicidade causada por cisplatina, na população infantil, variou de 22% a 70%.32–35 Publicação relativamente recente que visou investigar a audição de 200 sujeitos tratados para câncer na infância evidenciou que o tratamento que envolveu quimioterapia com cisplatina causou perda auditiva de 41,9% das orelhas direitas e 47,3% das orelhas esquerdas, com risco 11,7 vezes maior de perda auditiva na orelha direita e 17,6 vezes maior na orelha esquerda em relação aos pacientes não tratados com cisplatina.23
Estudo publicado em 2013, desenvolvido com uma coorte composta por 112 crianças e 17 adultos, 108 foram tratados com cisplatina, 13 receberam carboplatina e oito foram tratados com os dois compostos de platina, evidenciou que, após a interrupção da terapia, 47,3% dos pacientes demonstraram deficiência auditiva, 55 crianças (49,1%) e seis adultos (42,1%).15 A cisplatina é amplamente usada para a quimioterapia, porém é limitada pela resistência celular e possíveis efeitos colaterais graves nos tecidos, que incluem nefrotoxicidade, neurotoxicidade e ototoxicidade. A ototoxicidade ocorre nas células ciliadas externas mecanossensorial da cóclea.36
A ototoxicidade da carboplatina foi constatada em estudo desenvolvido com 60 crianças com retinoblastoma que foram tratadas com carboplatina associada a vincristina sistêmica. Doze crianças (20%) desenvolveram ototoxicidade em algum momento após o início do tratamento, em duas a ototoxicidade foi reversível e em 10 (17%), irreversível.14 Entretanto, em outra publicação na qual a carboplatina não foi usada em associação com outras drogas ototóxicas, nenhuma alteração auditiva foi constatada.37 A carboplatina apresenta uma atividade antitumoral similar à cisplatina, porém com ototoxicidade mais leve. Contudo, pode estar relacionada com a perda auditiva do tipo neurossensorial.14
Nos estudos admitidos na presente pesquisa, os indivíduos foram tratados com cisplatina e carboplatina, medicamento isolado ou em combinação, no entanto sem radiação craniana, a fim de descartar a participação dessa modalidade de tratamento nas alterações auditivas. O efeito da cisplatina na orelha interna é indiscutível e a associação da radioterapia aumenta a probabilidade da ocorrência da perda auditiva.38,39 As doses cumulativas de cisplatina, quando administradas isoladamente, variaram de 45 a 950 mg/m2, as de carboplatina também foram administradas isoladamente e ficaram entre 104 a 9436 mg/m2 e quando usadas em combinação as doses cumulativas de cisplatina variaram de 80 a 570 mg/m2 e a de carboplatina de 400 a 6043 mg/m2. Nitz et al.15 também evidenciaram doses cumulativas maiores de carboplatina quando comparada a cisplatina, tanto nos sujeitos tratados com as drogas isoladas quanto em combinação. A dose cumulativa média de carboplatina, quando usada isoladamente, foi de 1500 mg/m2, a dose cumulativa média de cisplatina foi de 360 mg/m2 e, ao usar as medicações combinadas, constataram dose cumulativa média de cisplatina de 240 mg/m2 e de carboplatina de 1200 mg/m2.15
Entre os fatores mais destacados como de maior risco para desenvolver perda auditiva induzida por platina, ressalta‐se a dosagem cumulativa de cisplatina maior do que 400 mg/m2,40 embora dosagens superiores a 200 mg/m2 já tenham se mostrado ototóxica.41 Pesquisadores defendem que crianças tratadas com cisplatina em doses cumulativas próximas de 400 mg/m2 necessitam de vigilância em longo prazo para evitar negligenciar os déficits auditivos. Já a carboplatina, em uma dose padrão, não parece ser um fator de risco significativo para ototoxicidade, mesmo em pacientes que já foram tratados com cisplatina.32
A ototoxicidade por cisplatina resulta em uma perda auditiva sensorioneural bilateral e simétrica, pior em altas frequências (4 a 8 kHz),16,42,43 pode ocorrer também o zumbido.43 Em estudo feito com indivíduos curados de câncer, tratados com cisplatina e associações, o acometimento ocorreu a partir de 1 kHz, com um crescimento acentuado a partir de 6 kHz.21 O grau de perda auditiva é dose‐dependente42,44 e está relacionado à frequência e ao método de avaliação.44 Os achados do estudo mais recente29 indicam que a deficiência auditiva causada pelos antineoplásicos a base de platina é irreversível em longo prazo, visto que nenhum dos indivíduos que desenvolveram perda auditiva após tratamento com antineoplásicos apresentou melhoria progressiva da função auditiva até 28,8 anos após a interrupção do tratamento. Em outra pesquisa selecionada para este estudo27 também não foi observada melhoria da perda auditiva nas avaliações feitas durante o acompanhamento.
Uma das pesquisas admitidas para esta revisão sistemática evidenciou que menor idade ao diagnóstico está associada a um risco aumentado de ototoxicidade,28 corroborou o encontrado em outros estudos,14,32,33 porém foi de encontro ao verificado em pesquisa que não constatou a idade como fator de risco para a ototoxicidade.15 Li et al.40 observaram que crianças com idade inferior a cinco anos no momento do tratamento apresentavam 21 vezes mais chances de adquirir uma perda auditiva de alta frequência moderadamente grave em relação a pacientes de 15 a 20 anos. Assim, crianças tratadas com antineoplásicos devem rotineiramente ser submetidas a um monitoramento audiológico em longo prazo.14
Nos estudos incluídos para esta revisão a idade no diagnóstico variou de 0 a 18,9 anos, divergiu entre os estudos e também do encontrado na literatura, na qual foi relatada idade média no diagnóstico de 13,56 (de 10,26 a 16,27) anos.15 O tempo médio entre a última quimioterapia e a avaliação auditiva foi referido em um dos estudos e variou de 0,3 a 57,3 semanas, o tempo médio foi de de 12,1 semanas no grupo com perda auditiva,27 inferior ao constatado em outro estudo que verificou intervalo médio entre o fim do último curso de quimioterapia com cisplatina e carboplatina e a primeira audiometria pós‐tratamento de 6,97 meses (0,87–15,63 meses).15
Outro fator relatado em pesquisas científicas sugere que a genética pode ser um fator relevante na ototoxicidade. No entanto, os resultados ainda são contraditórios e incipientes.45 O rastreamento da predisposição genética à ototoxicidade da cisplatina pode identificar indivíduos com risco aumentado de perda auditiva. Estudos farmacogenéticos que investigam variantes genéticas encontraram resultados variados, o que pode estar relacionado à variabilidade das populações de pacientes e tratamentos diferenciados.46
Quanto ao critério adotado para análise da perda auditiva, um estudo27 usou a classificação de Brock30 e os outros dois28,29 o sistema de classificação Münster.31 É importante salientar que as díspares classificações e a diferença de sensibilidade entre elas podem influenciar na frequência calculada. A classificação de Brock30 apresenta um sistema favorável na classificação da ototoxicidade em alta frequências, contudo a classificação de Münster31 apresenta melhor sensibilidade e especificidade.28 Clemens et al.28 citam que a frequência de ototoxicidade evidenciada foi de 42% com o sistema de classificação Münster,31 entretanto quando usados os critérios de classificação de Brock30 a frequência de ototoxicidade sofreu uma variação significativa, 29%.
Publicação de 2012 evidenciou que diferentes sistemas de classificação de ototoxicidade mostraram boa concordância geral na identificação de pacientes com esse acometimento,14 porém os sistemas de classificação usados foram: Brock et al.,30National Cancer Institute Common Terminology Criteria for Adverse Events (NCI‐CTCAE) versão 3 (National Cancer Institute) e Children's Cancer Group (CCG).47 Em relação à avaliação audiológica, salienta‐se que todos os estudos adotaram a audiometria convencional como procedimento. Por mais que a faixa de frequências tenha apresentado sensíveis diferenças, nenhuma delas objetivou avaliar altas frequências. No entanto, acredita‐se que a audiometria de altas frequências deveria ser sempre o procedimento de escolha, principalmente para monitorar pacientes expostos a drogas ototóxicas, em virtude do acometimento inicial das frequências agudas, característica dessa patologia.
A audiometria de altas frequências é considerada uma importante ferramenta para detecção e monitoração de perdas auditivas e auxilia na detecção da ototoxicidade por cisplatina, as frequências de 12 kHz e 14 kHz são especialmente importantes.48 Estudos feitos com pacientes tratados com cisplatina e avaliados por meio da audiometria convencional, bem como por meio da audiometria de altas frequências, constataram alteração auditiva principalmente nas frequências a partir de 6 e 9 kHz.21,49,50 Vale ressaltar que quanto mais tempo o medicamento permanecer no organismo, maior seu efeito nocivo. Contudo, devem‐se levar em consideração as diferenças individuais referentes a resposta ao agente tóxico e variáveis facilitadoras da ototoxicidade, como antecedentes familiares de surdez, suscetibilidade a ruído, entre outras.21
A partir de toda esta análise de evidências científicas, aponta‐se para a importância do acompanhamento audiológico regular durante e após o tratamento à base de platina e sugere‐se também avaliações da deficiência auditiva autorreferida durante e após a quimioterapia.27
ConclusãoOs estudos admitidos para essa revisão sistemática convergiram em seus resultados, evidenciaram o efeito das alterações auditivas após o uso de medicamentos antineoplásicos à base de cisplatina, a ototoxicidade causada pela cisplatina foi a mais evidente, pode em muitos casos ser irreversível.
No que diz respeito à frequência da ototoxicidade dos medicamentos antineoplásicos e à dose necessária para o desencadeamento desses efeitos, observou‐se uma importante heterogeneidade. A frequência da ototoxicidade causada pela cisplatina variou de 45% a 83,3% e, quando usada em associação com a carboplatina, variou de 16,6% a 75%. Nos sujeitos com perda auditiva as doses cumulativas de cisplatina, quando administrada isoladamente, variaram de 180 a 900 mg/m2, e quando administrada juntamente com a carboplatina variaram de 300 a 570 mg/m2, a dose cumulativa total de cisplatina mais elevada está associada à ototoxicidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Patatt FS, Gonçalves LF, Paiva KM, Haas P. Ototoxic effects of antineoplastic drugs: a systematic review. Braz J Otorhinolaryngol. 2022;88:130–40.