Isotretinoin (13 cis‐retinoic acid) is the most effective treatment for acne vulgaris and is the only treatment option that can provide either remission or a permanent cure.
ObjectiveThe aim of this study was to use both subjective and objective methods to assess the nasal complaints of patients with severe acne who received oral isotretinoin therapy.
MethodsFifty‐four subjects were enrolled in the study. All the subjects were assessed with subjective (NOSE and VAS questionnaires) and objective (rhinomanometry and saccharine) tests to determine the severity of their nasal complaints.
ResultsThe mean severity scores (min: 0; max: 100) for nasal dryness/crusting and epistaxis were 0.47±1.48 (0–5); 0.35±1.30 (0–5) at admission, 3.57±4.45 (0–10); 2.26±4.71 (0–20) at the first month, and 4.28±6 (0–20); 2.26±4.71 (0–20) at the third month of the treatment respectively. Total nasal resistance of 0.195±0.079 (0.12–0.56)Pa/cm3/s at admission, 0.21±0.084 (0.12–0.54)Pa/cm3/s at the first month, and 0.216±0.081 (0.14–0.54)Pa/cm3/s at the third month.
ConclusionOral isotretinoin therapy can cause the complaint of nasal obstruction. In addition, nasal complaints, such as dryness/crusting and epistaxis, significantly increase in patients during the therapy schedule.
A isotretinoína (ácido‐13 cis‐retinóico) é o tratamento por via oral mais eficaz para acne vulgar e é a única opção de tratamento que pode produzir remissão ou cura permanente.
ObjetivoUsar métodos subjetivos e objetivos para avaliar as queixas nasais de pacientes com acne grave que receberam terapia com isotretinoína oral.
MétodoForam incluídos no estudo 54 indivíduos. Todos os indivíduos foram avaliados por meio de testes subjetivos (questionários NOSE e escala EVA) e objetivos (rinomanometria e teste de sacarina) para determinar a gravidade de suas queixas nasais.
ResultadosOs escores médios de gravidade (min: 0; max: 100) para ressecamento/crostas e epistaxe nasal foram de 0,47±1,48 (0‐5); 0,35±1,30 (0‐5) no início, 3,57±4,45 (0‐10); 2,26±4,71 (0‐20) no primeiro mês e 4,28±6 (0‐20); 2,26±4,71 (0‐20) no terceiro mês do tratamento, respectivamente. A resistência nasal total foi de 0,195±0,079 (0,12 a 0,56)Pa/cm3/s no início, 0,21±0,084 (0,12 a 0,54)Pa/cm3/s no primeiro mês e 0,216±0,081 (0,14 a 0,54)Pa/cm3/s no terceiro mês.
ConclusãoA terapia com isotretinoína por via oral pode resultar em queixa de obstrução nasal. Além disso, queixas nasais, tais como ressecamento/formação de crostas e epistaxe, aumentam significativamente nos pacientes durante o esquema terapêutico.
A acne é uma doença dermatológica crônica caracterizada pelo desenvolvimento de lesões e cicatrizes que perduram pela vida toda.1 Esse distúrbio é mais comum e mais grave na adolescência (70% a 87% da população adolescente) e sua incidência diminui gradativamente na idade adulta.2 Apresenta uma fisiopatologia complexa, envolve queratinização anormal, disfunção hormonal, crescimento bacteriano e hipersensibilidade imunológica.3 Pode ser dividida tradicionalmente em três categorias, de acordo com o tipo de lesão e as apresentações dos sintomas: leve, moderada e grave. A forma mais amplamente aceita de tratamento para acne grave é a isotretinoína por via oral (ácido 13‐cis‐retinóico).
A isotretinoína oral foi aprovada pela primeira vez para o tratamento da acne vulgar em 1982.4 Foi originalmente indicada para tratamento na dose de 1 a 2mg/kg/dia até uma dose cumulativa de 120 a 150mg / kg, geralmente administrada em 4 a 5 meses.5 Embora tenha um perfil de segurança favorável, a principal limitação da isotretinoína são seus efeitos adversos bem descritos. O efeito adverso mais comum é o ressecamento mucocutâneo das superfícies epidérmicas, dá origem a queilite, xerose e dermatite.6 Apesar da ampla gama de efeitos adversos, inclusve queixas nasais, como epistaxe, nenhum dos estudos ainda mencionou a sensação de obstrução nasal e ressecamento/formação de crostas.
O objetivo deste estudo foi usar métodos subjetivos e objetivos para avaliar as queixas nasais de pacientes com acne grave que receberam terapia com isotretinoína oral.
MétodoPacientes com acne grave tratados com isotretinoína oral foram incluídos neste estudo entre 10 de agosto de 2014 e 10 de maio de 2016. O estudo foi feito de acordo com os princípios da declaração de Helsinque e foi previamente aprovado pelo comitê de ética local (2015‐269). Todos os dados foram coletados prospectivamente e cada indivíduo foi incluído no estudo após o consentimento informado por escrito. Todos os indivíduos preencheram o questionário NOSE (do inglês Nasal Obstruction Symptom Evaluation) para determinar a gravidade de suas queixas nasais. Dois métodos objetivos – rinomanometria anterior e teste de sacarina – também foram aplicados em cada paciente. Esses questionários e testes foram feitos em todos os pacientes no início e após o primeiro e o terceiro mês da terapia com isotretinoína oral e os resultados foram comparados estatisticamente para identificar alterações nas queixas nasais durante o processo de tratamento. A dose cumulativa de tratamento, que foi mais reprodutível e confiável do que a dose diária, foi usada como medida no presente estudo. O tratamento com isotretinoína foi administrado a uma dose cumulativa de 120mg / kg durante 6 meses.
Avaliação subjetiva da via aérea nasalA escala NOSE consiste em cinco itens relacionados à obstrução (congestão nasal ou nariz entupido, obstrução ou bloqueio nasal, dificuldade para respirar pelo nariz, dificuldade para dormir, não conseguir respirar pelo nariz durante o exercício) e é um método fácil para determinar a gravidade das queixas. Duas perguntas sobre a gravidade do ressecamento/formação de crostas nasais e epistaxe também foram feitas e pontuadas, além da escala NOSE. Todos os itens foram pontuados com uma escala Likert de 5 pontos e escalonados até um escore total de 0 a 100. Escores maiores indicaram maior obstrução nasal e sintomas mais graves de ressecamento/formação de crostas nasais e epistaxe. A Escala Visual Analógica (EVA) permite que os pacientes classifiquem seus sintomas em uma escala linear de 10cm, onde 0 corresponde a sintomas que não constituem um problema e 10 são os sintomas mais incômodos imagináveis.7
Avaliação objetiva da via aérea nasalA rinomanometria anterior foi usada para avaliação objetiva da obstrução nasal. Durante o teste, o paciente foi instruído a sentar‐se na posição vertical e a respirar tranquilamente por 20 a 30 minutos com um fluxo de ar mínimo de 300cm3/s. Com esse método, o fluxo aéreo nasal foi medido em uma narina de cada vez e o tubo sensível à pressão foi trocado de um lado para o outro. Portanto, as curvas de pressão/fluxo e as medidas de resistência ou condutância nasal foram determinadas separadamente para cada passagem nasal e o total foi então calculado.8
O teste de sacarina foi usado para determinar o clearance mucociliar (CMC). Cada indivíduo estava sentado e posicionado com a cabeça levemente estendida. Um grânulo de sacarina de 2 a 3mm de diâmetro foi colocado pelo testador, sob controle visual, 2cm dentro da narina direita. Cada indivíduo foi instruído a engolir a cada 30 segundos, determinado com um cronômetro. O indivíduo usou um cronômetro para indicar o momento da primeira percepção do sabor doce da sacarina e registrou o tempo em minutos. O CMC nasal normal deve variar entre 9 e 17 minutos.9
Critérios de inclusão/exclusãoApenas pacientes adultos com acne grave foram recrutados. Após exame médico detalhado, foi feito exame otorrinolaringológico completo, inclusive endoscopia nasal após vasoconstricção nasal. Os critérios de exclusão incluíram idade abaixo de 18 anos, qualquer terapia medicamentosa dentro de 6 meses, rinossinusite crônica de acordo com os critérios do EPOS,10 doença sinusal inflamatória ou infecciosa, rinite alérgica, história de radioterapia em cabeça e pescoço, malignidade nasossinusal, história ou evidência clínica de qualquer cirurgia nasal.
Análise estatísticaA avaliação das respostas foi feita com a comparação dos escores do questionário NOSE no início e durante o tratamento com isotretinoína oral por 3 meses. O teste dos postos sinalizados de Wilcoxon foi aplicado para medir a magnitude do efeito para a avaliação estatística e para comparar os resultados dos testes subjetivos e objetivos. As análises estatísticas foram feitas com o softwareStatistical Package for Social Sciences (SPSS 17.0 para Windows; SPSS Inc., IL, EUA). Valores de p<0,05 foram considerados estatisticamente significantes.
ResultadosForam incluídos no estudo 54 indivíduos. A média da idade foi 21±3 (18–33 anos). O tratamento com isotretinoína oral foi interrompido devido a efeitos colaterais adversos em 12 dos 54 pacientes. Três pacientes não conseguiram tolerar os testes objetivos, mas fizeram os testes subjetivos e sete pacientes não compareceram às consultas de seguimento regular, mas perguntamos a esses pacientes por telefone e obtivemos as respostas dos testes subjetivos. Completamos o estudo com testes subjetivos administrados a 42 dos 54 pacientes e testes objetivos administrados a 32 dos 54 pacientes no início e no primeiro e terceiro meses do esquema de terapia com isotretinoína oral.
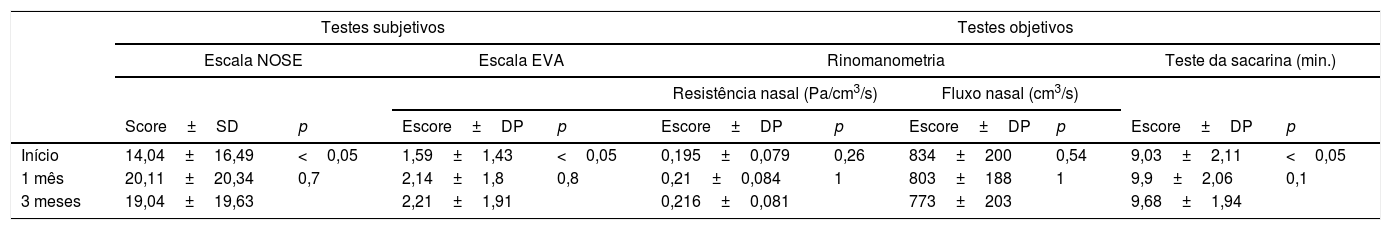
Testes subjetivosOs escores médios do NOSE foram 14,04±16,49 (0‐50) na admissão, 20,11±20,34 (0‐75) no primeiro mês e 19,04±19,63 (0‐75) no terceiro mês do tratamento. Os escores médios na EVA foram 1,59±1,43 (1‐3) no início, 2,14±1,8 (2-3) no primeiro mês e 2,21±1,91 (2-3) no terceiro mês do tratamento. Apenas 4 (9,5%) dos 42 pacientes referiram ressecamento/formação de crostas no início do tratamento. No primeiro e terceiro meses, 18 (43%) pacientes apresentaram essa queixa (tabela 1). Os escores médios de gravidade (min: 0; max: 100) para ressecamento/formação de crostas nasais foram de 0,47±1,48 (0‐5) no início, 3,57±4,45 (0‐10) no primeiro mês e 4,28±6 (0‐ 20) no terceiro mês de tratamento. Apenas 3 (7%) dos 42 pacientes referiram epistaxe no início do tratamento. No primeiro e terceiro meses, 13 (31%) e 11 (26,2%) pacientes apresentaram queixa de sangramento nasal. Os escores médios de gravidade da epistaxe (min: 0; max: 100) foram de 0,35±1,30 (0‐5) no início, 2,61±4,45 (0‐15) no primeiro mês e 2,26±4,71 (0‐20) no terceiro mês de tratamento (tabela 2).
Resultados de testes subjetivos e objetivos de pacientes com acne grave que receberam terapia oral com isotretinoína
| Testes subjetivos | Testes objetivos | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Escala NOSE | Escala EVA | Rinomanometria | Teste da sacarina (min.) | |||||||
| Resistência nasal (Pa/cm3/s) | Fluxo nasal (cm3/s) | |||||||||
| Score±SD | p | Escore±DP | p | Escore±DP | p | Escore±DP | p | Escore±DP | p | |
| Início | 14,04±16,49 | <0,05 | 1,59±1,43 | <0,05 | 0,195±0,079 | 0,26 | 834±200 | 0,54 | 9,03±2,11 | <0,05 |
| 1 mês | 20,11±20,34 | 0,7 | 2,14±1,8 | 0,8 | 0,21±0,084 | 1 | 803±188 | 1 | 9,9±2,06 | 0,1 |
| 3 meses | 19,04±19,63 | 2,21±1,91 | 0,216±0,081 | 773±203 | 9,68±1,94 | |||||
DP, desvio‐padrão; EVA: Escala Visual Analógica; NOSE (Nasal Obstruction Symptom Evaluation).
Escores de gravidade do ressecamento/crostas nasais e epistaxe
| Início | 1 mês | 3 meses | p | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | ME±DP | p | n | % | ME±DP | n | % | ME±DP | ||
| Ressecamento/ crostas | 4/42 | 10% | 0,47±1,48 | <0,05 | 18/42 | 43% | 3,57±4,45 | 18/42 | 43% | 4,28±6 | 0,8 |
| Epistaxe | 3/42 | 7% | 0,35±1,30 | <0,05 | 13/42 | 31% | 2,61±4,45 | 11/42 | 26% | 2,26±4,71 | 1 |
DP, desvio‐padrão; ME, média do escore.
As diferenças entre os escores no início e durante a terapia foram estatisticamente significantes (p <0,05), mas o primeiro e o terceiro mês não foram estatisticamente significantes para as escalas NOSE e EVA, gravidade do ressecamento/crostas nasais ou para epistaxe (p=0,7; 0,8, 0,8, 1).
Testes objetivosO escore médio para a resistência nasal total foi de 0,195±0,079 (0,12 a 0,56) Pa/cm3/s no início, 0,21±0,084 (0,12 a 0,54) Pa/cm3/s no primeiro mês e 0,216±0,081 (0,14‐0,54) Pa/cm3/s no terceiro mês. O escore médio do fluxo nasal total foi 834±200 (247‐1256) cm3/s no início, 803±188 (383‐1.211) cm3/s no primeiro mês e 773±203 (322‐1.201) cm3/s no terceiro mês de terapia. As diferenças entre os escores médios no início e no primeiro mês; e entre o primeiro e o terceiro meses não foram estatisticamente significantes, tanto para a resistência nasal total (p=0,26‐1) quanto para o fluxo nasal (p=0,54‐1) (tabela 1).
O tempo da atividade mucociliar nasal, determinado pelo teste de sacarina, foi de 9,03±2,11min (5‐15) no início, 9,9±2,06min (7‐15) no primeiro mês e 9,68±1,94min (6-14) no terceiro mês (tabela 1). As diferenças entre os escores no início e durante a terapia foram estatisticamente significantes (p <0,05), mas a diferença entre o primeiro e o terceiro meses não foi estatisticamente significante (p=0,1).
DiscussãoA isotretinoína é o tratamento mais eficaz para acne vulgar e é a única opção de tratamento que pode produzir remissão ou cura permanente.11 O efeito adverso mais comum é o ressecamento mucocutâneo das superfícies epidérmicas associado a queilite, xerose e dermatite.6 Além desses efeitos colaterais, as queixas nasais, como sensação de obstrução nasal e ressecamento/formação de crostas nasais, foram avaliadas neste estudo, pois não haviam sido avaliadas anteriormente. De acordo com este estudo, foi demonstrado que a terapia com isotretinoína oral causou a sensação de obstrução nasal, epistaxe e ressecamento/formação de crostas durante os três meses de seguimento.
O mecanismo das queixas nasais pode ser explicado pelas alterações histopatológicas que ocorrem em resposta ao tratamento com isotretinoína oral. A isotretinoína é um derivado da vitamina A que diminui a proliferação, diferenciação e atividade dos cistos sebáceos, interrompe seu ciclo cellular.11 As secreções dos cistos sebáceos hidratam a passagem nasal e determinam a viscosidade e elasticidade do muco que fica no topo da camada ciliar da mucosa. Eles protegem a mucosa do ressecamento e fornecem uma fisiologia nasal apropriada. A isotretinoína também inibe a síntese lipídica sebácea e reduz a taxa de excreção de sebo.12 Esses mecanismos bloqueiam o desenvolvimento da acne, mas também causam ressecamento mucocutâneo, um dos efeitos adversos mais comuns já mencionados.6 O ressecamento mucocutâneo pode levar à formação de crostas, que podem facilmente obstruir a passagem nasal e dar origem à queixa de obstrução nasal.
Vários estudos anteriores avaliaram a presença de epistaxe devido ao tratamento com isotretinoína. Blasiak et al. encontraram epistaxe em 37,9% dos 116 pacientes com acne que usaram isotretinoína oral por 12 meses e descreveram a epistaxe como um dos sintomas mais comuns durante o tratamento.13 Ertam et al.14, Gorpelioglu et al.15 e Alzoubi et al.16 também encontraram epistaxe em 23,1%, 40% e 55,4%, respectivamente, de suas coortes de pacientes de seus estudos, enquanto observamos isso em 19% de nossos 42 pacientes. A epistaxe é um efeito colateral comumente aceito do tratamento com isotretinoína e foi responsabilizada pelo ressecamento mucocutâneo observado em todos esses estudos; entretanto, o mecanismo que leva à epistaxe ainda permanece incerto. O ressecamento mucocutâneo e o surgimento de crostas, que foram observados em 33% de nossos pacientes, podem causar danos à mucosa nasal, com efeito traumático, e essa provavelmente foi a causa da epistaxe. De qualquer maneira, o ressecamento mucocutâneo foi seguido por um ciclo vicioso de formação de crostas e epistaxe durante a terapia.
O clearance mucociliar (CMC) garante a remoção de partículas estranhas, patógenos e toxinas da passagem nasal e é um bom indicador de uma fisiologia nasal normal. Muitos estudos recentes confirmaram que o CMC é facilmente afetada por toxinas, drogas, tabagismo, patologias nasossinusais e cirurgia,9 bem como pelo tratamento com isotretinoína.15 Gorpelioglu et al. avaliaram 40 pacientes com acne através do teste de sacarina e descobriram que o tempo de sacarina (TS) foi prolongado durante um tratamento com isotretinoína aplicado por 3 meses, como no presente estudo. Conclui‐se que o ressecamento mucocutâneo causado pelo tratamento com isotretinoína pode aumentar a viscosidade do muco na passagem nasal ao alterar o equilíbrio hídrico e eletrolítico e atribuem essas alterações à patogênese.15
Diferentemente dos resultados dos testes subjetivos, as medidas da rinomanometria demonstraram que não houve diferença entre os escores médios entre o início e o primeiro mês; e entre o primeiro e o terceiro meses de tratamento para resistência e fluxo nasal total. Essa controvérsia pode ser explicada pelo número limitado de pacientes. Embora as diferenças entre os escores não tenham sido estatisticamente significantes, o tratamento com isotretinoína oral claramente causou efeitos adversos nos pacientes, comprovados com os testes subjetivos e a atividade mucociliar prolongada também poderia ter contribuído para esse resultado.
As principais limitações deste estudo foram o número limitado de pacientes e o curto período de seguimento. Doze dos 54 pacientes inicialmente incluídos no estudo foram excluídos devido a efeitos colaterais adversos. Os testes objetivos também exigem um esforço substancial por parte do paciente e do médico e 7 pacientes não compareceram às consultas de seguimento regulares. Nossos achados sugerem a necessidade de mais estudos para demonstrar os efeitos colaterais nasais em longo prazo devido à terapia com isotretinoína oral para o tratamento da acne e a reversibilidade dessas queixas nasais.
ConclusãoA terapia com isotretinoína oral pode causar a queixa de obstrução nasal. Além disso, queixas nasais, como ressecamento/formação de crostas e epistaxe, aumentam significativamente nos pacientes durante o esquema terapêutico.
Consentimento informadoTodos os procedimentos realizados em estudos envolvendo participantes humanos estiveram de acordo com os padrões éticos do comitê de pesquisa institucional e / ou nacional e com a declaração de Helsinque de 1964 e suas alterações posteriores ou padrões éticos comparáveis. O consentimento informado foi obtido de todos os participantes incluídos no estudo.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Tasli H, Yurekli A, Gokgoz MC, Karakoc O. Effects of oral isotretinoin therapy on the nasal cavities. Braz J Otorhinolaryngol. 2020;86:99–104.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.
Este trabalho foi feito na Gulhane Medical School, Departamento de Otorrinolaringologia, Cirurgia de Cabeça e Pescoço, Ancara, Turquia.