O endpoint do tratamento da osteomielite da base do crânio ainda é uma questão de debate. Um tratamento baseado apenas em sintomas é sujeito a altas taxas de recorrência. Por outro lado, embora sejam mais informativos, o uso dos exames de imagem tem sido cada vez mais restringido. Os marcadores inflamatórios como a proteína‐C reativa e a velocidade de hemossedimentação, VHS, comumente usados, precisam de uma avaliação detalhada para aprimorar sua utilidade.
ObjetivosComparar a acurácia diagnóstica de marcadores inflamatórios em relação à tomografia computadorizada por emissão de pósitrons, PET‐TC, no monitoramento de osteomielite da base do crânio. O objetivo secundário foi obter um valor de corte desses marcadores para decidir sobre o momento da interrupção do antibiótico.
MétodoUm estudo de coorte prospectivo foi conduzido em um centro de atendimento terciário com 51 pacientes com osteomielite da base do crânio que atendiam aos critérios de elegibilidade. Os pacientes com diagnóstico de osteomielite da base do crânio foram monitorados semanalmente por meio de exames seriados de marcadores e PET‐CT após o início do tratamento. O exame de imagem foi feito em 6 a 8 semanas de tratamento e repetido se necessário. O período de acompanhamento variou de 6 semanas a 15 meses. As medidas de desfecho estudadas foram os valores dos marcadores inflamatórios e a atividade metabólica obtida por PET‐CT quando o paciente se tornou assintomático e quando estava livre da doença.
ResultadosProteína‐C reativa e VHS apresentaram uma correlação estatisticamente significante com a atividade da doença ao PET‐TC como marcadores prognósticos. Ambos mostraram boa correlação clínica. Um valor de corte de ≤ 3,6mg/L para proteína‐C reativa e ≤ 35mm/hora para VHS foi considerado como normalizado.
ConclusãoUm valor normalizado consistente de proteína‐C reativa e VHS por 8 a 12 semanas em um paciente assintomático pode ser um indicador de doença controlada, embora não de cura. Portanto, o uso apenas nesses marcadores para a interrupção do antibiótico pode ser causa de recidiva. Eles devem ser usados com cautela quando não há acesso a exames mais específicos. Em centros de atendimento terciários, o seguimento com exames de imagem pode ser feito com base nos títulos desses marcadores inflamatórios, o que limita a exposição dos pacientes à radiação.
A osteomielite da base de crânio (OBC) popularmente conhecida como otite externa maligna (OEM) ou otite externa necrosante é uma osteomielite potencialmente fatal que frequentemente afeta diabéticos idosos.1,2 A mortalidade associada, a qual costumava atingir 50%, apresentou redução significativa nos últimos tempos com a melhoria dos regimes de antibioticoterapia e do controle glicêmico. Embora a apresentação da doença seja predominantemente auricular, osteomielite central ou atípica da base do crânio também já foi relatada.3–6
O diagnóstico de OBC é baseado principalmente nas características clínicas, cultura do material, radiologia e histologia.2 Os critérios diagnósticos de Levenson incluem otite externa refratária, otalgia noturna grave e otorreia purulenta associada à infecção por Pseudomonas e presença de tecido de granulação em um paciente imunocomprometido ou diabético.7–9 É um fato bem conhecido que a velocidade de hemossedimentação (VHS) e a proteína C‐reativa (PCR) se encontram elevadas na OBC.10,11 Não existem, entretanto, diretrizes para o uso eficaz desses marcadores no seguimento e tratamento da OEM. Esses valores tendem a estar acima da faixa normal, mesmo quando os pacientes se tornam assintomáticos. Exames híbridos mais modernos, como a tomografia computadorizada por emissão de pósitrons PET/TC com 18F‐FDG e ressonância magnéticas (RNM), são ferramentas específicas no diagnóstico e acompanhamento de OBC.12 Outras técnicas apresentam várias desvantagens no diagnóstico e monitoramento da OBC. A TC de alta resolução com contraste, por exemplo, detecta erosão óssea quando há desmineralização de 30% ou mais; e embora a RNM seja eficaz na diferenciação de tecidos moles e na detecção de edema da medula óssea, ela não é capaz de avaliar a resposta e a resolução da doença.13 Modalidades de imagem nuclear, como cintilografia com tecnécio e gálio, são boas ferramentas diagnósticas, embora a resolução espacial deficiente seja uma desvantagem.12,14 A varredura com Tc‐99 detecta até mesmo um aumento de 10% na atividade osteoblástica e, portanto, detecta a osteomielite precocemente. Essa técnica é pouco dispendiosa e facilmente disponível. Entretanto, mostra positividade somente em condições com alto turnover ósseo, como no estado pós‐operatório ou malignidade com envolvimento ósseo. Além disso, recede com a melhoria clínica do paciente; portanto, não pode ser usada adequadamente no acompanhamento da resposta ao tratamento. O citrato de gálio 67, por sua vez, mostra normalização com a resposta ao tratamento e, portanto, é usado no monitoramento dessa resposta. O alto custo e as altas doses de radiação são as suas desvantagens. Ambos os marcadores gama têm baixa resolução espacial e não fornecem detalhes anatômicos. Há uma melhoria com o uso de emissores beta, como o FDG.
O ponto crucial do tratamento é o uso de antibióticos sistêmicos de duração variável até que os sintomas diminuam.2 O profissional médico enfrenta um dilema quanto à sua escolha, trocas frequentes e momento de encerramento do curso de antibioticoterapia. A combinação da terapia medicamentosa com o custo das modalidades de imagem para o diagnóstico e acompanhamento tem um custo financeiro para os pacientes.
ObjetivosO principal objetivo do estudo foi comparar a acurácia diagnóstica da PCR e da VHS como fatores prognósticos na OBC quando comparada à tomografia computadorizada com 18‐FDG – PET. O objetivo secundário foi obter um valor numérico para esses marcadores como fatores decisivos na descontinuação do antibiótico.
MétodoO protocolo do estudo foi revisado e aprovado pelo comitê de ética institucional de nosso instituto (IRB‐AIMS 2018−029) e estava de acordo com os padrões éticos estabelecidos na Declaração de Helsinque. Todas as intervenções e investigações foram feitas com o consentimento informado do paciente. Um estudo transversal prospectivo de acurácia diagnóstica foi conduzido por 24 meses em um centro de atendimento terciário com uma carga anual de pacientes ambulatoriais de otorrinolaringologia de aproximadamente 30.000. Devido à falta de estudos semelhantes, um estudo‐piloto foi feito em 20 pacientes e as observações foram usadas para delinear o presente estudo. Inicialmente, havia 70 pacientes, mas alguns deixaram de fazer o acompanhamento. No fim, 51 pacientes estavam disponíveis para análise.
A OBC foi diagnosticada em pacientes com história de otite externa refratária, imunocomprometimento, histopatologia do tecido de granulação, se disponível, radiologia e títulos elevados de VHS e PCR. A OBC central foi diagnosticada principalmente através de exames de imagens e títulos elevados de PCR e VHS. Em casos selecionados, exames laboratoriais foram feitos para descartar outras condições inflamatórias, como tuberculose e doenças vasculares do colágeno. Os marcadores foram monitorados semanalmente por 6 a 8 semanas de tratamento. A faixa normal institucional da PCR foi de 0‐1mg/L e da VHS foi de 8‐20mm/hora. Se o paciente continuasse sintomático (dor e otorreia) no fim de 6 a 8 semanas, os marcadores eram monitorados mensalmente.
A varredura por PET‐CT era geralmente feita em todos os pacientes no início e no fim da 6ª a 8ª semanas de tratamento. Para os pacientes que relataram que TC ou RM tinha sido feita em outro local, não foi exigida uma PET‐CT diagnóstica adicional, embora todos tenham sido submetidos à PET‐CT em 6 a 8 semanas. O equipamento GE Discovery PET/TC foi usado para o 18‐FDG‐PET/TC. O paciente foi mantido em jejum por 4 horas antes do procedimento e as imagens obtidas por uma câmera integrada de PET/TC, 45 minutos após a injeção de F‐18 FDG (0,1 mCi×peso em Kg). Um SUV (valor de captação padronizado) de 2,5 foi considerado como ponto de corte para diferenciar entre malignidade e OBC. Valores abaixo de 2,5 foram considerados inflamatórios.15 Um nível matinal de glicose no sangue entre 80 e 150mg/dL foi considerado um intervalo seguro para a varredura. O laudo foi feito por um especialista em imagem nuclear, com interesse especial nessa área. Após obter uma imagem com 6 a 8 semanas de tratamento, a varredura de repetição foi feita a cada três meses até que se tornasse metabolicamente inativa ou antes, se os marcadores se tornassem normais ou o paciente se tornasse assintomático. TC ou ressonância magnética adicionais foram feitas somente em caso de sintomas recentes.
Secreção auricular ou amostra de tecido de granulações foram submetidas a cultura na consulta inicial. Enquanto aguardavam as culturas, os pacientes iniciaram o tratamento empiricamente com ceftazidima intravenosa (IV) (2 gramas por dose a cada 12 horas) ou piperacilina‐tazobactam (4,5 gramas de 8 em 8 horas) combinada com ciprofloxacina IV ou oral (IV ‐ 400 miligramas [mg] de 12 em 12 horas; oral, 750mg de 12 em 12 horas). Se o paciente continuasse sintomático após duas semanas do início da terapia antimicrobiana, uma amostra de tecido profundo era considerada. Os locais de amostragem incluíram mastoide, clivo, asa maior do esfenoide, côndilo mandibular, canal carotídeo, forame jugular, tuba auditiva e anel timpânico. As amostras foram rotineiramente enviadas para exame histopatológico e submetidas a culturas para fungos, bactérias e bacilos álcool‐ácido resistentes. Naqueles pacientes já submetidos a terapia com múltiplos fármacos, um exame de DNA por reação em cadeia de polimerase foi feito com sequenciamento de genes para melhoria do produto. Quando viável, um desbridamento com o objetivo de eliminar a doença sem causar mais morbidade foi tentado durante a obtenção da amostra de tecido profundo.
Os antibióticos foram administrados por meio de um PICC (cateter central de inserção periférica) por um período mínimo de 6 a 8 semanas. O tratamento foi geralmente interrompido quando o PET tornou‐se normal. Se o paciente permanecesse sintomático durante o uso de antibióticos e as culturas fossem negativas, era iniciado o tratamento com antifúngicos. O tratamento antifúngico empírico também foi administrado a pacientes nos quais a obtenção de amostras de tecido profundo não havia sido feita. Foi administrado voriconazol IV em dose de ataque de 6mg/kg a cada 12 horas por 2 doses, seguidas por doses de 3mg/kg por via intravenosa ou 200mg via oral de 12 em 12 horas como dose de manutenção.
A análise estatística foi feita com o software IBM SPSS. As variáveis estudadas foram os valores de PCR, VHS, atividade do PET scan e os sintomas do paciente durante o tratamento. O teste de qui‐quadrado de McNemar foi aplicado para comparar a PCR e a VHS com a PET/TC. Foram calculados os parâmetros de validade diagnóstica – sensibilidade, especificidade, valores preditivos positivos e negativos e acurácia da PCR e VHS com relação à FDG‐ PET/TC. Um nível alfa ≤0,05 (valor de p) foi considerado estatisticamente significante.
ResultadosDos 51 pacientes, 27 tinham OBC central. O paciente mais jovem tinha 45 anos e o mais velho, 88. O perfil demográfico é apresentado na tabela 1. Pseudomonas aeruginosa (21,6) foi o organismo mais comumente isolado, seguido por espécies de Aspergillus (11,8). O grupo polimicrobiano ou sem crescimento representou 31,4%. Vinte e oito (54,9%) pacientes foram submetidos a desbridamento.
Perfil da população do estudo
| n=51 | Porcentagem (%) | |
|---|---|---|
| Sexo | ||
| Feminino | 12 | 23,5 |
| Masculino | 39 | 76,5 |
| Diabetes mellitus | 48 | 94,1 |
| Flora microbiana | ||
| Pseudomonas aeruginosa | 11 | 21,6 |
| Espécie Aspergillus | 6 | 11,8 |
| Espécie Candida | 5 | 9,8 |
| Staphylococcus aureus | 2 | 3,9 |
| Sem culturas / crescimento polimicrobiano | 16 | 31,4 |
| Desbridamento | 28 | 54,9 |
Predominância do sexo masculino (76,5%) e alta associação com diabetes (94,1%); Pseudomonas (21,6%) seguido por Aspergillus (11,8%) e Candida (9,8%) foram os principais organismos.
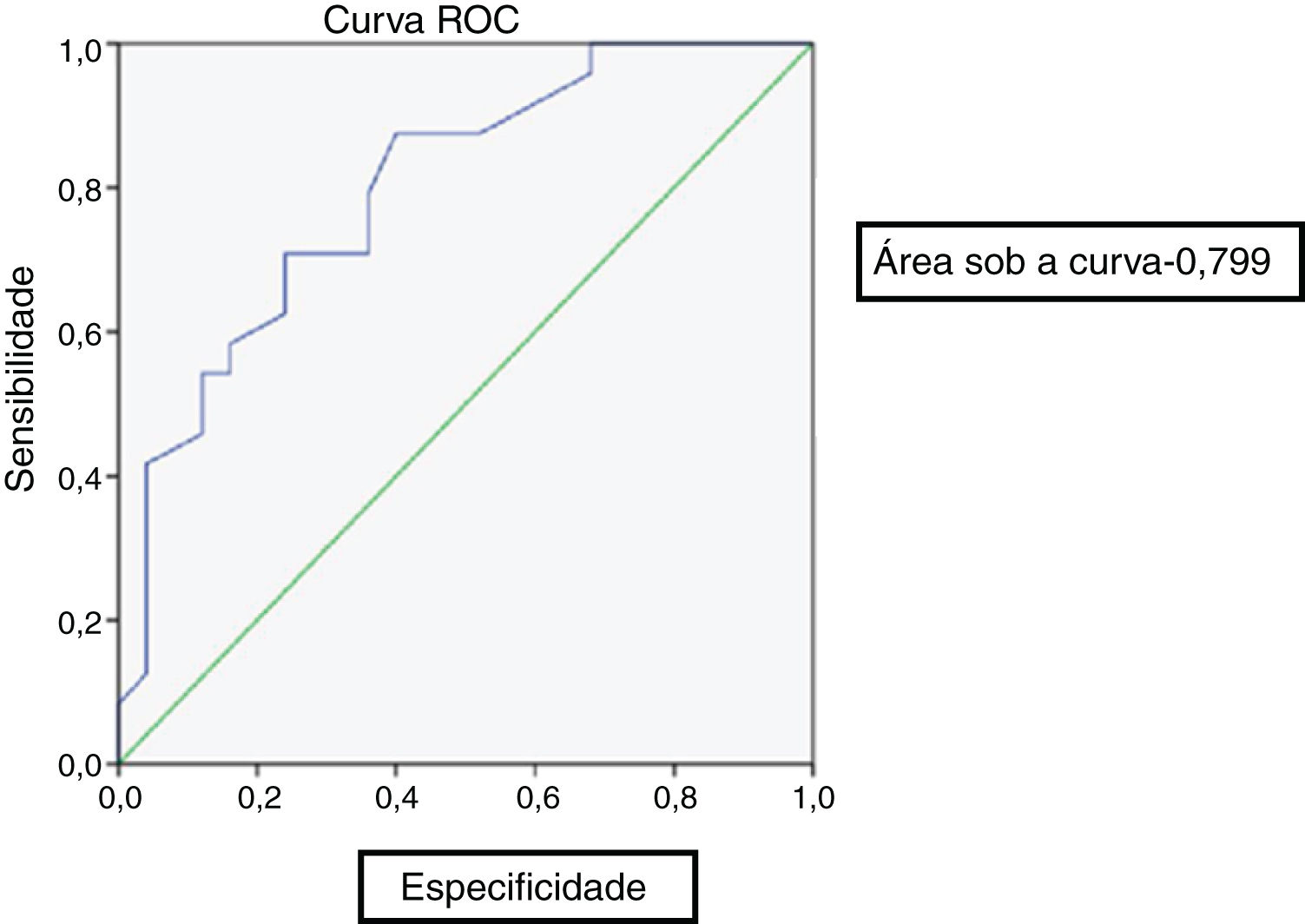
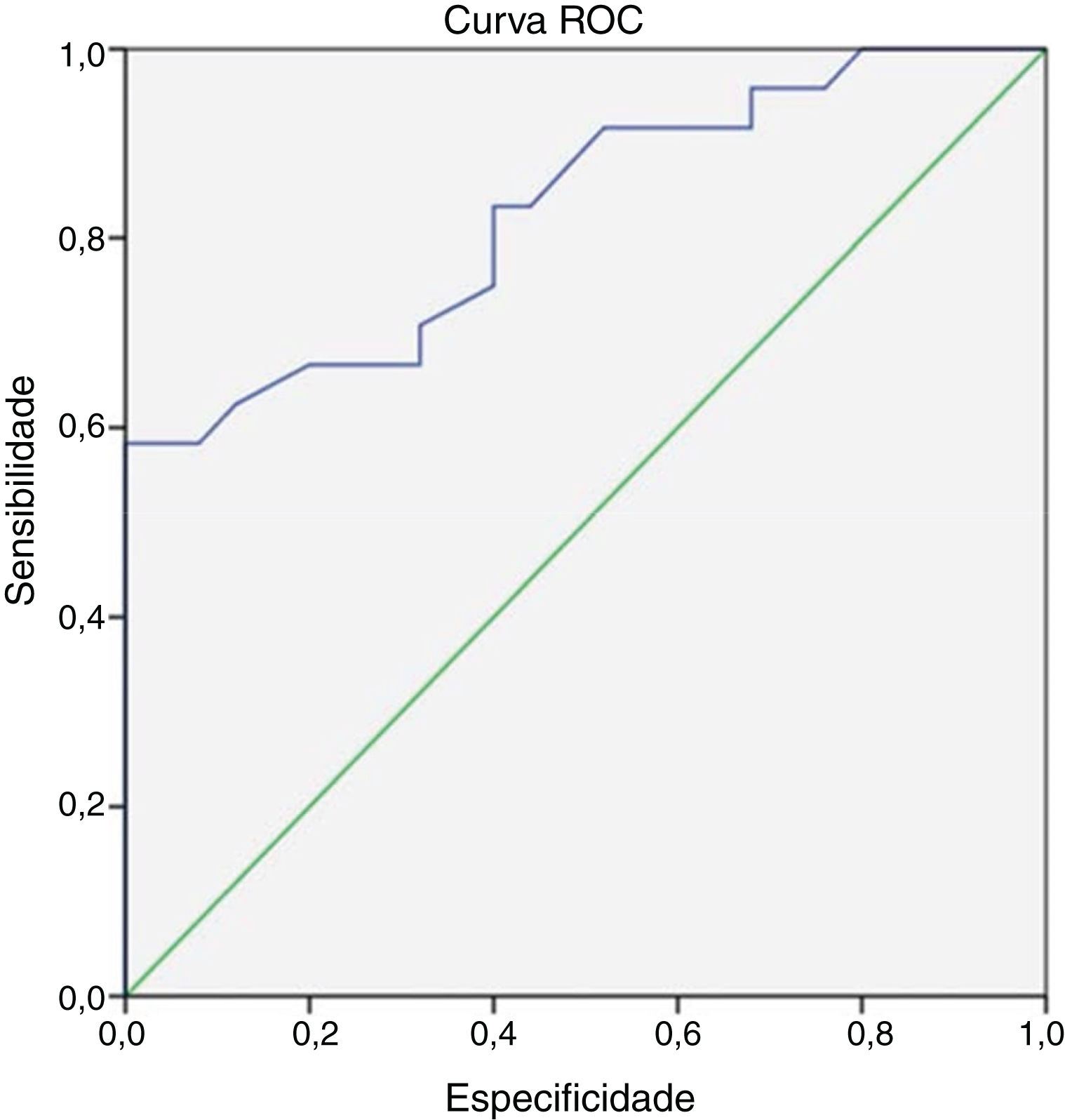
No fim de 8 semanas de tratamento, 30 pacientes estavam assintomáticos (tabela 2). Desses, 28 não apresentaram atividade metabólica no PET. Considerando esse fato como cura, o nível de PCR e VHS correspondente foi avaliado. Apenas 3 pacientes atingiram o valor institucional normal de PCR e VHS. Assim, um valor de corte para normalidade foi calculado para os marcadores através da curva ROC (fig. 1). O valor de corte para a PCR foi de 3,6mg/L com sensibilidade de 87% e especificidade de 60%, o que foi estatisticamente significante com p=0,002. De maneira similar, o valor de corte para VHS foi de 35mm/hora, com sensibilidade de 83% e especificidade de 60%, estatisticamente significante, com valor de p=0,013 (fig. 2). Dos 28 pacientes assintomáticos com PET negativo, 17 alcançaram o valor de corte para PCR e 16 para VHS. A PCR apresentou uma especificidade de 82,6% e uma sensibilidade de 60,7% e a VHS apresentou uma especificidade de 73,9% e uma sensibilidade de 57,1% quando comparada com o PET como um marcador de prognóstico, com uma concordância de 70,6 e 64,7 respectivamente, com significância estatística (tabela 3). No fim da análise da resposta dos pacientes depois de 8 semanas de tratamento, 30 pacientes estavam assintomáticos sem dor e secreção e interromperam o tratamento. Isso incluiu os dois pacientes com atividade positiva no PET, mas com marcadores normalizados. Todos esses pacientes continuaram assintomáticos até o fim do estudo.
Titulações de VHS, PCR, atividade metabólica de PET‐CT e resposta do paciente ao tratamento, mostra os títulos semanais dos marcadores e sua relação com a atividade metabólica do PET‐CT no início do tratamento e no fim de 6 semanas. O estado sintomático dos paciente no fim do período de estudo (6 semanas a 15 meses) é mostrado. Estão incluídos antibióticos cultura‐específicos administrados durante o curso do tratamento
| P n° | Idade (anos) | Sexo | Diagnóstico | PCR | VHS | Atividade PET inicial | PET CT final | Cultura | Tratamento Médico | Debridamento / Biópsia | Estado assintomático / estado do tratamento | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Semana 1 | Semana 2 | Semana 3 | Semana 4 | Semana 5 | Semana 6 | Semana 1 | Semana 2 | Semana 3 | Semana 4 | Semana 5 | Semana 6 | ||||||||||
| 1 | 67 | M | OEM | 3,5 | 18 | 6,4 | 29 | 27 | 28 | 29 | 28 | 51 | 59 | 99 | 102 | Não feito | Não | Sem crescimento | Itraconazol/ Piperacilina/tazobactam /ciprofloxacina | Sim | 3 meses |
| 2 | 76 | M | OBC central | 0,5 | 32 | 71 | 26 | 7 | 2 | 7 | 25 | 81 | 74 | 72 | 44 | Sim | Não | Aspergillus flavus | Fortium Inj. / voriconazol/ ciprofloxacina | Sim | 4 meses |
| 3 | 53 | M | OBC central | 11 | 20 | 13 | 9 | 4 | 4 | 55 | 55 | 56 | 40 | 36 | 10 | Sim | Sim | Klebsiella | Linezolida e vancomicina, Magnex voriconazol, meropenem, minociclina | Sim | 3 meses |
| 4 | 62 | F | OBC central | 23 | 30 | 38 | 20 | 15 | 9 | 91 | 101 | 83 | 56 | 34 | 30 | Sim | Não | Sem cultura | Ceftazidima, amicacina e Metrogyl, Magnex IV e linezolida oral e voriconazol, Piperacilina/tazobactam e ciprofloxacina | Sim | 6 semanas |
| 5 | 65 | M | OBC central | 24 | 117 | 68 | 23 | 21 | 14 | 107 | 108 | 113 | 108 | 97 | 50 | Sim | Não | Sem crescimento | Piperacilina, voriconazol | Sim | Perdido no seguimento |
| 6 | 61 | M | OBC central | 91 | 74 | 54 | 63 | 47 | 34 | 56 | 74 | 61 | 34 | 67 | 54 | Sim | Não | Aspergillus flavus | Voriconazol | Sim | 5 meses |
| 7 | 64 | F | OBC central | 13 | 10 | 9 | 4 | 3 | 2 | 19 | 52 | 54 | 43 | 40 | 38 | Sim | Sim | Chrysosporium, Pseudomonas aeruginosa | Ceftazidima, voriconazol, ciprofloxacina, fluconazol | Sim | 2 meses |
| 8 | 55 | M | OBC central | 24 | 110 | 68 | 23 | 21 | 14 | 98 | 108 | 103 | 108 | 97 | 50 | Sim | Não | Sem cultura | Ceftazidima | Não | 2 meses |
| 9 | 70 | M | OBC central | 11 | 20 | 13 | 9 | 4 | 4 | 55 | 55 | 56 | 40 | 36 | 30 | Sim | Sim | Sem cultura | Piperacilina | Não | Óbito |
| 10 | 73 | M | OBC central | 25 | 21 | 16 | 10 | 5 | 2 | 95 | 104 | 87 | 60 | 54 | 43 | Sim | Não | Candida parapsilosis | Voriconazol, piperacilina, meropenem | Sim | 6 semanas |
| 11 | 45 | M | OBC central | 24 | 21 | 15 | 8 | 3 | 1 | 67 | 80 | 57 | 65 | 45 | 14 | Sim | Não | Staphylococcus aureus | Voriconazol, piperacilina, clindamicina, Cloxacilina, linezolida, ciprofloxacina | Sim | Recebeu antibióticos por 1 ano e 1 mês, paciente teve alívio sintomático após 2 meses |
| 12 | 78 | M | OEM | 40 | 32 | 25 | 20 | 15 | 5 | 90 | 74 | 70 | 35 | 44 | 52 | Sim | Não | Pseudomonas, Candida albicans | Ciprofloxacina e Cefoperazona | Não | 2 meses |
| 13 | 60 | M | OBC central | 0,7 | 3,6 | 4 | 4,2 | 3 | 3,3 | 70 | 96 | 103 | 97 | 88 | 58 | Sim | Não | Enterococcus fecalis | Ceftazidima, ciprofloxacina, piperacilina, linezolida, fluconazol | Sim | Perdido no seguimento |
| 14 | 66 | F | OEM | 40 | 43 | 38 | 21 | 22 | 4 | 70 | 34 | 42 | 68 | 52 | 34 | Sim | Não | Sem crescimento | Ceftazidima, ciprofloxacina, voriconazol | Não | Perdido no seguimento após 6 meses IV e voriconazol |
| 15 | 66 | M | OEM | 1,5 | 5,1 | 4 | 2,3 | 1,9 | 0,7 | 40 | 73 | 57 | 52 | 40 | 46 | Sim | Não | Bactérias gram‐negativas | Piperacilina voriconazol, Itraconazol | Não | 2 meses |
| 16 | 78 | M | OEM | 20 | 17 | 10 | 9 | 9,2 | 1 | 60 | 61 | 58 | 44 | 30 | 29 | Sim | Não | Sem crescimento | Ceftazidima | Sim | 2 meses |
| 17 | 63 | M | OBC central | 30 | 120 | 210 | 344 | 400 | 412 | 70 | 77 | 92 | 100 | 90 | 102 | Sim | Sim | Sem crescimento | Piperacilina voriconazol, clindamicina | Sim | Antibióticos por 1 mês, morreu devido a choque séptico |
| 18 | 77 | M | OEM | 6,5 | 16 | 22 | 30 | 32 | 23 | 54 | 44 | 40 | 36 | 28 | 18 | Sim | Sim | Citrobacter koseri Klebsiella pneumoniae, Enterococcus fecalis | Ceftazidima, ciprofloxacina | Sim | 2 meses |
| 19 | 65 | M | OEM | 36 | 106 | 88 | 42 | 56 | 2 | 86 | 74 | 66 | 42 | 30 | 36 | Sim | Sim | Pseudomonas aeruginosa | Ciprofloxacina, piperacilina | Sim | 2 meses |
| 20 | 68 | M | OBC central | 10 | 22 | 8,04 | 4 | 1,3 | 11 | 96 | 42 | 36 | 53 | 50 | 52 | Sim | Sim | Candida haemulonii | Meropenem, voriconazol | Sim | 6 meses |
| 21 | 72 | M | OBC central | 47 | 79 | 13 | 31 | 26 | 23 | 96 | 107 | 97 | 90 | 88 | 80 | Sim | Sim | Kodamaea ohmeri | Cefoperazona, voriconazol, anfotericina | Não | 6 meses |
| 22 | 73 | M | OEM | 10 | 7,2 | 9,6 | 6 | 8 | 9,8 | 83 | 72 | 94 | 79 | 87 | Sim | Sim | Pseudomonas aeruginosa | Cefoperazona, ciprofloxacina, piperacilina, voriconazol | Sim | 4 semanas de Piperacilina/tazobactam e 4 meses de voriconazol | |
| 23 | 59 | M | OEM | 23 | 20 | 16 | 10 | 4 | 2 | 74 | 55 | 42 | 33 | 20 | 28 | Sim | Não | Sem cultura | Piperacilina, ciprofloxacina | Não | 6 semanas |
| 25 | 62 | M | OEM | 11 | 6,1 | 5,5 | 10 | 17 | 19 | 49 | 45 | 36 | 51 | 59 | 64 | Sim | Sim | Pseudomonas, Klebsiella, Streptococcus | Piperacilina, voriconazol | Sim | 8 meses de voriconazol e 3 meses de Piperacilina/tazobactam |
| 26 | 74 | F | OBC central | 16 | 10 | 8 | 2 | 1,4 | 0,8 | 46 | 43 | 36 | 29 | 20 | 16 | Sim | Não | Aspergillus flavus | Voriconazol, Cefoperazona, ciprofloxacina | Não | 2 meses |
| 27 | 72 | M | OBC central | 20 | 16 | 12 | 8 | 4 | 2 | 51 | 50 | 40 | 44 | 35 | 38 | Sim | Não | Sem crescimento | Ceftazidima, ciprofloxacina, piperacilina, linezolida, fluconazol | Não | 2 meses |
| 28 | 64 | F | OEM | 31 | 15 | 34 | 98 | 108 | 9 | 81 | 46 | 42 | 44 | 34 | 20 | Sim | Não | Pseudomonas aeruginosa | Ceftazidima | Não | 6 semanas |
| 29 | 61 | M | OEM | 7 | 16 | 18 | 15 | 93 | 1,3 | 50 | 61 | 76 | 85 | 53 | 25 | Sim | Não | Pseudomonas aeruginosa | Piperacilina, Cefoperazona, voriconazol | Sim | 3 meses |
| 30 | 71 | M | OBC central | 43 | 13 | 6,5 | 6,07 | 5 | 3,2 | 69 | 81 | 68 | 40 | 42 | 38 | Sim | Não | Sem crescimento | Cefoperazona, ciprofloxacina | Sim | 2 meses |
| 31 | 68 | M | OBC central | 1,4 | 17 | 16 | 13 | 14,5 | 14 | 50 | 54 | 90 | 92 | 66 | 60 | Sim | Sim | Sem cultura | Voriconazol, linezolida | Não | 7 semanas de voriconazol |
| 32 | 60 | M | OEM | 71 | 57 | 12,57 | 6,5 | 5,19 | 1,62 | 97 | 94 | 83 | 47 | 25 | 14 | Sim | Não | Sem crescimento | Piperacilina, meropenem | Sim | 3 meses |
| 33 | 70 | M | OEM | 11,58 | 11,94 | 27 | 24 | 10 | 2,28 | 61 | 56 | 81 | 32 | 35 | 30 | Sim | Não | Candida non albicans (SG), Pseudomonas aeruginosa (SG) | Voriconazol, anfotericina B, doxiciclina | Sim | 2 meses |
| 34 | 80 | F | OEM | 9,3 | 19 | 5,79 | 10,85 | 9,9 | 8 | 90 | 69 | 88 | 17 | 62 | 60 | Sim | Sim | Sem crescimento | Vancomicina, meropenem, voriconazol | Não | 10 semanas |
| 35 | 63 | F | OBC central | 8,59 | 11,19 | 10 | 9 | 6 | 5,6 | 97 | 30 | 32 | 40 | 20 | 18 | Sim | Não | Sem crescimento | Ceftazidima | Não | 6 semanas |
| 36 | 70 | F | OBC central | 17,68 | 24,46 | 67,31 | 50 | 46 | 30 | 37 | 57 | 60 | 48 | 32 | 50 | Sim | Sim | Staphylococcus aureus (MG), Candida albicans | Ceftazidima, ciprofloxacina | Não | Perdido no seguimento após 4 semanas |
| 37 | 56 | F | OBC central | 10 | 18,92 | 16 | 14 | 8,4 | 5,63 | 60 | 63 | 71 | 74 | 65 | 60 | Sim | Sim | Sem cultura | Voriconazol | Não | 4 meses |
| 38 | 54 | M | OEM | 4,76 | 4,7 | 11,5 | 11 | 16,8 | 4,3 | 37 | 47 | 57 | 47 | 30 | 36 | Sim | Sim | Candida non albicans (MG) | Meropenem, voriconazol | Sim | 6 meses |
| 39 | 62 | M | OBC central | 10 | 7 | 5 | 3 | 11 | 9 | 46 | 47 | 44 | 38 | 42 | 40 | Sim | Sim | Pseudomonas aeruginosa (MG) | Ceftazidima | Não | 2 meses |
| 40 | 75 | M | OEM | 3 | 2 | 54 | 15 | 2 | 0,93 | 23 | 23 | 30 | 27 | 10 | 5 | Sim | Não | Candida albicans | Ceftazidima | Não | 6 semanas |
| 41 | 75 | M | OEM | 20 | 22 | 35 | 40 | 30 | 20 | 44 | 50 | 38 | 30 | 67 | 100 | Sim | Sim | Aspergillus flavus,Enterobacter sp. | Ciprofloxacina, Cefoperazona | Sim | 6 meses |
| 42 | 73 | M | OEM | 11 | 31 | 20 | 14 | 9,14 | 1,66 | 103 | 100 | 100 | 115 | 80 | 70 | Sim | Sim | Aspergilose invasiva | Ciprofloxacina, Cefoperazona | Sim | 2 meses |
| 43 | 71 | M | OEM | 8,38 | 17,26 | 22,4 | 20 | 15 | 13,2 | 30 | 80 | 54 | 40 | 60 | 76 | Sim | Sim | Sem crescimento | Ciprofloxacina, Ceftazidima | Sim | ˃ 8 meses |
| 44 | 75 | M | OBC central | 66 | 54 | 6,8 | 2,1 | 4 | 5 | 12 | 15 | 8 | 14 | 7 | 6 | Sim | Não | Pseudomonas aeruginosa (crescimento moderado), Staphylococcus aureus | Ciprofloxacina, Cefoperazona | Não | 3 meses |
| 45 | 65 | F | OEM | 152 | 112 | 95 | 88 | 70 | 73 | 74 | 74 | 80 | 64 | 123 | 80 | Sim | Sim | Aspergillus fumigatus | Cefoperazona, ciprofloxacina, voriconazol | Não | Perdido no seguimento após 6 semanas |
| 46 | 71 | M | OEM | 47 | 70 | 13 | 31 | 26 | 2 | 90 | 100 | 97 | 90 | 80 | 19 | Sim | Sim | Staphylococcus aureus, Chrysosporium sp. | Voriconazol, terbinafina | Sim | 6 meses |
| 47 | 70 | F | OEM | 4,76 | 4,7 | 11,5 | 12 | 16,8 | 4,3 | 60 | 50 | 52 | 38 | 32 | 24 | Sim | Não | Pseudomonas aeruginosa (pouco crescimento) | Ciprofloxacina, Ceftazidima | Não | 3 meses |
| 48 | 57 | M | OEM | 24,9 | 1,3 | 22,4 | 80,9 | 52 | 34 | 38 | 30 | 24 | 18 | 20 | 67 | Sim | Sim | Pseudomonas aeruginosa (crescimento significativo) | Ceftazidima, piperacilina | Sim | Perdido no seguimento após 4 meses |
| 48 | 62 | F | OBC central | 12 | 6,1 | 5,5 | 10 | 2,32 | 1,38 | 30 | 44 | 50 | 19 | 52 | 27 | Sim | Não | Pseudomonas aeruginosa,Chrysosporium | Ceftazidima, ciprofloxacina | Sim | 2 meses |
| 50 | 69 | M | OBC central | 31 | 13 | 34 | 98 | 108 | 10 | 81 | 42 | 42 | 44 | 34 | 20 | Sim | Não | Aspergillus flavus | Ciprofloxacina, Cefoperazona, Itraconazol | Não | 3 meses |
| 51 | 88 | M | OBC central | 22,56 | 8,4 | 70 | 60 | Não | Pseudomonas aeruginosa | Ceftazidima, ciprofloxacina | Não | 3 meses | |||||||||
No fim de 8 semanas, os 21 pacientes restantes apresentaram atividade positiva (tabela 2). Eles foram monitorados por mais tempo, embora isso estivesse além do período de estudo planejado. Desses, 4 pacientes tinham PCR normalizada e 4 tinham VHS normalizada. Desses 21 pacientes, 9 interromperam o tratamento em 6 meses. Outros quatro pacientes completaram o tratamento em 15 meses. Dos 51 pacientes, 43 completaram o tratamento com sucesso. Dos 8 pacientes restantes, enquanto dois tiveram recidiva, dois sucumbiram à longa doença. Seis pacientes perderam seguimento no fim de 6 meses, dos quais metade eram assintomática com tratamento com antibióticos em andamento, esperavam os marcadores se estabilizarem. Re‐hospitalizações foram observadas em quatro pacientes que receberam voriconazol com transaminite e outros dois com recidiva.
DiscussãoVários estudos, inclusive o nosso, observaram uma distribuição por sexo que favoreceu a predominância masculina. Devido à raridade da doença, nosso tamanho de amostra foi pequeno, embora seja comparável a outros estudos. Não encontramos osteomielite pediátrica, ao contrário de Truck e Thompson et al., que descreveram 2 casos nos quais o clivo era afetado.16 Tivemos 48 pacientes diabéticos. Shaun e Shyang et al. relataram que 94,7% de seus 18 pacientes eram diabéticos.17
Em um estudo de 22 pacientes de Shaun et al., os microrganismos foram identificados em apenas 63,2%. Nicholas et al. relataram 31 casos de OBC nos quais 61% desenvolveram Pseudomonas (49% eram sensíveis à ciprofloxacina e 16% resistentes), seguido por espécies de Aspergillus (10%).
A monoterapia com ciprofloxacina foi o tratamento de escolha inicialmente na OBC.17 Tivemos quase o mesmo número de casos com crescimento de Pseudomonas e fungos (tabela 1). Nossos pacientes receberam antifúngicos por 6 meses a um ano, semelhantemente ao estudo de Volsky.18 Considerando a alta incidência de organismos fúngicos, é importante ponderar se a administração de antibióticos em longo prazo poderia ter predisposto a infecção fúngica secundária. Entretanto, não há literatura disponível sobre essa possibilidade.
Dos 51 pacientes, 23 foram tratados apenas com medicação e 28 foram submetidos a algum tipo de desbridamento cirúrgico (tabela 2). A eliminação completa ou quase completa da doença foi possível apenas em 12 pacientes. O local e a morbidade foram os principais fatores na limitação do desbridamento nos 16 pacientes restantes. Todos os 12 pacientes com bom clearence local apresentaram melhoria imediata após o procedimento. Alguns deles receberam mudança na antibioticoterapia pós‐procedimento. Portanto, é difícil dizer se a melhoria foi devido apenas à cirurgia. Mas, clinicamente, sentimos que o debridamento cirúrgico completo encurtou a duração do tratamento, além de propiciar a obtenção de culturas positivas. Entretanto, em um estudo de Nicholas et al., apenas 3 dos 18 pacientes foram submetidos à cirurgia sem melhoria.19 No estudo de Sang et al., 9 entre 28 pacientes foram submetidos a tratamento cirúrgico. Eles relataram que as culturas intraoperatórias não produziram informações adicionais além das obtidas com as amostras de swabs da orelha e a doença persistiu.16 Nossa experiência mostrou o contrário, inclusive os dois pacientes com desbridamento intracraniano que se recuperaram rapidamente após o procedimento. Pode ser recomendado optar pelo desbridamento completo, se possível, para encurtar a duração do tratamento. Khan et al. opinaram sobre a necessidade de debridamento cirúrgico quando o tratamento se prolonga.20 Shaun et al. descreveram a duração variável da terapia com antibióticos, de um a 6 meses.8 A Bone Infection Unit em Oxford, Inglaterra, recomendou o tratamento intravenoso de 6 semanas, seguido por 6 a 12 meses de medicação oral, orientado pela resposta clínica. Nossos pacientes receberam antimicrobianos por 6 semanas a 15 meses.
No momento do diagnóstico, tanto a PCR quanto a VHS estavam elevadas em todos os casos. Aqueles que responderam mostraram alívio da dor e secreção com tendência a diminuição dos níveis da PCR seguida pela VHS. A diminuição dos níveis se correlacionou com a redução da atividade metabólica no PET. Não encontramos literatura disponível sobre OBC a esse respeito para efeito de comparação. Não houve correlação com a extensão da doença, embora clinicamente consideremos que as lesões clivais que se estendem para ambos os lados da base do crânio não responderam bem. O estudo de Michail et al. sobre a osteomielite do pé diabético estudou a utilidade da PCR, da VHS, contagem total e procalcitonina como marcadores de atividade.21 Eles opinaram que não se podia basear apenas nesses valores para prever o resultado. Todos os marcadores diminuíram com o tratamento, mas a VHS continuamente elevada foi um indicador de osteomielite em curso. O estudo de Shaun relatou que a contagem total era um marcador melhor, diferentemente de nossa observação, na qual a contagem total foi normal para a maioria dos pacientes.16 Pacientes com doença que apresentou resolução após 6 a 8 semanas de terapia intravenosa mostraram uma redução de 21,71% nos valores médios de VHS em comparação com o grupo com doença persistente, no qual os valores de VHS permaneceram inalterados. Uma tendência semelhante de queda também foi observada nos níveis de PCR. Nenhum de nossos pacientes atingiu o valor normal institucional de PCR e VHS quando estava livre de sintomas ou da doença. Mas esses pacientes atingiram o valor de corte para PCR (≤ 3,6mg/L) e para VHS (≤ 35mm/hora). Ambos foram considerados estatisticamente significantes. A VHS demorou mais para normalizar. Uma vez que um estudo semelhante não havia sido feito antes, nenhuma literatura anterior estava disponível para comparação. Esses valores podem ser considerados como indicadores para interromper o tratamento. Em nossa série, um paciente assintomático apresentou um aumento na PCR e VHS após um procedimento cirúrgico não relacionado. Em nosso estudo, a PCR apresentou especificidade de 82,6% e sensibilidade de 60,7% e a VHS apresentou especificidade de 73,9% e sensibilidade de 57,1% quando comparada à PET. Embora os valores fossem menores, eles foram estatisticamente significantes e observamos que também eram clinicamente significativos. Foi particularmente útil levar em consideração o tempo de feitura da PET quando o paciente se tornou assintomático.
No fim de 8 semanas, 17 dos 30 pacientes assintomáticos atingiram o valor de corte da PCR e 16 atingiram o valor de corte da VHS. Houve uma excelente correlação entre os marcadores inflamatórios e a PET/TC. Verificamos que a TC e a ressonância magnética não eram ferramentas confiáveis para avaliar a resposta ao tratamento, exceto para encontrar novas áreas de envolvimento em caso de desenvolvimento de novos sintomas. Kroonenburgh et al. mencionaram as desvantagens da TC e da RNM em relação à PET/TC.12 A tomografia computadorizada avalia tecidos moles e as estruturas intracranianas, além de sua incapacidade de distinguir infecção de malignidade. Como a normalização das alterações ósseas pode nunca ocorrer, apesar da resolução da infecção, a TC é limitada no rastreamento da resposta ao tratamento. A ressonância magnética geralmente não é útil no monitoramento da resposta à terapia em pacientes com osteomielite, porque as alterações medulares causadas pela inflamação levam de 2 a 6 meses para voltar ao normal. De acordo com Gherini et al., a TC com emissão de fóton único melhora o monitoramento da terapia.22 Fizemos um PET/TC no fim de 6 a 8 semanas em todos os pacientes e, posteriormente, para monitorar a progressão da doença, se necessário. Havia 10 pacientes assintomáticos que recebiam antibióticos intravenosos com PET/TC e mostraram atividade metabólica persistente. A PCR e a VHS nesses pacientes mostraram valores consistentemente estáveis na faixa de corte, evidenciaram que os marcadores inflamatórios podem prever a resolução da doença antes do FDG‐PET/TC. Uma comissão médica formada por profissionais dos departamentos de otorrinolaringologia, controle de doenças infecciosas, medicina nuclear, neurocirurgia e microbiologia, discutiu um plano de ação adicional para esses 10 pacientes e decidiu suspender os antimicrobianos nos pacientes com marcadores normalizados por mais de 3 meses com monitoramento mensal de PCR e VHS e FDG‐PET/TC trimestral. Entre esses 10 pacientes assintomáticos nos quais o tratamento foi interrompido com base em uma decisão da comissão médica, dois tiveram exacerbações. Outros dois não mostraram atividade metabólica depois de quase um ano. Portanto, um valor normalizado estável e consistente de PCR e VHS pode indicar o controle da doença, embora não a cura. Todos os pacientes sem atividade metabólica na avaliação por PET permaneceram sem sintomas até o momento, o que indica cura. As observações indicam o fato de que os pacientes com OBC durante o uso de antibióticos mostraram um padrão previsível de se tornarem assintomáticos primeiro, seguido por níveis de PCR normalizados e depois VHS normalizada, seguidos por imagem de varredura híbrida. O tratamento deve continuar em um paciente assintomático até que o PET se torne normal ou até que os marcadores inflamatórios mostrem valores normalizados estáveis.
Durante o curso do estudo, desenvolveu‐se um padrão de tratamento, o qual foi seguido. Antibióticos cultura‐específicos (se disponíveis) foram administrados preferencialmente como terapia combinada por um mínimo de 6 a 8 semanas em um paciente com uma resposta positiva. Com uma resposta pobre, a primeira tentativa seria feita para obter uma amostra de tecido profundo. Os antifúngicos foram iniciados em pacientes sintomáticos sem cultura e que não responderam ao tratamento empírico. Observamos que geralmente os não respondedores eram OBC fúngicos. Os antifúngicos exigiram uma duração mais longa, de 6 meses a um ano ou mais, em comparação com os antibióticos. Agora descontinuamos os antibióticos em um paciente que está clinicamente assintomático com PET negativo no fim de 6 a 8 semanas. Se o PET continuasse a mostrar atividade após o tratamento prolongado, os antibióticos eram interrompidos quando os marcadores inflamatórios atingissem e se estabilizassem no valor de corte de ≤ 3,6mg / L para PCR e ≤ 35mm/hora para VHS por pelo menos 8 a 12 semanas. Isso foi baseado em nossa observação de 10 pacientes assintomáticos com marcadores estáveis, mas doença ativa na varredura por PET. Esses pacientes foram monitorados mensalmente para observar títulos crescentes e pela feitura do PET a cada 3 meses.
Nossas observações podem ser usadas com algum cuidado em ambientes com poucos recursos, onde não há acesso a exames de imagens híbridas. Em um estabelecimento de cuidados terciários, isso ajuda a levar em consideração o tempo de feitura da imagem por PET para decidir sobre o momento do término da antibioticoterapia. A repetição do exame de imagem pode ser feita se os marcadores inflamatórios se estabilizarem por 8 a 12 semanas. O tamanho da amostra foi limitado devido à raridade da doença e ao longo tempo de seguimento necessário. Um estudo semelhante com PET/RNM com sua avaliação funcional e resolução espacial superiores e, obviamente, menor radiação é necessário.23 A população do estudo com múltiplas combinações terapêuticas pode ter atuado como variável de confusão.
ConclusãoPCR e VHS são ferramentas confiáveis para a detecção, progressão e resolução do estado da doença em comparação com a PET/TC na OBC. A menor especificidade dos marcadores pode limitar seu uso como único indicador de resolução da doença. Entretanto, eles podem ser usados de forma eficaz, repetida e econômica para estabelecer o tempo de feitura dos PET híbridos durante o curso da doença, a fim de decidir sobre a interrupção do antibiótico. Este estudo pode ser usado para desenvolver uma diretriz de tratamento no manejo da OBC.
Declaração éticaO protocolo do estudo foi revisado e aprovado pelo comitê de ética institucional da nossa instituição (IRB‐AIMS 2018−029), estando de acordo com os padrões éticos estabelecidos na declaração de Helsinque. Todas as intervenções e investigações foram feitas com o consentimento informado dos pacientes.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Professor Shanmugham Sundaram, Departamento de Medicina Nuclear, Amrita Institute of Medical Sciences. Ao Professor Sundaram, Departamento de Bioestatística, Amrita Institute of Medical Sciences, Kochi, Índia. Ao Dr. Vidya, Dr. Merlin, Departamento de Doenças Infecciosas, Amrita Institute of Medical Sciences.
Como citar este artigo: Faizal B, Surendran B, Kumar M. Comparative study of reliability of inflammatory markers over 18‐FDG−PET CT scan in monitoring skull base osteomyelitis. Braz J Otorhinolaryngol. 2022;88:691–700.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.