Obstructive sleep apnea causes changes in normal sleep architecture, fragmenting it chronically with intermittent hypoxia, leading to serious health consequences in the long term. It is believed that the occurrence of respiratory events during sleep, such as apnea and hypopnea, can impair the transmission of nerve impulses along the auditory pathway that are highly dependent on the supply of oxygen. However, this association is not well established in the literature.
ObjectiveTo compare the evaluation of peripheral auditory pathway and brainstem among individuals with and without obstructive sleep apnea.
MethodsThe sample consisted of 38 adult males, mean age of 35.8 (±7.2), divided into four groups matched for age and Body Mass Index. The groups were classified based on polysomnography in: control (n=10), mild obstructive sleep apnea (n=11) moderate obstructive sleep apnea (n=8) and severe obstructive sleep apnea (n=9). All study subjects denied a history of risk for hearing loss and underwent audiometry, tympanometry, acoustic reflex and Brainstem Auditory Evoked Response. Statistical analyses were performed using three‐factor ANOVA, 2‐factor ANOVA, chi‐square test, and Fisher's exact test. The significance level for all tests was 5%.
ResultsThere was no difference between the groups for hearing thresholds, tympanometry and evaluated Brainstem Auditory Evoked Response parameters. An association was observed between the presence of obstructive sleep apnea and changes in absolute latency of wave V (p=0.03). There was an association between moderate obstructive sleep apnea and change of the latency of wave V (p=0.01).
ConclusionThe presence of obstructive sleep apnea is associated with changes in nerve conduction of acoustic stimuli in the auditory pathway in the brainstem. The increase in obstructive sleep apnea severity does not promote worsening of responses assessed by audiometry, tympanometry and Brainstem Auditory Evoked Response.
A Apneia Obstrutiva do Sono provoca modificações na arquitetura normal do sono, fragmentando-o de forma crônica com hipóxias intermitentes levando, a longo prazo, a sérias consequências na saúde. Acredita-se que a ocorrência de eventos respiratórios durante o sono como apneia e hipopneia pode prejudicar a transmissão de impulsos nervosos ao longo da via auditiva que são altamente dependentes do fornecimento do oxigênio. Contudo, essa associação não se encontra bem estabelecida na literatura.
ObjetivoComparar os achados da avaliação da via auditiva periférica e no tronco encefálico entre indivíduos portadores e não portadores de apneia obstrutiva do sono.
MétodoA casuística foi composta por 38 adultos do sexo masculino, média de idade de 35,8 (±7,2); divididos em quatro grupos experimentais pareados por idade e índice da massa corpórea. Os grupos foram classificados com base na polissonografia em: controle (n=10), apneia obstrutiva do sono leve (n=11), apneia obstrutiva do sono moderada (n=8) e apneia obstrutiva do sono grave (n=9). Todos os sujeitos do estudo negaram história pregressa de risco para perda auditiva e foram submetidos à audiometria, timpanometria, pesquisa dos reflexos acústicos e Potenciais Evocados Auditivos de Tronco Encefálico. As análises estatísticas foram realizadas por meio de ANOVA 3-fatores, ANOVA 2-fatores, teste de Qui-quadrado e teste exato de Fisher. O nível de significância adotado para todos os testes foi de 5%.
ResultadosNão houve diferença entre os grupos para os limiares auditivos, timpanometria e parâmetros avaliados do Peate. Observou-se associação entre a presença da apneia obstrutiva do sono e alteração da latência absoluta da onda V (p=0,03). Observou-se associação entre apneia obstrutiva do sono de grau moderado e alteração da latência da onda V (p=0,01).
ConclusãoA presença de apneia obstrutiva do sono está associada à presença de alteração na condução nervosa do estímulo acústico na via auditiva em tronco encefálico. O aumento do grau de severidade da apneia obstrutiva do sono não promove piora das respostas avaliadas pela audiometria, timpanometria e Potenciais Evocados Auditivos de Tronco Encefálico.
A apneia obstrutiva do sono (AOS) é reconhecida como uma das importantes causas de morbidade e mortalidade, é associada a uma extensa gama de alterações cardiovasculares, metabólicas, neurológicas e fisiológicas, além de prejuízos cognitivos, e tem sido considerada como um dos grandes problemas da saúde pública.1–6 Um estudo recente, feito com adultos na Região Metropolitana de São Paulo, mostrou que é cada vez mais alta a prevalência da síndrome da apneia obstrutiva do sono (SAOS), atualmente em torno de 33%.5
A possibilidade de a AOS interferir no processo de geração e transmissão de impulsos nervosos no nível do sistema auditivo é relatada por estudos anteriores, porém essa associação não se encontra bem estabelecida, há dúvidas quanto ao real efeito da AOS sobre a audição.7,8 Ainda, os indivíduos com AOS poderiam apresentar sérias alterações nos mecanismos descritos acima, em decorrência da hiperviscosidade do plasma sanguíneo9 e dos ciclos de hipóxia presentes na AOS.10
Este estudo teve como objetivo comparar os achados da avaliação da via auditiva periférica e do tronco encefálico entre indivíduos portadores e não portadores de AOS.
MétodoEsta pesquisa foi aprovada pela Comissão de Ética institucional sob o protocolo número 1.437.604 e todos os voluntários concordaram em participar do estudo mediante assinatura do Termo de Consentimento Livre e Esclarecido, antes de serem submetidos às avaliações.
A casuística foi composta por 38 adultos do sexo masculino, divididos em quatro grupos experimentais: controle (n = 10), AOS leve (n = 11), AOS moderada (n = 8) e AOS grave (n = 9). Todos foram pareados por idade e índice de massa corporal (IMC). Todos os indivíduos passaram por exame de polissonografia. Seguiu‐se a seguinte classificação da Academia Americana de Medicina do Sono para a gravidade da AOS, considerando o índice de apneia e hipopneia (IAH) por hora de sono: AOS de grau leve (IAH entre 5 e 15 eventos por hora de sono); AOS de grau moderado (IAH entre 15 e 30 eventos por hora de sono); e AOS de grau grave (IAH ≥ 30 eventos por hora de sono).11
Os critérios de exclusão adotados no estudo foram: índice de massa corporal (IMC) igual ou superior a 40 kg/m2, tratamento para AOS com equipamento de pressão aérea positiva contínua (CPAP) ou aparelhos intraorais, insuficiência cardíaca, diabetes, hipertensão arterial sistêmica, alteração de tireoide, dislipidemia, acidente vascular cerebral e história pregressa de risco para perda auditiva, inclusive exposição ao ruído laboral.
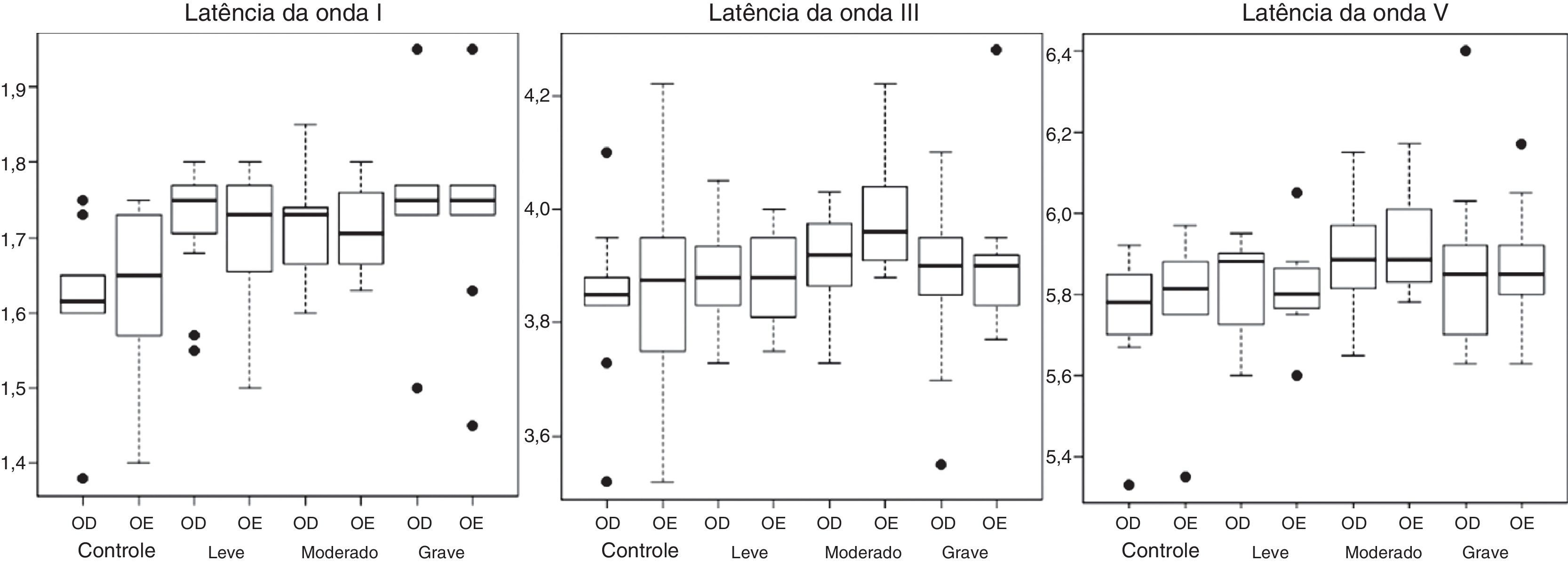
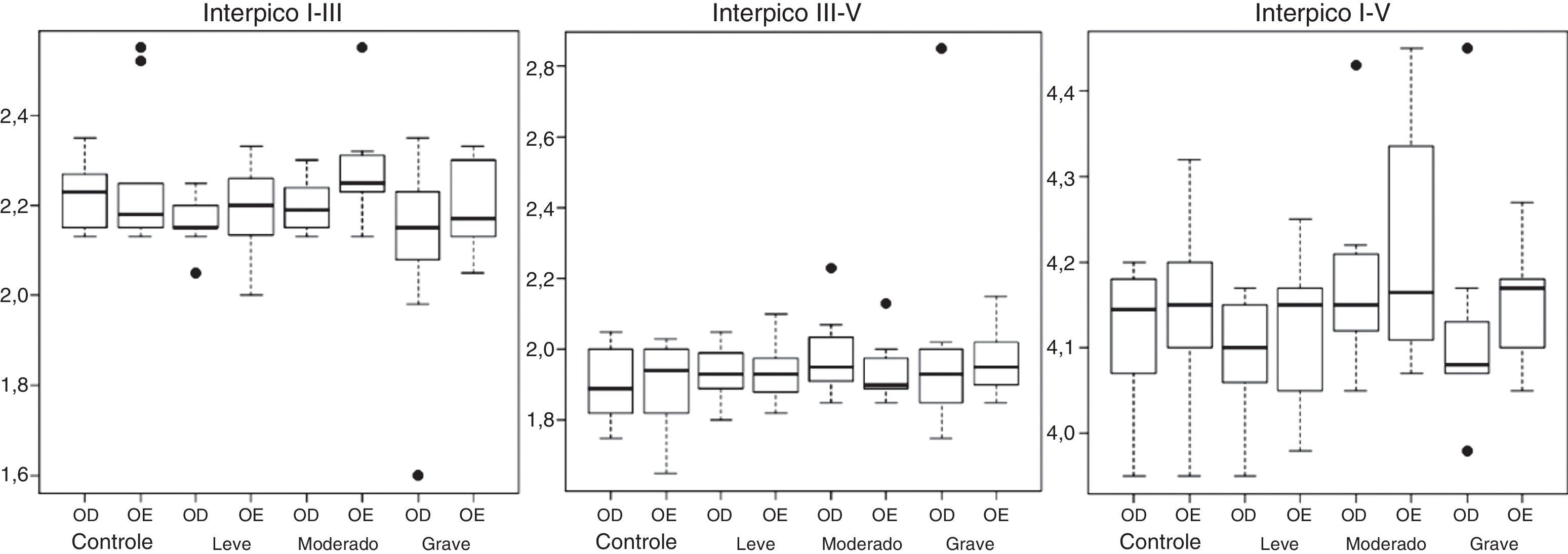
A audiometria tonal limiar convencional foi pesquisada nas frequências de 250–8.000 Hz por meio do equipamento GSI‐61 (Grason Stadler, Estados Unidos) e fones de ouvido supra‐aurais TDH 50P (Telephonics, Estados Unidos). Para a pesquisa de timpanometria, foi registrada a curva timpanométrica de admitância com tom de sonda de 226 Hz e a pesquisa do reflexo acústico ipsilateral e contralateral nas frequências de 500, 1.000, 2.000 e 4.000 Hz. As avaliações de timpanometria e dos reflexos acústicos foram feitas por meio do equipamento Titan (Interacoustics, Dinamarca). A avaliação dos potenciais evocados auditivos de tronco encefálico (Peate) foi feita pelo Smart EP (Intelligent Hearing Systems, Estados Unidos). O estímulo acústico usado para o registro do Peate foi o clique com polaridade rarefeita (com filtro passa‐alto 100 Hz e passa‐baixo de 3.000 Hz) apresentado monoauralmente a 80 dBnNA, com duração do estímulo de 0,1 ms e frequência de apresentação de 19,1 estímulos por segundo. Foram apresentados 2.048 estímulos, o número de artefatos foi sempre inferior a 10% do total de estímulos apresentados. O estímulo com polaridade condensada foi empregado em situações nas quais as amplitudes das respostas apresentaram‐se reduzidas, o que possibilitou a escolha do melhor traçado das ondas para análise. Foram registrados dois traçados para garantir a reprodutibilidade da onda. Os valores das latências absolutas das ondas I, III e V e dos interpicos I–III, III–V e I–V em milissegundos (ms) foram identificados e analisados quantitativamente (figuras 1 e 2).
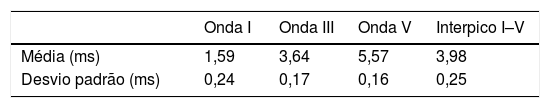
Os resultados do Peate foram classificados como normal ou alterado em cada lado da orelha. Foi adotado o padrão de normalidade dos valores de latências absolutas das ondas I, III e V e do interpico I–V proposto pelo manual do equipamento Smart‐EP –Intelligent Hearing Systems12 (tabela 1).
Padrão de normalidade dos valores de latências e interpico do Peate para adultos proposto pelo manual do Smart–EP–IHS
| Onda I | Onda III | Onda V | Interpico I–V | |
|---|---|---|---|---|
| Média (ms) | 1,59 | 3,64 | 5,57 | 3,98 |
| Desvio padrão (ms) | 0,24 | 0,17 | 0,16 | 0,25 |
Considerados dois valores de desvio padrão para classificação de latência normal.
O teste não paramétrico de Kruskal‐Wallis foi usado para avaliar a homogeneidade entre os grupos das variáveis basais como idade, índice de massa corporal (IMC) e índice de apneia e hipopneia (IAH). Foram usados os modelos de análise de variância (Anova) de três fatores13 para audiometria e reflexos acústicos ipsilateral e contralateral. Nos modelos foram considerados os fatores grupo da doença (Grupo), lado da orelha (Orelha) e Frequência, os dois últimos foram considerados fatores com medidas repetidas. Devido ao grande número de níveis descritivos associados ao fator Frequência, foi aplicada a correção proposta por Greenhouse‐Geisser (1959).14 Para os parâmetros da timpanometria, pressão de pico timpanométrico (PPT) e admitância compensada na altura da membrana timpânica (YMT) e do Peate (latências das ondas I, III e V e interpicos I–III, III–V e I–V), foram usados os modelos de Anova 2‐fatores. Para as comparações múltiplas foi usado o método proposto por Holm (1979).15
Para verificar a associação do grau de severidade da AOS com o número de orelhas com respostas fora do padrão de normalidade para as latências I, III e V e interpico I–V foi feito o teste não paramétrico qui‐quadrado. Por meio do teste não paramétrico exato de Fisher, foram feitas comparações múltiplas do número de orelhas com respostas fora do padrão de normalidade para as latências I, III e V e interpico I–V do Peate de cada grupo de doença (leve, moderado e grave) e foram confrontados com o grupo controle.
Todas as análises estatísticas foram feitas por meio do software R versão 3.2.2 (R Foundation, Estados Unidos) e Minitab 17 (Minitab Inc., Estados Unidos). O nível de significância adotado para todos os testes foi de 5% (α = 0,05).
ResultadosCaracterização da amostraForam incluídos no estudo 38 indivíduos, média de 35,3 (± 7,1) anos e média de IMC de 28,8 (± 3,8) kg/m2. Como previsto, não foram observadas diferenças significantes entre os grupos de doença quanto a idade (p = 0,08) e IMC (p = 0,15). Além disso, foi encontrada diferença significante para o IAH (p < 0,001). Isso indica que todos os grupos deste estudo diferiram estatisticamente quanto ao grau de severidade da AOS.
Audiometria, timpanometria e reflexos acústicosAs médias dos limiares auditivos não diferiram entre os grupos estudados (0,22). Houve diferença somente entre as frequências testadas em audiometria (p = 0,002), com as frequências mais altas (4, 6 e 8 kHz) apresentando maiores limiares do que em 3 kHz. Para os parâmetros timpanométricos de PPT e YMT não foi possível detectar diferença significante. Além disso, os valores para os reflexos acústicos ipsilaterais não diferiram entre os grupos nem em quaisquer outros fatores analisados. Já os resultados para o reflexo acústico contralateral mostraram diferença apenas para o fator Frequência (p < 0,001). Ou seja, as médias das frequências 500, 1.000 e 4.000 Hz foram maiores do que a média da frequência de 2.000 Hz.
Potencial evocado auditivo de tronco encefálicoNão foi observada diferença estatística para nenhum dos efeitos de interação entre os fatores Grupo e Orelha nos parâmetros de Peate avaliados. Também não houve diferença significante para os efeitos principais dos fatores Grupo e Orelha. Assim, para variáveis do Peate, não foram observadas diferenças significantes entre as médias dos grupos e entre as médias das orelhas. Não houve diferença significante entre os grupos (p = 0,8517). As figuras 1 e 2 apresentam os gráficos do tipo boxplot para as latências absolutas das ondas I, III e V e interpicos I–III, III–V e I–V, de acordo com o lado da orelha e grupo.
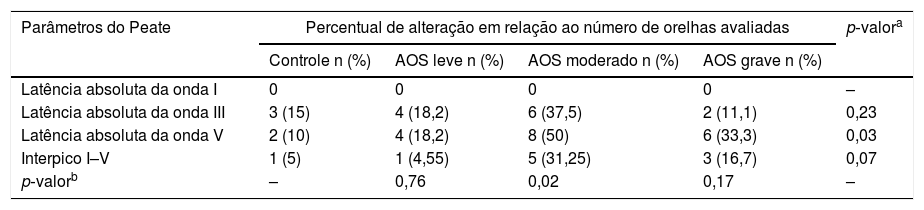
A tabela 2 mostra o percentual das alterações encontradas em cada grupo em relação às latências absolutas das ondas I, III, V e interpico I–V, levaram‐se em conta os valores de normalidade12 fornecidos pelo equipamento usado no estudo. O teste de qui‐quadrado mostrou associação entre a presença da AOS e alteração na latência absoluta da onda V (p = 0,03). Considerando o grau de severidade da AOS, o teste exato de Fisher verificou a associação entre a presença da AOS de grau moderado e a presença da alteração na latência absoluta da onda V (p=0,02).
Alteração das latências das ondas I, III, V e interpico I–V para cada orelha de cada grupo considerando os valores de normalidade fornecidos pelo Smart–EP–IHS
| Parâmetros do Peate | Percentual de alteração em relação ao número de orelhas avaliadas | p‐valora | |||
|---|---|---|---|---|---|
| Controle n (%) | AOS leve n (%) | AOS moderado n (%) | AOS grave n (%) | ||
| Latência absoluta da onda I | 0 | 0 | 0 | 0 | – |
| Latência absoluta da onda III | 3 (15) | 4 (18,2) | 6 (37,5) | 2 (11,1) | 0,23 |
| Latência absoluta da onda V | 2 (10) | 4 (18,2) | 8 (50) | 6 (33,3) | 0,03 |
| Interpico I–V | 1 (5) | 1 (4,55) | 5 (31,25) | 3 (16,7) | 0,07 |
| p‐valorb | – | 0,76 | 0,02 | 0,17 | – |
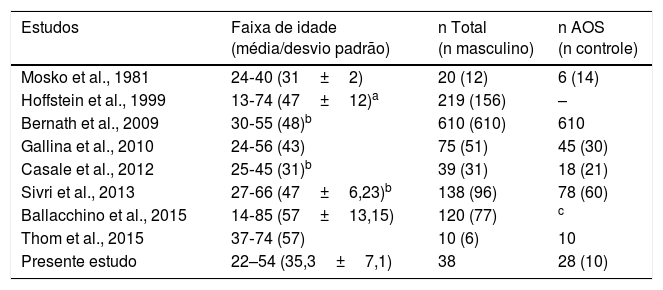
No tocante às variáveis basais, observa‐se que os quatro grupos de estudo encontram‐se adequadamente pareados por idade e IMC. A faixa etária da amostra deste estudo foi ampla. Entretanto, muitos estudos que envolveram a audição de indivíduos com AOS também incluíram amostras com faixa etária de forma semelhante8,9,16 e até maior do que a encontrada neste estudo17–19 (tabela 3).
Faixa etária amostral em estudos que relacionam AOS e audição, em comparação com o presente estudo
| Estudos | Faixa de idade (média/desvio padrão) | n Total (n masculino) | n AOS (n controle) |
|---|---|---|---|
| Mosko et al., 1981 | 24‐40 (31±2) | 20 (12) | 6 (14) |
| Hoffstein et al., 1999 | 13‐74 (47±12)a | 219 (156) | – |
| Bernath et al., 2009 | 30‐55 (48)b | 610 (610) | 610 |
| Gallina et al., 2010 | 24‐56 (43) | 75 (51) | 45 (30) |
| Casale et al., 2012 | 25‐45 (31)b | 39 (31) | 18 (21) |
| Sivri et al., 2013 | 27‐66 (47±6,23)b | 138 (96) | 78 (60) |
| Ballacchino et al., 2015 | 14‐85 (57±13,15) | 120 (77) | c |
| Thom et al., 2015 | 37‐74 (57) | 10 (6) | 10 |
| Presente estudo | 22–54 (35,3±7,1) | 38 | 28 (10) |
Em relação à audiometria, não foi observada diferença estatística dos limiares auditivos causada pela presença de AOS. Especificamente, um indivíduo do grupo AOS grave apresentou perda auditiva de grau leve20 em orelha esquerda, cuja média dos limiares auditivos de 500, 1.000 e 2.000 Hz foi de 26,66 dBNA. Além disso, poucos indivíduos apresentaram rebaixamento do limiar auditivo em frequências isoladas: um indivíduo do grupo controle e três do grupo com AOS de grau grave. Resultado similar foi observado em outro estudo,16 no qual encontraram presença de rebaixamento de limiar auditivo, especificamente em indivíduos do grupo controle, sem AOS, e igualmente sem relato de história pregressa para perda auditiva. Diferentemente do presente estudo, outro trabalho18 verificou que os indivíduos com alto risco para presença de AOS apresentaram limiares tonais rebaixados quando comparados com o controle. Entretanto, para o estudo citado, o risco para AOS foi avaliado por questionário padronizado, sem o diagnóstico por polissonografia. E o fato de ter selecionado uma faixa etária muito ampla (14–85 anos) com presença de zumbido pode ter contribuído para haver diferença no limiar auditivo, uma vez que os dois fatores estão fortemente relacionados à manifestação da perda auditiva.21,22
Em relação à timpanometria, os resultados foram considerados normais para população adulta,23,24 provavelmente devido aos critérios de exclusão adotados no presente estudo. Esses dados não concordaram com os achados da literatura, na qual foram observadas curvas timpanométricas do tipo B e C em indivíduos com AOS de grau moderado e grave.25 Isso pode ser explicado pelo fato de o estudo citado ter incluído indivíduos que haviam passado por cirurgia de septoplastia três meses antes da avaliação auditiva.25
O exame de Peate oferece informações objetivas que podem ser consideradas como parâmetros para fins diagnósticos, quanto à integridade estrutural e funcional das vias auditivas até o tronco encefálico, e atualmente é bastante utilizado clinicamente, tanto por ter geradores bem definidos quanto pela característica de reprodutibilidade.26 Segundo um estudo, os adultos portadores de AOS apresentam elevada viscosidade de plasma sanguíneo; essa hiperviscosidade foi correlacionada positivamente com a gravidade da AOS.27 A hiperviscosidade e sua consequente alteração da microcirculação foram consideradas as principais causas para as alterações no Peate em adultos com AOS.9 Esses estudos sugerem que os indivíduos que têm a doença da AOS, quando não tratados com, por exemplo, dispositivo de pressão aérea positiva contínua (CPAP – Continuous Positive Airway Pressure), apresentam o quadro de hiperviscosidade sanguínea. Além disso, a hipóxia intermitente presente nos adultos com AOS de grau grave poderia representar um fator de risco para prejuízo na via auditiva e a gravidade e/ou duração da AOS pode contribuir para a diminuição da função neuronal e vascular da via auditiva.8 Dessa forma, eram esperadas alterações na via auditiva em adultos com AOS, conforme a gravidade da doença.
No presente estudo, a análise dos dados qualitativos mostrou associação entre presença da AOS e alteração na latência absoluta da onda V do Peate (tabela 2). Além disso, considerando‐se as comparações múltiplas dos grupos com doença em relação ao controle, o grupo com AOS de grau moderado apresentou associação com alteração na latência da onda V. Embora não seja significante, é importante considerar que o grupo com AOS de grau grave apresentou percentual aumentado (33%) de alteração na latência da onda V, comparado com o controle (10%). Da mesma forma, os grupos com maior grau de severidade da AOS (moderado e grave) apresentaram maior ocorrência de alteração no interpico I–V, comparados com o controle.
Estudo mostra que os indivíduos com quadro severo de hipoxemia ou hipercapnia têm alta prevalência de anormalidades no Peate.28 Resultados similares já foram relatados, mostraram aumento do interpico I–V em 36,5% dos indivíduos com AOS.16 Casale et al. (2012) encontraram alteração nos interpicos III–V e I–V no grupo com AOS de grau grave que evidenciou presença da alteração nas vias auditivas retrococleares.8 Os mesmos autores ainda identificaram aumento dos valores das latências I, III, V e interpicos III–V e I–V na AOS de grau grave, comparada com o controle.8 Em outro trabalho, indivíduos com AOS e hiperviscosidade sanguínea apresentaram prejuízo na via auditiva do tronco encefálico na porção caudal até o complexo olivar superior.9 Essas alterações podem estar presentes em decorrência da redução do fluxo sanguíneo na região do tronco encefálico, já observada em indivíduos com apneia e que, portanto, poderia agravar os efeitos nocivos da apneia na via auditiva em tronco encefálico.29 Adicionalmente, a alterada microcirculação resultante da hiperviscosidade sanguínea surge como a principal causa de alterações no Peate em indivíduos com AOS.9
A reversibilidade da alteração no Peate (latênciada onda III normalizada) foi relatada em adultos com AOS tratados e que tiveram a viscosidade sanguínea normalizada. Os mesmos autores especulam que os pacientes portadores de AOS sem hiperviscosidade sanguínea com resultados dentro dos padrões de normalidade no Peate apresentam mecanismos compensatórios efetivos que equilibram a hipoxemia, a hipercapnia, a acidose e a alterada microcirculação surgidas durante a apneia.
Existem estudos30,31 que apresentaram resultados discordantes do atual trabalho, uma vez que não verificaram alteração em tronco encefálico em indivíduo com síndrome de AOS. Contudo, os mesmos autores30,31 fizeram estudos de caso com amostra consideravelmente pequena, com 11 e seis indivíduos com AOS, respectivamente. O presente estudo não observou diferença entre os valores obtidos nos parâmetros do Peate conforme a gravidade da AOS. Contudo, o poder do teste estatístico para as análises quantitativas do Peate na presente amostra de 38 adultos foi de 80% apenas para efeitos grandes, o que foi considerado um fator limitante. Ainda, a presença de indivíduos do grupo controle com alterações nas latências absolutas das ondas I, III, V e interpicos I–III, III–V e I–V do Peate pode ter dificultado a identificação mais precisa, que confirmaria a hipótese de que a AOS influencia nas respostas auditivas nos diferentes sítios geradores da via auditiva, conforme o grau de severidade da doença.
Considerando que a literatura disponível que envolve estudo do Peate na AOS encontra‐se escassa e exibe um cenário ainda inconsistente, ainda não é possível estabelecer a real influência da AOS na integridade estrutural e funcional da via auditiva, o que evidencia a importância de novos estudos que possam esclarecer a associação da AOS com o prejuízo da via auditiva em tronco encefálico.
ConclusãoA presença de AOS está associada à presença de alteração na condução nervosa do estímulo acústico na via auditiva em tronco encefálico. O aumento do grau de severidade da AOS não promove piora das respostas avaliadas pela audiometria, timpanometria e Peate.
FinanciamentoEste estudo recebeu o financiamento da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) (FAPESP 2013/10281‐7).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Matsumura E, Matas CG, Magliaro FC, Pedreño RM, Lorenzi‐Filho G, Sanches SG, et al. Evaluation of peripheral auditory pathways and brainstem in obstructive sleep apnea. Braz J Otorhinolaryngol. 2018;84:51–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.