Tinnitus is defined as the perception of sound in the head or in the head in the absence of external sounds. The cause of tinnitus is still unknown.
ObjectiveWe aimed to compare the serum levels of total oxidant status, total antioxidant status, serum prolidase enzyme activity and the oxidative stress index in patients with tinnitus to those of normal subjects.
MethodsTwenty five patients with tinnitus (mean age 34.3) and 25 healthy controls (mean age 37.2) were included in the study.
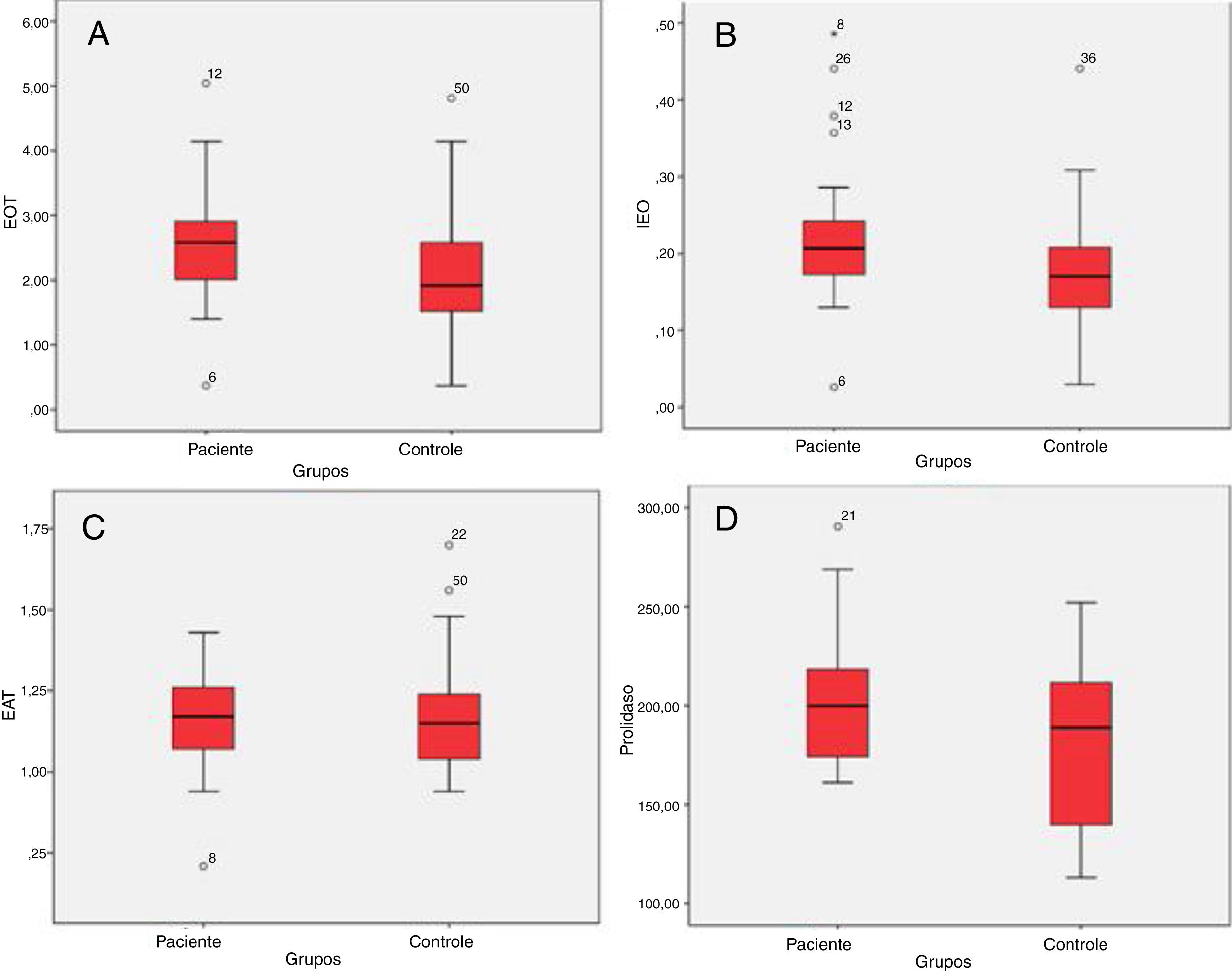
ResultsTotal oxidant status levels in the patient group were significantly higher than in the control group (p = 0.037). The mean total oxidant status value was 2.54 ± 0.95 mmoL/L in the patient group, and 2.06 ± 0.98 mmoL/L in the control group. The mean oxidative stress index level was 0.22±0.10 AU in the patient group, while it was 0.17 ± 0.08 AU in the control group. Oxidative stress index was significantly higher in the patient group (0.026). There was no significant difference between the groups in terms of total antioxidant status values (p = 0.838). The mean serum prolidase enzyme activity level was 202.74 ± 33.56 U/L in the patient group and 175.46 ± 42.68 U/L in the control group. Serum prolidase enzyme activity levels in the patient group were significantly higher than in the control group (0.040).
ConclusionWe detected that the total oxidant status, oxidative stress index and serum prolidase enzyme activity levels were higher in patients with tinnitus when compared to the healthy controls. This finding suggests that oxidative stress index and serum prolidase enzyme activity may play a role in the etiopathogenesis of tinnitus.
O zumbido é definido como a percepção de um som na cabeça na ausência de sons externos. A causa do zumbido ainda é desconhecida.
ObjetivoComparar os níveis séricos do estado oxidante total, estado antioxidante total, atividade da enzima prolidase sérica e o índice de estresse oxidativo em pacientes com zumbido e em indivíduos normais.
MétodoForam incluídos no estudo 25 pacientes com zumbido (média de 34,3 anos) e 25 controles saudáveis (média de 37,2 anos).
ResultadosOs níveis do estado oxidante total no grupo de pacientes foram significantemente maiores do que no grupo controle (p = 0,037). O valor médio do estado oxidante total foi de 2,54 ± 0,95 mmoL/L no grupo de pacientes e de 2,06 ± 0,98 mmoL/L no grupo controle. O nível médio de índice de estresse oxidativo foi de 0,22 ± 0,10 AU no grupo de pacientes, enquanto no grupo controle foi de 0,17 ± 0,08 AU. O índice de estresse oxidativo foi significantemente maior no grupo de pacientes (0,026). Não houve diferença significante entre os grupos em relação aos valores do estado antioxidante total (p = 0,838). O nível médio de atividade da enzima prolidase sérica foi de 202,74 ± 33,56 U/L no grupo de pacientes e de 175,46 ± 42,68 U/L no grupo controle. Os níveis de atividade da enzima prolidase sérica no grupo de pacientes foram significantemente maiores do que no grupo controle (0,040).
ConclusãoDetectamos que os níveis de estado oxidante total, índice de estresse oxidativo e atividade da enzima prolidase sérica foram maiores nos pacientes com zumbido quando comparados aos controles saudáveis. Esse achado sugere que o índice de estresse oxidativo e a atividade da enzima prolidase sérica podem desempenhar um papel na etiopatogenia do zumbido.
O zumbido é definido como a percepção de um som na cabeça sem a presença de um som externo. O zumbido é um dos sintomas mais comuns do sistema auditivo, afeta de maneira adversa a qualidade de vida dos pacientes.1 A incidência de zumbido ocorre na faixa de 10% a 15% da população.2 O zumbido é causado por uma série de doenças que afetam o sistema auditivo sensorial. No entanto, a causa do zumbido ainda é desconhecida.3
A prolidase é uma metaloenzima pertencente à família das hidrolases, que desempenha importante papel na degradação e biossíntese do colágeno. A atividade enzimática da prolidase foi detectada em muitos tecidos, como estômago, coração, cérebro, pâncreas, rim, fígado e líquido amniótico.4 Acredita‐se que alterações na atividade da enzima prolidase podem ter um papel no desenvolvimento de muitas doenças, como pólipos nasais, esquizofrenia, ansiedade, transtorno bipolar, depressão maior, diabetes mellitus tipo 2, hepatite C crônica, osteoporose, asma brônquica e fibrose hepática.5–11
As espécies reativas do oxigênio (ERO) são moléculas reativas que contêm um ou mais elétrons não pareados em suas órbitas mais externas.12 A superprodução de ERO está envolvida na patogênese de muitas doenças, inclusive diabetes mellitus, câncer, artrite reumatoide, lúpus eritematoso sistêmico, doença de Behçet e aterosclerose.13 Vários mecanismos de defesa antioxidante foram desenvolvidos no organismo como uma forma de proteção contra os efeitos adversos das ERO. Em condições normais, há um equilíbrio entre o mecanismo de defesa antioxidante e os radicais livres, mas se observa estresse oxidativo quando esse equilíbrio é desviado, o que favorece os radicais livres.14 As moléculas oxidantes e antioxidantes podem ser medidas individualmente no plasma, mas atualmente as formas de mensuração do estado oxidante total (EOT) e do estado antioxidante total (EAT) foram melhoradas.15
Decidimos fazer este estudo porque o estresse oxidativo e a enzima prolidase têm sido investigados em muitas doenças e há um número limitado de estudos sobre a etiopatogenia do zumbido, que ainda não é completamente esclarecida. Nosso objetivo foi comparar os níveis séricos de prolidase, EAT e EOT em pacientes com zumbido e indivíduos saudáveis. Verificamos que, embora a relação entre zumbido e estresse oxidativo tenha sido estudada anteriormente, a relação com a prolidase nunca foi investigada. Este é o primeiro estudo na literatura a examinar os níveis da enzima prolidase em pacientes com zumbido.
Material e métodosEste estudo foi feito no ambulatório de otorrinolaringologia da Hitit University entre 10 de janeiro de 2018 e 31 de março de 2018. O protocolo do estudo foi aprovado pelo comitê de ética em pesquisa clínica da Hitit University, (decreto n° 2018‐23). Foram incluídos no estudo 25 pacientes com diagnóstico de zumbido e 25 indivíduos saudáveis. No grupo zumbido, 14 indivíduos eram do sexo masculino e 11 do feminino, com média de 34,3 anos. O grupo controle consistiu de 25 indivíduos, 12 do sexo masculino e 13 do feminino, com média de 37,2 anos. Todos os participantes forneceram o consentimento livre e informado por escrito para participar do estudo. Todos os pacientes foram submetidos a exame otorrinolaringológico com histórico detalhado. Além disso, foram feitos exames de sangue de rotina, avaliação audiológica e avaliação diagnóstica neurotológica. Os critérios para inclusão no grupo zumbido foram: ter apresentado zumbido subjetivo por pelo menos um ano, entre 18 e 65 anos e não ter feito qualquer tratamento médico para o zumbido até pelo menos 8 semanas antes de entrar no estudo. O grupo controle incluiu indivíduos saudáveis normais que não se queixavam de zumbido, de 18 a 65 anos, e que foram atendidos em nossa clínica por outros motivos. Em ambos os grupos, os critérios de exclusão foram: presença de otosclerose, timpanoesclerose, otite média crônica, schwannoma vestibular, doença de Ménière, “hum” venoso, lesões malignas, histórico de cirurgia autóloga, uso de medicamentos ototóxicos, traumatismo do osso temporal, problemas de orelha média ou externa. Pacientes com doenças metabólicas, hematológicas, cardiovasculares, psiquiátricas e neurológicas também foram excluídos do estudo. Exames otológicos, neurológicos e audiológicos foram normais para todos os participantes. Apenas uma amostra de soro foi retirada, sem qualquer tratamento, tanto de pacientes quanto dos voluntários saudáveis. O consentimento informado foi obtido de todos os pacientes em ambos os grupos como demonstração de sua participação voluntária no estudo. Uma amostra de 10mL de sangue venoso foi coletada de cada paciente, entre 8h e 10h, em tubos que continham ativador de coagulação (Isotherm, Hongyu Medical, Weihai, China) após 12 horas de jejum. Após a formação do coágulo sanguíneo, as amostras foram centrifugadas por 10min a 4000rpm e o soro foi separado e armazenado a ‐80°C até o dia da análise.
Medidas de EAT, EOT e prolidaseForam usadas as medidas da capacidade antioxidante total e oxidante total, desenvolvidas por Erel.15,16 Para as análises do EAT e EOT, usou‐se o método desenvolvido por Erel, com o kit RelAssay totalmente automatizado (kit Rel Assay Diagnostics, Mega Tip, Gaziantep, Turquia) e o método colorimétrico, com uso do autoanalisador VitalScientific, Selectra/Flexor E (Países Baixos). Os resultados do EAT e EOT foram apresentados como μmoL H2O2 equivalente/L. Os níveis de SPEA foram medidos pelo teste ELISA (Cat. n° CSB‐E16196h, Cusabo Biotech Co. Ltd). O coeficiente de variação (CV) intraensaio e o coeficiente interensaio foram < 8% e < 10%, respectivamente. O intervalo do teste era de 93,75 a 6.000 mU/mL, com uma sensibilidade de 93,75 mU/mL. Para as medições, foi usado o teste ELISA automático, da Radim Company ALİSEİ.
Análise estatísticaO pacote de software SPSS (versão 22.0, SPSS Inc. Chicago, IL, EUA) foi escolhido para a análise estatística. A distribuição da normalidade foi determinada pelo teste de Shapiro‐Wilk. As variáveis contínuas foram apresentadas como média ± desvio‐padrão, mediana (mín – máx) de acordo com as hipóteses de dispersão e variáveis categóricas, apresentadas como número e porcentagem. Quando as variáveis contínuas foram avaliadas, dois fatores independentes foram analisados pelo teste t de Student no caso de variáveis normalmente distribuídas. O teste U de Mann‐Whitney foi usado quando amostras independentes não eram normalmente distribuídas. O nível de significância foi aceito como p < 0,05.
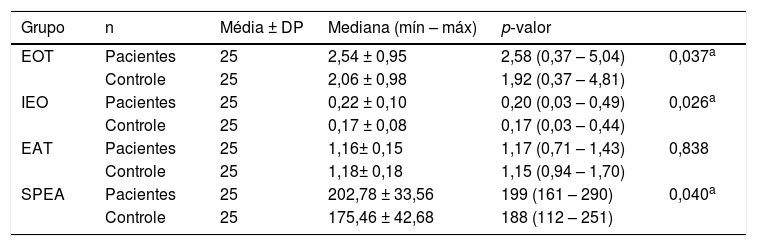
ResultadosO grupo de pacientes e o grupo controle foram semelhantes em termos de idade e sexo (p> 0,05 para ambos). O valor médio do EOT foi 2,54 ± 0,95 mmoL/L e mediana (mín – máx) 2,58 (0,37-5,04 mmoL/L) no grupo de pacientes e de 2,06 ± 0,98 mmoL/L e mediana (mín – máx) de 1,92 (0,37 ± 4,81 mmoL/L) no grupo controle. Os níveis séricos do EOT no grupo de pacientes foram significantemente maiores do que no grupo controle (p = 0,037) (tabela 1, fig. 1A). Os níveis médios de IEO foram de 0,22 ± 0,10 AU e a mediana (mín – máx) 0,20 (0,03 ± 0,49 AU) no grupo de pacientes e foram de 0,17 ± 0,08 AU e mediana (mín – máx) de 0,17 (0,03 ± 0,44 AU) no grupo controle. O IEO foi significantemente maior no grupo de pacientes (0,026) (tabela 1, fig. 1B). O nível médio do EAT foi 1,16 ± 0,15 mmoL/L e mediana (mín – máx) 1,17 (0,71 ± 1,43 mmoL/L) no grupo de pacientes e 1,18 ± 0,18 mmoL e mediana (mín – máx) de 1,15 (0,94‐1,70 mmoL/L) no grupo controle. Não houve diferença significante entre os grupos em termos de valores de EAT (p = 0,838) (tabela 1, fig. 1C). O nível médio de SPEA foi 202,74 ± 33,56 U/L e mediana (mín – máx) 199 (161–290 U/L) no grupo de pacientes e 175,46 ± 42,68 U/L e mediana (mín – máx) 188 (112–251 U/L) no grupo controle. Os níveis de SPEA no grupo de pacientes foram significantemente maiores do que no grupo controle (0,040) (tabela 1, fig. 1D).
Comparação entre o grupo de pacientes e grupo controle em relação aos níveis de EOT, IEO, EAT e SPEA
| Grupo | n | Média ± DP | Mediana (mín – máx) | p‐valor | |
|---|---|---|---|---|---|
| EOT | Pacientes | 25 | 2,54 ± 0,95 | 2,58 (0,37 – 5,04) | 0,037a |
| Controle | 25 | 2,06 ± 0,98 | 1,92 (0,37 – 4,81) | ||
| IEO | Pacientes | 25 | 0,22 ± 0,10 | 0,20 (0,03 – 0,49) | 0,026a |
| Controle | 25 | 0,17 ± 0,08 | 0,17 (0,03 – 0,44) | ||
| EAT | Pacientes | 25 | 1,16± 0,15 | 1,17 (0,71 – 1,43) | 0,838 |
| Controle | 25 | 1,18± 0,18 | 1,15 (0,94 – 1,70) | ||
| SPEA | Pacientes | 25 | 202,78 ± 33,56 | 199 (161 – 290) | 0,040a |
| Controle | 25 | 175,46 ± 42,68 | 188 (112 – 251) |
DP, desvio‐padrão; Máx, máximo; Mín, mínimo.
O zumbido é classificado como objetivo e subjetivo. O objetivo também é ouvido por outras pessoas e as causas mais comuns são as anomalias vasculares.2 O subjetivo é definido como sons ouvidos apenas pelo paciente. A doença que leva ao zumbido pode estar em qualquer local, desde o canal auditivo externo até o sistema auditivo central. O zumbido associado ao ruído, acompanhado por perda auditiva neurossensorial, é a causa mais comum de zumbido subjetivo.17 Entre as causas do zumbido subjetivo estão otosclerose, timpanoesclerose, trauma acústico, surdez súbita, estresse, medicamentos ototóxicos, doença de Ménière, traumatismo craniano e neuroma do acústico.18 O zumbido também pode ser causado por distúrbios metabólicos, neurológicos, psicológicos e farmacológicos.19
A etiopatogenia do zumbido ainda não foi totalmente esclarecida. O desenvolvimento do zumbido muitas vezes pode ser causado por dano coclear.20 Em alguns estudos, foi relatado que o estresse oxidativo altera o epitélio neurossensorial dos nervos labirínticos, acústicos e vestibulares.20–22 Estudos experimentais, relataram que as ERO podem danificar o epitélio sensorial coclear.23 Recentemente, pesquisas observaram aumento do estresse oxidativo em pacientes com zumbido.24 O estresse oxidativo desempenha um papel importante na patogênese do zumbido por ruído. Durante a exposição ao ruído excessivo, ele causa acúmulo de ERO, o que pode causar necrose e apoptose das células ciliadas externas.25 Normalmente, a cóclea humana contém vitaminas antioxidantes, glutationa e várias enzimas contra moléculas oxidativas. Tem sido relatado que esses antioxidantes podem não ser suficientemente desintoxicantes para ter algum papel no tratamento adequado após um trauma agudo e algumas doenças otológicas.26 O epitélio neurossensorial coclear está sob risco de lesões induzidas por ERO. Segundo pesquisadores, o estresse oxidativo poderia danificar o labirinto, o epitélio do sistema nervoso acústico e vestibular.27
Savastano et al. prescreveram, por 18 semanas, fosfolipídios e várias vitaminas como terapia antioxidante oral para 31 pacientes com zumbido unilateral idiopático. A audiometria de tom puro e a aferição da gravidade do zumbido segundo escores de uma escala visual analógica (EVA) foram feitas 48 horas antes e após o tratamento médico. Foi relatada uma redução da intensidade do zumbido após tratamento com antioxidantes.28 Da mesma forma, Gopal et al. relataram que a gravidade do zumbido diminuiu após a terapia com antioxidantes e que os agentes antioxidantes podem ser uma opção no seu tratamento.29 Por outro lado, Polanski et al. relataram que agentes antioxidantes não são benéficos para o tratamento do zumbido.30
Neri et al. investigaram os níveis das enzimas malonaldeído, 4‐hidroxinonenal e mieloperoxidase, que são marcadores de dano oxidativo, em seu estudo com 44 pacientes com zumbido e 25 voluntários saudáveis.31 Em pacientes com zumbido, esses 3 parâmetros apresentaram valores maiores do que no grupo controle. A enzima antioxidante glutationa peroxidase apresentou um valor menor. Eles relataram que o estresse oxidativo elevado pode causar disfunção endotelial vascular e um defeito na microcirculação da orelha interna. Com base nesses achados, o estresse oxidativo foi considerado importante na patogênese do zumbido. Koc et al. avaliaram 54 pacientes com zumbido e 60 indivíduos no grupo controle e relataram que os níveis de TIN e estresse oxidativo foram estatisticamente e significantemente maiores em pacientes com zumbido. Os níveis de EAT e paraoxanase‐1 (PON‐1) foram significantemente menores no grupo com zumbido do que no grupo controle. Como resultado, eles relataram que os pacientes com zumbido foram expostos ao estresse oxidativo.24 Em nosso estudo, descobrimos que os níveis de EOT e IEO eram estatisticamente mais altos em pacientes com zumbido do que nos controles. Também encontramos altos níveis de SPEA em pacientes com zumbido.
Aubert et al., em um estudo experimental feito em rãs, verificaram que a injeção de metassulfato de fenazina na região perilinfática causou um aumento na formação de ERO e deterioração da secreção da endolinfa. Eles relataram que a adição de trimetazidina à região perilinfática era protetora contra os efeitos nocivos das ERO.22 Esses resultados indicam que o efeito benéfico da trimetazidina observado durante o tratamento do zumbido pode ser devido às suas propriedades antioxidantes.
A prolidase desempenha um papel importante na regulação da biossíntese e degradação do colágeno. A enzima prolidase é a única enzima que catalisa a rápida hidrólise intracelular da prolina e hidroxiprolina que ocorre no fim do catabolismo do colágeno, de forma que o metabolismo do colágeno pode ser determinado se observarmos os níveis da SPEA.32 Em um estudo feito com ratos, foi demonstrado que a exposição do cérebro de ratos à prolina reduz o potencial antioxidante e induz o estresse oxidativo.33
Alguns estudos na literatura relatam que há uma relação direta entre o zumbido e vários distúrbios psicológicos.34 Em nossa revisão da literatura, verificamos que a relação entre o zumbido e a enzima prolidase não havia sido investigada anteriormente. No entanto, tem sido relatado que a atividade da enzima prolidase aumenta em certas doenças, como no transtorno de ansiedade, depressão e transtorno bipolar, as quais são frequentemente associadas ao zumbido. Por essa razão, decidimos analisar a enzima prolidase.
Simsek et al. verificaram que a incidência de transtorno de ansiedade e depressão era significantemente mais alta em pacientes que apresentavam zumbido subjetivo.35 O estudo de Ercan et al. mostrou que o índice de estresse oxidativo (IEO) e a atividade da enzima prolidase estavam aumentados nos pacientes com transtorno de ansiedade em comparação ao grupo controle. Também relataram que os níveis de estresse oxidativo podem estar relacionados aos níveis da SPEA, apontam, portanto, que os níveis de SPEA podem ser indicativos da atividade da doença nos transtornos de ansiedade.12
A limitação deste estudo é o pequeno tamanho dos grupos de pacientes e controles. Entretanto, os autores acreditam que a relação entre os escores dos sintomas do zumbido e os níveis de SPEA e IEO possa ser útil na investigação.
ConclusãoVerificamos que os níveis de estado oxidante total, índice de estresse oxidativo e atividade da enzima prolidase sérica eram estatisticamente maiores nos pacientes com zumbido do que nos controles. Não houve diferença significante entre o grupo de pacientes com zumbido e o grupo controle em relação aos níveis de estado antioxidante total. Esses achados sugerem que os pacientes com zumbido foram expostos a um estresse oxidativo maior. Níveis elevados de atividade da enzima prolidase sérica e índice de estresse oxidativo podem ter um papel na patogênese do zumbido. Há necessidade de um trabalho mais extenso e abrangente nesta área.
FinanciamentoHitit University Scientific Research Projects.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Ekinci A, Kamasak K. Evaluation of serum prolidase enzyme activity and oxidative stress in patients with tinnitus. Braz J Otorhinolaryngol. 2020;86:405–10.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.