A recorrência do carcinoma basocelular (CBC) cutâneo está associada a margens cirúrgicas inadequadas. A frequência e os fatores associados a margens cirúrgicas comprometidas ou inadequadas no carcinoma basocelular de cabeça e pescoço variam.
ObjetivoAvaliar os fatores clínicos e patológicos associados a margens cirúrgicas inadequadas no carcinoma basocelular de cabeça e pescoço.
MétodoConduzimos um estudo transversal que abrangeu todos os pacientes submetidos à ressecção de carcinoma basocelular de cabeça e pescoço de janeiro de 2017 a dezembro de 2019. Dados sobre idade, sexo, topografia na cabeça e pescoço, achados histopatológicos e estadiamento foram recuperados e comparados. Cada tumor foi considerado como um caso individual. As margens comprometidas e próximas foram denominadas “inadequadas” ou “incompletas”. As variáveis que foram significantemente associadas à presença de margens incompletas foram avaliadas adicionalmente por regressão logística.
ResultadosForam incluídos 605 tumores de 389 pacientes. No geral, 16 casos (2,6%) foram classificados como comprometidos, 52 (8,5%) como próximos e 537 (88,7%) como margens livres. Presença de esclerodermia (p=0,005), nível de Clark mais elevado (p <0,001), variantes agressivas (p <0,001), invasão além do tecido adiposo (p <0,001), estágio T mais avançado (p <0,001), invasão perineural (p=0,002), sítio primário (p=0,04), multifocalidade (p=0,01) e diâmetro do tumor (p=0,02) mostraram associação com margens inadequadas. Após a regressão logística, a multifocalidade, o nível de Clark e a profundidade de invasão foram considerados fatores de risco independentes para margens inadequadas.
ConclusãoO exame clínico macroscópico pode ser suficiente para determinar baixa prevalência de margens cirúrgicas inadequadas no tratamento do carcinoma basocelular de cabeça e pescoço em centros oncológicos altamente experientes. Multifocalidade, nível de Clark e profundidade de invasão foram considerados fatores de risco independentes para margens incompletas.
O carcinoma basocelular (CBC) é uma doença que afeta a região da cabeça e pescoço, principalmente de indivíduos de pele clara com histórico de exposição ao sol ao longo da vida. A maioria dos casos ocorre em indivíduos após a sexta década de vida, com uma leve tendência no sexo masculino.1 Os CBCs geralmente são tumores de crescimento lento, que raramente estão associados à morte. O potencial metastático dessas lesões é restrito a poucos casos.2 A maioria das mortes relacionadas à doença, quando ocorrem, se deve à irressecabilidade, inoperabilidade, mortalidade perioperatória em cirurgias de alto risco ou a casos raros de metástase regional ou a distância.2,3 Na região da cabeça e pescoço, essas características podem estar presentes em lesões do terço médio superior da face, com doença infiltrativa na base do crânio.3
A recorrência também está associada a maiores taxas de doença a distância e grandes ressecções, sendo diretamente relacionada a margens cirúrgicas inadequadas.2,4,5 A definição de margens cirúrgicas adequadas para CBC geralmente varia de acordo com o tamanho da lesão e sua localização. A maioria das diretrizes indica margens clínicas macroscópicas de 2–4mm.1,6 Na análise histopatológica, os casos de ressecção completa são aqueles com margens microscópicas livres de neoplasia de pelo menos 1mm. Embora recorrências possam ser observadas em casos com margens cirúrgicas microscópicas maiores, o risco do evento é quatro vezes menor quando comparado aos casos de ressecção incompleta.7
Na literatura, a frequência de margens cirúrgicas comprometidas ou inadequadas varia no CBC. Na cabeça e pescoço, a prevalência de margens positivas varia de 9% a 37,2%.8–12 Os tumores de cabeça e pescoço, especialmente em algumas sub‐regiões topográficas e entre profissionais menos experientes, parecem estar mais associados a margens comprometidas ou inadequadas em comparação com o CBC em outros locais. 11–14 Assim, nosso principal objetivo foi avaliar os fatores clínicos e patológicos associados às margens cirúrgicas inadequadas no CBC de cabeça e pescoço, através de uma série institucional em um centro oncológico terciário.
MétodoO presente estudo recebeu a aprovação do comitê de ética em pesquisa (CAAE: 93792318.4.0000.5304). Desenvolvemos um estudo transversal, incluindo todos os pacientes submetidos à ressecção de neoplasias malignas da pele da cabeça e do pescoço, de janeiro de 2017 a dezembro de 2019. Dados sobre idade, sexo, topografia, achados histopatológicos e estadiamento foram recuperados e incluídos em um banco de dados específico. A classificação dos casos de CBC foi feita de acordo com Rosai em: nodulares, superficiais, infiltrantes, micronodulares, fibroepiteliais, basoescamosas, queratóticas, pigmentadas, infundíbulo císticas, adenoides, císticas, esclerosantes e células claras.15 Os casos submetidos apenas à ampliação da margem (33 casos) ou com uma histologia diversa do CBC (266 casos com carcinoma espinocelular, um caso com carcinoma de células de Merkel, 3 sarcomas cutâneos e 15 casos com melanoma) foram excluídos da análise.
O mesmo cirurgião de cabeça e pescoço (FMG) tratou todos os pacientes e todas as cirurgias foram feitas pela técnica convencional, sem análise histopatológica transoperatória. Antes da excisão, todos os tumores eram inspecionados visualmente a olho nu para garantir margens macroscopicamente livres de pelo menos 0,2‐0,4cm, de acordo com o diâmetro do tumor, conforme estabelecido nas atuais Diretrizes do Reino Unido.6
Os tumores foram estadiados histopatologicamente, de acordo com a 8ª edição do sistema de estadiamento patológico Tumor‐Node‐Metastasis (pTNM) do American Joint Committee on Cancer (AJCC).16 O diâmetro do tumor e a profundidade de invasão (DOI, do inglês Depth of Invasion) foram expressos em cm. As margens foram consideradas comprometidas, próximas (< 0,1cm) ou livres (≥ 0,1cm) de acordo com os achados da análise histopatológica. Margens comprometidas e próximas foram consideradas “inadequadas” ou “incompletas”. Os casos foram considerados agressivos se classificados microscopicamente como micronodulares, infiltrantes, fibroepiteliais ou basoescamosos. Todos os outros subtipos microscópicos foram considerados não agressivos.17 As regiões topográficas de cabeça e pescoço foram divididas em: fronte; sobrancelha; periorbital; temporal; zigomática; infraorbital; nasal; orelha; lábio superior; mandibular; lábio inferior; mento; cervical; couro cabeludo; e retroauricular. Ao comparar o sítio primário, os tumores no nariz, lábio, orelha e zona periorbital foram denominados “locais nobres” e comparados juntos com as outras partes da face e pescoço. Cada tumor foi analisado como um caso individual para comparação entre os grupos. A única exceção foi a avaliação do status da margem de acordo com o número de tumores ressecados no mesmo paciente, quando o paciente foi considerado a unidade de comparação.
Os dados foram resumidos através de análise descritiva. Variáveis contínuas com distribuição normal foram expressas como média e desvio‐padrão. Variáveis com distribuição não normal foram expressas como valores de mediana, mínimo e máximo. As variáveis categóricas foram expressas como frequência absoluta e relativa. A associação do status da margem cirúrgica e variáveis contínuas foi avaliada pelo teste U de Kruskal‐Wallis ou Mann‐Whitney. O teste do qui‐quadrado e o teste exato de Fischer foram usados para variáveis categóricas. As variáveis que foram significantemente associadas à presença de margens inadequadas foram avaliadas por regressão logística para calcular a odds ratio (OR) e o intervalo de confiança de 95% (IC95%) em um modelo univariado. A seguir, as variáveis foram incorporadas a um modelo multivariado e o método stepwise‐backward foi usado para obter um modelo final no qual as variáveis com p <0,10 foram mantidas. A análise estatística foi feita com o software SPSS versão 20.0 (SPSS Inc., Chicago, IL). Todos os testes consideraram um nível de significância de 5%.
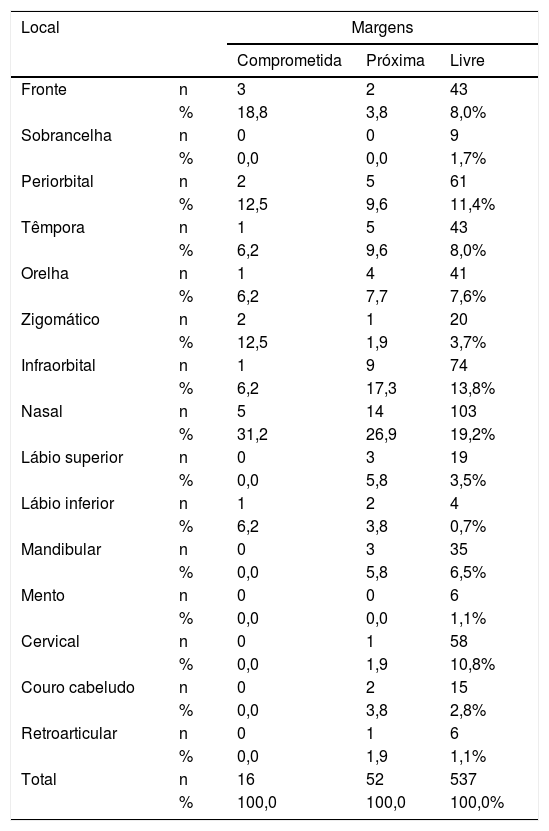
ResultadosDos 923 tumores de pele ressecados, incluímos 605 excisados de 389 pacientes. A média de idade dos pacientes foi de 69±11,45 anos, com discreta predominância de pacientes do sexo masculino (52,8%). A topografia mais comum foi nasal (122 casos, 20,2%), seguida pela zona infraorbital (84 casos, 13,9%). As demais topografias e taxas foram mostradas na tabela 1. O tipo histológico mais comum foi o nodular (382 casos, 63,1%), seguido pelo tipo basoescamoso (57 casos, 9,4%). Havia 136 casos com mais de uma variante (22,4%). As margens laterais apresentavam‐se comprometidas, próximas e livres em 12 (1,9%), 29 (4,7%) e 564 casos (93,2%), respectivamente. As margens profundas foram milimetricamente especificadas em apenas 207 casos (34,2%); 6 casos (0,9%) estavam comprometidos e 29 casos (4,7%) eram próximos. No geral, com base nas margens lateral e profunda, 16 casos (2,6%) foram classificados como comprometidos, 52 (8,5%) como próximos e 537 (88,7%) como margens livres.
Distribuição topográfica dos casos de CBC de acordo com o status da margem
| Local | Margens | |||
|---|---|---|---|---|
| Comprometida | Próxima | Livre | ||
| Fronte | n | 3 | 2 | 43 |
| % | 18,8 | 3,8 | 8,0% | |
| Sobrancelha | n | 0 | 0 | 9 |
| % | 0,0 | 0,0 | 1,7% | |
| Periorbital | n | 2 | 5 | 61 |
| % | 12,5 | 9,6 | 11,4% | |
| Têmpora | n | 1 | 5 | 43 |
| % | 6,2 | 9,6 | 8,0% | |
| Orelha | n | 1 | 4 | 41 |
| % | 6,2 | 7,7 | 7,6% | |
| Zigomático | n | 2 | 1 | 20 |
| % | 12,5 | 1,9 | 3,7% | |
| Infraorbital | n | 1 | 9 | 74 |
| % | 6,2 | 17,3 | 13,8% | |
| Nasal | n | 5 | 14 | 103 |
| % | 31,2 | 26,9 | 19,2% | |
| Lábio superior | n | 0 | 3 | 19 |
| % | 0,0 | 5,8 | 3,5% | |
| Lábio inferior | n | 1 | 2 | 4 |
| % | 6,2 | 3,8 | 0,7% | |
| Mandibular | n | 0 | 3 | 35 |
| % | 0,0 | 5,8 | 6,5% | |
| Mento | n | 0 | 0 | 6 |
| % | 0,0 | 0,0 | 1,1% | |
| Cervical | n | 0 | 1 | 58 |
| % | 0,0 | 1,9 | 10,8% | |
| Couro cabeludo | n | 0 | 2 | 15 |
| % | 0,0 | 3,8 | 2,8% | |
| Retroarticular | n | 0 | 1 | 6 |
| % | 0,0 | 1,9 | 1,1% | |
| Total | n | 16 | 52 | 537 |
| % | 100,0 | 100,0 | 100,0% | |
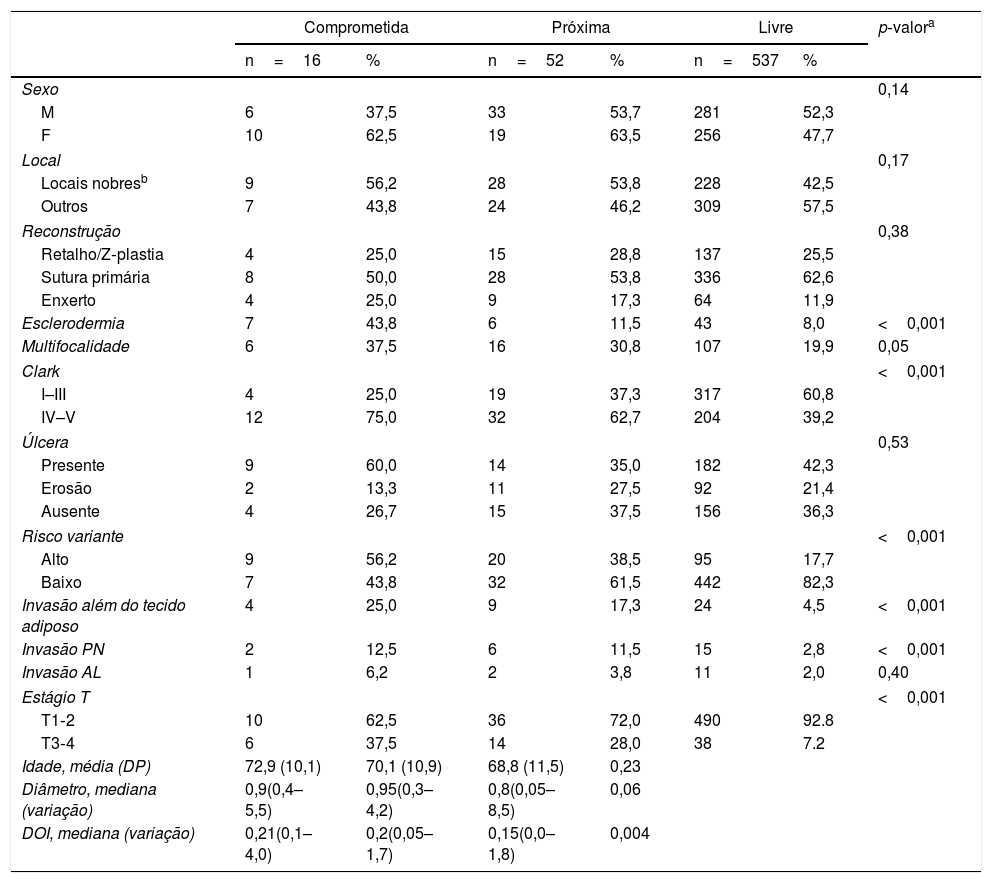
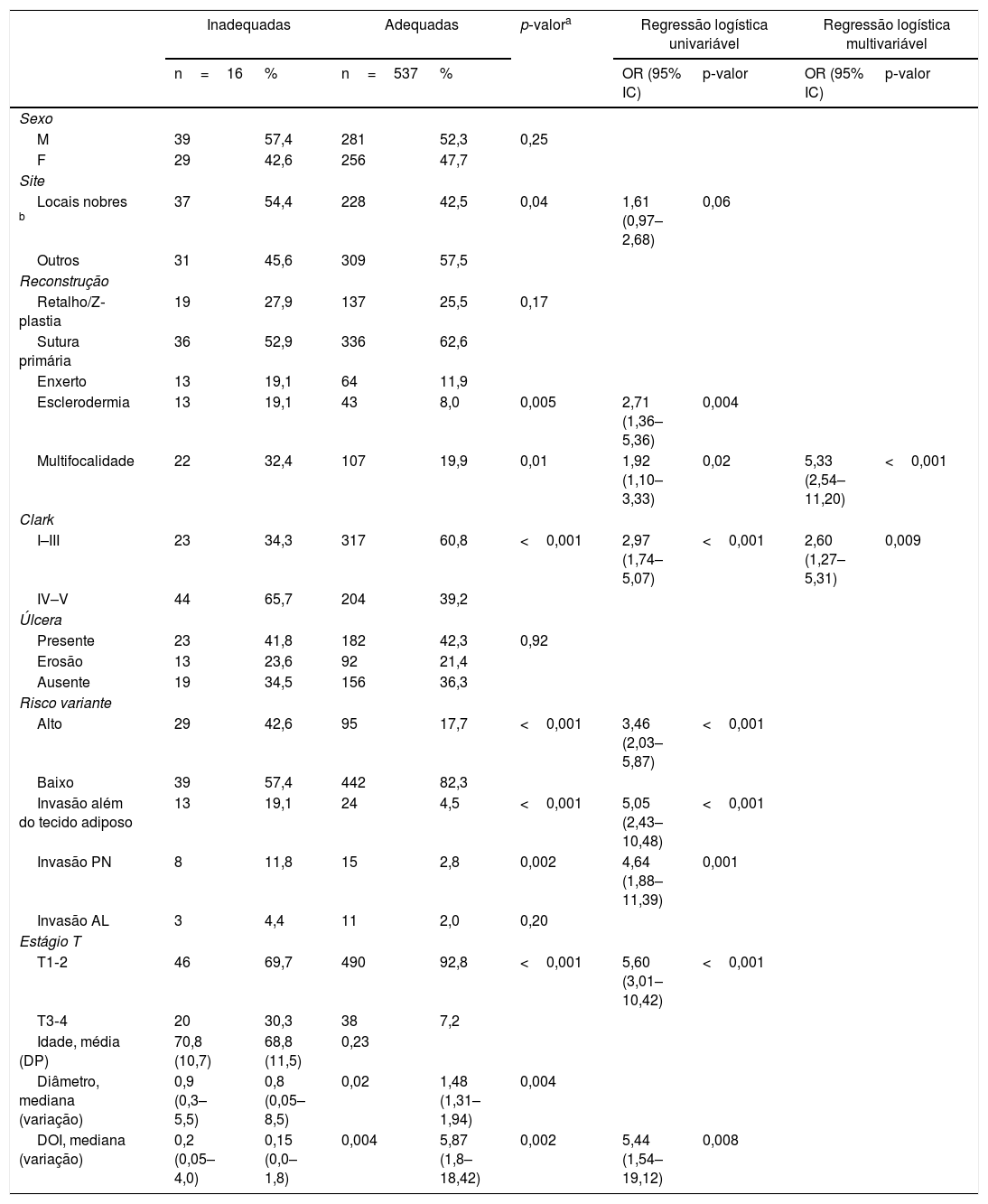
Esses dados foram usados para a análise estatística. Foi encontrada uma associação significativa entre margens comprometidas e variantes mais agressivas (p <0,001), nível de Clark mais alto (p <0,001), maior prevalência de invasão além do tecido adiposo (p <0,001), estágio T mais alto (p <0,001), presença de esclerodermia (p <0,001), invasão perineural (p <0,001) e DOI (p <0,001) (tabela 2). Nenhuma associação foi observada para tumores múltiplos operados no período de três anos de estudo (p=0,14), sexo (p=0,14), idade (p=0,23), tipo de reconstrução (p=0,38), invasão angiolinfática (p=0,40), ulceração (p=0,53) e local primário (p=0,17). Houve tendência de associação entre margens comprometidas e multifocalidade (p=0,05), além de diâmetro do tumor (p=0,06), embora sem significância estatística. Ao analisar margens adequadas versus inadequadas, não apenas presença de esclerodermia (p=0,005), nível de Clark mais elevado (p <0,001), variantes agressivas (p <0,001), invasão além do tecido adiposo (p <0,001), nível mais alto de estágio T (p <0,001) e invasão perineural (p=0,002) mostraram associação estatística com margens inadequadas, mas também o sítio primário (p=0,04), multifocalidade (p=0,01) e diâmetro do tumor (p=0,02) (tabela 3). A análise de regressão stepwise foi usada para avaliar os fatores independentes associados a margens inadequadas. A tabela 3 resume os OR e os intervalos de confiança dos fatores que apresentaram significância estatística na análise multivariada. O conjunto incluiu todas as variáveis analisadas. Multifocalidade, nível de Clark e DOI foram considerados fatores de risco independentes para margens inadequadas.
Associação de características clínico‐patológicas do CBC e status da margem
| Comprometida | Próxima | Livre | p‐valora | ||||
|---|---|---|---|---|---|---|---|
| n=16 | % | n=52 | % | n=537 | % | ||
| Sexo | 0,14 | ||||||
| M | 6 | 37,5 | 33 | 53,7 | 281 | 52,3 | |
| F | 10 | 62,5 | 19 | 63,5 | 256 | 47,7 | |
| Local | 0,17 | ||||||
| Locais nobresb | 9 | 56,2 | 28 | 53,8 | 228 | 42,5 | |
| Outros | 7 | 43,8 | 24 | 46,2 | 309 | 57,5 | |
| Reconstrução | 0,38 | ||||||
| Retalho/Z‐plastia | 4 | 25,0 | 15 | 28,8 | 137 | 25,5 | |
| Sutura primária | 8 | 50,0 | 28 | 53,8 | 336 | 62,6 | |
| Enxerto | 4 | 25,0 | 9 | 17,3 | 64 | 11,9 | |
| Esclerodermia | 7 | 43,8 | 6 | 11,5 | 43 | 8,0 | <0,001 |
| Multifocalidade | 6 | 37,5 | 16 | 30,8 | 107 | 19,9 | 0,05 |
| Clark | <0,001 | ||||||
| I–III | 4 | 25,0 | 19 | 37,3 | 317 | 60,8 | |
| IV–V | 12 | 75,0 | 32 | 62,7 | 204 | 39,2 | |
| Úlcera | 0,53 | ||||||
| Presente | 9 | 60,0 | 14 | 35,0 | 182 | 42,3 | |
| Erosão | 2 | 13,3 | 11 | 27,5 | 92 | 21,4 | |
| Ausente | 4 | 26,7 | 15 | 37,5 | 156 | 36,3 | |
| Risco variante | <0,001 | ||||||
| Alto | 9 | 56,2 | 20 | 38,5 | 95 | 17,7 | |
| Baixo | 7 | 43,8 | 32 | 61,5 | 442 | 82,3 | |
| Invasão além do tecido adiposo | 4 | 25,0 | 9 | 17,3 | 24 | 4,5 | <0,001 |
| Invasão PN | 2 | 12,5 | 6 | 11,5 | 15 | 2,8 | <0,001 |
| Invasão AL | 1 | 6,2 | 2 | 3,8 | 11 | 2,0 | 0,40 |
| Estágio T | <0,001 | ||||||
| T1‐2 | 10 | 62,5 | 36 | 72,0 | 490 | 92.8 | |
| T3‐4 | 6 | 37,5 | 14 | 28,0 | 38 | 7.2 | |
| Idade, média (DP) | 72,9 (10,1) | 70,1 (10,9) | 68,8 (11,5) | 0,23 | |||
| Diâmetro, mediana (variação) | 0,9(0,4–5,5) | 0,95(0,3–4,2) | 0,8(0,05–8,5) | 0,06 | |||
| DOI, mediana (variação) | 0,21(0,1–4,0) | 0,2(0,05–1,7) | 0,15(0,0–1,8) | 0,004 | |||
Dados expressos em valores absolutos e relativos.
M, sexo masculino; F, sexo feminino; PN perineural; AL, angiolinfática; Idade expressa em anos. DOI, profundidade de invasão; Diâmetro e DOI expressos em cm; DP, desvio‐padrão; Variação, valores mínimos e máximos; p: nível de significância.
Preditores de margens inadequadas de CBC
| Inadequadas | Adequadas | p‐valora | Regressão logística univariável | Regressão logística multivariável | |||||
|---|---|---|---|---|---|---|---|---|---|
| n=16 | % | n=537 | % | OR (95% IC) | p‐valor | OR (95% IC) | p‐valor | ||
| Sexo | |||||||||
| M | 39 | 57,4 | 281 | 52,3 | 0,25 | ||||
| F | 29 | 42,6 | 256 | 47,7 | |||||
| Site | |||||||||
| Locais nobres b | 37 | 54,4 | 228 | 42,5 | 0,04 | 1,61 (0,97–2,68) | 0,06 | ||
| Outros | 31 | 45,6 | 309 | 57,5 | |||||
| Reconstrução | |||||||||
| Retalho/Z‐plastia | 19 | 27,9 | 137 | 25,5 | 0,17 | ||||
| Sutura primária | 36 | 52,9 | 336 | 62,6 | |||||
| Enxerto | 13 | 19,1 | 64 | 11,9 | |||||
| Esclerodermia | 13 | 19,1 | 43 | 8,0 | 0,005 | 2,71 (1,36–5,36) | 0,004 | ||
| Multifocalidade | 22 | 32,4 | 107 | 19,9 | 0,01 | 1,92 (1,10–3,33) | 0,02 | 5,33 (2,54–11,20) | <0,001 |
| Clark | |||||||||
| I–III | 23 | 34,3 | 317 | 60,8 | <0,001 | 2,97 (1,74–5,07) | <0,001 | 2,60 (1,27–5,31) | 0,009 |
| IV–V | 44 | 65,7 | 204 | 39,2 | |||||
| Úlcera | |||||||||
| Presente | 23 | 41,8 | 182 | 42,3 | 0,92 | ||||
| Erosão | 13 | 23,6 | 92 | 21,4 | |||||
| Ausente | 19 | 34,5 | 156 | 36,3 | |||||
| Risco variante | |||||||||
| Alto | 29 | 42,6 | 95 | 17,7 | <0,001 | 3,46 (2,03–5,87) | <0,001 | ||
| Baixo | 39 | 57,4 | 442 | 82,3 | |||||
| Invasão além do tecido adiposo | 13 | 19,1 | 24 | 4,5 | <0,001 | 5,05 (2,43–10,48) | <0,001 | ||
| Invasão PN | 8 | 11,8 | 15 | 2,8 | 0,002 | 4,64 (1,88–11,39) | 0,001 | ||
| Invasão AL | 3 | 4,4 | 11 | 2,0 | 0,20 | ||||
| Estágio T | |||||||||
| T1‐2 | 46 | 69,7 | 490 | 92,8 | <0,001 | 5,60 (3,01–10,42) | <0,001 | ||
| T3‐4 | 20 | 30,3 | 38 | 7,2 | |||||
| Idade, média (DP) | 70,8 (10,7) | 68,8 (11,5) | 0,23 | ||||||
| Diâmetro, mediana (variação) | 0,9 (0,3–5,5) | 0,8 (0,05–8,5) | 0,02 | 1,48 (1,31–1,94) | 0,004 | ||||
| DOI, mediana (variação) | 0,2 (0,05–4,0) | 0,15 (0,0–1,8) | 0,004 | 5,87 (1,8–18,42) | 0,002 | 5,44 (1,54–19,12) | 0,008 | ||
Dados expressos em valores absolutos e relativos.
M, sexo masculino; F, sexo feminino; PN perineural; AL, angiolinfática; Idade expressa em anos. DOI, profundidade de invasão; Diâmetro e DOI expressos em cm; DP, desvio‐padrão; Variação, valores mínimos e máximos; p: nível de significância.
Na literatura, a frequência de margens cirúrgicas inadequadas no CBC varia. Margens positivas no CBC de cabeça e pescoço são mais comuns em comparação com outros locais da pele, com uma prevalência de 9 a 37,2% de margens comprometidas.8–12 Em nossa experiência, 2,6% e 8,5% dos casos apresentaram margens comprometidas e margens cirúrgicas inadequadas, respectivamente. É possível que o tratamento por um cirurgião de cabeça e pescoço tenha influenciado os resultados. Estudos comparativos poderiam elucidar esse achado, embora taxas diferentes de margens cirúrgicas incompletas para câncer de pele ao comparar algumas especialidades médicas tenham sido demonstradas na literatura.14,18,19 Este relato é o primeiro a incluir apenas cirurgiões de cabeça e pescoço nesse cenário. Isso ocorre porque, na maioria dos centros oncológicos, o comprometimento desses profissionais com câncer de pele não melanoma se concentra apenas em casos agressivos ou recorrentes, envolve estruturas subjacentes profundas e ressecções maiores. Podemos dizer que a realidade observada em nosso centro é uma exceção, pois tratamos a maioria dos casos de câncer de pele em nossa região, inclusive pequenas lesões de cabeça e pescoço. Transpondo esses fatos para a realidade do câncer de boca, Hanasono et al. mostraram que casos avançados reconstruídos com retalhos microcirúrgicos apresentam menor prevalência de margens comprometidas quando comparados aos de menor diâmetro tratados através de outras formas de reconstrução. Os autores sugeriram que ressecções maiores poderiam ser feitas, sabendo que defeitos mais extensos poderiam ser reconstruídos com segurança. Em outras palavras, a disponibilidade e a capacidade de fazer a reconstrução podem interferir na “liberdade” do cirurgião no momento da ressecção do tumor.20
A ressecção tumoral completa é um dos principais fatores prognósticos na oncologia de cabeça e pescoço21 e isso não é diferente entre as neoplasias cutâneas.3 As recorrências estão associadas a piores desfechos, estão diretamente relacionadas a margens cirúrgicas inadequadas.2,5,12 Codazzi et al. verificaram que cerca de 25% dos casos de câncer de pele com ressecção incompleta apresentaram recorrência, enquanto apenas 6% dos casos completamente ressecados recidivaram.7 Godoy et al. encontraram uma associação entre CBC fibrótico e aumento do risco de margens inadequadas.13 Cho et al. também encontraram uma associação entre margens inadequadas, variantes de CBC mais agressivas e invasão perineural.22 Estudando CBCs de todas as partes do corpo, Codazzi et al. observaram maior prevalência de margens incompletas nos casos de doença de cabeça e pescoço, tumores recorrentes com maior DOI, variantes mais agressivas e idade avançada.7 Farhi et al. identificaram maior frequência de margens incompletas nos CBCs nasais, no canto interno do olho e em tumores mais infiltrativos e multifocais.23 Aqui, observamos que margens cirúrgicas inadequadas foram mais frequentes se houvesse maior prevalência de invasão além do tecido adiposo, invasão perineural, estágio T, diâmetro e DOI maiores, fatores considerados para pioria do estágio histopatológico de acordo com a 8ª edição do Sistema de Estadiamento do AJCC. É provável que os mesmos fatores também estejam envolvidos com uma maior chance de recorrência, o que corrobora as atualizações do sistema de estadiamento atual. A multifocalidade, a presença de tumores em zonas nobres e a presença de esclerodermia também conferem ao tumor um risco aumentado de margens cirúrgicas inadequadas. A indefinição das bordas do tumor e os limites de ressecção sem comprometer significativamente a função e a estética provavelmente influenciaram esses resultados.
Há diferentes maneiras de reduzir o risco de envolvimento das margens cirúrgicas em tumores cutâneos. A mais aceita é a cirurgia micrográfica de Mohs, atualmente considerada o padrão‐ouro para cirurgia oncológica cutânea.24 Essa cirurgia não é rotina em nosso centro terciário. O método não é coberto pela saúde pública ou mesmo pelos planos de saúde privados em nosso país, que são o recurso financeiro para a maioria dos tratamentos de nossos pacientes. A nossa instituição é um centro de referência para uma região com alta incidência de câncer de pele, com uma população branca ativamente ligada a atividades agrárias. Mantendo as mesmas taxas de recorrência observadas por Codazzi et al.7 e nossas taxas de margens comprometidas e incompletas, nossa estimativa é de 4 a 17 reoperações por ano diretamente relacionadas ao status da margem. Não observamos dificuldades no resgate dos casos recorrentes e defendemos que, para centros com alto volume de cirurgias e baixo índice de margens cirúrgicas inadequadas, é possível que a prática cirúrgica permaneça conservadora.
A principal limitação do nosso estudo é o baixo volume de casos com margens comprometidas, compensado pela divisão da amostra em margens adequadas e inadequadas. Outra possível limitação é a perda de discriminação milimétrica nas margens profundas em uma parcela significativa dos casos, embora eles tenham sido descritos como livres. É importante enfatizar que, em algumas áreas específicas, margens profundas próximas, mas com a preservação do tecido subjacente, podem ser apropriadas. Um exemplo clássico são os casos de câncer da concha auricular, ramos da hélice ou anti‐hélice, sem sinais de infiltração de cartilagem, onde a ressecção do pericôndrio pode ser suficiente e adequada para preservar a estética e a funcionalidade. Em outras áreas onde o tecido adiposo subcutâneo é abundante, é uma prática comum extrair uma amostra espessa de tecido profundo, mesmo em tumores cutâneos iniciais. Estudos de acompanhamento ou análise do padrão de casos recorrentes podem ajudar a resolver esse problema.
ConclusãoO exame clínico macroscópico pode ser o suficiente para garantir uma baixa prevalência de margens cirúrgicas inadequadas no tratamento do CBC de cabeça e pescoço em centros oncológicos altamente experientes. Multifocalidade, nível de Clark e DOI foram considerados fatores de risco independentes para margens inadequadas.
Aprovação éticaTodos os procedimentos feitos em estudos que envolvem participantes humanos estavam de acordo com os padrões éticos do comitê de pesquisa institucional e/ou nacional e com a declaração de Helsinque de 1964 e suas alterações posteriores ou padrões éticos comparáveis.
Consentimento informadoComo este estudo foi retrospectivo e não houve intervenção, o consentimento informado não foi aplicado.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp 2016/21785‐4) pela bolsa de estudos e ao Laboratório de Patologia Objetiva pela ajuda na revisão dos dados. Manoela Domingues Martins recebe apoio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Como citar este artigo: Girardi FM, Wagner VP, Martins MD, Abentroth AL, Hauth LA. Factors associated with incomplete surgical margins in basal cell carcinoma of the head and neck. Braz J Otorhinolaryngol. 2021;87:695–701.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.