Os tumores malignos das glândulas salivares são entidades patológicas incomuns, representam menos de 5% das neoplasias de cabeça e pescoço. O prognóstico dos pacientes com tumores malignos das glândulas salivares é altamente variável e alguns fatores clínicos podem influenciar significativamente a sobrevida global.
ObjetivoAnalisar as características clinicopatológicas e sociodemográficas que influenciam a sobrevida em pacientes com tumores malignos das glândulas salivares.
MétodoEste estudo retrospectivo analisou sexo, idade, etnia, nível de escolaridade, localização do tumor, tamanho do tumor, envolvimento linfonodal, metástase distante, margens, tipo de tratamento, estado civil, método de acesso à assistência médica e sobrevida global em 15 anos de 193 pacientes com tumores malignos das glândulas salivares. Foram usados os testes X2, log‐rank Mantel‐Cox, regressão multinomial e regressão logística de Cox (SPSS 20.0, p <0,05).
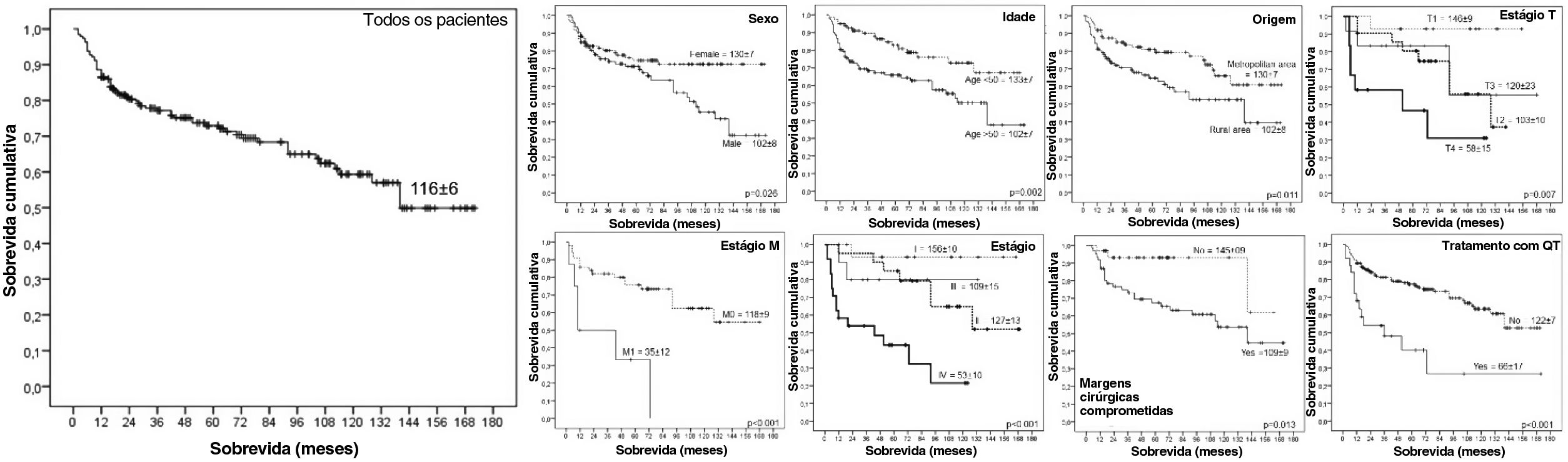
ResultadosOs tipos histológicos mais comuns foram adenocarcinoma (32,1%), carcinoma adenoide cístico (31,1%) e carcinoma mucoepidermoide (18,7%). A taxa de sobrevida global em 15 anos foi de 67,4%, com média de 116±6 meses. A análise univariada revelou que sexo masculino (p=0,026), idade >50 anos (p=0,001), origem de referência do sistema público de saúde (p=0,011), estádio T (p=0,007), estádio M (p <0,001)), estágio clínico (p <0,001), margens cirúrgicas comprometidas (p=0,013) e quimioterapia (p <0,001) foram associados a um prognóstico ruim. As análises multivariadas também mostraram que a idade >50 anos foi associada independentemente a um prognóstico ruim (p=0,016). O nível de escolaridade foi o único fator mais prevalente em pacientes idosos (p=0,011).
ConclusãoPacientes com tumores malignos das glândulas salivares acima de 50 anos apresentam pior prognóstico e associação independente com baixo nível de escolaridade.
Tumores malignos das glândulas salivares (TMGS) são entidades patológicas incomuns, representando menos de 5% das neoplasias de cabeça e pescoço.1 O prognóstico dos pacientes com TMGS varia muito e alguns fatores clínicos influenciam significativamente o tempo livre da doença e a sobrevida global. A taxa de sobrevida desses tumores varia de 19,6% a 84,7%, a depender do tipo histológico e do sítio anatômico e, principalmente, da terapia de escolha.2–5
Epidemiologicamente, essas neoplasias são mais frequentes na glândula parótida em mulheres adultas de meia idade e são representadas principalmente pelo carcinoma mucoepidermoide (CME) e carcinoma adenoide cístico (CAC).6 Apesar de sua alta prevalência na glândula parótida, essas lesões são distribuídas de forma heterogênea, se considerarmos sua distribuição topográfica: apenas 25% dos tumores da glândula parótida são malignos; entretanto, os tumores da glândula submandibular e os tumores das glândulas salivares menores representam 50% e 81% das lesões malignas respectivamente.7
Os estudos de sobrevida relataram diferentes frequências e distribuições de fatores sociodemográficos, como idade, sexo e etnia.8–10 Essas variáveis tornam‐se difíceis de comparar entre os estudos porque são muito diversas e sofrem reclassificações intensas.11 Além disso, o prognóstico é diretamente influenciado pelo sítio de envolvimento, o estadiamento do tumor e seu tipo histológico. O comportamento dos tumores das glândulas salivares ainda tem pouca previsibilidade devido à falta de fatores prognósticos bem delineados, o que torna a maioria desses tumores extremamente agressivos, resulta em um prognóstico ruim.2,7
Vários fatores parecem estar associados ao prognóstico ruim dos TMGS e é muito importante que isso seja considerado durante o diagnóstico para orientar o tratamento adequado. De fato, diferentes populações têm fatores de risco individuais e, às vezes, muito específicos no desenvolvimento desse conjunto de lesões.12,13 Da mesma forma, a abordagem terapêutica do centro de tratamento também pode influenciar o prognóstico dos pacientes com essas lesões.4
Entretanto, a raridade desses tumores torna difícil a realização de estudos de caso‐controle, de coorte e ensaios clínicos. Isso faz dos estudos observacionais transversais uma fonte importante de informação sobre esse tipo de lesão.6,9,12,14 Assim, o objetivo deste estudo foi caracterizar, com base em uma análise retrospectiva, tumores malignos das glândulas salivares e identificar fatores clínicos e sociodemográficos que influenciam a sobrevida desse grupo de pacientes.
MétodoDesenho do estudo e preceitos éticosEste é um estudo observacional, retrospectivo, transversal, no qual foram coletados dados clínicos e histopatológicos de pacientes com tumores malignos das glândulas salivares diagnosticados no Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará, por 15 anos (1° de janeiro de 2000 a 31 de dezembro de 2014). Este estudo foi submetido ao comitê de ética em pesquisa (CEP) do Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará, e foi aceito sob o parecer número 1.203.732.
Amostragem de dados e pesquisaAvaliamos os laudos de biópsia e os prontuários médicos de pacientes cuja entrada no serviço ocorreu entre 1° de janeiro de 2000 e 31 de dezembro de 2014. A classificação foi baseada nas diretrizes da Organização Mundial da Saúde em 2017.11 Dados sobre o tipo histológico, sexo, idade, etnia, origem do paciente (área rural/área metropolitana), nível de escolaridade do paciente, modo de acesso ao hospital (serviço público ou privado), localização primária do tumor (glândulas salivares maiores ou menores; se menores, região da cavidade oral), tamanho do tumor (T), presença de metástase linfonodal (N), presença de metástase distante (M), estadiamento e tipo de tratamento (cirurgia, radioterapia, quimioterapia e suas associações) foram analisados.
O status de sobrevida global também foi avaliado e o tempo de sobrevida (em meses) foi calculado subtraindo a data no diagnóstico inicial da data do último retorno ao hospital ou morte.15
Análise estatísticaOs dados descritivos e as frequências de óbito foram expressos como frequências absolutas e percentagens e comparados pelo teste exato de Fisher ou pelo teste do qui‐quadrado de Pearson. O tempo de sobrevida foi baseado nas curvas de Kaplan‐Meier e comparado pelo teste de log‐rank de Mantel‐Cox (expresso como média e erro‐padrão). Em seguida, foi usado o modelo stepwise forward, no qual variáveis com p <0,200 foram adicionadas ao modelo multivariado. As curvas de sobrevida introduzidas no modelo foram analisadas por regressão de Cox e os dados categóricos subsequentes foram analisados por regressão logística multinomial. Todas as análises foram feitas com o software Statistical Package for Social Sciences (SPSS), versão 17.0 (SPSS, Chicago, IL, EUA) (p <0,05).
ResultadosCaracterização da amostra: tipos histológicosDe 2000 a 2014, 193 pacientes com tumores malignos das glândulas salivares foram diagnosticados no Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará. Desses, 62 (32,1%) foram diagnósticos de adenocarcinoma, NOS (not otherwise specified) (AC‐NOS), seguidos por 60 (31,1%) de CAC, 36 (18,7%) de CME e 35 (18,1%) de outro tumor: 11 carcinomas de células acinares, 9 carcinomas epiteliais‐mioepiteliais, 5 carcinomas do ducto salivar, 4 carcinomas intraductais, 3 carcinomas mioepiteliais, 2 carcinomas linfoepiteliais e um carcinosarcoma.
Caracterização da amostra: fatores sociodemográficos e sobrevida globalAo longo dos 15 anos de avaliação, a taxa de sobrevida global foi de 67,4% (n=130), com tempo médio de sobrevivência de 116±6 meses. Entre os pacientes pesquisados, 99 (55,1%) eram do sexo feminino e 94 (48,7%) do masculino. Nos pacientes do sexo masculino, o número total de pacientes vivos (p=0,011) e o tempo médio de sobrevida (p=0,026) foram significativamente menores do que nas pacientes do sexo feminino. A maioria dos pacientes tinha idade superior a 50 anos (n=112, 58,0%) e os pacientes com idade superior a esse ponto de corte apresentaram maior taxa de óbito (p=0,003) e menor tempo de sobrevida (p=0,001) (tabela 1, fig. 1).
Influência do perfil sociodemográfico na frequência de óbitos e no tempo de sobrevida de pacientes com lesões malignas das glândulas salivares diagnosticados e tratados no Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará, entre 2000 e 2014
| Óbito | Média da sobrevida | |||||
|---|---|---|---|---|---|---|
| Total | Vivo | Morto | p‐valor | p‐valor | ||
| Sexo | ||||||
| Masculino | 94 (48,7%) | 55 (42,3%) | 39 (61,9%)a | 0,011a | 102±8 | 0,026a |
| Feminino | 99 (51,3%) | 75 (57,7%)a | 24 (38,1%) | 130±7b | ||
| Idade | ||||||
| Até 50 anos | 81 (42,0%) | 64 (49,2%)a | 17 (27,0%) | 0,003a | 133±7b | 0,001a |
| Mais de 50 anos | 112 (58,0%) | 66 (50,8%) | 46 (73,0%)a | 102±7 | ||
| Etnia | ||||||
| Branco | 75 (40,8%) | 52 (43,0%) | 23 (36,5%) | 0,491 | 110±7 | 0,442 |
| Pele escura | 109 (59,2%) | 69 (57,0%) | 40 (63,5%) | 116±8 | ||
| Nível de escolaridade | ||||||
| Analfabeto(a) / Ensino fundamental incompleto | 78 (56,9%) | 43 (49,4%) | 35 (70,0%)a | 0,019a | 110±7 | 0,212 |
| Ensino fundamental completo ou superior | 59 (43,1%) | 44 (50,6%)a | 15 (30,0%) | 116±8 | ||
| Origem | ||||||
| Área metropolitana | 97 (50,3%) | 73 (56,2%)a | 24 (38,1%) | 0,019a | 130±7b | 0,011a |
| Área rural | 96 (49,7%) | 57 (43,8%) | 39 (61,9%)a | 102±8 | ||
| Estado civil | ||||||
| Casado(a) | 52 (27,1%) | 39 (30,2%) | 13 (20,6%) | 0,358 | 125±10 | 0,594 |
| Solteiro(a) | 111 (57,8%) | 72 (55,8%) | 39 (61,9%) | 114±7 | ||
| Outros | 29 (15,1%) | 18 (14,0%) | 11 (17,5%) | 102±12 | ||
| Referência | ||||||
| Sistema Público de Saúde | 96 (77,4%) | 59 (73,8%) | 37 (84,1%) | 0,188 | 109±10 | 0,278 |
| Sistema Privado de Saúde | 28 (22,6%) | 21 (26,3%) | 7 (15,9%) | 106±7 | ||
| Histórico familiar | ||||||
| Sim | 28 (46,7%) | 22 (50,0%) | 6 (37,5%) | 0,391 | 91±8 | 0,747 |
| Não | 32 (53,3%) | 22 (50,0%) | 10 (62,5%) | 108±9 | ||
| Alcoolismo | ||||||
| Sim | 52 (88,1%) | 38 (88,4%) | 14 (87,5%) | 1,000 | 105±8 | 1,000 |
| Não | 7 (11,9%) | 5 (11,6%) | 2 (12,5%) | 37±6 | ||
| Tabagismo | ||||||
| Sim | 43 (78,2%) | 35 (83,3%) | 8 (61,5%) | 0,129 | 102±6 | 0,070 |
| Não | 12 (21,8%) | 7 (16,7%) | 5 (38,5%) | 73±13 | ||
A maior parte da coorte era de etnia parda (n=109, 59,2%). Pacientes com baixo nível de escolaridade (n=78, 56,9%) também eram a maioria. Apesar de apresentar maior taxa de mortalidade (p=0,019), esses pacientes tiveram o mesmo tempo de sobrevida dos pacientes com nível maior de escolaridade (p=0,212) (tabela 1, fig. 1).
Pacientes que viviam em área metropolitana (n=97, 50,3%) apresentaram menores taxas de mortalidade e maior tempo de sobrevida em comparação com aqueles que moravam em área rural (n=96, 49,7%). Morar em área rural também teve uma influência significante na mortalidade (p=0,019) e no tempo de sobrevida (p=0,011) (tabela 1, fig. 1).
Outros fatores sociodemográficos estudados foram estado civil, com maior prevalência de solteiros (n=111, 57,8%), e modo de acesso hospitalar, com maior prevalência do serviço público (n=96, 77,4%). A história familiar de câncer estava ausente na maioria dos pacientes (n=32, 53,3%) e do uso prévio de álcool e tabagismo estava presente na maioria dos pacientes (n=52, 88,1% e n=43, 78,2%, respectivamente). Entretanto, esses fatores não influenciaram a mortalidade ou o tempo de sobrevida (tabela 1, fig. 1).
Fatores clinicopatológicos e sobrevida globalA maioria dos tumores era de glândulas salivares maiores (n=127, 65,8%), mas esse fator não influenciou o tempo de sobrevida dos pacientes (p=0,073 e p=0,097). O tipo histológico mais comum, AC‐NOS, apresentou a maior taxa de mortalidade (n=27, 42,9%), seguido por CAC (n=21, 33,3%) e outros tumores (n=10, 15,9%). A menor taxa de mortalidade foi observada em pacientes com CME (n=5, 7,9%) (p=0,023). Não houve diferenças na sobrevida global entre esses tipos histológicos principais de tumores (p=0,054) (tabela 2).
Influência do perfil clínico‐patológico e terapêutico na taxa de mortalidade e no tempo de sobrevida de pacientes com lesões malignas das glândulas salivares diagnosticados e tratados no Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará entre 2000 e 2014
| Óbito | Média de Sobrevida | |||||
|---|---|---|---|---|---|---|
| Total | Vivo | Morto | p‐valor | Total | ||
| Localização | ||||||
| Menor | 66 (34,2%) | 50 (38,5%) | 16 (25,4%) | 0,073 | 130±9 | 0,097 |
| Maior | 127 (65,8%) | 80 (61,5%) | 47 (74,6%) | 110±7 | ||
| Tipo histológico | ||||||
| AC‐NOS | 61 (32,1%) | 35 (26,9%) | 27 (42,9%)a | 0,023a | 101±10 | 0,054 |
| CAC | 60 (31,1%) | 39 (30,0%) | 21 (33,3%) | 114±9 | ||
| CME | 36 (18,7%) | 31 (23,8%)a | 5 (7,9%) | 130±8b | ||
| Outros | 36 (18,7%) | 25 (19,2%) | 10 (15,9%) | 109±11 | ||
| T | ||||||
| 1 | 14 (23,7%) | 13 (32,5%)a | 1 (5,3%) | 0,038a | 146±9b | 0,007a |
| 2 | 21 (35,6%) | 13 (32,5%) | 8 (42,1%) | 103±10 | ||
| 3 | 12 (20,3%) | 9 (22,5%) | 3 (15,8%) | 120±23 | ||
| 4 | 12 (20,3%) | 5 (12,5%) | 7 (36,8%)a | 58±15 | ||
| N | ||||||
| N0 | 45 (81,8%) | 32 (84,2%) | 13 (76,5%) | 0,479 | 124±10 | 0,342 |
| N+ | 9 (16,4%) | 6 (15,8%) | 4 (23,5%) | 81±16 | ||
| M | ||||||
| 0 | 56 (87,5%) | 38 (95,0%)a | 18 (75,0%) | 0,044a | 118±9b | <0,001 |
| 1 | 8 (12,5%) | 2 (5,0%) | 6 (25,0%)a | 35±12 | ||
| Estágio | ||||||
| 1 | 16 (22,9%) | 15 (33,3%)a | 1 (4,0%) | 0,002a | 156±10b | <0,001 |
| 2 | 20 (28,6%) | 13 (28,9%) | 7 (28,0%) | 127±13 | ||
| 3 | 10 (14,3%) | 8 (17,8%) | 2 (8,0%) | 109±15 | ||
| 4 | 24 (34,3%) | 9 (20,0%) | 15 (60,0%)a | 53±10 | ||
| Cirurgia | ||||||
| Não | 100 (51,8%) | 65 (50,0%) | 35 (55,6%) | 0,469 | 111±8 | 0,325 |
| Sim | 93 (48,2%) | 65 (50,0%) | 28 (44,4%) | 121±8 | ||
| Margens cirúrgicas comprometidas | ||||||
| Não | 32 (34,4%) | 29 (44,6%)a | 3 (10,7%) | 0,002 | 145±9 | 0,013 |
| Sim | 61 (65,6%) | 36 (55,4%) | 25 (89,3%)a | 109±9 | ||
| RT | ||||||
| Não | 71 (36,8%) | 50 (38,5%) | 21 (33,3%) | 0,488 | 122±9 | 0,598 |
| Sim | 122 (63,2%) | 80 (61,5%) | 42 (66,7%) | 113±7 | ||
| QT | ||||||
| Não | 168 (87,0%) | 119 (91,5%)a | 49 (77,8%) | 0,008a | 122±7b | <0,001 |
| Sim | 25 (13,0%) | 11 (8,5%) | 14 (22,2%)a | 66±17 | ||
RT, radioterapia; QT, quimioterapia.
Os pacientes apresentaram estágios homogêneos: T1 (n=14, 23,7%), T2 (n=21, 35,6%), T3 e T4 (ambos com n=12, 20,3%). Os pacientes no estágio T4 apresentaram a maior taxa de mortalidade (p=0,038) e tempo de sobrevida curto (p=0,007). A maioria dos pacientes não apresentou metástase linfonodal (n=45, 81,8%) e esse fator não influenciou significantemente a taxa de mortalidade (p=0,479) ou o tempo de sobrevida (p=0,342). Observamos a presença de metástases apenas em 8 pacientes (12,5%). Esse fator aumentou significantemente a taxa de mortalidade (p=0,002) e reduziu o tempo de sobrevida (p <0,001).
Os pacientes originários da área rural apresentaram um ligeiro aumento na prevalência de tumores T3 / 4 (n=18, 52,9% vs. n=14, 40,0%; p=0,281) e tumores M1 (n=7, 21,2% vs. n=4, 11,1%; p=0,330); porém, essas variáveis não foram significantemente influenciadas pela procedência dos pacientes.
Dos tratamentos feitos, a radioterapia foi a mais usada (n=122, 63,2%), seguida pela cirurgia (n=93, 48,2%) e quimioterapia (n=25, 13,0%). Os pacientes com margens cirúrgicas comprometidas e os pacientes submetidos à quimioterapia apresentaram alta taxa de mortalidade (p=0,002 e p=0,008, respectivamente) e curto tempo de sobrevida (p=0,013 e p <0,001, respectivamente) (tabela 2, fig. 1).
Análise de sobrevida: idade e escolaridade como fatores direta e indiretamente associadosNa análise de sobrevida multivariada, apenas a idade acima de 50 anos influenciou de forma significante e independente a sobrevida (p=0,016). Pacientes acima de 50 anos apresentaram risco de morte 9,967 vezes maior do que os pacientes mais jovens com esse ponto de corte (IC95%: 5,772‐171,507) (tabela 3).
Análise multivariada da sobrevida de pacientes com lesões malignas da glândula salivar diagnosticados e tratados no Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará entre 2000 e 2014
| p‐valor | HR ajustado | IC 95% | ||
|---|---|---|---|---|
| Sexo | 0,833 | 1,230 | 0,178 | 8,458 |
| Idade | 0,016a | 9,967 | 5,772 | 171,507 |
| Origem | 0,062 | 6,217 | 0,628 | 26,731 |
| Tabagismo | 1,000 | 0,470 | 0,008 | 7,421 |
| Localização | 0,052 | 4,021 | 0,939 | 17,287 |
| Tipo histológico | 0,053 | 0,193 | 0,036 | 1,024 |
| T | 0,082 | 5,471 | 0,987 | 20,512 |
| M | 0,087 | 0,397 | 0,016 | 7,779 |
| Estadiamento | 0,080 | 0,021 | 0,001 | 1,838 |
| Margens cirúrgicas comprometidas | 0,999 | 1,390 | 0,123 | 13,912 |
| QT | 0,089 | 1,454 | 0,117 | 1,808 |
HR, hazard risk; IC, intervalo de confiança (95%); QT, quimioterapia.
Pacientes com mais de 50 anos apresentaram maior prevalência de homens (p=0,030), com baixa escolaridade (p=0,002), indivíduos solteiros (p <0,001) e não fumantes (p=0,002) e foram mais frequentemente tratados com radioterapia (p=0,029) e quimioterapia (p=0,018) (tabela 4). O fator que se associou independentemente à idade foi o nível de escolaridade (p=0,011), 0,047 vez menor em pacientes acima de 50 anos (IC95%: 0,004‐0,503) (tabela 5).
Influência da idade no perfil sociodemográfico, clínico‐patológico e terapêutico de pacientes com lesões malignas das glândulas salivares diagnosticados e tratados no Hospital Haroldo Juaçaba, Instituto do Câncer do Ceará entre 2000 e 2014
| Idade | |||
|---|---|---|---|
| Até 50 anos | Acima de 50 anos | p‐valor | |
| Sexo | |||
| Masculino | 32 (39,5%) | 62 (55,4%)a | 0,030 |
| Feminino | 49 (60,5%)a | 50 (44,6%) | |
| Etnia | |||
| Branco | 33 (43,4%) | 42 (38,9%) | 0,538 |
| Pele escura | 43 (56,6%) | 66 (61,1%) | |
| Nível de escolaridade | |||
| Analfabeto/ Ensino fundamental incomplete | 20 (39,2%) | 58 (67,4%)b | 0,002a |
| >Ensino fundamental | 31(60,8%)a | 28 (32,6%) | |
| Origem | |||
| Área metropolitan | 44 (54,3%) | 53 (47,3%) | 0,337 |
| Área rural | 37 (45,7%) | 59 (52,7%) | |
| Estado civil | |||
| Casado(a) | 35 (43,2%)a | 17 (15,3%) | <0,001 |
| Solteiro (a) | 41 (50,6%) | 70 (63,1%) | |
| Divorciado (a)/ Separado (a) | 5 (6,2%) | 24 (21,6%)a | |
| Encaminhamento | |||
| Sistema Público de Saúde | 43 (79,6%) | 53 (75,7%) | 0,605 |
| Sistema Privado de Saúde | 11 (20,4%) | 17 (24,3%) | |
| Histórico familiar | |||
| Sim | 9 (47,4%) | 19 (46,3%) | 0,941 |
| Não | 10 (52,6%) | 22 (53,7%) | |
| Alcoolismo | |||
| Sim | 22 (95,7%) | 30 (83,3%) | 0,229 |
| Não | 1 (4,3%) | 6 (16,7%) | |
| Tabagismo | |||
| Sim | 21 (100,0%)a | 22 (64,7%) | 0,002a |
| Não | 0 (0,0%) | 12 (35,3%)a | |
| Localização | |||
| Menor | 28 (34,6%) | 38 (33,9%) | 1,000 |
| Maior | 53 (65,4%) | 74 (66,1%) | |
| Tipo histológico | |||
| NOS‐AC | 19 (23,5%) | 43 (38,4%) | 0,086 |
| CAC | 28 (34,6%) | 32 (28,6%) | |
| CME | 20 (24,7%) | 16 (14,3%) | |
| Outros | 14 (17,3%) | 21 (18,8%) | |
| T | |||
| 1 | 10 (35,7%) | 4 (12,9%) | 0,210 |
| 2 | 9 (32,1%) | 12 (38,7%) | |
| 3 | 4 (14,3%) | 8 (25,8%) | |
| 4 | 5 (17,9%) | 7 (22,6%) | |
| N | |||
| N0 | 24 (85,7%) | 21 (77,8%) | 0,503 |
| N+ | 4 (14,3%) | 6 (22,2%) | |
| M | |||
| 0 | 26 (86,7%) | 30 (88,2%) | 1,000 |
| 1 | 4 (13,3%) | 4 (11,8%) | |
| Estadiamento | |||
| 1 | 11 (33,3%) | 5 (13,5%) | 0,164 |
| 2 | 10 (30,3%) | 10 (27,0%) | |
| 3 | 4 (12,1%) | 6 (16,2%) | |
| 4 | 8 (24,2%) | 16 (43,2%) | |
| Cirurgia | |||
| Não | 41 (50,6%) | 59 (52,7%) | 0,884 |
| Sim | 40 (49,4%) | 53 (47,3%) | |
| Margens cirúrgicas comprometidas | |||
| Não | 23 (57,5%) | 38 (71,7%) | 0,201 |
| Sim | 17 (42,5%) | 15 (28,3%) | |
| RT | |||
| Não | 37 (45,7%)a | 34 (30,4%) | 0,029a |
| Sim | 44 (54,3%) | 78 (69,6%)a | |
| QT | |||
| Não | 76 (93,8%)a | 92 (82,1%) | 0,018a |
| Sim | 5 (6,2%) | 20 (17,9%)a | |
Análise multivariada da influência da idade nas características sociodemográficas, clinicopatológicas e terapêuticas de pacientes com lesões malignas das glândulas salivares diagnosticados e tratados no Hospital Haroldo Juaçaba ‐ Instituto do Câncer do Ceará entre 2000 e 2014
| p‐valor | OR ajustado | IC95% | ||
|---|---|---|---|---|
| Sexo | 0,414 | 0,454 | 0,068 | 3,021 |
| Nível de escolaridade | 0,011a | 0,047 | 0,004 | 0,503 |
| Estado civil | 0,134 | 0,143 | 0,011 | 1,826 |
| Tabagismo | 0,998 | 0,123 | 0,012 | 3,213 |
| Tipo histológico | 0,201 | 0,119 | 0,005 | 3,106 |
| Estadiamento | 0,315 | 3,058 | 0,345 | 27,109 |
| RT | 0,715 | 0,689 | 0,094 | 5,074 |
| QT | 0,212 | 7,793 | 0,311 | 195,466 |
OR, Odds Ratio; IC, Intervalo de Confiança (95%); RT, Radioterapia; QT, Quimioterapia.
Os TMGS são um grupo heterogêneo de tumores raros, nos quais os preditores de mortalidade são incertos e a morte pode ocorrer até décadas após o tratamento inicial, o que justifica a tendência para recorrência tardia.8,14 Portanto, para obter informações confiáveis sobre fatores prognósticos, é necessário acompanhar os pacientes por muitos anos. Essa é provavelmente a razão pela qual a grande maioria dos estudos é retrospectiva.6,9,12,14
O presente estudo observou uma sobrevida global de 67,4% e um tempo de sobrevida de 116±6 meses em um seguimento de 15 anos. Outros autores relataram menores taxas de sobrevida global em 15 anos, variaram de 39,8% a 42%.12,13 Mesmo nas estimativas de 10 e 5 anos, foram relatadas taxas mais baixas, variaram de 19,6% a 51% e 35,3% a 65,9%, respectivamente.5,8,9,12,13,16 Valores mais altos também foram apresentados na literatura.4,17 Ouyang et al.4 apresentaram taxas de sobrevida global de 5, 10 e 15 anos, 84,7%, 70.8% e 34%, respectivamente. Monteiro et al.17 apresentaram um valor ligeiramente superior ao que encontramos (sobrevida de 71% em 5 anos). Essas diferenças podem estar relacionadas à variabilidade histológica das amostras e à abordagem terapêutica empregada em cada centro.9,17
Os TMGS provaram ser um grupo heterogêneo e a variabilidade histológica da amostra foi compatível com os dados relatados anteriormente.3,5,10,12,13,17,18 No presente estudo, o AC foi o tipo histológico mais comum, seguido por CAC, CME e nove outros tumores.
Nossos dados não apresentaram prognósticos diferentes para os tipos histológicos. No entanto, Baddour et al.19 e Kokemueller et al.13 demonstraram maiores taxas de sobrevida em 5, 10 e 15 anos para o CME em relação ao AC.
Em nosso estudo, não houve predominância de gênero, o que está de acordo com outros achados.13,17,20–22 Entretanto, em estudos brasileiros anteriores, uma predileção por mulheres6,23–25 foi observada ao se analisarem diferentes tumores. Um grande estudo brasileiro, com 2.292 casos, demonstrou uma proporção de mulheres: homens de 1,5:1, mas quando somente o CAC foi descrito houve uma leve predominância do sexo masculino (M:F=1,22:1).26 A predileção pelo sexo masculino também foi demonstrada ao avaliar tumores malignos e benignos juntos, mas esses achados são apoiados por um número menor de casos avaliados.27
A análise univariada mostrou maior frequência de óbitos nos homens. Esse achado está de acordo com vários outros estudos anteriores.5,8,12,16,21,28 Iwata et al.16 encontraram, em uma análise univariada, que o sexo feminino é um fator protetor, traz um aumento de 50% na taxa de sobrevida em 5 anos e um aumento de 40% na taxa de sobrevida em 10 anos. Esse fato permaneceu na análise multivariada, na qual o sexo feminino trouxe um aumento de 47% na taxa de sobrevida em 5 anos e um aumento de 40% na taxa de sobrevida em 10 anos.16 Curiosamente, Baddour et al.19 verificaram que o sexo não é um fator prognóstico independente que influencia a sobrevida global desses pacientes, semelhantemente ao nosso estudo.
Encontramos uma influência da procedência dos pacientes na sobrevida global. Pacientes de áreas rurais apresentaram pior prognóstico do que pacientes de regiões metropolitanas. Esses achados se assemelham aos de estudos americanos.16,28 O acesso a serviços oncológicos de alta complexidade é um importante fator prognóstico;28 evidências confirmadas por Iwata et al.16 mostraram que, com o aumento na densidade populacional, houve uma melhoria na sobrevida em 5 e 10 anos.
O estágio clínico avançado, de acordo com a classificação TNM da AJCC, tem sido relatado como um preditor significante de prognóstico em pacientes com TMGS,3,12,13,16–18,21 o que foi confirmado em nosso estudo. Ambos os estágios T e M apresentaram influência significante na frequência de óbitos e na sobrevida dos pacientes, de acordo com a literatura.3,16–18,21,26 Além disso, o estágio IV apresentou o pior prognóstico.
Além disso, para terapia e prognóstico, é importante determinar o status das margens cirúrgicas.13 Nossos dados demonstraram uma sobrevida reduzida em pacientes com margens cirúrgicas comprometidas, semelhante à literatura atual.4,12,13 Ouyang et al.4 também demonstraram o envolvimento das margens como um fator de risco independentemente para metástases distantes. De acordo com Lewis et al.,29 os fatores preditivos de uma resposta parcial à radiação definitiva incluem tamanho maior do que 4cm, câncer em estágio T4 e doença em estágio IV. A radioterapia é reservada principalmente para casos inoperáveis e para pacientes que recusam a cirurgia.13,29,30 A maioria dos pacientes de nossa coorte não foi submetida a cirurgia, o que pode estar relacionado ao número considerável de casos de câncer T4 e estágio IV.
Além disso, em nosso estudo, apenas a quimioterapia foi um preditor significante (os pacientes tratados com quimioterapia tiveram uma sobrevida mais curta), semelhantemente a relatos anteriores.8,13 De fato, os TMGS mostram uma resposta limitada à quimioterapia convencional, geralmente reservada para tratamento paliativo.13,14,30
Na análise multivariada, apenas a idade acima de 50 anos influenciou independentemente a sobrevida desses pacientes. Vários estudos confirmaram a influência da idade no prognóstico de tumores malignos das glândulas salivares.4,5,8,9,12,16,18,19,28 No entanto, também foram encontrados resultados opostos.17 Consistente com nossos achados, Iwata et al.16 mostraram que, para cada ano, há um aumento de 5% no risco de morte em 5 anos (HR=1,50, IC95% 1,08‐2,08) e 6% no risco de morte em 10 anos (IC95% 1,04‐1,08).
Esse achado pode ser parcialmente explicado pelo fato de haver uma tendência a tratamentos mais agressivos e, por sua vez, mais eficazes em pacientes mais jovens e por causa do efeito da idade na mortalidade em geral.12 Além disso, pacientes mais idosos tendem a ter mais comorbidades, o que limita a resposta ao tratamento e compromete a tolerância a tratamentos mais agressivos.4 Na coorte de Cheung et al.,8 várias comorbidades afetaram a sobrevida dos pacientes avaliados e Iwata et al.16 demonstraram através do índice de comorbidade de Charlson31 que, para cada aumento de 1 ponto no índice, há um aumento de 19% no risco de morte na análise de 5 anos e um aumento de 18% na análise de 10 anos.
Na distribuição dos pacientes quanto à idade, na análise multivariada, apenas o nível de escolaridade apresentou associação independente com o prognóstico dos pacientes avaliados, atuou como fator indiretamente associado a um pior prognóstico. Esse achado está de acordo com estudos recentes feitos para analisar a influência de variáveis socioeconômicas nos TMGS.16,28 No estudo de Olarte et al.,28 o nível educacional influenciou a sobrevida dos pacientes na análise univariada. No estudo de Iwata et al.,16 a análise multivariada revelou a influência do nível educacional no aumento do risco de morte em 5 e 10 anos.
Os resultados do presente estudo destacam a importância da idade e do nível educacional no prognóstico dos TMGS. Entretanto, o estudo tem algumas limitações. Como um estudo retrospectivo e unicêntrico, ele não oferece o nível mais alto de evidência clínica. Foi observado um viés significativo relacionado ao nível de ensino superior da população tratada em nosso centro. Pacientes mais instruídos têm maior probabilidade de procurar atendimento médico mais cedo, o que melhora o prognóstico. Portanto, a aplicação e a generalização de nossos resultados devem ser vistas com cautela. Além disso, é necessário considerar a heterogeneidade dos tratamentos aplicados nesse longo período e a perda de dados de acompanhamento. Entretanto, este estudo avaliou dados de acompanhamento de 15 anos, que é um longo tempo de observação, e apresentou uma grande amostra de TMGS, contribui fortemente para o reconhecimento dos fatores prognósticos nesse raro grupo de tumores.
ConclusãoPacientes com mais de 50 anos têm um prognóstico ruim e o nível de escolaridade é a principal variável associada a esse fator de risco. São necessários extensos estudos multicêntricos e revisões sistemáticas com metanálises para uma melhor compreensão do prognóstico dessas neoplasias, para aprimorar estratégias de tratamento e desenvolver terapias direcionadas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosÀ Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) (Bolsa).
Como citar este artigo: Filho OV, Rêgo TJ, Mendes FH, Dantas TS, Cunha MP, Malta CE, et al. Prognostic factors and overall survival in a 15‐year followup of patients with malignant salivary gland tumors: a retrospective analysis of 193 patients. Braz J Otorhinolaryngol. 2022;88:365–74.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.