A biópsia de linfonodo sentinela é o padrão‐ouro para estadiamento de melanomas cutâneos em cabeça e pescoço.
ObjetivoAvaliar aspectos técnicos, positividade e efeito prognóstico da pesquisa de linfonodo sentinela cervico‐facial.
MétodoEstudo retrospectivo, unicêntrico. Entre 2009 e 2014, 49 pacientes com melanoma cutâneo de cabeça e pescoço foram operados no Instituto do Câncer do Estado de São Paulo (ICESP).
ResultadoDos 49 pacientes, cinco tiveram metástases cervicais detectáveis à admissão. Níveis de Clark e Breslow e índice mitótico foram preditores de risco de óbito. Entre os 31 pacientes submetidos à biópsia de linfonodo sentinela, três tiveram resultados positivos (9,7%). Faleceram dois (66,6%) dos portadores de micrometástases e cinco (17,8%) entre os pacientes com linfonodos sentinela negativos. A média do índice de Breslow foi de 11,3 mm entre os casos positivos e 4,3 mm nos negativos. A positividade foi associada aos níveis de Clark e Breslow. A localização malar teve efeito protetor. A média de tempo de sobrevivência dos pacientes com índice mitótico abaixo de 3,5 foi de 181 meses e para aqueles com índice mitótico acima de 3,5 foi de 63,4 meses.
ConclusãoA frequência de linfonodo sentinela positivo foi mais baixa do que a encontrada em outros estudos, apesar de a amostra ter sido composta por melanomas avançados. O índice mitótico foi importante na predição de prognóstico.
O melanoma é o tumor maligno de pele mais letal. O número de casos da doença aumenta a cada ano no Brasil e no mundo.1,2 Segundo estimativas do Instituto Nacional do Cancer, INCA, para 2020 estão previstos no país 8.450 novos casos de melanoma cutâneo, 4.200 em homens e 4.250 em mulheres.1 Estima‐se que no mundo foram registrados 290.000 casos novos e 61.000 mortes em 2018.1
O tratamento é fundamentalmente cirúrgico e os principais indicadores prognósticos são: índice de Breslow, acometimento linfonodal (macro ou micro metástases), ulceração e índice mitótico.3,4
A biópsia de linfonodo sentinela, desenvolvida por Morton no início da década de 1990, passou a ser padrão‐ouro para o estadiamento de melanomas cutâneos, com o intuito de selecionar os casos para linfadenectomia.4,5 Existem peculiaridades no tocante à pesquisa de linfonodo sentinela em região de cabeça e pescoço: a experiência mostra que o uso de menor quantidade de azul patente é desejável, no intuito de evitar tatuagem pelo corante;6 nem sempre é possível a ampliação de margem mais adequada em locais como nariz e periórbita;7 além disso, alguns autores descrevem menor frequência de micrometástases em linfonodo sentinela para a região cervicofacial, quando comparada a melanomas de drenagem para as regiões axilar e inguinal.8–10
Avanços tecnológicos incrementaram a acurácia dos resultados e melhoraram as técnicas empregadas na região cervicofacial, em especial a fusão de imagem da linfocintolografia à tomografia computadorizada (spect CT), até minimizaram o percentual de falsos‐negativos na amostra.10 A conduta atual prevê a pesquisa de linfonodo sentinela para melanomas com índice de Breslow superior a 1,0mm (ou abaixo, caso haja ulceração e/ou índice mitótico positivo).2
A realidade brasileira implica um substancial número de pacientes tratados pelo sistema único de saúde, SUS, que são portadores de melanomas avançados. Além disso, existem poucos serviços com medicina nuclear integrada para se fazer a pesquisa de linfonodo sentinela.11 No Instituto do Câncer do Estado de São Paulo (Icesp), os melanomas cervico‐faciais são tratados por uma equipe multidisciplinar, da qual faz parte a equipe de cirurgia de cabeça e pescoço. Uma avaliação dos aspectos técnicos, positividade e efeito prognóstico da pesquisa de linfonodo sentinela é o objeto deste estudo.
MétodoEstudo retrospectivo, aprovado pelo comitê de ética em pesquisa (parecer n° 743.366), em que foram revisados os prontuários médicos de 49 pacientes com melanoma cutâneo primário em região de cabeça e pescoço, sem metástase a distância no momento do diagnóstico, submetidos à cirurgia no Instituto do Câncer do Estado de São Paulo (Icesp) pela equipe de cirurgia de cabeça e pescoço, entre 2009 e 2014. Os pacientes foram atendidos consecutivamente e tiveram tempo de seguimento mínimo de cinco anos acompanhados pelo mesmo cirurgião. Casos de melanoma em mucosa e tumores cutâneos primários de outras regiões topográficas, que não cabeça e pescoço, foram excluídos.
Foram coletados dados sobre as variáveis gênero, idade, local do tumor primário, índice de Breslow, nível de Clark, ulceração, índice mitótico, TNM, estádio clínico, indicação de pesquisa de linfonodo sentinela, tempo de seguimento, recidiva e óbito.
Todos os pacientes foram submetidos à biopsia excisional. Nos casos em que o procedimento foi feito previamente em outra instituição, fez‐se revisão de lâminas. Todos os pacientes foram submetidos a exames de estadiamento, inclusive raios X de tórax. Para 30 pacientes, indicou‐se também tomografia computadorizada pré‐operatória.
Seguindo as recomendações das diretrizes do NCCN (National Comprehensive Cancer Network),2 pacientes com melanoma in situ foram submetidos à ampliação de margem de 0,5cm em torno da cicatriz prévia. Aqueles que apresentaram, no anatomopatológico, índice de Breslow entre 0 e 1,0mm, tiveram ampliação de 1,0cm em torno da incisão anterior. Nos casos em que o índice de Breslow foi entre 1,0 e 2,0mm, optou‐se pela ampliação entre 1,0 e 2,0cm, de acordo com o melhor resultado estético e funcional, e nos casos com espessura superior a 2,0mm, ampliou‐se a margem em 2,0cm. Em todos os casos ocorreu reconstrução com retalhos ou enxertos de pele no mesmo tempo cirúrgico.
Houve indicação de linfonodo sentinela nos pacientes sem metástase linfonodal ou a distância detectadas em que o Breslow foi acima de 1,0mm ou menos do que 1,0mm na presença de ulceração e/ou índice mitótico positivo. Os pacientes elegíveis receberam injeção de radiofármaco (tecnécio 99; 0,5 mCi em 1 mL), à véspera da cirurgia, e a imagem obtida pelo spect CT foi analisada pela equipe no momento da cirurgia. A pesquisa de micrometástases no linfonodo retirado foi feita após fixado em formaldeído, processado em parafina, analisaram‐se com cortes seriados em hematoxilina‐eosina e pesquisada a expressão imuno‐histoquímica de HMB‐45, S‐100 e Melan‐A, conforme protocolo.2
Em pacientes com metástase linfonodal confirmada histologicamente foi feito esvaziamento linfonodal de acordo com o local do tumor primário e do linfonodo detectado. Fez‐se parotidectomia, com preservação do nervo facial, se a metástase foi parotídea, acompanhada de esvaziamento dos níveis I, II e III; esvaziamento posterolateral, quando a metástase foi retroauricular ou occipital; em caso de metástase em níveis I a V foi feito esvaziamento radical modificado. A indicação de radioterapia ocorreu nos pacientes com macrometástase identificada no produto do esvaziamento. Pacientes que tiveram diagnóstico de metástase a distância durante o seguimento foram tratados com quimioterapia à base de dacarbazina.
Em todas as análises estatísticas foi usado o programa SPSS versão 24.0 (SPSS Inc. Illinois, USA). Os valores obtidos pelo estudo das variáveis quantitativas foram organizados e descritos através da média e do desvio‐padrão e para as variáveis qualitativas foram usadas frequências absolutas e relativas. As variáveis quantitativas foram comparadas pelo teste t de Student e os padrões de normalidade foram conferidos pelo teste de Kolgomorov‐Smirnov. Para as variáveis não paramétricas foi empregado o teste de Mann‐Whitney. O teste do qui‐quadrado comparou as variáveis qualitativas, foi usado o teste de Fisher, quando necessário. Curvas de Kaplan‐Meier foram construídas para evidenciar diferenças nas análises de sobrevivência e os testes de log‐rank, Breslow e Tarone‐Ware foram aplicados na comparação entre elas. Curva ROC foi produzida para determinar o melhor valor discriminatório para o índice mitótico. Adotou‐se nível de significância estatística inferior a 5% (p <0,05).
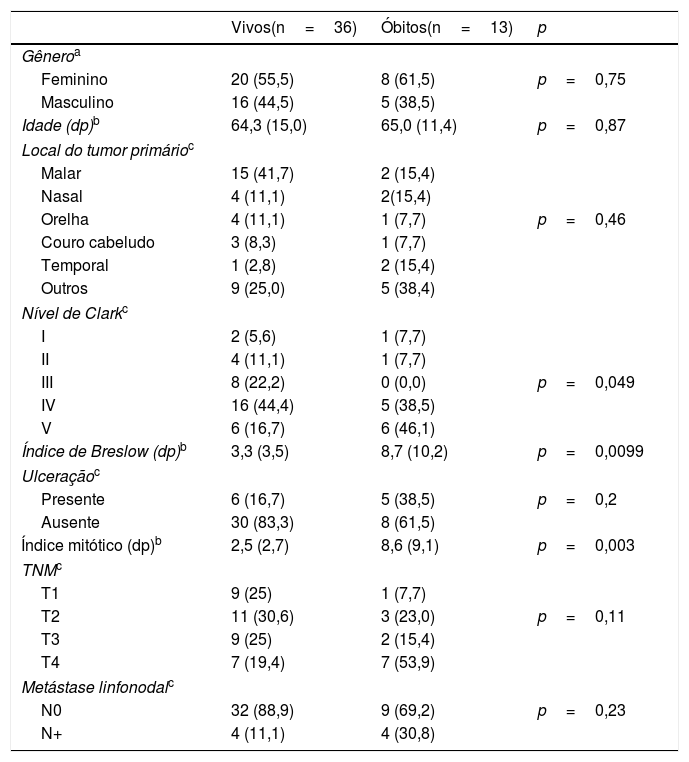
ResultadoO tempo de seguimento variou de 4 a 222 meses. Dos 49 pacientes acompanhados, 36 (73,4%) permaneceram vivos, 10 (20,4%) apresentaram recidiva e 13 (26,5%) faleceram. Dos 10 pacientes com recidiva, cinco apresentaram metástase pulmonar, um recorrência linfonodal cervical, um linfonodo axilar, um metástase hepática, um nódulo mediastinal e um recidiva local. Entre os 13 que faleceram, em 10 a causa foi progressão do melanoma e três devido uma segunda neoplasia primária (hemorragia digestiva por linfoma de Burkitt gástrico, evolução de carcinoma supraglótico e progressão de carcinoma de cólon). Na tabela 1 foi descrita a distribuição dos dados demográficos, clínicos, anatomopatológicos e de estadiamento, conforme o desfecho.
Distribuição dos casos de melanoma maligno cutâneo de cabeça e pescoço de acordo com variáveis demográficas, clínicas, anatomopatológicas, status vital no fim do período de seguimento
| Vivos(n=36) | Óbitos(n=13) | p | |
|---|---|---|---|
| Gêneroa | |||
| Feminino | 20 (55,5) | 8 (61,5) | p=0,75 |
| Masculino | 16 (44,5) | 5 (38,5) | |
| Idade (dp)b | 64,3 (15,0) | 65,0 (11,4) | p=0,87 |
| Local do tumor primárioc | |||
| Malar | 15 (41,7) | 2 (15,4) | |
| Nasal | 4 (11,1) | 2(15,4) | |
| Orelha | 4 (11,1) | 1 (7,7) | p=0,46 |
| Couro cabeludo | 3 (8,3) | 1 (7,7) | |
| Temporal | 1 (2,8) | 2 (15,4) | |
| Outros | 9 (25,0) | 5 (38,4) | |
| Nível de Clarkc | |||
| I | 2 (5,6) | 1 (7,7) | |
| II | 4 (11,1) | 1 (7,7) | |
| III | 8 (22,2) | 0 (0,0) | p=0,049 |
| IV | 16 (44,4) | 5 (38,5) | |
| V | 6 (16,7) | 6 (46,1) | |
| Índice de Breslow (dp)b | 3,3 (3,5) | 8,7 (10,2) | p=0,0099 |
| Ulceraçãoc | |||
| Presente | 6 (16,7) | 5 (38,5) | p=0,2 |
| Ausente | 30 (83,3) | 8 (61,5) | |
| Índice mitótico (dp)b | 2,5 (2,7) | 8,6 (9,1) | p=0,003 |
| TNMc | |||
| T1 | 9 (25) | 1 (7,7) | |
| T2 | 11 (30,6) | 3 (23,0) | p=0,11 |
| T3 | 9 (25) | 2 (15,4) | |
| T4 | 7 (19,4) | 7 (53,9) | |
| Metástase linfonodalc | |||
| N0 | 32 (88,9) | 9 (69,2) | p=0,23 |
| N+ | 4 (11,1) | 4 (30,8) | |
dp, desvio‐padrão.
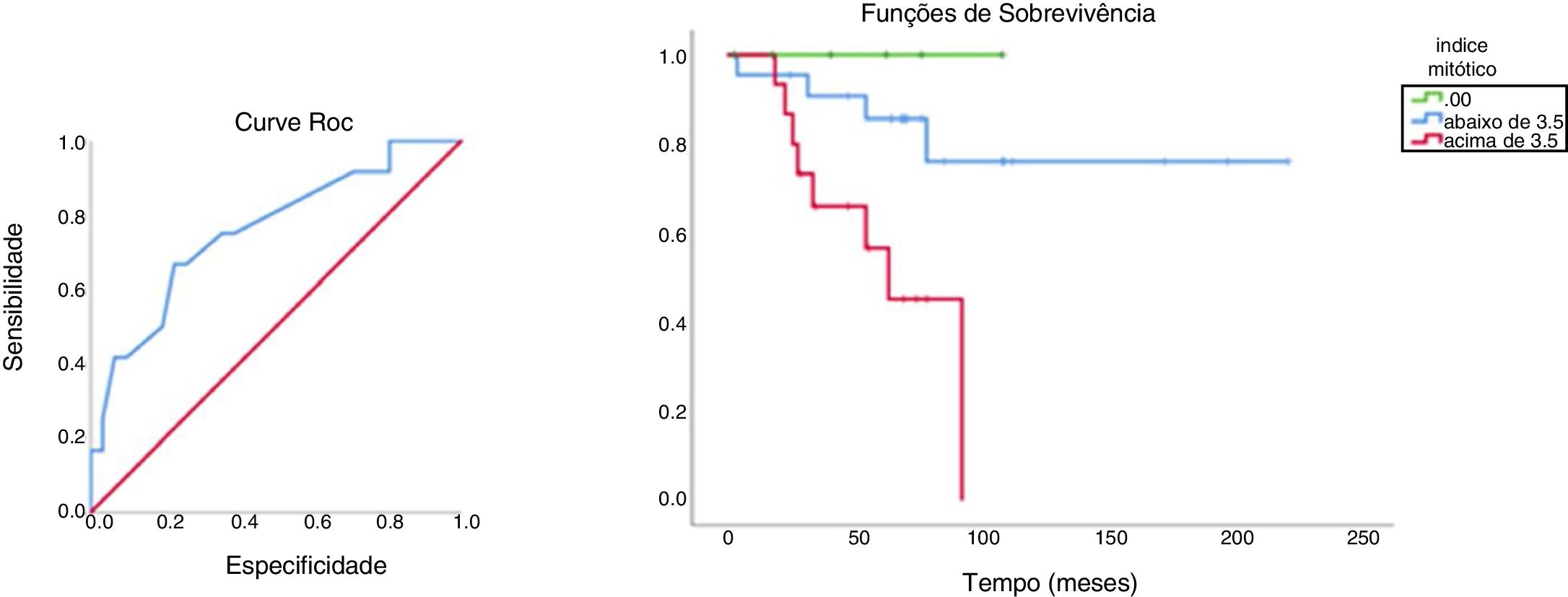
Com o valor discriminatório de 3,5, a análise de sobrevivência em relação ao índice mitótico e a respectiva curva ROC podem ser observadas na figura 1. A média de tempo de sobrevivência dos pacientes com índice mitótico abaixo de 3,5 foi de 181 meses e para aqueles com índice mitótico acima de 3,5 foi de 63,4 meses.
Dos pacientes, 31 tiveram indicação de pesquisa de linfonodo sentinela (65,3%). Em 20 pacientes, foi retirado um único linfonodo; em sete, dois linfonodos; em três, três linfonodos, em um, quatro linfonodos. O local mais comum de ocorrência foi o nível Ib (15 casos), seguido por nível II (10 casos), parótida (cinco casos), nível Ia e retroauricular (dois casos) e nível V (um caso). Houve três casos de linfonodo sentinela positivo, dois em nível Ib e um parotídeo. Em dois pacientes, o diagnóstico anatomopatológico foi feito com hematoxilina‐eosina e um com imuno‐histoquímica. Em um paciente, foi necessária a dissecção do tronco do nervo facial para pesquisa do linfonodo sentinela. Esse foi submetido à parotidectomia e esvaziamento cervical radical modificado após resultado anatomopatológico que confirmou micrometástase.
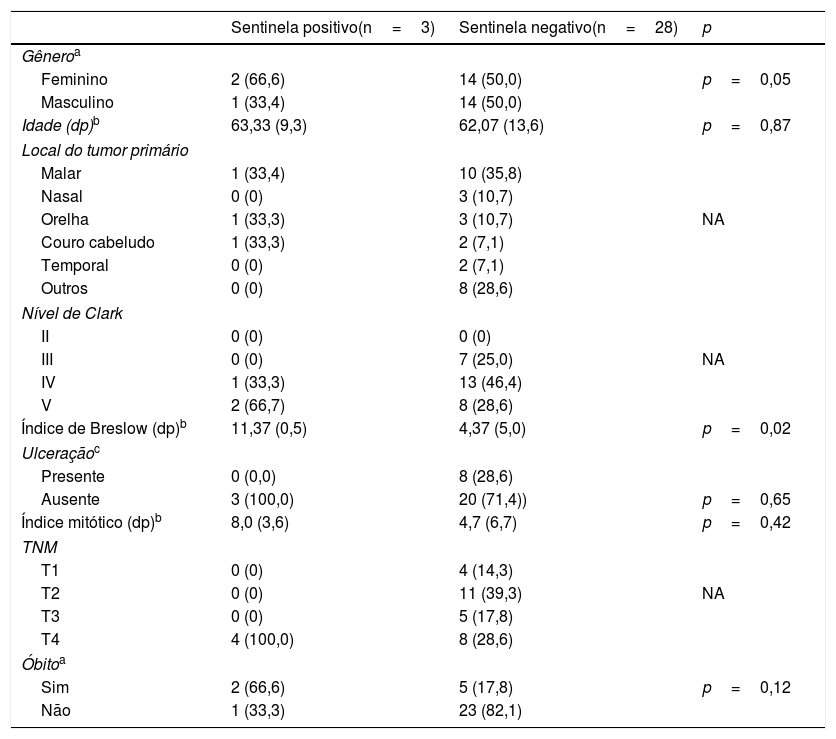
Entre os três pacientes que tiveram linfonodo sentinela positivo, dois foram submetidos a esvaziamento cervical radical modificado e um à parotidectomia com esvaziamento cervical radical modificado. Nos dois esvaziamentos radicais modificados e no esvaziamento associado à parotidectomia não foi observada doença residual. No esvaziamento posterolateral, um linfonodo sem extensão extracapsular apresentava metástase, entre 17 dissecados. Esse paciente foi encaminhado à radioterapia, os demais não foram submetidos a tratamento adjuvante. Dos 28 pacientes com linfonodo sentinela negativo, 22 permaneceram livres de recidiva até a última informação objetiva de seguimento, três tiveram metástase pulmonar, uma metástase axilar, outro progressão em mediastino e um último desenvolveu metástase cervical cinco anos após a biópsia de linfonodo sentinela. Esse paciente foi submetido a esvaziamento cervical radical modificado de resgate, radioterapia adjuvante e encontrava‐se em seguimento um ano depois, sem metástase detectável. Na tabela 2, estão descritos os dados demográficos, clínicos, anatomopatológicos, estadiamento e desfecho desse grupo de pacientes.
Distribuição dos casos de melanoma maligno cutâneo de cabeça e pescoço submetidos à pesquisa de linfonodo sentinela de acordo com variáveis demográficas, clínicas, anatomopatológicas e resultado anatomopatológico relacionado à metástase cervical
| Sentinela positivo(n=3) | Sentinela negativo(n=28) | p | |
|---|---|---|---|
| Gêneroa | |||
| Feminino | 2 (66,6) | 14 (50,0) | p=0,05 |
| Masculino | 1 (33,4) | 14 (50,0) | |
| Idade (dp)b | 63,33 (9,3) | 62,07 (13,6) | p=0,87 |
| Local do tumor primário | |||
| Malar | 1 (33,4) | 10 (35,8) | |
| Nasal | 0 (0) | 3 (10,7) | |
| Orelha | 1 (33,3) | 3 (10,7) | NA |
| Couro cabeludo | 1 (33,3) | 2 (7,1) | |
| Temporal | 0 (0) | 2 (7,1) | |
| Outros | 0 (0) | 8 (28,6) | |
| Nível de Clark | |||
| II | 0 (0) | 0 (0) | |
| III | 0 (0) | 7 (25,0) | NA |
| IV | 1 (33,3) | 13 (46,4) | |
| V | 2 (66,7) | 8 (28,6) | |
| Índice de Breslow (dp)b | 11,37 (0,5) | 4,37 (5,0) | p=0,02 |
| Ulceraçãoc | |||
| Presente | 0 (0,0) | 8 (28,6) | |
| Ausente | 3 (100,0) | 20 (71,4)) | p=0,65 |
| Índice mitótico (dp)b | 8,0 (3,6) | 4,7 (6,7) | p=0,42 |
| TNM | |||
| T1 | 0 (0) | 4 (14,3) | |
| T2 | 0 (0) | 11 (39,3) | NA |
| T3 | 0 (0) | 5 (17,8) | |
| T4 | 4 (100,0) | 8 (28,6) | |
| Óbitoa | |||
| Sim | 2 (66,6) | 5 (17,8) | p=0,12 |
| Não | 1 (33,3) | 23 (82,1) | |
dp, desvio‐padrão; NA, não se aplica cálculo de valor de p.
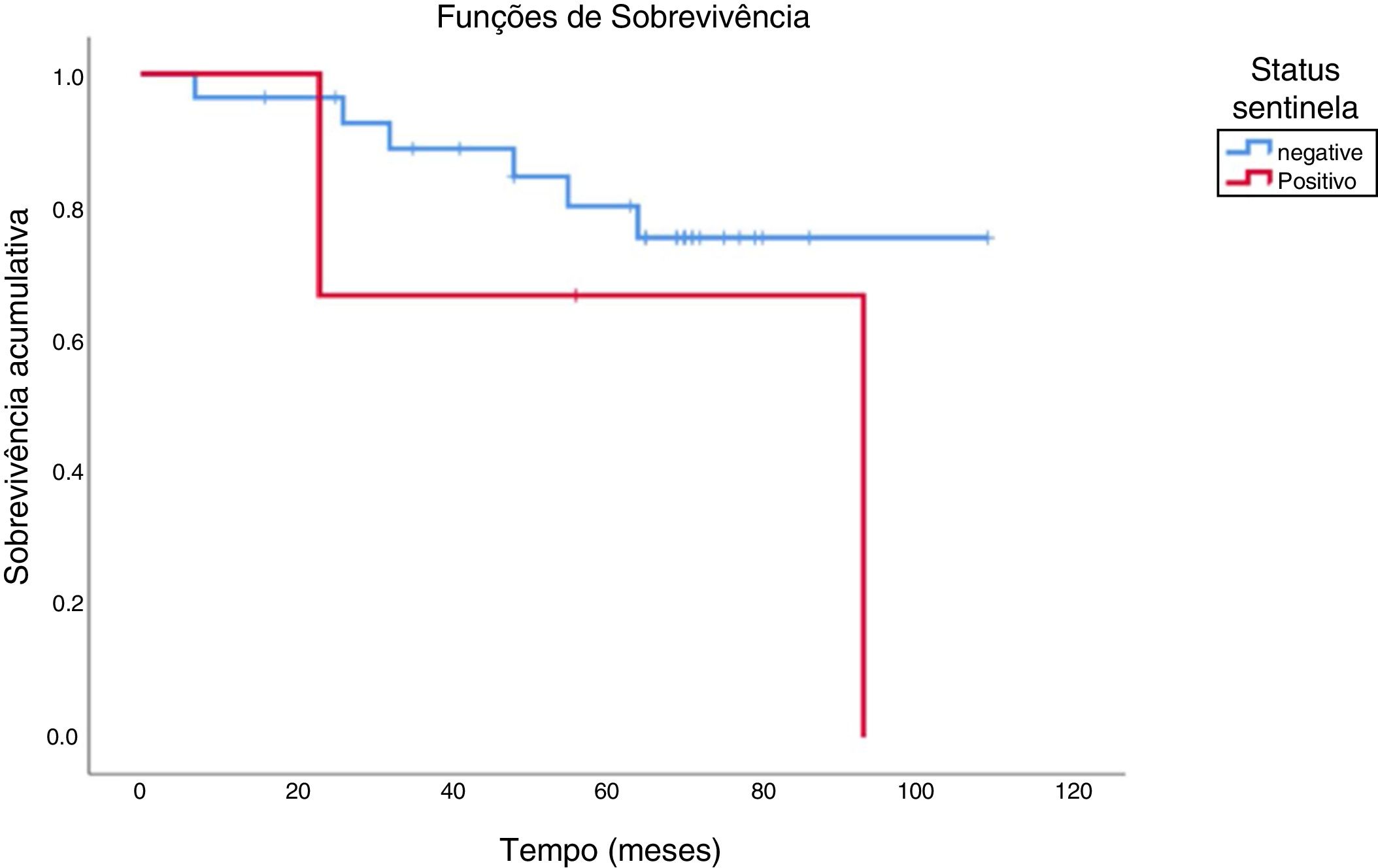
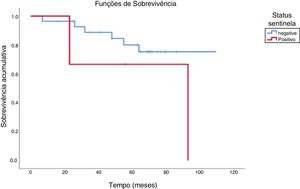
Cinco pacientes tinham metástases cervicais detectáveis à admissão. Quatro foram submetidos a esvaziamento cervical radical modificado e um a esvaziamento radical clássico acompanhado de radical modificado contralateral. Os cinco pacientes foram submetidos à radioterapia adjuvante, três faleceram em decorrência de metástase (dois deles em pulmão, um em fígado) e dois permaneceram vivos até a última informação de seguimento, com sobrevida global de 40%. Quando comparamos esses casos aos pacientes com linfonodo sentinela positivo da casuística, observou‐se um padrão semelhante: dos três pacientes com sentinela positivo, um faleceu de segundo tumor primário em supraglote e outro apresentou metástase pulmonar, compôs‐se sobrevida global de 33,3%. Por fim, a sobrevida dos pacientes com linfonodo sentinela negativo foi de 82,2%. A figura 2 mostra a comparação da taxa de sobrevivência global acumulada entre os grupos com linfonodo sentinela positivo e negativo.
DiscussãoEssa casuística foi composta por pacientes com melanomas de espessuras mais elevadas que a encontrada por outros autores.12 A média de índice de Breslow foi de 3,0mm entre os que apresentaram linfonodo sentinela negativo e acima de 10,0mm entre os positivos. Stephansson et al., que estudou a evolução das espessuras de Breslow, valoriza ainda mais esse achado, ao verificar um declínio na mediana das espessuras de Breslow, de 2,15mm (entre 1980–1989) para 0,9mm (entre 2000–2009), em um estudo de 854 casos de melanoma cutâneo registrados no Banco de Dados de Câncer da Islândia.13
Ainda que a importância da biópsia do linfonodo sentinela tenha crescido à luz da indicação de adjuvância com imunoterápicos, é de se notar que muitos casos avançados apresentaram linfonodo sentinela negativo nessa casuística. As micrometástases foram encontradas somente nos casos com índice de Breslow acima de 7,0mm.
A positividade do linfonodo sentinela, de uma maneira geral, gira em torno de 20%.14 Nessa casuística, embora selecionada por casos avançados provenientes do sistema público de saúde, a frequência de casos com linfonodos sentinela positivos foi menor do que o esperado 9,7%, mesmo que sabidamente a positividade nos subsítios da cabeça e pescoço seja menor do que em outras regiões.8 Possivelmente a heterogeneidade de casos cervicofaciais, que incluem subsítios tão distintos quanto couro cabeludo e região malar, possa explicar em parte as diferenças encontradas.15 No entanto, chama atenção o fato de três quartos da casuística serem constituídos por tumores em estádios T3 e T4,2 no grupo de casos submetidos à biópsia do linfonodo sentinela.
A pesquisa de linfonodo sentinela em região de cabeça e pescoço, especialmente após a introdução do SPECT‐CT como exame localizatório, é um procedimento de pouca morbidade e se traduz em um excelente dado de estadiamento. Com o auxílio do probe intraoperatório e da injeção de azul patente, a dissecção de tecidos profundos é mínima, quando comparada ao esvaziamento eletivo.
Historicamente, observamos melhoria técnica na pesquisa do linfonodo sentinela cervical. Reportamos nessa casuística somente um caso de falso‐negativo em 28 (frequência de 3,5%), em que o paciente apresentou metástase cervical cinco anos após uma pesquisa de linfonodo sentinela negativa. Um estudo prospectivo de fluorescência assistida acompanhou 125 pacientes com melanoma cutâneo, 24,8% em região de cabeça e pescoço. Foram encontrados dois casos de falsos‐negativos, um deles metástase em trânsito, que produziram uma frequência de falsos‐negativos de 2% e 1% de frequência ajustada, valores modestos e que corroboram com a presente casuística.16
Mereceu menção neste estudo a localização em região malar, que foi sede de 34,7% dos tumores primários, totalizou 17 pacientes, 11 (64,7%) com tumores de espessura suficiente para serem submetidos à biópsia do linfonodo sentinela. Nesse grupo, apenas dois (11,7%) faleceram devido a recorrência ou metástase, comparado a uma taxa de 34,4% de óbitos entre pacientes com primários em outros locais. A provável relação seja a maior ocorrência nessa região do subtipo lentigo maligno,15 que está associado à menor agressividade. De maneira semelhante, ao comparar um grupo de pacientes com melanomas de cabeça e pescoço não malar com outro de região malar, Faruk observou, nesse último, maior associação ao subtipo lentigo maligno, além de maior taxa de sobrevida global.17
Outro parâmetro prognóstico importante, o índice mitótico, mereceu destaque. Não houve óbitos entre os pacientes com índice mitótico zero e a sobrevivência acumulada foi marcadamente diferente, de acordo com os achados acima ou abaixo do melhor valor discriminatório. Esse dado teve impacto prognóstico mais relevante do que o linfonodo sentinela, com a ressalva de que o baixo número de sentinelas positivos deva ter concorrido para esse resultado. O índice mitótico também emergiu na análise de Balch como um poderoso fator preditivo de sobrevivência. Informações extraídas do Banco de Dados de Estadiamento de Melanoma AJCC demonstraram forte correlação entre o aumento do índice mitótico e o declínio nas taxas de sobrevivência (p <0,0001).3
Discute‐se a importância prognóstica da biópsia do linfonodo sentinela desde sua introdução na prática clínica.18,19 Mesmo nessa casuística, em que eram raros os linfonodos sentinelas positivos, é notável que 66,6% dos portadores de micrometástases foram a óbito contra 17,8% entre os negativos. Da mesma forma, em um estudo de uma série de melanomas avançados, foi encontrado por Gajdos et al. risco relativo para óbito de 2,28 vezes para pacientes com sentinela positivo, quando comparados aos sem micrometástases, confirmado por análise multivariada.20
A média de sobrevida dos pacientes que se apresentaram com metástase cervical ao diagnóstico foi de 20,8 meses. Já naqueles com linfonodo sentinela positivo, esse tempo foi de 34,2 meses. Esse dado é compatível com o da casuística estudada por Balch, em que aos dois anos e meio de seguimento havia 50% de sobrevivência acumulada para os pacientes com metástase.3
Na presente casuística, os pacientes foram tratados com cirurgia até 2014, a feitura do esvaziamento cervical permitiu controle locorregional em um período em que não estava estabelecida como rotina a adjuvância com imunoterapia.
ConclusãoNessa casuística de melanomas avançados de cabeça e pescoço, tratados pelo SUS no Brasil, foram encontradas micrometásases numa frequência baixa (9,6%), exclusivamente em melanomas espessos (acima de 7 mm), denotaram positividade somente em casos avançados.
A frequência de falsos‐negativos na casuística foi de 3,5%, à semelhança de outros estudos feitos em condições técnicas equivalentes.
O impacto do índice mitótico sobre o prognóstico do paciente foi tão relevante quanto o status do linfonodo sentinela nesse estudo; não ocorreram óbitos entre os pacientes com tumores de índice mitótico zero e as taxas de sobrevivência acumuladas foram marcadamente diferentes, de acordo com os valores de índice mitótico abaixo ou acima do melhor valor discriminatório. Contudo, 66,6% dos portadores de micrometástases faleceram contra 17,8% entre os negativos.
Por fim, o estudo nos remete à gravidade do diagnóstico de melanoma e, ainda que raros os linfonodos sentinelas positivos, evidencia a importância prognóstica que a pesquisa de linfonodo sentinela continua a ter no cenário de tratamento dos melanomas da região cervicofacial. Lembra‐nos, ainda, que a existência de mais serviços com medicina nuclear integrada ampliaria a sua acessibilidade, proporcionaria aos pacientes um estadiamento adequado da doença e, com isso, a escolha do tratamento mais assertivo.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Bonachela NL, Kowalski LP, Santos AB. Risk factors for positive sentinel lymph nodes in head and neck melanoma ‐ a survival analysis. Braz J Otorhinolaryngol. 2021;87:103–9.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.