The fine‐needle cytology is being used as a first line of investigation in the diagnosis of head and neck swellings, as it is simple, cost effective and less invasive as compared to biopsy.
ObjectiveThe aims of this study were to evaluate the results of the fine‐needle non‐aspiration cytology of cervical lymphadenopathy and to study the factors influencing the rate of non‐diagnosis results.
MethodsThis retrospective study was conducted on selected patients with cervical lymphadenopathy that had undergone a fine‐needle non‐aspiration cytology followed by a histological biopsy. The sensitivity, specificity, positive predictive value and negative predictive value of fine‐needle non‐aspiration cytology for diagnosing tuberculosis were estimated. The risk factors of non‐diagnosis results were evaluated.
ResultsThe sensitivity, specificity, positive predictive value rates of fine‐needle non‐aspiration cytology for tuberculosis were 83.3%, 83.3%, 78.9% and 86.9% respectively. In total, 47 out of the 131 samples (35.8%) were considered non‐diagnosis. Of the non‐diagnosis samples, 84.2% (38 out of 47) were benign mostly due to tuberculosis (30 cases). Among the studied factors, only tuberculosis (confirmed by histopathological examination) was significantly associated with non‐diagnosis cytology (p=0.02, Odds‐Ratio=2.35).
ConclusionTuberculosis is currently the commonest cause of cervical lymphadenopathy in North Africa. Fine‐needle non‐aspiration cytology is safe and accurate in the diagnosis of cervical tuberculous lymph node that is associated with the risk of non‐diagnosis cytology.
A punção não aspirativa com agulha fina tem sido utilizada como primeira linha de investigação no diagnóstico de tumores de cabeça e pescoço, por ser uma técnica simples, custo‐efetiva e menos invasiva quando comparada à biópsia.
ObjetivoOs objetivos deste estudo foram avaliar os resultados de citologia por punção não‐aspirativa com agulha fina de linfadenopatias cervicais e estudar os fatores que influenciam a taxa de falha diagnóstica.
MétodoEste estudo retrospectivo foi realizado em pacientes selecionados com linfadenopatia cervical submetidos a punção não aspirativa com agulha fina, seguida por biópsia histológica. Foram estimadas a sensibilidade, especificidade, o valor preditivo positivo e valor preditivo negativo da punção não aspirativa com agulha fina para o diagnóstico de tuberculose. Os fatores de risco dos resultados com falha diagnóstica foram avaliados.
ResultadosAs taxas de sensibilidade, especificidade, valor preditivo positivo e valor preditivo negativo da punção não aspirativa com agulha fina para tuberculose foram de 83,3%, 83,3%, 78,9% e 86,9%, respectivamente. Das 131 amostras, 47 (35,8%) foram consideradas como falha diagnóstica. Das amostras não diagnosticadas, 84,2% (38 de 47) eram benignas, principalmente devido à tuberculose (30 casos). Entre os fatores estudados, apenas a tuberculose (confirmada pelo exame histopatológico) estava significativamente associada à citologia com falha diagnóstica (p=0,02, odds ratio=2,35).
ConclusãoA tuberculose é atualmente a causa mais comum de linfadenopatia cervical no norte da África. A punção não aspirativa com agulha fina é uma técnica segura e precisa no diagnóstico de linfonodos cervicais associados ao risco de citologia com falha diagnóstica.
De acordo com o relatório de 2015da Organização Mundial da Saúde, a prevalência e incidência de tuberculose (TB) na Tunísia foram de 42/100.000 e 33/100.000, respectivamente.1
As linfadenopatias são a forma mais comum de tuberculose extrapulmonar e a linfadenite tuberculosa é a causa mais comum de linfadenopatia periférica dos países em desenvolvimento.2 O procedimento padrão‐ouro para o diagnóstico de linfadenopatia cervical é a biópsia aberta com exame histológico do tecido excisado.2
A citologia por agulha fina tem sido usada como a primeira linha de investigação no diagnóstico de tumefações de cabeça e pescoço, por ser simples, custo‐efetiva e menos invasiva quando comparada à biópsia.3 Esse procedimento não tem sido comumente usado no norte da África, já que a maioria dos médicos ainda prefere biópsias de excisão cirúrgica primária.
Os objetivos deste estudo retrospectivo foram avaliar os resultados da citologia por punção não aspirativa com agulha fina (PNAAF) da linfadenopatia cervical e estudar os fatores que influenciam a taxa de resultados não diagnósticos (ND).
MétodoO presente estudo foi feito em pacientes selecionados com linfadenopatia cervical aumentada. Este estudo limitou‐se aos casos selecionados que haviam sido submetidos a uma PNAAF da linfadenopatia cervical, seguida por uma biópsia excisional subsequente da mesma linfadenopatia ou biópsia do sítio primário suspeito para um diagnóstico histopatológico definitivo. Pacientes com relatos ausentes da PNAAF ou casos que não puderam ser submetidos à biópsia foram excluídos.
Em cada caso, a história detalhada, apresentação clínica da linfadenopatia cervical e exame clínico foram feitos.
Um cirurgião otorrinolaringologista fez a PNAAF. A lesão foi imobilizada com uma das mãos e, após a desinfecção da pele, uma agulha calibre 25 foi introduzida na linfadenopatia com a outra mão. A agulha penetrou a lesão da mesma maneira que na citologia por punção aspirativa com agulha fina (PAAF), mas sem sucção do conteúdo. O material presente na agulha através de ação capilar foi então expresso em lâminas de vidro limpas após ser acoplada a uma seringa cheia de ar. Múltiplos esfregaços (3 a 5) foram preparados. Os esfregaços secos ao ar (10 minutos) foram corados com a coloração May‐Grünwald‐Giemsa (MGG) para o citodiagnóstico de rotina.
Os laudos da citologia foram categorizados em quatro resultados principais: (a) diagnóstico benigno com recomendação de seguimento; (b) diagnóstico metastático maligno com recomendação de busca dos tumores primários3,4; (c) linfoma primário maligno (linfoma não Hodgkin ou linfoma de Hodgkin) com recomendação de excisão para confirmação e imunofenotipagem; (d) esfregaços inadequados ou não diagnósticos (ND) devido a amostras escassas/acelulares.
Casos sugestivos ou suspeitos foram considerados positivos para malignidade, todos foram investigados e tratados apropriadamente.
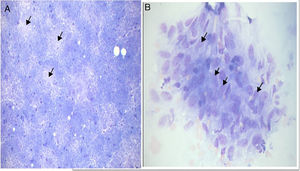
As lesões citomorfológicas da tuberculose foram classificadas em três grupos, conforme descrito por Das et al.5 As características citológicas das lesões tuberculosas foram agrupadas sob três principais tipos de resposta citológica, como descrito a seguir:
- •
Tipo I – Granuloma epitelioide sem necrose;
- •
Tipo II – Granuloma epitelioide com necrose;
- •
Tipo III – Necrose sem granuloma epitelioide.
Os dados foram inseridos no software estatístico (versão 20.0, SPSS, IBM Company, Armonk, Nova York).
Para as variáveis qualitativas, usou‐se o percentual como índice descritivo e para as variáveis quantitativas usaram‐se média e desvio‐padrão (DP) ou mediana e intervalo interquartil (IIQ).
Após descartar os resultados ND, foram calculados a sensibilidade (S), especificidade (E), o valor preditivo positivo (VPP) e valor preditivo negativo (VPN) da PNAAF para o diagnóstico de tuberculose.
Os resultados ND foram estudados de acordo com a idade, o tamanho e a localização do linfonodo e o resultado histológico. Os valores de corte das variáveis quantitativas (idade, tempo até a primeira consulta e tamanho) foram calculados através da análise da curva ROC.
Sempre que necessário, os valores foram comparados pelo teste de qui‐quadrado para determinar a significância na diferença entre as variáveis. Estimamos o odds ratio (OR) com intervalo de confiança de 95% (IC 95%) dos resultados ND associado a cada fator de risco. Um valor de p < 0,05 foi estabelecido como nível de significância.
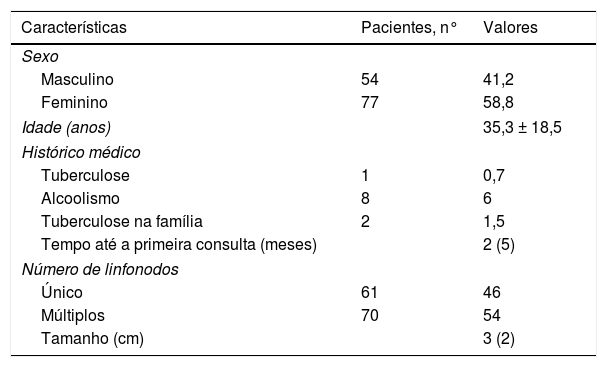
ResultadosA PNAAF foi feita em 131 pacientes com linfadenopatia palpável na região cervical. As principais características dos pacientes são apresentadas na tabela 1. O local da linfadenopatia cervical mais comumente envolvido foram os linfonodos cervicais profundos superiores (66,4%), seguidos pelos linfonodos cervicais profundos inferiores (29%). A mediana do tamanho da linfadenopatia foi de 3cm (IIQ = 2).
Características demográficas e clínicas dos pacientes estudados
| Características | Pacientes, n° | Valores |
|---|---|---|
| Sexo | ||
| Masculino | 54 | 41,2 |
| Feminino | 77 | 58,8 |
| Idade (anos) | 35,3 ± 18,5 | |
| Histórico médico | ||
| Tuberculose | 1 | 0,7 |
| Alcoolismo | 8 | 6 |
| Tuberculose na família | 2 | 1,5 |
| Tempo até a primeira consulta (meses) | 2 (5) | |
| Número de linfonodos | ||
| Único | 61 | 46 |
| Múltiplos | 70 | 54 |
| Tamanho (cm) | 3 (2) | |
Os valores são dados em % ou média ± desvio‐padrão ou mediana (intervalo interquartil).
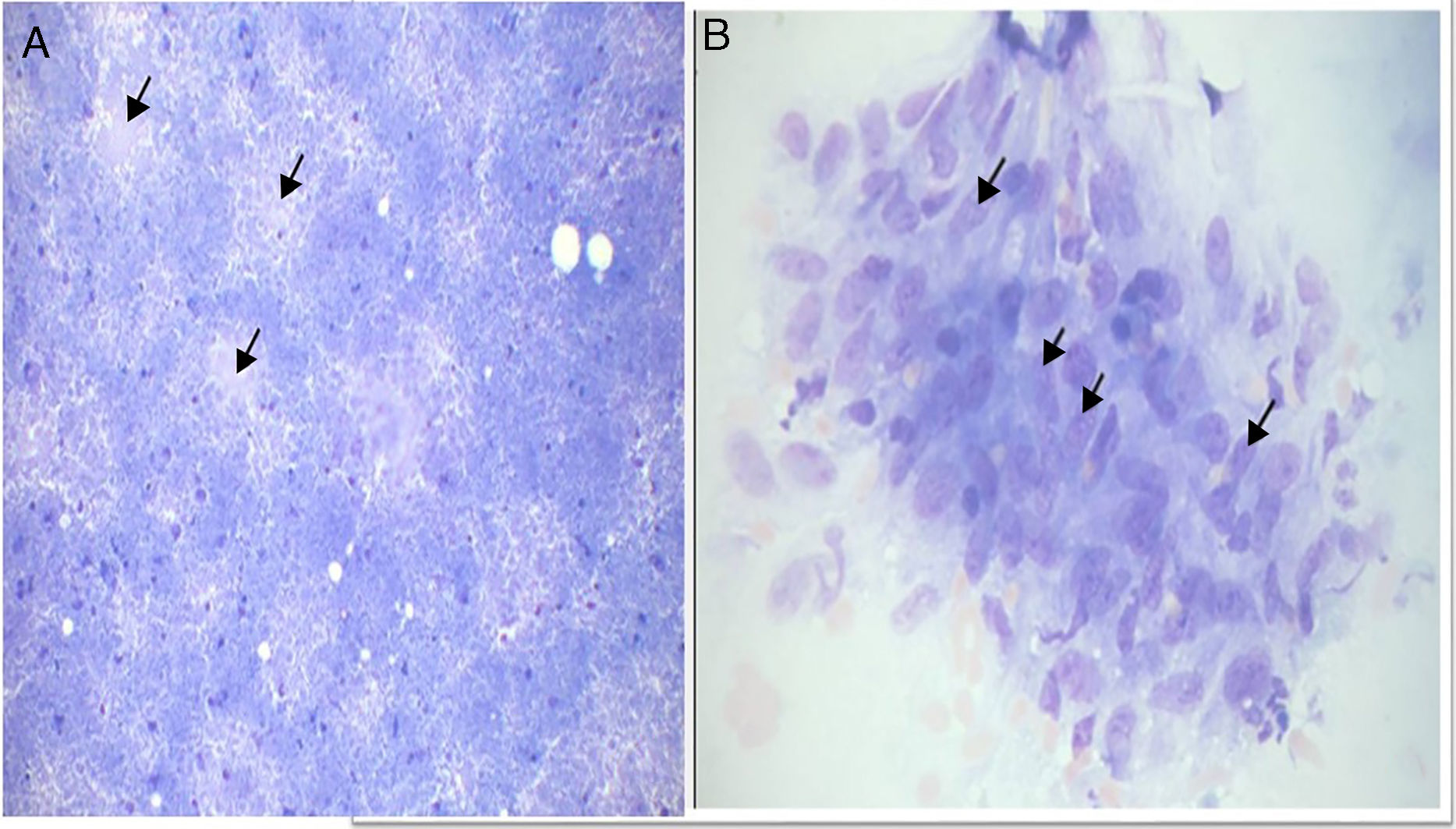
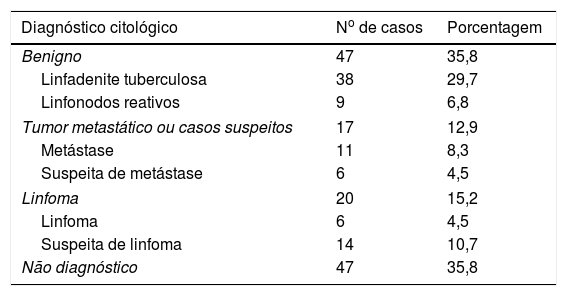
A tabela 2 mostra a distribuição dos resultados da PNAAF; 35,8% eram benignos. A maioria dos casos era de linfadenite tuberculosa (38 em 47). Entre os aspirados das linfadenopatias com lesões tuberculosas (39 casos), as reações do tipo I, II e III foram observadas em 50%, 24% e 26%, respectivamente (fig. 1).
Resultados citológicos dos 131 pacientes estudados
| Diagnóstico citológico | No de casos | Porcentagem |
|---|---|---|
| Benigno | 47 | 35,8 |
| Linfadenite tuberculosa | 38 | 29,7 |
| Linfonodos reativos | 9 | 6,8 |
| Tumor metastático ou casos suspeitos | 17 | 12,9 |
| Metástase | 11 | 8,3 |
| Suspeita de metástase | 6 | 4,5 |
| Linfoma | 20 | 15,2 |
| Linfoma | 6 | 4,5 |
| Suspeita de linfoma | 14 | 10,7 |
| Não diagnóstico | 47 | 35,8 |
O diagnóstico histológico mostrou que 50,4% eram tuberculose, 20,6% linfonodo reativo, 17,55% linfoma e 11,45% carcinoma metastático secundário.
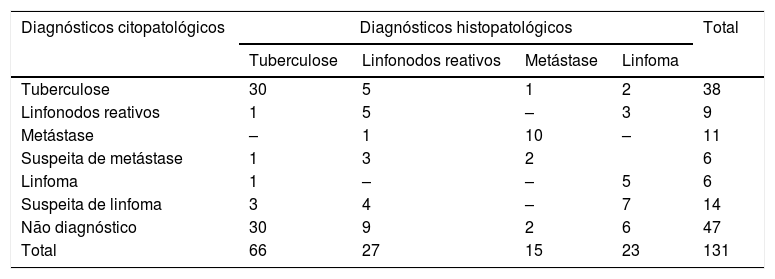
Os resultados citopatológicos foram comparados com os diagnósticos histopatológicos dos linfonodos correspondentes excisados ou biópsia do sítio primário suspeito (tabela 3).
Análise comparativa de diagnósticos citológicos e histopatológicos
| Diagnósticos citopatológicos | Diagnósticos histopatológicos | Total | |||
|---|---|---|---|---|---|
| Tuberculose | Linfonodos reativos | Metástase | Linfoma | ||
| Tuberculose | 30 | 5 | 1 | 2 | 38 |
| Linfonodos reativos | 1 | 5 | – | 3 | 9 |
| Metástase | – | 1 | 10 | – | 11 |
| Suspeita de metástase | 1 | 3 | 2 | 6 | |
| Linfoma | 1 | – | – | 5 | 6 |
| Suspeita de linfoma | 3 | 4 | – | 7 | 14 |
| Não diagnóstico | 30 | 9 | 2 | 6 | 47 |
| Total | 66 | 27 | 15 | 23 | 131 |
Os dados são apresentados como número de pacientes.
Das amostras, 84 (64%) foram consideradas adequadas.
Em geral, 70% (59 de 84) das amostras adequadas estavam de acordo com os resultados histológicos para os mesmos pacientes.
As taxas de S, E, VPP e VNP da PNAAF para tuberculose foram de 83,3%, 83,3%, 78,9% e 86,9%, respectivamente.
Das 131 amostras, 47 (35,8%) foram consideradas não diagnósticas (ND). Das amostras ND, 84,2% (38 de 47) eram benignas, em sua maior parte devido à tuberculose (30 casos).
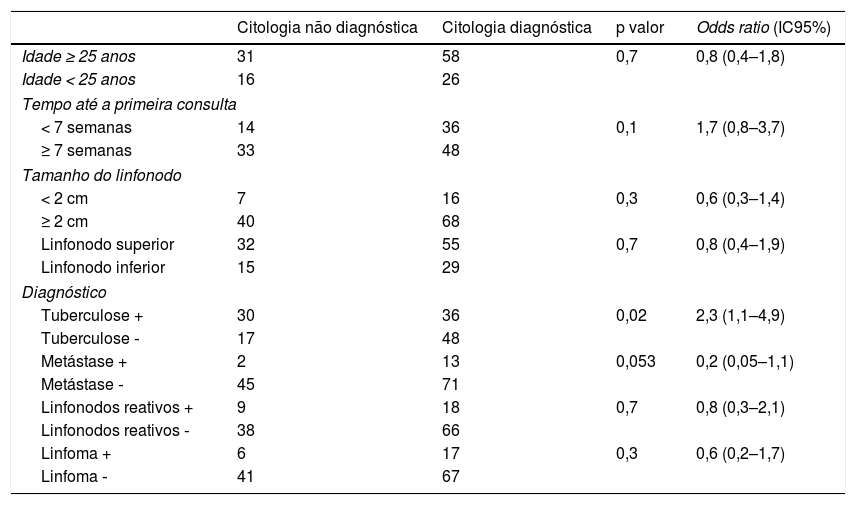
Com base na análise da curva ROC, os valores de corte para os resultados ND foram: idade de 25 anos, tempo para a primeira consulta de sete semanas e tamanho de linfonodo de 2cm. Entre os fatores estudados, apenas a tuberculose (confirmada pelo exame histopatológico) foi significativamente associada à citologia ND (p = 0,02, OR = 2,3 e IC95% = 1,1‐4,9) (tabela 4).
Estudo dos fatores de risco para citologia não diagnóstica
| Citologia não diagnóstica | Citologia diagnóstica | p valor | Odds ratio (IC95%) | |
|---|---|---|---|---|
| Idade ≥ 25 anos | 31 | 58 | 0,7 | 0,8 (0,4–1,8) |
| Idade < 25 anos | 16 | 26 | ||
| Tempo até a primeira consulta | ||||
| < 7 semanas | 14 | 36 | 0,1 | 1,7 (0,8–3,7) |
| ≥ 7 semanas | 33 | 48 | ||
| Tamanho do linfonodo | ||||
| < 2 cm | 7 | 16 | 0,3 | 0,6 (0,3–1,4) |
| ≥ 2 cm | 40 | 68 | ||
| Linfonodo superior | 32 | 55 | 0,7 | 0,8 (0,4–1,9) |
| Linfonodo inferior | 15 | 29 | ||
| Diagnóstico | ||||
| Tuberculose + | 30 | 36 | 0,02 | 2,3 (1,1–4,9) |
| Tuberculose ‐ | 17 | 48 | ||
| Metástase + | 2 | 13 | 0,053 | 0,2 (0,05–1,1) |
| Metástase ‐ | 45 | 71 | ||
| Linfonodos reativos + | 9 | 18 | 0,7 | 0,8 (0,3–2,1) |
| Linfonodos reativos ‐ | 38 | 66 | ||
| Linfoma + | 6 | 17 | 0,3 | 0,6 (0,2–1,7) |
| Linfoma ‐ | 41 | 67 | ||
IC95%, intervalo de confiança de 95%.
A tuberculose continua a ser um grande problema de interesse de saúde pública no norte da África. Nosso estudo revelou que a tuberculose é a causa mais comum de linfadenopatia cervical, seguida de linfadenite reativa e linfoma.
Lesões linfonodais podem ser encontradas entre pacientes jovens até idade avançada.4 Em nosso estudo, o paciente mais jovem no presente estudo tinha três anos e o mais velho, 83.
Em 1981, foi introduzida a amostragem por agulha fina sem aspiração, denominada citologia por punção não aspirativa com agulha fina (PNAAF).6 Essa técnica (não aspirativa) permite melhor controle da mão durante o procedimento e uma boa percepção da consistência da lesão.7
Srikanth et al. compararam as técnicas de PAAF e PNAAF em tumefações de cabeça e pescoço e concluíram que a técnica da PNAAF fornece um rendimento celular adequado para um diagnóstico definitivo em todas as tumefações de cabeça e pescoço com uma melhor retenção da arquitetura, estatisticamente significativa nos esfregaços de linfonodos por PNAAF.6
O diagnóstico da tuberculose depende da identificação do granuloma epitelioide com ou sem necrose. Outros componentes reativos, como linfócitos, polimorfos e células gigantes de Langhans, podem ou não estar presentes.5 Casos nos quais o esfregaço da PNAAF contém material necrótico sem granuloma epitelioide também têm sido considerados lesões tuberculosas, como fazemos neste estudo.8
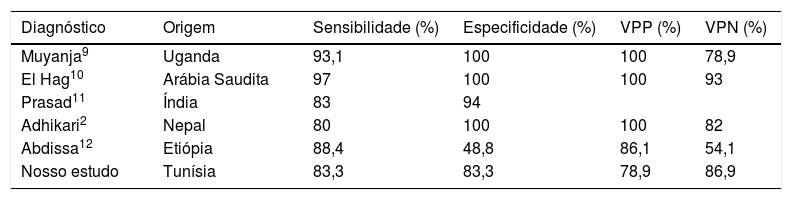
Em nosso estudo, o padrão citológico mais comum da tuberculose foi a presença de granuloma de células epitelioides (Tipo I), observado em 50% dos casos (19 amostras). No entanto, a tuberculose foi confirmada em apenas 12 casos (positivos verdadeiros). A PNAAF mostrou ser um método altamente preciso no diagnóstico da tuberculose, com taxas de sensibilidade e especificidade de mais de 80%. Isso se compara favoravelmente com outros estudos feitos em outras partes do mundo em desenvolvimento, nas quais a tuberculose é endêmica (tabela 5).
Resultados da punção aspirativa por agulha fina para o diagnóstico de tuberculose
| Diagnóstico | Origem | Sensibilidade (%) | Especificidade (%) | VPP (%) | VPN (%) |
|---|---|---|---|---|---|
| Muyanja9 | Uganda | 93,1 | 100 | 100 | 78,9 |
| El Hag10 | Arábia Saudita | 97 | 100 | 100 | 93 |
| Prasad11 | Índia | 83 | 94 | ||
| Adhikari2 | Nepal | 80 | 100 | 100 | 82 |
| Abdissa12 | Etiópia | 88,4 | 48,8 | 86,1 | 54,1 |
| Nosso estudo | Tunísia | 83,3 | 83,3 | 78,9 | 86,9 |
VPN, valor preditivo negativo; VPP, valor preditivo positivo.
Esses achados foram diferentes de um estudo retrospectivo de cinco anos feito em um hospital público nos Estados Unidos, no qual a aspiração com agulha fina (AAF) mostrou uma baixa sensibilidade (53%) no diagnóstico de tuberculose.13 Encontramos seis diagnósticos falsos negativos feitos com a PNAAF para o diagnóstico da tuberculose quando comparados com a histologia. Isso é comparável com estudos anteriores.9,10
A falta de um diagnóstico preciso pode ocorrer devido a erro de amostragem e, nessas circunstâncias, a repetição da aspiração ou biópsia excisional pode ser considerada.14 Em nossa experiência, a taxa de ND foi de 35,8%. A taxa não diagnóstica (ND) para a AAF, de acordo com a literatura, varia de 0,9% a 48%.9,15
Rammeh et al. estudaram os fatores que influenciam a taxa de não diagnóstico da AAF e descobriram que essa taxa depende do tamanho < 1cm, da localização submandibular do linfonodo e da experiência do profissional que faz a aspiração.14
A fibrose ou a extensa necrose encontrada na tuberculose também pode explicar a taxa de ND associada a essa condição em nosso estudo (30 de 47). Assim, verificamos que a tuberculose confirmada pela histologia foi significativamente associada a um resultado não diagnóstico de PNAAF.
A experiência do profissional que faz a aspiração é um fator importante que determina a qualidade da AAF. Singh et al. investigaram 5.226 amostras de AAF dos seis sítios mais comuns e compararam as taxas de inadequação.16 Os autores observaram que a taxa de ND foi mais baixa quando a AAF foi feita por um citopatologista (12%) e mais alta quando feita por um não citopatologista (32%).
Ahn declarou que, com treinamento e experiência no manejo de pelo menos 100 casos de PAAF guiados por ultrassom, os cirurgiões podem garantir uma baixa taxa de amostragem inadequada e boa precisão diagnóstica.17
A melhoria da eficiência da PAAF guiada por ultrassom sobre a PAAF guiada por palpação nas massas da cabeça e pescoço tem sido bem documentada, levou à sua aceitação como padrão de cuidados entre radiologistas e muitos citopatologistas.18,19 A adição do ultrassom à técnica reduz a taxa de não diagnóstico.20 No entanto, é uma técnica mais dispendiosa do que a AAF não guiada por ultrassom e deve ser feita para linfadenopatias de tamanho pequeno ou em sítios difíceis.20 Em nosso estudo, usamos a técnica guiada por palpação em todos os casos.
A repetição da citologia é útil e deve ser considerada especialmente em casos não diagnósticos. No estudo de Shykhon et al., a taxa de ND foi de 48% na primeira citologia e diminuiu para 32% após a segunda.15
ConclusãoNosso estudo mostra que atualmente, a tuberculose é a causa mais comum de linfadenopatia cervical no norte da África. Essa condição foi significativamente associada com a citologia ND.
A PNAAF é uma técnica segura e precisa para ser usada no diagnóstico de tuberculose linfonodal cervical, a qual está associada ao risco de citologia não diagnóstica.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sellami M, Charfi S, Chaabouni MA, Mrabet S, Charfeddine I, Ayadi L, et al. Fine needle non‐aspiration cytology for the diagnosis of cervical lymph node tuberculosis: a single center experience. Braz J Otorhinolaryngol. 2019;85:617–22.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.