The 72 kDa heat shock protein, HSP72, located intracellularly provides cochlear cytoprotective and anti‐inflammatory roles in the inner ear during stressful noise challenges. The expression of intracellular HSP72 can be potentiated by alanyl‐glutamine dipeptide supplementation. Conversely, these proteins act as pro‐inflammatory signals in the extracellular milieu.
ObjectiveWe explore whether noise‐induced hearing loss promotes both intracellular and extracellular HSP72 heat shock response alterations, and if alanyl‐glutamine dipeptide supplementation could modify heat shock response and prevent hearing loss.
MethodsFemale 90 day‐old Wistar rats (n=32) were randomly divided into four groups: control, noise‐induced hearing loss, treated with alanyl‐glutamine dipeptide and noise‐induced hearing loss plus alanyl‐glutamine dipeptide. Auditory brainstem responses were evaluated before noise exposure (124 dB SPL for 2h) and 14 days after. Cochlea, nuclear cochlear complex and plasma samples were collected for the measurement of intracellular HSP72 and extracellular HSP72 by a high‐sensitivity ELISA kit.
ResultsWe found an increase in both iHSP72 and eHSP72 levels in the noise‐induced hearing loss group, which was alleviated by alanyl‐glutamine dipeptide treatment. Furthermore, H‐index of HSP72 (plasma/cochlea extracellular HSP72/intracellular HSP72 ratio) was increased in the noise‐induced hearing loss group, but prevented by alanyl‐glutamine dipeptide treatment, although alanyl‐glutamine dipeptide had no effect on auditory threshold.
ConclusionsOur data indicates that cochlear damage induced by noise exposure is accompanied by local and systemic heat shock response markers. Also, alanyl‐glutamine reduced stress markers even though it had no effect on noise‐induced hearing loss. Finally, plasma levels of 72 kDa heat shock proteins can be used as a biomarker of auditory stress after noise exposure.
A proteína de choque térmico de 72 kDa, HSP72 localizada intracelularmente, tem papéis citoprotetores e anti‐inflamatórios cocleares na orelha interna durante situações de ruído estressantes. A expressão dessa proteína pode ser potencializada pela suplementação com dipeptídeo de alanil‐glutamina. Por outro lado, essas proteínas atuam como sinais pró‐inflamatórios no meio extracelular.
ObjetivoInvestigar se a perda auditiva induzida por ruído promove alterações tanto das proteínas HSP72 intracelulares quanto extracelulares na resposta de choque térmico e se a suplementação com alanil‐glutamina pode modificar a resposta de choque térmico e evitar a perda auditiva.
MétodoRatos Wistar fêmeas, com 90 dias de idade (n=32), foram divididos aleatoriamente em quatro grupos: controle, perda auditiva induzida por ruído, tratados com alanil‐glutamina e perda auditiva induzida por ruído mais alanil‐glutamina. Os potenciais evocados auditivos do tronco encefálico foram avaliados antes da exposição ao ruído (124dB NPS por 2h) e 14 dias após. A cóclea, o complexo nuclear coclear e amostras de plasma foram coletadas para mensuração de HSP72 intra e extracelular com um kit Elisa de alta sensibilidade.
ResultadosHouve um aumento nos níveis de HSP72 intra e extracelular no grupo perda auditiva induzida por ruído, que foi minimizado pelo tratamento com alanil‐glutamina. Além disso, o índice H das HSP72 (razão HSP72 extracelular/HSP72intracelular plasma/cóclea) aumentou no grupo perda auditiva induzida por ruído, mas foi limitado pelo tratamento com alanil‐glutamina, embora o alanil‐glutamina não tenha efeito no limiar auditivo.
ConclusõesNossos dados indicam que o dano coclear induzido pela exposição ao ruído é acompanhado por marcadores da resposta de choque térmico locais e sistêmicos. Além disso, alanil‐glutamina reduziu os marcadores de estresse, mesmo não tendo efeito sobre a perda auditiva induzida por ruído. Finalmente, os níveis plasmáticos de proteínas de choque térmico de 72 kDa podem ser usados como biomarcador do estresse auditivo, após a exposição ao ruído.
A perda auditiva afeta aproximadamente 360 milhões de pessoas em todo o mundo, com grande impacto nos relações e na capacidade de comunicação. Embora o ruído seja o principal fator de risco evitável para danos auditivos, estima‐se que 10% da população humana estejam expostos a pressão sonora excessiva, a níveis que possam induzir lesão auditiva. A perda auditiva induzida por ruído (PAIR) é a doença ocupacional mais prevalente nos EUA, com 22 milhões de trabalhadores expostos a altos níveis de ruído, demanda US$ 240 milhões em tratamento de perda auditiva.1–3 Muitas estratégias terapêuticas para tratar ou prevenir a PAIR foram investigadas. Terapias antioxidantes têm mostrado sucesso na prevenção do estresse oxidativo induzido pela exposição ao ruído em modelos animais.3 A Food and Drug Administration tem recomendado estudos sobre opções de tratamento administrados por via oral para doenças auditivas.4,5
Um alto nível de exposição ao ruído promove intensa atividade metabólica na cóclea, o que induz estresse oxidativo associado a danos transitórios ou permanentes nas células ciliadas cocleares.4,6,7 Para proteção contra situações de ruído, a cóclea requer uma resposta citoprotetora, na forma da expressão de uma família de proteínas de choque térmico de 70 kDa (HSP70). O HSPA1A é o gene de resposta de choque térmico (HSR) mais estudado, devido à sua alta expressão em células de mamíferos sob condições de estresse. Está localizado na região do complexo principal de histocompatibilidade (MHC – Major Histocompatibility Complex) III e codifica uma forma induzível de 72 kDa (HSP72). Em estudos com camundongos submetidos a pré‐condicionamento com choque térmico, a expressão dessas proteínas aumentou, o que forneceu proteção contra danos auditivos induzidos por ruído; isso enfatiza a importância da expressão de HSP70.8 Além disso, a supressão do fator de choque térmico 1 (HSF1), o fator de transcrição necessário para a síntese de HSP72, mostrou resultar em perda auditiva permanente após exposição ao ruído.9
Vários estudos avaliaram métodos para induzir o HSR na cóclea e o papel citoprotetor da HSP70.10–14 A glutamina é um aminoácido avaliado como potencializador da HSR, tanto em estudos in vitro como in vivo.15,16 A influência da glutamina ou do dipeptídeo de alanil‐glutamina (DIP) na defesa antioxidante intracelular devido ao aumento dos níveis de glutationa17 e a presença dos transportadores de glutamina nas células ciliadas da cóclea sugerem que a suplementação com glutamina pode ser importante para a saúde auditiva em indivíduos expostos ao ruído.18
A HSP72 intracelular (iHSP72) atua como um protetor molecular de outras proteínas (limita assim a agregação de proteínas, facilita a reativação de proteínas e mantém a função estrutural) e tem propriedades anti‐inflamatórias, através da inibição da ativação do fator nuclear kB (NF‐kB).19 Por outro lado, um número crescente de observações indica que, quando localizadas no meio extracelular (eHSP72), essas proteínas podem afetar células adjacentes ou distantes.20,21 A eHSP72 é capaz de promover interações moleculares com os receptores da superfície celular e, assim, promover a sinalização celular pró‐inflamatória através da interação com vários receptores de eHSP72. A esse respeito, a liberação de eHSP72 para o meio extracelular pode ser caracterizada como um estado pró‐inflamatório, enquanto a expressão intracelular de iHSP72 representa um papel anti‐inflamatório mais amplo. Com base nessas observações, a razão eHSP72/iHSP72 (índice H) foi estabelecida, na qual [eHSP72/iHSP70] no estado basal é 1: 1=1 (isto é, grupo controle) representa uma condição normal.22–24 Que seja de nosso conhecimento, o índice H nunca foi usado em estudos de perda auditiva. No presente estudo com ratos, investigamos se a exposição ao ruído pode induzir a HSR localmente na cóclea (iHSP72) e sistemicamente (eHSP72). Também avaliamos se a suplementação com DIP pode modificar a HSR e prevenir a perda auditiva. Nossa hipótese é que os níveis plasmáticos de eHSP72 e/ou o índice H podem ser usados como biomarcadores do estresse auditivo após a exposição ao ruído.
MétodoAnimaisRatos Wistar fêmeas, com 90 dias de idade (n=32) e aproximadamente 200g, foram obtidos do Biotério da Universidade Regional do Noroeste do Estado do Rio Grande do Sul (Unijuí). Elas foram mantidas sob temperatura controlada (23°±1°C) em um ciclo claro/escuro de 12/12h (luzes acesas às 07:00da manhã) e alojadas em gaiolas plásticas (49×34×16cm). Durante os experimentos, os ratos tiveram acesso à água e foram alimentados com ração de laboratório padrão peletizada (Nuvilab®) ad libitum. A ausência de otite após otoscopia feita por especialista foi usada como critério de inclusão. Os animais foram distribuídos aleatoriamente em grupos, conforme descrito na seção Desenho Experimental (a seguir). A investigação seguiu todas as regras éticas estabelecidas pelas Diretrizes Brasileiras para o Cuidado e Uso de Animais de Laboratório e o Guia de Cuidados e Uso de Animais de Laboratório, publicado pelo National Institutes of Health (NIH publicação n° 85‐23, revisto em 1996). Todos os procedimentos foram aprovados pelo Comitê de Bem‐Estar Animal (Ceua‐Unijuí, protocolo n° 058/15). Todos os procedimentos experimentais foram feitos entre outubro de 2016 e fevereiro de 2017. A análise bioquímica foi feita entre março e junho de 2017.
Desenho experimentalDurante sete dias consecutivos, os ratos receberam dipeptídeo de alanil‐glutamina (DIP) por via oral ou água (veículo) e foram então avaliados pelo teste dos potenciais evocados auditivos do tronco encefálico (Peate). Um dia depois, a metade dos animais foi exposta ao ruído por 2h e então todos (n=32) foram divididos nos seguintes grupos experimentais (n=8 por grupo): controle (CON), perda auditiva induzida por ruído (PAIR), tratado com DIP (DIP) e PAIR mais DIP (DIP+PAIR). Os grupos DIP e DIP+PAIR foram tratados com DIP por mais de 14 dias após exposição ao ruído. O teste do Peate foi repetido em todos os ratos e a cóclea e os complexos nucleares cocleares foram extraídos cirurgicamente por um especialista. Amostras de plasma também foram obtidas para análises. Um resumo do desenho experimental é mostrado na figura 1.
Desenho experimental. Sete dias antes da indução do modelo animal de perda auditiva induzida por ruído, o tratamento com alanil‐glutamina (grupos DIP e DIP‐PAIR) ou água (grupos CON e PAIR) foi iniciado. Um dia antes, a avaliação auditiva com Peate foi feita para determinar limiares auditivos basais. No dia zero, os grupos PAIR e DIP‐PAIR foram expostos a 124dB NPS por 2h. Após 14 dias, o Peate foi feito em todos os animais, seguido da extração da cóclea, núcleos cocleares e plasma para mensuração da concentração de HSP72.
Os ratos foram suplementados diariamente com L‐alanil‐L‐glutamina DIP (Dipeptiven®, Fresenius Kabi®) a uma dose de 1,5g/kg (diluída em água para uma concentração final de 0,2g/mL). Os animais receberam suplementos através de alimentação por gavagem (1mL/100g de peso corporal) por 21 dias (7 dias antes e 14 dias após exposição ao ruído).
Potencial evocado auditivo de tronco encefálico (Peate)Para a avaliação auditiva dos ratos, o potencial evocado auditivo de tronco encefálico (Peate) foi feito com o sistema Vivosonic Integrity V500®. Os ratos foram anestesiados por via intraperitoneal com cetamina (80mg/kg) e xilazina (10mg/kg) e colocados em sala anecoica. Eletrodos do tipo agulha subcutâneos foram inseridos posteriormente ao pavilhão auricular testado (eletrodo ativo), vértice (eletrodo de referência) e pavilhão auricular contralateral (eletrodo terra). Os estímulos sonoros foram cliques (tempo de subida/descida, 2ms; duração total, 2ms; taxa de repetição, 21s). As respostas foram filtradas (banda de passagem de 100 a 3000Hz) e a média foi de 500 amostras.
O Peate de rato consiste em quatro componentes (chamados de P1 a P4) que ocorrem dentro de 6ms do início do estímulo. Esses componentes refletem a atividade neural do nervo auditivo (P1), do núcleo coclear (P2), do complexo olivar superior (P3) e do lemnisco lateral e/ou colículo inferior (P4). Os limiares auditivos foram determinados diminuindo‐se a intensidade do som em decrementos de 5dB, começando em 100dB e chegando a 0dB, ou até que um componente do Peate com escore confiável fosse detectado. Em roedores, a onda P2 do Peate é a maior e geralmente a última a desaparecer à medida que o estímulo sonoro diminui. Assim, o valor do limiar foi definido como a menor intensidade capaz de provocar uma onda P225 e os dados do Peate foram expressos como limiares auditivos (LA) e alterações no limiar auditivo (ALA). Esse último representa a diferença entre os limiares, antes e depois da exposição ao ruído em cada rato.
Exposição ao ruídoOs ratos foram expostos por 2h a ruído branco contínuo de amplo espectro de frequência e intensidade de pico de 8000Hz, a 124dB NPS. Durante a exposição, os ratos foram colocados em uma caixa dentro de uma sala anecoica. O ruído branco foi produzido por um gerador de sinal de áudio, conectado a alto‐falantes no centro da caixa (EP125, Insight®). O nível de ruído foi medido com um decibelímetro (Decibelímetro Digital TDEC100, Incoterm®) localizado dentro da caixa no início e após a conclusão da exposição ao ruído.
Níveis de iHSP72 na cóclea e complexo nuclear coclear e níveis plasmáticos de eHSP72As amostras da cóclea (duas para cada animal) e do complexo nuclear coclear foram rapidamente removidas e lavadas em solução salina tamponada com fosfato (PBS) gelada, pH 7,4. As amostras foram homogeneizadas mecanicamente dentro de microtubos com 50 uL de tampão fosfato de potássio com inibidor de protease (fluoreto de fenil‐metil‐sulfonila, PMSF, 100μM) e centrifugadas (5000rpm por 10min). Os sobrenadantes foram congelados em microtubos com nitrogênio líquido, até a análise dos níveis de iHSP70. O plasma foi obtido por centrifugação (sangue com EDTA; 3000rpm por 10min) e armazenado a ‐20°C para análise dos níveis de eHSP72. Os níveis de iHSP70da cóclea e do complexo nuclear coclear e os níveis de eHSP70 no plasma foram medidos com um kit Elisa de alta sensibilidade (kit Elisa de alta sensibilidade AMP’D® HSP70, EnzoLifesciences®).
Índice de razão HSP70 extracelular‐para‐intracelular (índice H)O índice da razão HSP70 extracelular‐para‐intracelular (índice‐H) tem sido descrito como um novo índice geral do estado imunoinflamatório de um indivíduo.19,22–24,26,27 A justificativa para o índice H é que quanto maior o nível de eHSP70, maior o sinal inflamatório, devido à natureza pró‐inflamatória da proteína. Por outro lado, se as células são capazes de responder a estímulos estressantes ao aumentar a produção de iHSP70, elas entram simultaneamente em um estado de anti‐inflamação. Portanto, se Rc=[eHSP70]c/[iHSP70]c representa a razão HSP70 em uma situação controlada, o índice‐H para uma situação estressante (Rj) pode ser calculado como o quociente de diferentes valores de Rj=[eHSPA]j/[iHSPA]j, relativo a Rc (onde Rc=1, isto é, linha de base). Assim, o índice H (Rj/Rc) permite comparações entre qualquer situação de estresse e o controle.22
Análise estatísticaAntes da análise estatística, todas as variáveis de desfecho foram avaliadas para normalidade com o teste de Kolmogorov‐Smirnov. Os dados são apresentados como média±desvio‐padrão. Para a análise da perda auditiva e da resposta de HSR, o tamanho mínimo da amostra necessário para detectar diferenças (mantendo‐se α=0,05 e poder de teste de 80%) é de 8 ratos em cada grupo.28 O teste t foi usado para comparar limiares auditivos basais e finais dentro dos grupos. As comparações entre os grupos foram feitas por Anova unidirecional seguido pelo teste post hoc de Student Newman‐Keuls.
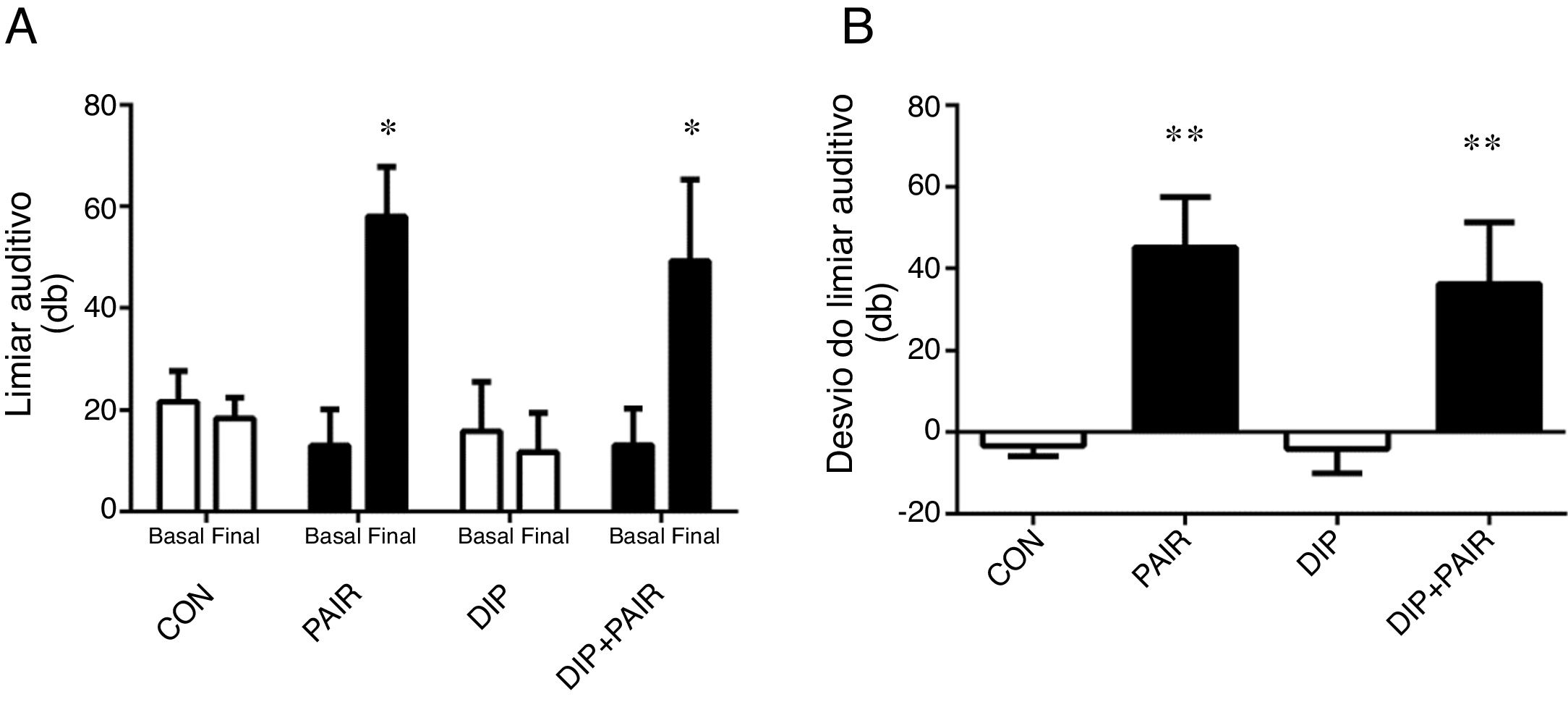
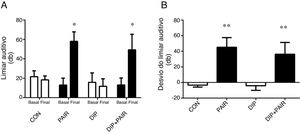
ResultadosAntes de qualquer intervenção, todos os ratos apresentaram um limiar auditivo próximo a 20dB (fig. 2A). A exposição ao ruído promoveu um aumento de 40dB no limiar auditivo nos grupos PAIR e DIP+PAIR (fig. 2 A ‐ B).
Efeitos do dipeptídeo alanil‐glutamina (DIP) na perda auditiva induzida por ruído (PAIR). (A) Limiar da audição e (B) Desvio do limiar auditivo. PAIR e DIP+PAIR mostraram um aumento no limiar auditivo (* p<0,05 vs. mesmo grupo antes da exposição ao ruído) e desvio do limiar auditivo (** p<0,05 vs. grupos sem exposição ao ruído).
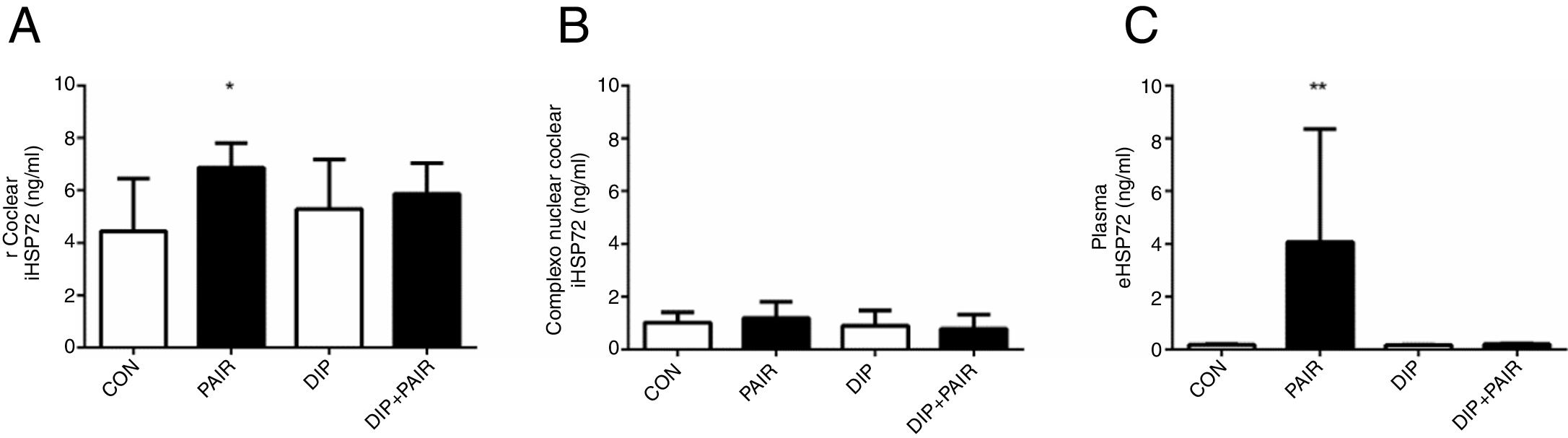
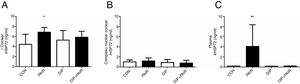
A exposição ao ruído (14 dias) induziu um aumento nos níveis cocleares do iHSP70 (grupo PAIR) quando comparado ao grupo controle (fig. 3A), enquanto os níveis do iHSP70 no complexo nuclear coclear permaneceram inalterados (fig. 3B). Os níveis de eHSP72 aumentaram devido à exposição ao ruído e esse efeito foi atenuado pelo tratamento com DIP (fig. 3C).
Efeitos do tratamento com o dipeptídeo de alanil‐glutamina (DIP) na resposta de choque térmico em perda auditiva induzida por ruído (PAIR). (A) A PAIR promoveu um aumento na expressão de iHSP72 coclear (*p <0,05 vs. controle). (B) Nenhuma alteração foi observada na expressão do iHSP72 no complexo nuclear coclear. (C) As concentrações de eHSP72 no plasma foram maiores no grupo PAIR do que todos os grupos combinados (**p <0,05).
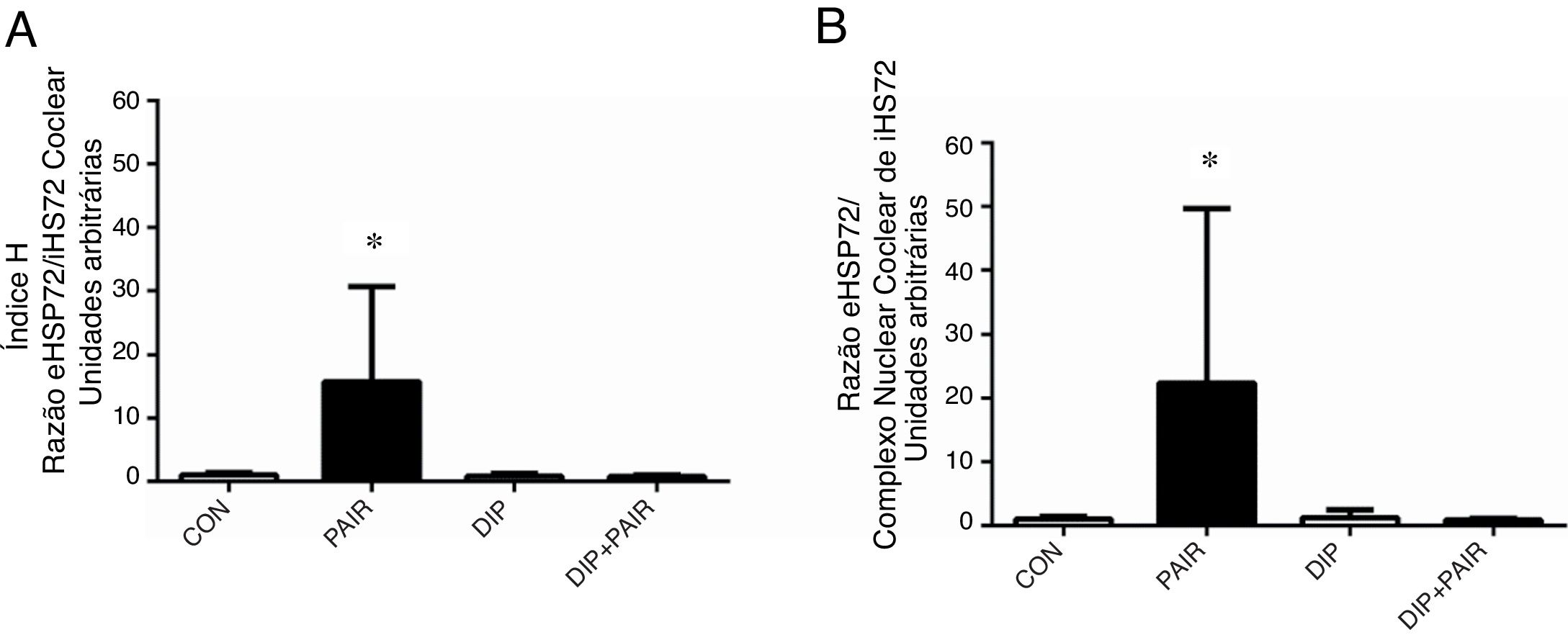
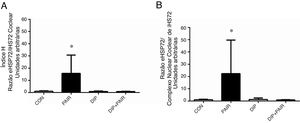
Após a exposição ao ruído, foi avaliado o estado do choque térmico na razão eHSP70/iHSP70 (índice H). Observaram‐se aumentos tanto na razão HSP70 plasma/coclear (fig. 4A) como na razão HSP70 do complexo nuclear coclear/plasma (fig. 4B). O tratamento com DIP removeu esses efeitos e resultou em níveis do índice H, nas razões plasma/coclear e plasma/complexo nuclear coclear que eram similares aos do grupo controle.
Efeitos do tratamento com dipeptídeo de alanil‐glutamina (DIP) na perda auditiva induzida por ruído (PAIR) e na razão eHSP72/iHSP72 (índice‐H). (a) Razão HSP70 plasma/coclear e (b) razão plasma/complexo coclear nuclear do HSP70. A PAIR promoveu um aumento tanto na razão plasma/coclear quanto na razão plasma/complexo coclear nuclear de eHSP72/iHSP72 (* p <0,05 vs. todos os grupos).
Este estudo relata a primeira evidência de que o dano coclear induzido pela exposição ao ruído é acompanhado por HSR local e sistêmica e a suplementação com DIP pode atenuar os marcadores de estresse em um modelo de PAIR em ratos. Observamos também que o tratamento com DIP não evita a perda auditiva, apesar das reduções nos níveis de marcadores de estresse.
O modelo de PAIR em ratos foi baseado em um estudo anterior, no qual a perda de audição foi induzida com 124dB NPS por 2h.28 Esse diferiu do nosso estudo no uso de ratos Sprague‐Dawley e o pico de intensidade sonora foi estabelecido a uma frequência de 4000Hz. O presente estudo também usou um estímulo clique para o Peate. Estímulos de clique e de tom puro são comumente usados em investigações dessa natureza. O estímulo clique tem alta reprodutibilidade e estabilidade da forma de onda e é um dos estímulos mais comuns usados em estudos clínicos. Em humanos, a avaliação auditiva com cliques produz um espectro de frequência de 2000–4000Hz, comparado a 8000‐10.000Hz em ratos. Uma possível explicação para essa diferença é a diferença anatômica entre as orelhas humanas e de ratos.29 Em nosso estudo, o estímulo clique foi adequado para avaliação coclear devido à sua excelente reprodutibilidade. Devido à correspondência espectral (8000–10000Hz) do estímulo clique, uma intensidade sonora de pico de 124dB NPS foi escolhida a 8000Hz. Mesmo com as diferenças entre esses estudos, ambos os conjuntos de resultados demonstraram alterações semelhantes no limiar auditivo de aproximadamente 40dB, 14 dias após a exposição ao ruído.
A HSR tecidual é necessária para a manutenção de um estado inflamatório balanceado, devido aos papéis citoprotetores e anti‐inflamatórios da expressão da iHSP70. Isso é essencial para a homeostase proteica (proteostase) contra exposições ao ruído prejudiciais, como o estresse oxidativo.30 Vários estressores são capazes de induzir a expressão da iHSP70 na cóclea de roedores, inclusive choque térmico corporal,8 hipertermia local,31 isquemia transitória,32 ototoxicidade da cisplatina33 e altos níveis de exposição ao ruído.8,10,34 O papel da iHSP70 em situações de estresse sonoro foi investigado por Fairfield et al.9 e Gong et al.35 Ambos os grupos mostraram a importância do fator de choque térmico 1 (HSF1) o principal fator de transcrição da família HSP70, na prevenção e reparo de danos cocleares após intensa exposição ao ruído em camundongos knockout hsf ‐ / ‐.9,35 A HSR iniciou‐se logo após a exposição ao ruído (106dB NPS por 2h), com um pico de expressão de RNAm de HSP70 após 4h. 35 Demonstramos, pela primeira vez, uma persistente resposta ao estresse do sistema auditivo após exposição ao ruído. Os ratos do grupo PAIR exibiram aumentos sustentados nos níveis de iHSP70 durante 14 dias após a exposição ao ruído. Entretanto, o tratamento com DIP não resultou na potencialização de iHSP70 no complexo nuclear coclear ou cóclea e, portanto, não conseguiu evitar a perda auditiva; isto é, a dose posológica, a frequência e o período de tratamento do DIP não levaram a melhorias na HSR quando comparado aos ratos controle. A falha em iniciar uma HSR robusta sob situações de estresse é um sério comprometimento da função celular.22,36
O InterAcademy Medical Panel recomenda a prevenção e o tratamento da PAIR.1 Assim, investigamos o efeito da suplementação com DIP na perda auditiva. L‐glutamina é o aminoácido livre mais abundante no corpo, nutricionalmente classificado como um aminoácido não essencial. Como a glutamina é o precursor imediato do glutamato, a síntese de novo da glutationa pode aumentar com o tratamento com DIP e fornecer uma defesa antioxidante adicional nos espaços intracelulares17,37 e assim evitar danos por estresse oxidativo.38 Esses efeitos foram observados em estudos que administraram as mesmas doses de DIP (1,5g/kg) usadas em nosso estudo.39,40 Apenas alguns estudos investigaram o metabolismo coclear da glutamina. Ryan e Schwartz41 rastrearam a captação de glutamina em células ciliadas da cóclea e observaram níveis mais altos nas células ciliadas internas do que nas externas. Esse fato sugere a existência de um sistema de membrana de alta afinidade para o transporte de glutamina na cóclea. Além disso, o glutamato é o principal neurotransmissor usado pela sinalização auditiva da cóclea, principalmente pelas células ciliadas internas. Consequentemente, essas células são ricas em enzimas glutaminase.42 As membranas pré‐sinápticas dendríticas expressam grandes quantidades de receptor de glutamato ácido α‐amino‐3‐hidroxi‐5‐metil‐ 4‐isoxazol‐propiónico (AMPA) SAT1 (alternativamente denominado GlnT, SA2, SNAT1 e ATA1), um membro da família de transportadores de aminoácidos neutros (SLC38). Tem afinidade preferencial pela glutamina e transporta esse aminoácido da endolinfa (espaço extracelular) para as células ciliadas internas para a síntese do glutamato.18
Os efeitos protetores da glutamina estão associados à potencialização da HSR, pois ela pode promover um ligeiro aumento na trimerização do Heat Shock Factor 1 (HSF‐1), um passo necessário para a HSR. No entanto, em situações de desafio, como o choque térmico, a glutamina aumenta a ativação do HSF1 e, consequentemente, a síntese da HSP70.37 A ativação da via de glicosilação ligada à O (O‐GlcNAc) pela glutamina pode promover a fosforilação recíproca,15 o que leva à translocação nuclear de HSF1 para a região do Heat Shock Element (HSE) que é responsável pela expressão da família HSP70.16
Esses fatores reforçam a hipótese de que a suplementação com DIP é benéfica para o sistema auditivo, com papéis na sinalização, antioxidante e defesa contra estresse celular. Embora a suplementação com DIP (com 1,5g/kg) possa promover um aumento de 62% na concentração plasmática de glutamina,17 a dose de DIP necessária para melhorar a função e proteção das células cocleares não está clara.38 Além disso, o tempo de evolução da HSR coclear sob estresse acústico requer uma investigação mais profunda, especialmente porque a HSR rápida foi observada após 4h e mantida durante os 14 dias do estudo.
Um aspecto crucial da fisiologia da HSP70 é a versatilidade e dualidade dessas proteínas. A iHSP70 atua como agente anti‐inflamatório e inibe a ativação de fatores de transcrição nuclear do intensificador da cadeia leve Kappa de células B ativadas (κB, família; NF‐κB) em múltiplos níveis regulatórios.37 Em contraste, a eHSP70 tem uma função oposta. Ela sinaliza a presença de desafios homeostáticos para sistemas fisiológicos, após a ligação a receptores Toll‐like (TLR‐2, ‐4 e ‐7) em uma variedade de células.19 Isso leva à ativação das vias pró‐inflamatórias.43 Desde a descoberta da eHSP70 no sistema circulatório, muitas associações entre os níveis da eHSP70 e mau prognóstico em pacientes têm sido descritas em diversas doenças, geralmente relacionadas ao estresse oxidativo. A liberação da eHSP70 ocorre através de várias vias. Acredita‐se que a HSP70 seja encontrada no plasma como resultado de um processo ativo, como sinalização de perigo, ou por morte celular necrótica passiva.21 Pela primeira vez, demonstramos que os efeitos nocivos da exposição ao ruído podem ser detectados por um aumento nos níveis plasmáticos de eHSP72. Além disso, a diminuição nos níveis de eHSP70 pode facilitar o desenvolvimento de terapia baseada em DIP para o tratamento da perda auditiva.
Avaliamos os níveis de iHSP70 na cóclea e no complexo nuclear coclear e níveis plasmáticos de eHSP70 com um kit Elisa de alta sensibilidade. Supôs‐se que tanto as formas induzíveis de HSPA1A e HSPA6 (HSP70B’) como a forma cognata HSPA8 de HSP70 se acumulariam no espaço extracelular de diferentes tipos de células após estímulos de estresse adequados. Entretanto, apenas o kit HSPA1A Elisa foi submetido a avaliação global e tem a sensibilidade (intervalo pg/mL) para detectar quantidades mínimas de HSP70 em meios de cultura e soros. Além disso, os resultados anteriores desse laboratório23 indicaram que as principais formas de eHSP70 (HSPA1A e HSPA8) são secretadas em quantidades semelhantes. Portanto, supôs‐se que a forma HSPA1A é representativa da secreção total de eHSP70. Os resultados do presente estudo indicam que o dano coclear induzido pela exposição ao ruído é acompanhado por HSR local e sistêmica. Assim, os níveis plasmáticos de eHSP72 podem ser usados como um biomarcador do estresse coclear causado por exposição ao ruído.
Devido à versatilidade da HSP70 em induzir diferentes respostas inflamatórias de acordo com sua localização, é provável que essa proteína possa ser um marcador importante para o estado imunoinflamatório durante o exercício.26 De fato, seus níveis na circulação parecem ser fundamentais para a manutenção da homeostase.19 Além disso, o balanço da razão [eHSP72/iHSP70], medido pelo cálculo matemático do índice H, pode representar um importante biomarcador de saúde e servir como referência para processos biológicos subclínicos.
Nossos dados demonstram que o tratamento com DIP prejudica a liberação de eHSP72 em ratos expostos ao ruído. Possivelmente, a glutamina diminui o estresse oxidativo e, portanto, reduz o estresse celular. Podemos descartar a hipótese de que diminuições na liberação de eHSP72 são devidas ao mau funcionamento celular (por exemplo, morte, necrose ou apoptose celular), já que o limiar auditivo foi similar nos grupos PAIR e DIP+PAIR. Além disso, a média do índice H no grupo PAIR foi de 16,0, enquanto no grupo DIP+NIHL foi de aproximadamente 1,0 (unidades arbitrárias da concentração de eHSP72/iHSP72). Esses achados são satisfatórios, porque o índice H pode estratificar o estado de HSP70 (ou seja, o índice H de um, em relação ao perfil normal, e os índices‐H mais altos sob um perfil de estresse), bem como outras condições clínicas de acordo com seus estados imunoinflamatórios.22 De fato, o índice‐H emergiu recentemente como um potencial biomarcador do efeito de situações de estresse no sistema imune e de desequilíbrios imunoinflamatórios relacionados a flutuações de níveis de citocinas e HSR deficitária. Finalmente, o alto valor do Índice H observado aqui (15,7 no grupo PAIR) aproxima‐se do ponto de inflexão (19,18, unidades arbitrárias da razão eHSP72/iHSP70), o que representa um perigoso perfil pró‐inflamatório.22
ConclusãoNossos dados indicam que o dano coclear induzido pela exposição ao ruído é acompanhado por respostas de choque térmico local e sistêmico. Além disso, a suplementação com DIP não evitou a perda auditiva induzida por ruído, mas promoveu uma redução nos marcadores de estresse. Os resultados deste estudo confirmam que os níveis plasmáticos de proteínas de choque térmico de 72 kDa podem ser usados como biomarcadores de estresse auditivo após a exposição ao ruído.
FinanciamentoFundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (PqG‐2013‐Fapergs processo 002106‐2551/13‐5 e ARD/PPP/Fapergs/CNPq‐08/2014 processo 16/2551‐0000196‐6) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico9 (CNPq) (Universal MCTI/CNPq N° 01/2016). ABS foi bolsista da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A M. Turcato (Unijuí) e colegas do Grupo de Pesquisa em Fisiologia (Unijuí) pelo apoio técnico.
Como citar este artigo: Soares M, Santos AB, Weich TM, Mânica GG, Homem de Bittencourt PI, Ludwig MS, et al. Heat shock response in noise‐induced hearing loss: effects of alanyl‐glutamine dipeptide supplementation on heat shock proteins status. Braz J Otorhinolaryngol. 2020;86:703–10.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.