Nos casos de transtornos do espectro autista com perda auditiva severa a profunda, o implante coclear é uma opção terapêutica.
ObjetivoIdentificar evidências na literatura científica de que o implante coclear traz benefícios para pessoas com transtorno do espectro autista com perda auditiva associada.
MétodoRevisão sistemática da literatura com base nos critérios recomendados pela lista de verificação do Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (PRISMA). A estratégia População, Intervenção, Comparação, Desfechos e Desenho do Estudo (PICOS) foi usada para definir os critérios de elegibilidade. Os estudos que atenderam aos critérios de inclusão dessa segunda etapa foram incluídos em uma síntese qualitativa. Cada tipo de estudo foi analisado de acordo com a avaliação de risco de viés do Joanna Briggs Institute através da lista de verificação crítica para estudos de coorte, estudos de prevalência e critérios críticos e relatos de casos.
ResultadosForam encontrados 484 artigos em oito bases de dados e 100 na literatura cinzenta que mencionavam a relação entre o implante coclear em pacientes com transtorno do espectro autista e deficiência auditiva. Doze artigos foram lidos na íntegra e 7 foram selecionados para análise qualitativa nesta revisão sistemática. Todos os sete artigos foram analisados de acordo com o checklist de avaliação crítica. Quatro artigos apresentaram baixo risco de viés e três artigos, risco moderado de viés. Neste estudo, foram incluídos 66 pacientes com transtorno do espectro autista e deficiência auditiva que receberam implante coclear.
ConclusãoEsta revisão sistemática indica que o implante coclear pode trazer benefícios para indivíduos com transtorno do espectro autista e surdez associada.
Há um aumento no número de pacientes com transtornos do espectro autista (TEA), um grupo de deficiências de desenvolvimento caracterizadas por dificuldades na interação social e de comunicação. Os TEA também apresentam padrões de comportamento restritos, repetitivos e estereotipados. Os sintomas geralmente se tornam aparentes antes dos três anos.1 Um estudo feito nos Estados Unidos em 2012 mostrou que a prevalência é de 14,5 por 1.000 (um em 69). A prevalência estimada foi significativamente maior entre meninos (23,4 por 1.000) do que entre meninas (5,2 por 1.000).2 Ainda não existem dados oficiais sobre a prevalência dessa condição de saúde no Brasil. Indivíduos com autismo diferem acentuadamente no número e na gravidade dos sintomas exibidos.3 Os sinais típicos de autismo incluem, mas não estão limitados a, atraso na fala e na linguagem, regressão de marcos de desenvolvimento aos 18‐24 meses, evitação do contato visual, defensividade tátil e envolvimento em comportamentos repetitivos e autoestimulantes. Aproximadamente 80% das crianças com autismo apresentam algum grau de comprometimento cognitivo.4
Além disso, alguns indivíduos com TEA podem ter perda auditiva associada. Beers et al.5 fizeram uma revisão sistemática (RS) e constataram que a prevalência de perda auditiva entre indivíduos com TEA é controversa. Estudos objetivam encontrar maior incidência de perda auditiva em pessoas com TEA do que na população em geral.6–8 Os autores também alertaram para a dificuldade de generalizar a prevalência encontrada, considerando as limitações da amostra estudada. Não foi encontrada uma relação clara entre a gravidade do comportamento autista e o grau de perda auditiva.8 Gravel et al.9 não encontraram evidências de diferenças no sistema auditivo periférico entre crianças com TEA e seus pares com desenvolvimento típico.
Nos casos em que o TEA e a deficiência auditiva ocorrem simultaneamente, o diagnóstico de uma condição geralmente leva a um atraso no diagnóstico da outra.8,10 O diagnóstico de perda auditiva pode ter obscurecido o reconhecimento de comportamentos autistas em crianças com até cinco anos.10 Recomenda‐se que as crianças recebam uma avaliação audiológica completa quando houver suspeita de TEA. Dessa forma, a perda auditiva periférica pode ser diagnosticada precocemente e tratada como parte do programa de habilitação e educação da criança.5,7,10 O implante coclear (IC) é uma opção terapêutica para casos de TEA com surdez associada. O IC é o tratamento de escolha para crianças com perda auditiva neurossensorial severa a profunda.11 Esse implante é um dispositivo eletrônico de alta tecnologia desenvolvido para fazer a função das células ciliadas cocleares danificadas ou ausentes e fornecer estimulação elétrica às fibras restantes do nervo auditivo.12
Esta RS tem como objetivo identificar evidências na literatura científica de que o IC favorece o desenvolvimento auditivo, a linguagem e a interação social em pessoas com TEA com perda auditiva associada severa e/ou profunda.
MétodoA estratégia de busca desta RS seguiu os critérios recomendados pela estratégia Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (PRISMA).13 O protocolo foi registrado em 27 de abril de 2020, no International Prospective Register of Systematic Reviews (PROSPERO) (https://www.crd.york.ac.uk/PROSPERO/) sob número de registro: CRD4202015045.
Estratégia de pesquisaA estratégia de busca foi feita em inglês e as bases de dados usadas foram: PubMed, Cochrane, Lilacs, Livivo, Medline, Science Direct, Scopus e Web of Science. A literatura cinza foi consultada através do banco de dados Google Scholar. Não houve restrição quanto ao período ou idioma de publicação.
As palavras‐chave usadas na estratégia de busca para identificar artigos publicados até setembro de 2019 foram descritas e combinadas da seguinte forma: “autism spectrum disorder” OR “autistic disorder” OR “autism” OR “autistic spectrum” (AND) “cochlear implant” OR “cochlear implants” OR “cochlear implantation” OR “cochlear implantations”. Essa mesma estratégia de busca foi usada em todas as bases de dados e literatura cinza.
Após a busca, as referências de cada banco de dados foram exportadas para o programa EndNote X9 (https://endnote.com) e, em seguida, essas mesmas referências foram exportadas do EndNote X98 para o programa Rayyan QCRI (https://rayyan.qcri.org/ bem‐vinda). O objetivo desses dois programas foi registrar todos os artigos duplicados encontrados na literatura científica, promover maior confiabilidade na seleção dos artigos e proceder ao estágio de elegibilidade.
Critério de elegibilidadeA estratégia PICOS (população, intervenção, comparação, desfechos, desenho [s] do estudo)13 foi usada para definir os critérios de elegibilidade. Os critérios de inclusão foram: 1) população: indivíduos com TEA e perda auditiva severa e/ou profunda usuários de IC; 2) intervenção: ter recebido o IC em qualquer idade e ter sido diagnosticado com TEA em qualquer idade; 3) comparação: desenvolvimento de habilidades auditivas, de linguagem e de interação social antes e após a cirurgia de IC em cada indivíduo, bem como comparar o desenvolvimento dessas habilidades em pacientes que apresentam apenas TEA e aqueles com outras deficiências associadas; 4) desfechos: avaliação de mudanças comportamentais ou habilidades de comunicação após uso de IC; 5) desenho do estudo: coorte clínica prospectiva, casos clínicos e relatos de casos.
Os critérios de exclusão foram: (1) artigos com pacientes não considerados para implante coclear, (2) estudos em animais e in vitro e (3) estudos com ausência de dados pós‐operatórios.
Todos os estudos foram analisados quanto à elegibilidade nas fases de triagem com base nos critérios de inclusão e exclusão. Na primeira fase, todos os estudos foram selecionados com base na análise de títulos e dos resumos por dois revisores. Não houve discordância entre os revisores nessa fase, dispensou‐se a consulta com o terceiro revisor. No caso da falta do resumo, mas com título relevante, o estudo foi incluído na segunda fase.
Na segunda fase, os mesmos dois revisores leram o texto completo de cada artigo selecionado com os mesmos critérios de inclusão e exclusão, mas adicionaram a justificativa de exclusão para cada estudo descartado. Os estudos que atenderam aos critérios de inclusão nessa segunda etapa foram incluídos em uma síntese qualitativa. Cada tipo de estudo foi analisado de acordo com a avaliação do risco de viés do Joanna Briggs Institute (JBI).14
Síntese qualitativaOs instrumentos usados para a avaliação do risco de viés foram as listas de verificação de avaliação crítica validadas do JBI para cada desenho de estudo: estudos de coorte, estudos que relataram dados de prevalência e relatos de caso. Na lista de verificação de avaliação crítica do JBI, cada questão deve ser respondida através de quatro opções: sim (S), não (N), incerto (I) e não aplicável (NA). O cálculo da porcentagem de risco de viés é feito pela quantidade de “Y” selecionada na lista de verificação. Quando “NA” foi selecionado, a questão não foi considerada no cálculo, segundo o Joanna Briggs Institute (JBI).14 Até 49% é considerado um alto risco de viés; de 50% a 70% é moderado; acima de 70%, há baixo risco de viés.
Nessa fase, os mesmos dois revisores aplicaram a avaliação de risco de viés do JBI de forma independente. Não houve discordância entre eles, dispensou‐se a consulta ao terceiro revisor.
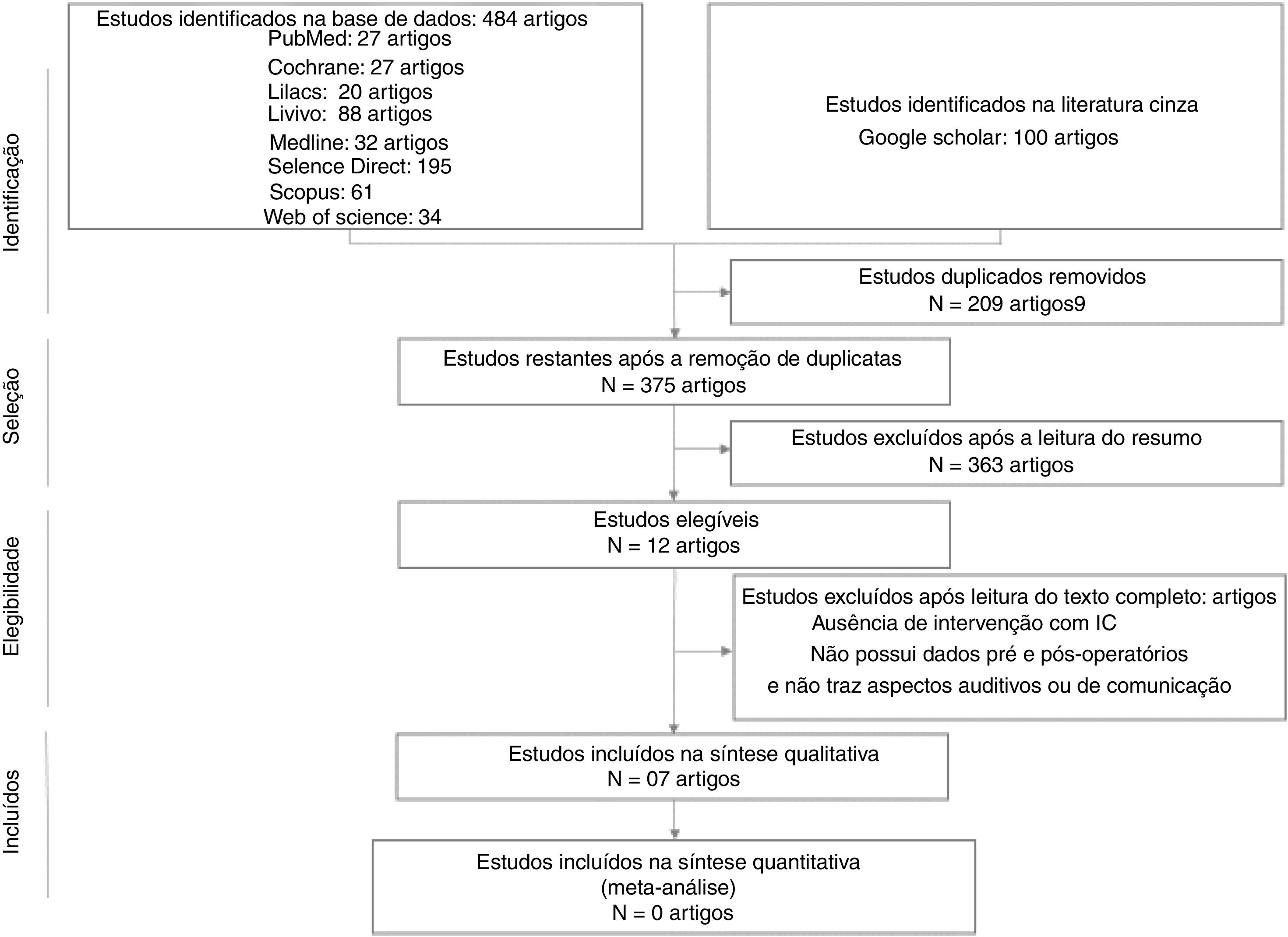
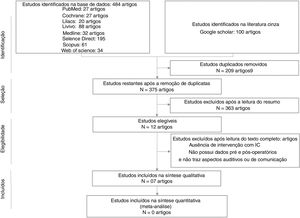
ResultadosA primeira fase desta RS encontrou 484 artigos em oito bases de dados e 100 na literatura cinza. Depois de eliminar 209 estudos duplicados, 375 foram selecionados pelos revisores para a leitura de títulos e resumos. Desses, 363 artigos foram excluídos de acordo com os critérios de exclusão estabelecidos e 12 artigos foram incluídos na segunda etapa, que consistiu na leitura do manuscrito na íntegra. Quatro artigos foram excluídos nessa etapa pelos seguintes motivos: dois artigos15,16 evidenciaram a ausência de um sujeito com TEA + IC; dois17,18 não apresentaram dados pré e pós‐operatórios dos sujeitos, apresentam percepção materna e não apresentam aspectos auditivos ou de comunicação. Sete estudos11,19–24 foram selecionados para análise qualitativa na presente RS (tabela 1). Não foram encontrados estudos através da busca manual nas referências dos artigos. Todo o processo de seleção dos artigos está descrito na figura 1, que mostra o diagrama de fluxo PRISMA para inclusão.
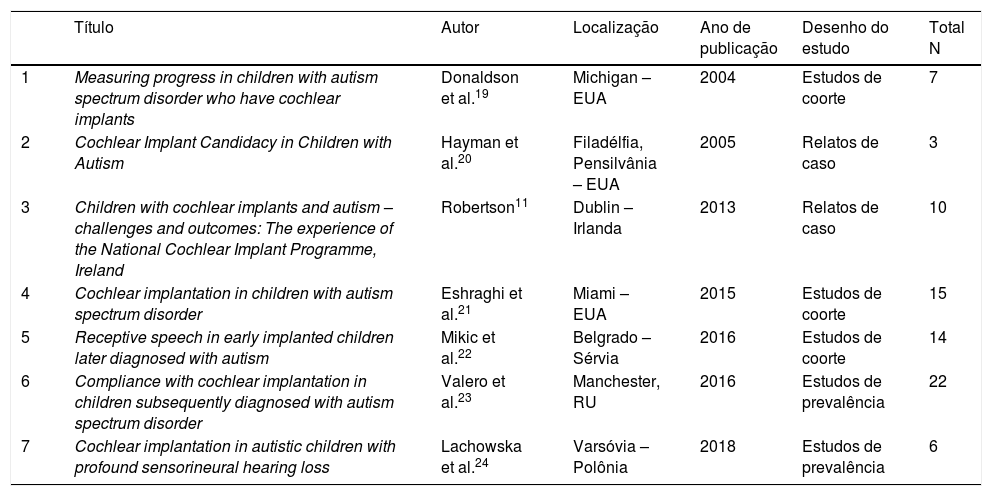
Estudos selecionados de acordo com os critérios de inclusão e exclusão estabelecidos na revisão sistemática
| Título | Autor | Localização | Ano de publicação | Desenho do estudo | Total N | |
|---|---|---|---|---|---|---|
| 1 | Measuring progress in children with autism spectrum disorder who have cochlear implants | Donaldson et al.19 | Michigan – EUA | 2004 | Estudos de coorte | 7 |
| 2 | Cochlear Implant Candidacy in Children with Autism | Hayman et al.20 | Filadélfia, Pensilvânia – EUA | 2005 | Relatos de caso | 3 |
| 3 | Children with cochlear implants and autism – challenges and outcomes: The experience of the National Cochlear Implant Programme, Ireland | Robertson11 | Dublin – Irlanda | 2013 | Relatos de caso | 10 |
| 4 | Cochlear implantation in children with autism spectrum disorder | Eshraghi et al.21 | Miami – EUA | 2015 | Estudos de coorte | 15 |
| 5 | Receptive speech in early implanted children later diagnosed with autism | Mikic et al.22 | Belgrado – Sérvia | 2016 | Estudos de coorte | 14 |
| 6 | Compliance with cochlear implantation in children subsequently diagnosed with autism spectrum disorder | Valero et al.23 | Manchester, RU | 2016 | Estudos de prevalência | 22 |
| 7 | Cochlear implantation in autistic children with profound sensorineural hearing loss | Lachowska et al.24 | Varsóvia – Polônia | 2018 | Estudos de prevalência | 6 |
Os sete artigos foram analisados de acordo com o JBI14 e de acordo com cada tipo de estudo: lista de verificação de avaliação crítica do JBI para estudos de coorte (tabela 2), lista de verificação de avaliação crítica do JBI para estudos relatando dados de prevalência (tabela 3) e lista de verificação de avaliação crítica do JBI para relato de caso (tabela 4). Quatro artigos11,20–22 mostraram um baixo risco de viés e três artigos 19,23,24 mostraram um risco moderado de viés.
Lista de verificação de avaliação crítica do JBI para estudos de coorte
| Donaldson et al.19 | Eshraghi et al.21 | Mikic et al.22 | |
|---|---|---|---|
| Os dois grupos eram semelhantes e foram recrutados na mesma população? | S | S | S |
| As exposições foram medidas de forma semelhante para designar as pessoas a grupos expostos e não expostos? | I | S | S |
| A exposição foi medida de forma válida e confiável? | S | S | S |
| Os fatores de confusão foram identificados? | N | S | S |
| Foram estabelecidas estratégias para lidar com os fatores de confusão? | NA | S | I |
| Os grupos/participantes estavam livres do desfecho no início do estudo (ou no momento da exposição)? | I | S | S |
| Os desfechos foram medidos de forma válida e confiável? | S | S | S |
| O tempo de seguimento foi relatado e foi longo o suficiente para que os desfechos ocorressem? | S | S | S |
| O seguimento foi completo e, em caso negativo, os motivos da perda de seguimento foram descritos e explorados? | S | S | S |
| Foram usadas estratégias para lidar com o seguimento incompleto? | I | S | I |
| Foi usada uma análise estatística apropriada? | I | S | S |
| Risco de viés (%) | 50% | 100% | 81,81% |
S, sim; N, não; I, incerto; NA, não aplicável.
Lista de verificação de avaliação crítica do JBI para estudos que relatam dados de prevalência
| Valero et al.23 | Lachowska et al.24 | |
|---|---|---|
| O quadro de amostra foi apropriado para abordar a população‐alvo? | S | S |
| Os participantes do estudo foram amostrados de maneira apropriada? | S | S |
| O tamanho da amostra foi adequado? | I | I |
| Os sujeitos do estudo e o ambiente foram descritos em detalhes? | I | I |
| A análise de dados foi conduzida com cobertura suficiente da amostra identificada? | I | I |
| Foram usados métodos válidos para a identificação da condição? | S | S |
| A condição foi medida de maneira padrão e confiável para todos os participantes? | S | S |
| Houve uma análise estatística apropriada? | I | I |
| A taxa de resposta foi adequada e, em caso negativo, a baixa taxa de resposta foi manejada de maneira adequada? | S | S |
| Risco de viés (%) | 55% | 55% |
S, sim; I, incerto.
Lista de verificação de avaliação crítica do JBI para relatos de caso
| Hayman et al.20 | Robertson 11 | |
|---|---|---|
| As características demográficas do paciente foram claramente descritas? | S | S |
| A história do paciente foi claramente descrita e apresentada como uma linha do tempo? | S | S |
| A condição clínica atual do paciente na apresentação foi claramente descrita? | S | S |
| Os testes de diagnóstico ou métodos de avaliação e os resultados foram descritos de forma clara? | S | S |
| A (s) intervenção (ões) ou procedimento (s) de tratamento foram claramente descritos? | S | S |
| A condição clínica pós‐intervenção foi claramente descrita? | S | S |
| Os eventos adversos (danos) ou imprevistos foram identificados e descritos? | S | S |
| O relato de caso fornece lições a serem obtidas? | S | S |
| Risco de viés (%) | 100% | 100% |
S, sim.
Nos sete estudos selecionados para a análise qualitativa, foram descritos 67 indivíduos com TEA e deficiência auditiva. Desses, 66 receberam IC (o IC era contraindicado para um sujeito). Quarenta e um sujeitos (62%) foram diagnosticados com TEA após o IC, 7 (11%) antes do IC e para 18 indivíduos (27%) os autores não informaram se o diagnóstico de TEA foi antes ou depois do IC. Nem todos os sujeitos tinham as mesmas características do TEA. Dois (2) indivíduos tinham TEA sem déficits intelectuais e linguísticos (anteriormente conhecido como síndrome de Asperger), cinco (5) tinham TID‐SOE (transtorno invasivo do desenvolvimento – sem outra especificação) e 24 (24) tinham autismo. Ao analisar a descrição dos sujeitos da pesquisa com TEA, observou‐se que 31 deles (46,3%) apresentavam alguma outra deficiência associada e 35 (53,7%) não apresentavam relato de outras deficiências associadas.
As características dos pacientes com TEA e deficiência auditiva, sem outras deficiências associadas, que receberam implante coclear são apresentadas na tabela 5. A tabela 6 apresenta os resultados dos pacientes com TEA e deficiência auditiva que receberam IC e apresentavam outras deficiências associadas.
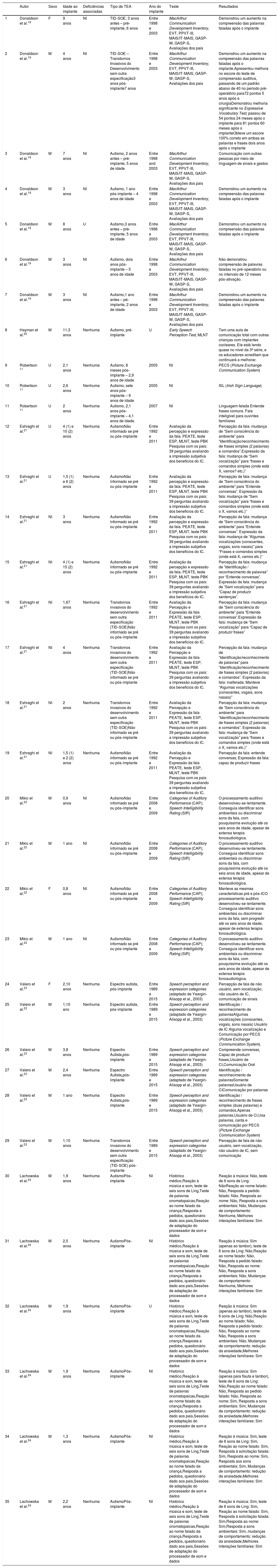
Dados demográficos e detalhes do implante para pacientes com transtorno do espectro autista e perda auditiva com implante coclear sem outras deficiências associadas
| Autor | Sexo | Idade ao implante | Deficiências associadas | Tipo de TEA | Ano do implante | Teste | Resultados | |
|---|---|---|---|---|---|---|---|---|
| 1 | Donaldson et al.19 | F | 9 anos | NI | TID‐SOE, 3 anos antes – pré‐implante, 6 anos | Entre 1998 e 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Demonstrou um aumento na compreensão das palavras faladas após o implante |
| 2 | Donaldson et al.19 | M | 4 anos | NI | TID‐SOE – Transtornos Invasivos do Desenvolvimento sem outra especificação3 anos pós‐implante7 anos | Entre 1998 e 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Demonstrou um aumento na compreensão das palavras faladas após o implante.Apresentou melhora no escore do teste de compreensão auditiva, passando de um padrão abaixo de 40 no período pré‐operatório para72 pontos 5 anos após a cirurgiaDemonstrou melhoria significante no Expressive Vocabulary Test, passou de 54 pontos 24 meses após o implante para 81 pontos 60 meses após o implanteObteve um escore 100% correto em ambas as palavras e frases dois anos após o implante |
| 3 | Donaldson et al.19 | M | 7 anos | NI | Autismo, 2 anos antes – pré‐implante, 5 anos de idade | Entre 1998 and 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Comunicação com outras pessoas por meio de linguagem de sinais e gestos |
| 4 | Donaldson et al.19 | M | 3 anos | NI | Autismo, 1 ano pós‐implante – 4 anos de idade | Entre 1998 e 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Demonstrou um aumento na compreensão das palavras faladas após o implante |
| 5 | Donaldson et al.19 | M | 8 anos | U | Autismo,3 anos antes – pré‐implante, 5 anos de idade | Entre 1998 e 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Demonstrou um aumento na compreensão das palavras faladas após o implante |
| 6 | Donaldson et al.19 | M | 3 anos | NI | Autismo, dois anos pós‐implante – 5 anos de idade | Entre 1998 e 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Não demonstrou compreensão de palavras faladas no pré‐operatório ou no intervalo de 12 meses pós‐ativação. |
| 7 | Donaldson et al.19 | M | 3 anos | NI | Autismo,1 ano antes – pé‐implante, 2 anos de idade | Entre 1998 e 2003 | MacArthur Communication Development Inventory, EVT, PPVT‐III, MAIS/IT‐MAIS, GASP‐W, GASP‐S, Avaliações dos pais | Demonstrou um aumento na compreensão das palavras faladas após o implante |
| 8 | Hayman et al.20 | M | 11,3 anos | Nenhuma | Autismo, pré‐implante | U | Early Speech Perception Test, MLNT | Tem uma aula de comunicação total com outras crianças com implantes cocleares. Ele está lendo quase no nível da 3ª série, e os educadores acreditam que continuará a melhorar. |
| 9 | Robertson 11 | U | 2,1 anos | Nenhuma | Autismo, 8 meses pós‐implante – 2,9 anos de idade | 2005 | NI | PECS (Picture Exchange Communication System) |
| 10 | Robertson 11 | U | 2,6 anos | Nenhuma | Autismo, sete anos pós‐implante – 9 anos de idade | 2005 | NI | ISL (Irish Sign Language) |
| 11 | Robertson 11 | U | 2 anos | Nenhuma | Autismo, 2,1 anos pós‐implante – 4,1 anos de idade. | 2007 | NI | Linguagem falada Entende frases comuns. Fala inteligível para ouvintes familiares |
| 12 | Eshraghi et al.21 | U | 4 (1) e 10 (2) anos | Nenhuma | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da percepção e expressão da fala. PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: mudança de “Sem consciência do ambiente” para “Identificação/reconhecimento de frases simples (2 palavras) e comandos”.Expressão da fala: mudança de “Sem vocalização” para “frases e comandos simples (onde está X, vamos? etc.)” |
| 13 | Eshraghi et al.21 | U | 1,5 (1) e 6 (2) anos | Nenhuma | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da percepção e expressão da fala. PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção de fala: mudança de “Sem consciência do ambiente” para “Entende conversas”. Expressão da fala: mudança de “Sem vocalização” para “frases e comandos simples (onde está o X, vamos etc.)” |
| 14 | Eshraghi et al.21 | NI | 3 anos | Nenhuma | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da percepção e expressão da fala. PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: mudança de “Sem consciência do ambiente” para “Entende conversas”. Expressão da fala: mudança de “Algumas vocalizações (consoantes, vogais, sons nasais)” para “Frases e comandos simples (onde está X, vamos etc.)” |
| 15 | Eshraghi et al.21 | NI | 4 (1) e 15 (2) anos | Nenhuma | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da percepção e expressão da fala. PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: mudança de “Identificação / reconhecimento de palavras” por “Entende conversas”. Expressão da fala: mudança de “Sem vocalização” para “Capaz de produzir sentenças”. |
| 16 | Eshraghi et al.21 | NI | 1,67 anos | Nenhuma | Transtornos invasivos do desenvolvimento sem outra especificação (TID‐SOE)Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: mudança de “Sem consciência do ambiente” para “Entende conversas”.Expressão da fala: mudança de “Sem vocalização” para “Capaz de produzir frases” |
| 17 | Eshraghi et al.21 | NI | 4 anos | Nenhuma | Transtornos invasivos do desenvolvimento sem outra especificação (TID‐SOE)Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: mudança de “Identificação/reconhecimento de palavras” para “Identificação/reconhecimento de frases simples (2 palavras) e comandos”. Expressão da fala: inalterada. Manteve “Algumas vocalizações (consoantes, vogais, sons nasais)” |
| 18 | Eshraghi et al.21 | NI | 2 anos | Nenhuma | Transtornos invasivos do desenvolvimento sem outra especificação (TID‐SOE)Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: mudança de “Sem consciência do ambiente” para “Identificação/reconhecimento de frases simples (2 palavras) e comandos”. Expressão da fala: mudança de “Sem vocalização” para “frases e comandos simples (onde está o X, vamos etc.)” |
| 19 | Eshraghi et al.21 | NI | 1,5 (1) e 2 (2) anos | Nenhuma | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC. | Percepção da fala: entende conversas; Expressão da fala: capaz de produzir frases |
| 20 | Mikic et al.22 | M | 0,9 anos | NI | AutismoNão informado se pré ou pós‐implante | Entre 2008 e 2009 | Categories of Auditory Performance (CAP); Speech Intelligibility Rating (SIR) | O processamento auditivo desenvolveu‐se lentamente. Conseguia identificar sons ambientais ou discriminar sons da fala, com pouquíssima evolução até os seis anos de idade, apesar de extensa terapia fonoaudiológica. |
| 21 | Mikic et al.22 | M | 1 ano | NI | AutismoNão informado se pré ou pós‐implante | Entre 2008 e 2009 | Categories of Auditory Performance (CAP); Speech Intelligibility Rating (SIR) | O processamento auditivo desenvolveu‐se lentamente. Conseguia identificar sons ambientais ou discriminar sons da fala, com pouquíssima evolução até os seis anos de idade, apesar de extensa terapia fonoaudiológica. |
| 22 | Mikic et al.22 | F | 0,8 anos | NI | AutismoNão informado se pré ou pós‐implante | Entre 2008 e 2009 | Categories of Auditory Performance (CAP); Speech Intelligibility Rating (SIR) | Manteve as mesmas características pré e pós‐ICO processamento auditivo desenvolveu‐se lentamente. Conseguia identificar sons ambientais ou discriminar sons da fala, sem progredir até os seis anos de idade, apesar de extensa terapia fonoaudiológica. |
| 23 | Mikic et al.22 | M | 1 ano | NI | AutismoNão informado se pré ou pós‐implante | Entre 2008 e 2009 | Categories of Auditory Performance (CAP); Speech Intelligibility Rating (SIR) | O processamento auditivo desenvolveu‐se lentamente. Conseguia identificar sons ambientais ou discriminar sons da fala, com pouquíssima evolução até os seis anos de idade, apesar de extensa terapia fonoaudiológica. |
| 24 | Valero et al.23 | F | 2,10 anos | Nenhuma | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Percepção de fala de não usuário, sem vocalização, não usuário de IC, comunicação de sinais |
| 25 | Valero et al.23 | M | 1,10 ano | Nenhuma | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação / reconhecimento de palavrasAlgumas vocalizações (consoantes, vogais, sons nasais) Usuário de IC Alguma vocalização e Comunicação por PECS (Picture Exchange Communication System). |
| 26 | Valero et al.23 | M | 3,8 anos | Nenhuma | Espectro Autista,pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Compreende conversas, Capaz de produzir frases,Usuário de CI,Comunicação Oral |
| 27 | Valero et al.23 | M | 2,4 anos | Nenhuma | Espectro Autista,pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação / reconhecimento de palavrasSomente palavrasUsuário de CIComunicação por palavras |
| 28 | Valero et al.23 | M | 1 ano | Nenhuma | Espectro Autista,pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação / reconhecimento de frases simples (duas palavras) e comandos,Apenas palavras,Usuário de CI,Usa palavras, canta e comunicação por PECS (Picture Exchange Communication System) |
| 29 | Valero et al.23 | M | 1,10 anos | Nenhuma | Transtornos invasivos do desenvolvimento sem outra especificação (TID‐SOE) pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Percepção de fala de não usuário, sem vocalização, não usuário de IC, sem comunicação |
| 30 | Lachowska et al.24 | M | 1,9 anos | Nenhuma | AutismoPós‐implante | NI | Histórico médico,Reação à música e som, teste de seis sons de Ling,Teste de palavras onomatopaicas,Reação ao nome falado da criança,Resposta a pedidos, questionário dado aos pais,Sessões de adaptação do processador de som e dados | Reação à música: Não, teste de 6 sons de Ling: NãoReação ao nome falado: Não, Resposta a pedido falado: Não, Resposta ao nome: Não, Resposta a sons ambientais: Não, Mudanças de comportamento: Nenhuma, Melhores interações familiares: Sim |
| 31 | Lachowska et al.24 | M | 2,5 anos | Nenhuma | AutismoPós‐implante | NI | Histórico médico,Reação à música e som, teste de seis sons de Ling,Teste de palavras onomatopaicas,Reação ao nome falado da criança,Resposta a pedidos, questionário dado aos pais,Sessões de adaptação do processador de som e dados | Reação à música: Sim (apenas ao tambor), teste de 6 sons de Ling: Não,Reação ao nome falado: Não, Resposta a pedido falado: Não, Resposta ao nome: Não, Resposta a sons ambientais: Não, Mudanças de comportamento: Nenhuma, Melhores interações familiares: Sim |
| 32 | Lachowska et al.24 | M | 1,9 anos | Nenhuma | AutismoPós‐implante | U | Histórico médico,Reação à música e som, teste de seis sons de Ling,Teste de palavras onomatopaicas,Reação ao nome falado da criança,Resposta a pedidos, questionário dado aos pais,Sessões de adaptação do processador de som e dados | Reação à música: Sim (apenas ao tambor), teste de 6 sons de Ling: Não,Reação ao nome falado: Não, Resposta a pedido falado: Não, Resposta ao nome: Não, Resposta a sons ambientais: Não, Mudanças de comportamento: redução da ansiedade,Melhores interações familiares: Sim |
| 33 | Lachowska et al.24 | M | 1,9 anos | Nenhuma | AutismoPós‐implante | NI | Histórico médico,Reação à música e som, teste de seis sons de Ling,Teste de palavras onomatopaicas,Reação ao nome falado da criança,Resposta a pedidos, questionário dado aos pais,Sessões de adaptação do processador de som e dados | Reação à música: Sim (apenas para flauta e tambor), teste de 6 sons de Ling: Não,Reação ao nome falado: Não, Resposta ao pedido falado: Não, Resposta ao nome: Sim, Resposta a sons ambientais: Sim, Mudanças de comportamento: redução da ansiedade,Melhores interações familiares: Sim |
| 34 | Lachowska et al.24 | M | 1,3 anos | Nenhuma | AutismoPós‐implante | NI | Histórico médico,Reação à música e som, teste de seis sons de Ling,Teste de palavras onomatopaicas,Reação ao nome falado da criança,Resposta a pedidos, questionário dado aos pais,Sessões de adaptação do processador de som e dados | Reação à música: Sim, teste de 6 sons de Ling: Sim, Reação ao nome falado: Sim, Resposta à solicitação falada: Sim, Resposta ao nome: Sim, Resposta aos sons ambientais: Sim, Mudanças de comportamento: redução da ansiedade,Melhores interações familiares: Sim |
| 35 | Lachowska et al.24 | M | 2,2 anos | Nenhuma | AutismoPós‐implante | NI | Histórico médico,Reação à música e som, teste de seis sons de Ling,Teste de palavras onomatopaicas,Reação ao nome falado da criança,Resposta a pedidos, questionário dado aos pais,Sessões de adaptação do processador de som e dados | Reação à música: Sim, teste de 6 sons de Ling: Sim, Reação ao nome falado: Sim, Resposta à solicitação falada: Sim,Resposta ao nome: Sim,Resposta a sons ambientais: Sim, mudanças de comportamento: redução da ansiedade,Melhores interações familiares: Sim |
F, Feminino; M, Masculino; NI, Não informado.
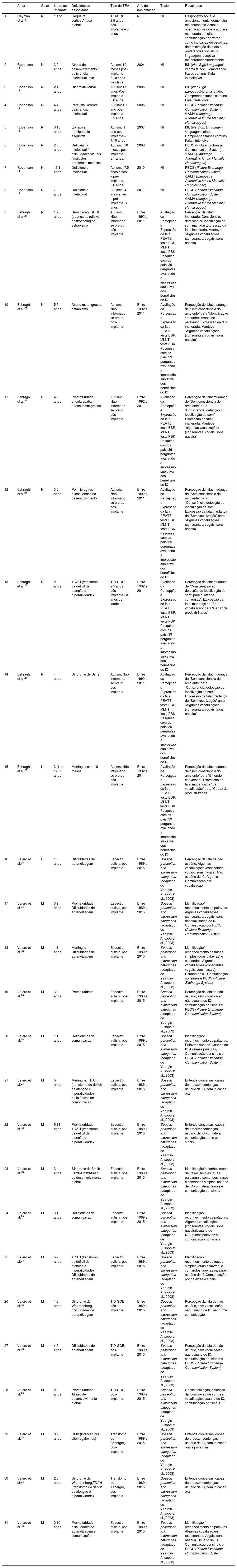
Dados demográficos e detalhes do implante em pacientes com Transtorno do Espectro Autista e perda auditiva com implante coclear e outras deficiências associadas
| Autor | Sexo | Idade ao implante | Deficiências associadas | Tipo de TEA | Ano de implantação | Teste | Resultados | |
|---|---|---|---|---|---|---|---|---|
| 1 | Hayman et al.20 | NI | 1 ano | Cegueira corticalAtraso global | TID‐SOE 2,5 anos pós‐implante – 3 anos | NI | NI | Responsivo social e emocionalmente, demonstra melhorcontato visual e orientação, resposta auditiva melhorada e melhor comunicação não verbal, como indicação de escolhas, demonstração de afeto e preferências sociais, a linguagem receptiva melhorouacentuadamente |
| 2 | Robertson 11 | NI | 3,2 anos | Atraso de desenvolvimento / deficiência intelectual leve | Autismo10 meses pós‐implante ‐ 3,10 anos de idade | 2004 | NI | ISL (Irish Sign Language)/ idioma falado. Compreende frases comuns. Fala ininteligível |
| 3 | Robertson 11 | NI | 2,4 anos | Dispraxia verbal | Autismo1,2 anos Pós‐implante ‐ 3,6 anos | 2005 | NI | ISL (Irish Sign Language)/idioma falado. Compreende frases comuns. Fala ininteligível |
| 4 | Robertson 11 | NI | 4,4 anos | Paralisia Cerebral / deficiência intelectual | Autismo1,1 ano pós‐implante – 5,5 anos) | 2005 | NI | PECS (Picture Exchange Communication System) /LAMH (Language Alternative for the Mentally Handicapped) |
| 5 | Robertson 11 | NI | 3,10 anos | Epilepsia, hemiparesia esquerda | Autismo 1 ano pós‐implante – 4,10 anos | 2007 | NI | ISL (Iris Sign. Linguagem) /linguagem falada. Compreende frases comuns. Fala ininteligível |
| 6 | Robertson 11 | NI | 2,3 anos | Deficiência intelectual / dificuldades visuais / múltiplos problemas médicos | Autismo, 10 meses pós‐implante –3,1 anos. | 2009 | NI | PECS (Picture Exchange Communication System) /LAMH (Language Alternative for the Mentally Handicapped) |
| 7 | Robertson 11 | NI | 13,1 anos | Deficiência intelectual | Autismo, 7,5 anos antes – pré‐implante, 5,6 anos. | 2010 | NI | PECS (Picture Exchange Communication System) /LAMH (Language Alternative for the Mentally Handicapped) |
| 8 | Robertson 11 | NI | 7 anos | Deficiência intelectual | Autismo, 4 anos antes – pré‐implante, 3 anos | 2011 | NI | PECS (Picture Exchange Communication System) /LAMH (Language Alternative for the Mentally Handicapped) |
| 9 | Eshraghi et al.21 | NI | 1,75 anos | Ruminação, DRGE (doença do refluxo gastroesofágico), estrabismo | Autismo Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção da fala: inalterada. Consciência, detecção ou localização do som mantidasExpressão da fala: inalterada. Manteve “Algumas vocalizações (consoantes, vogais, sons nasais)” |
| 10 | Eshraghi et al.21 | NI | 5,5 anos | Atraso motor grosso, estrabismo | Autismo Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala, PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção de fala: mudança de “Sem consciência do ambiente” para “Identificação / reconhecimento de palavras”. Expressão da fala: inalterada. Manteve “Algumas vocalizações (consoantes, vogais, sons nasais)” |
| 11 | Eshraghi et al.21 | U | 4,5 anos | Prematuridade, encefalopatia, atraso motor grosso | Autismo Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala, PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção da fala: mudança de “Sem consciência do ambiente” para “Consciência, detecção ou localização de som”. Expressão da fala: inalterada. Manteve “algumas vocalizações (consoantes, vogais, sons nasais)” |
| 12 | Eshraghi et al.21 | NI | 3,5 anos | Polimicrogiria, gliose, atraso no desenvolvimento | Autismo Não informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala, PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção de fala: mudança de “Sem consciência do ambiente” para “Consciência, detecção ou localização de som”. Expressão da fala: mudança de “Sem vocalização” para “Algumas vocalizações (consoantes, vogais, sons nasais)” |
| 13 | Eshraghi et al.21 | NI | 2 anos | TDAH (transtorno de déficit de atenção e hiperatividade) | TID‐SOE 2,5 anos pós‐implante ‐ 3 anos de idade | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala, PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção da fala: mudança de “Conscientização, detecção ou localização de som” para “Entende conversas”. Expressão da fala: mudança de “Sem vocalização” para “Capaz de produzir frases” |
| 14 | Eshraghi et al.21 | NI | 4 anos | Síndrome de Usher | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala, PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção da fala: mudança de “Sem consciência do ambiente” para “Consciência, detecção ou localização de som”. Expressão da fala: mudança de “Sem vocalização” para “Algumas vocalizações (consoantes, vogais, sons nasais)” |
| 15 | Eshraghi et al.21 | NI | 3 (1) e 12 (2) anos | Meningite com 18 meses | AutismoNão informado se pré ou pós‐implante | Entre 1992 e 2011 | Avaliação da Percepção e Expressão da fala, PEATE, teste ESP, MLNT, teste PBK Pesquisa com os pais: 39 perguntas avaliando a impressão subjetiva dos benefícios do IC | Percepção da fala: mudança de “Sem consciência do ambiente” para “Entende conversas”. Expressão da fala: mudança de “Sem vocalização” para “Capaz de produzir frases” |
| 16 | Valero et al.23 | F | 1,8 anos | Dificuldades de aprendizagem | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Percepção da fala de não usuário, Algumas vocalizações (consoantes, vogais, sons nasais). Não usuário de IC. Alguma Comunicação por vocalização |
| 17 | Valero et al.23 | M | 3,2 anos | Prematuridade Dificuldades de aprendizagem | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação/ reconhecimento de palavras. Algumas vocalizações (consoantes, vogais, sons nasais)Usuário de IC, Comunicação por PECS (Picture Exchange Communication System) |
| 18 | Valero et al.23 | M | 1,8 anos | Meningite Dificuldades de aprendizagem | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação/ reconhecimento de frases simples (duas palavras) e comandos; Algumas vocalizações (consoantes, vogais, sons nasais). Usuário de IC. Comunicação por sinais e PECS (Picture Exchange System) |
| 19 | Valero et al.23 | M | 3,9 anos | Prematuridade | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Percepção da fala de não usuário, sem vocalização, não usuário de IC, comunicação por sinais e PECS (Picture Exchange Communication System) |
| 20 | Valero et al.23 | M | 1,10 anos | Deficiências de comunicação | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação/ reconhecimento de palavras. Palavras apenas. Usuário de IC Algumas palavras, Comunicação por sinais e PECS (Picture Exchange Communication System) |
| 21 | Valero et al.23 | M | 5 anos | Meningite, TDAH (transtorno de déficit de atenção e hiperatividade), deficiências de comunicação | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Entende conversas, capaz de produzir sentenças, usuário de IC, comunicação oral |
| 22 | Valero et al.23 | M | 6,11 anos | Prematuridade, TDAH (transtorno de déficit de atenção e hiperatividade) | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Entende conversas, capaz de produzir sentenças, usuário de IC ‐ unilateral, comunicação oral e por sinais |
| 23 | Valero et al.23 | M | 3 anos | Síndrome de Smith‐Lemli‐OpitzAtraso de desenvolvimento global | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação/reconhecimento de frases simples (duas palavras) e comandos, frases e comandos simples, usuário de IC ‐ unilateral, frases e comunicação por sinais |
| 24 | Valero et al.23 | M | 3,1 anos | Deficiências de comunicação | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação / reconhecimento de palavras. Algumas vocalizações (consoantes, vogais, sons nasais)Usuário de ICAlgumas palavras e comunicação por sinais |
| 25 | Valero et al.23 | M | 5,2 anos | TDAH (transtorno de déficit de atenção e hiperatividade) Dificuldades de aprendizagem | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação / reconhecimento de frases simples (duas palavras) e comandos, apenas palavras, usuário de IC,Comunicação por palavras e sinais |
| 26 | Valero et al.23 | M | 1,3 anos | Síndrome de Waardenberg, dificuldades de aprendizagem | TID‐SOE pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Percepção da fala de não usuário, sem vocalização, não usuário de IC, nenhuma comunicação |
| 27 | Valero et al.23 | M | 4,6 anos | Dificuldades de aprendizagem | TID‐SOE, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Percepção da fala do não usuário, sem vocalização, não usuário de IC, comunicação por sinais e PECS (Picture Exchange Communication System) |
| 28 | Valero et al.23 | M | 2,8 anos | Prematuridade Atraso de desenvolvimento global | TID‐SOE, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Conscientização, detecção da localização de som, sem vocalização, usuário de IC, comunicação por sinais |
| 29 | Valero et al.23 | M | 8,2 anos | CMV (Infecção por citomegalovírus) | Transtorno de Asperger, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Entende conversas, capaz de produzir sentenças, usuário de IC, comunicação oral e por sinais |
| 30 | Valero et al.23 | M | 2,8 anos | Síndrome de Waardenburg,TDAH (transtorno de déficit de atenção e hiperatividade) | Transtorno de Asperger, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Entende conversas, capaz de produzir sentenças, usuário de IC, comunicação oral |
| 31 | Valero et al.23 | M | 2,10 anos | Prematuridade, dificuldades de aprendizagem e comunicação | Espectro autista, pós‐implante | Entre 1989 e 2015 | Speech perception and expression categories (adaptado de Yeargin‐Alisopp et al., 2003) | Identificação / reconhecimento de palavras. Algumas vocalizações (consoantes, vogais, sons nasais). Usuário de IC. Comunicação por sinais e PECS (Picture Exchange Communication System) |
F, Feminino; M, Masculino; NI, Não informado. TID‐SOE, Transtornos invasivos do desenvolvimento sem outra especificação.
Entre os 35 pacientes com TEA e perda auditiva sem outras deficiências associadas, 6 (17%) não estabeleceram forma de comunicação. No entanto, houve uma melhoria na interação com os parentes. Seis (17%) não desenvolveram comunicação oral – entretanto, usavam comunicação em linguagem de sinais avançada ou comunicação alternativa (imagens). Além disso, 9 (26%) indivíduos demonstraram reconhecimento de comandos verbais simples e falaram frases simples; e 14 (40%) desenvolveram linguagem e comunicação oral fluentes.
Entre os 31 pacientes que, além de TEA e hipoacusia, apresentavam outras deficiências, 15 (48%) não desenvolveram comunicação oral. Esses indivíduos se comunicavam através de linguagem de sinais ou comunicação alternativa por imagens. Doze pacientes (39%) demonstraram reconhecimento de comandos verbais únicos e palavras simples vocalizadas. Além disso, quatro pacientes (13%) estabeleceram comunicação oral de forma simplificada após o uso do IC.
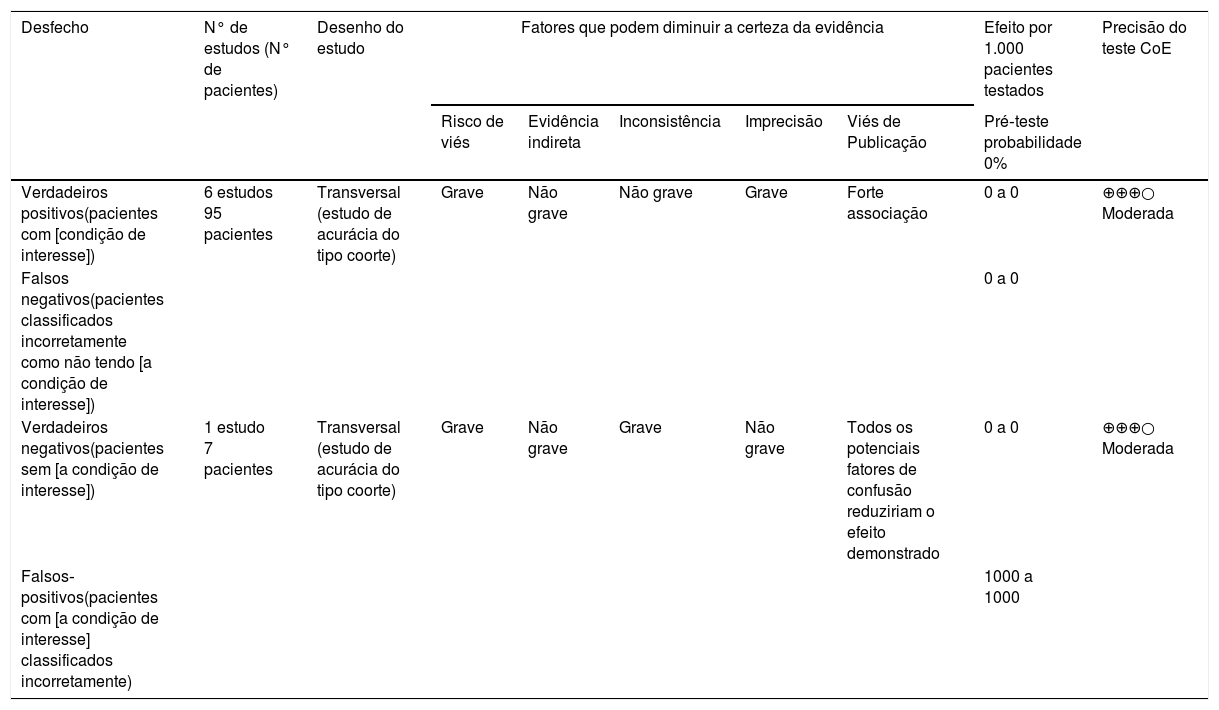
Todos os sete artigos foram analisados de acordo com o Grades of Recommendation, Assessment, Development, and Evaluation (GRADEpro)25,26 (tabela 7).
Analisados de acordo com Grades of Recommendation, Assessment, Development, and Evaluation (Grader)
| Desfecho | N° de estudos (N° de pacientes) | Desenho do estudo | Fatores que podem diminuir a certeza da evidência | Efeito por 1.000 pacientes testados | Precisão do teste CoE | ||||
|---|---|---|---|---|---|---|---|---|---|
| Risco de viés | Evidência indireta | Inconsistência | Imprecisão | Viés de Publicação | Pré‐teste probabilidade 0% | ||||
| Verdadeiros positivos(pacientes com [condição de interesse]) | 6 estudos 95 pacientes | Transversal (estudo de acurácia do tipo coorte) | Grave | Não grave | Não grave | Grave | Forte associação | 0 a 0 | ⊕⊕⊕○ Moderada |
| Falsos negativos(pacientes classificados incorretamente como não tendo [a condição de interesse]) | 0 a 0 | ||||||||
| Verdadeiros negativos(pacientes sem [a condição de interesse]) | 1 estudo 7 pacientes | Transversal (estudo de acurácia do tipo coorte) | Grave | Não grave | Grave | Não grave | Todos os potenciais fatores de confusão reduziriam o efeito demonstrado | 0 a 0 | ⊕⊕⊕○ Moderada |
| Falsos‐positivos(pacientes com [a condição de interesse] classificados incorretamente) | 1000 a 1000 | ||||||||
Como mostrado na tabela 7, dos sete artigos analisados nesta RS, 6 tinham um desenho de estudo transversal (estudo de acurácia do tipo coorte) com um N total de 95 pacientes e apresentaram qualidade de evidência pela avaliação do sistema GRADE moderado. Apesar de ter um desenho de estudo transversal (estudo de acurácia do tipo coorte), um dos artigos não avaliou seus sete pacientes com os mesmos critérios usados pelos demais autores. Porém, apresentou resultados semelhantes aos demais estudos com qualidade de evidência moderada pela avaliação do sistema GRADE.
DiscussãoA revisão sistemática do JBI começa com um modelo de saúde baseado em evidências que se concentra nas melhores informações disponíveis e não se preocupa exclusivamente com a eficácia. O modelo é adaptável às diversas origens dos problemas de saúde e usa diversas metodologias de pesquisa para gerar evidências relacionadas ao assunto. O JBI acredita que os profissionais de saúde precisam de evidências para apoiar uma ampla gama de atividades e intervenções e, ao tomar decisões clínicas, devem considerar se sua abordagem é viável, apropriada, significativa e eficaz. Os instrumentos usados para avaliar o viés foram listas de verificação de avaliação crítica validadas pelo JBI para cada desenho de estudo: estudos de coorte e estudos que relatam dados de prevalência e relatos de caso. Quatro artigos11,20–22 mostraram um baixo risco de viés e três artigos19,23,24 mostraram um risco moderado de viés. Essas informações corroboram a sinalização da qualidade satisfatória dos estudos encontrados.
Esta RS mostrou que nem todos os indivíduos com TEA e perda auditiva associada que fizeram implante coclear desenvolveram comunicação oral. No entanto, a intervenção demonstrou outros benefícios, como melhoria na interação com os parentes, estabelecimento de contato visual com mais frequência e identificação de sons. Os resultados corroboram os achados de estudos anteriores de que os ganhos das crianças foram pequenos em comparação com a população geral que recebeu o IC; entretanto, as crianças mostraram progresso de desenvolvimento na comparação das avaliações pré e pós‐cirúrgicas.19
A comunicação oral não é um metateste realista em crianças com TEA e implantes cocleares. Entretanto, as crianças obtiveram vários benefícios funcionais que os métodos tradicionais de avaliação dos resultados de implantes cocleares em crianças com autismo geralmente são insuficientes para avaliar completamente.24 Portanto, estudos futuros que avaliem o impacto do IC em crianças com TEA precisam expandir os critérios de sucesso e avaliar as habilidades de desenvolvimento total do indivíduo, em vez de critérios restritos focados apenas na aquisição de comunicação oral. Essa nova abordagem vai melhorar as recomendações de intervenção em IC, considerando o bem‐estar e a qualidade de vida das crianças.
Estudos argumentam que a documentação objetiva de mudanças de desempenho pode ser difícil ou impossível para algumas crianças com TEA. Nesses casos, os autores argumentaram que relatos subjetivos de pais e profissionais que indicaram que o implante teve um efeito positivo na criança e na família podem ser a única medida de sucesso no qual se pode confiar.20 Nesta RS, 21 pacientes – 31,8% – não estabeleceram qualquer forma de comunicação tradicional. Porém, houve um aumento na interação com os parentes. Essa condição é mais presente nos casos de TEA e deficiência auditiva que tinham outras deficiências. Esses dados exemplificam que o desenvolvimento da interação social pode passar despercebido nas avaliações tradicionais, mas estar presente nos relatos de parentes, cuidadores e profissionais que acompanham o desenvolvimento dessas crianças. Essa informação reforça a possibilidade de que pacientes com TEA e perda auditiva submetidos ao implante coclear ampliam outras habilidades de comunicação, mesmo que não desenvolvam a comunicação oral.
Quarenta e um (62%) dos participantes dos artigos selecionados foram diagnosticados com TEA após o IC. A média de idade do IC foi de 2,9 anos para os indivíduos sem outras alterações e 3,76 anos para aqueles com outras deficiências associadas. Não foi possível determinar a média de idade para o diagnóstico de TEA, pois a maioria dos estudos não apresentava essa informação.
Há um esforço mundial para aumentar o diagnóstico precoce da perda auditiva neurossensorial e a intervenção com IC em uma idade cada vez menor. No Brasil, a cobertura da triagem auditiva neonatal mostra um aumento de 9,3% para 37,2% de 2008 a 2015. Embora tenha ocorrido um aumento significativo da cobertura da triagem auditiva neonatal no Brasil nos últimos anos, a cobertura nacional ainda é baixa (37,2%) e muito inferior à preconizada na literatura. Além disso, no Brasil, há uma desigualdade inter‐regional nas taxas de cobertura da triagem auditiva neonatal. As regiões Sul e Sudeste concentram os melhores índices, enquanto as regiões Norte, Nordeste e Centro‐Oeste precisam de mais esforços para implantação dos programas de Triagem Auditiva Neonatal.27
O diagnóstico de TEA geralmente é feito posteriormente, considerando o processo de diagnóstico de exclusão.11 Estudos anteriores observaram que o tempo médio entre a implantação e o diagnóstico de autismo foi de 19 meses para a maioria dos participantes e aproximadamente dois anos após o IC.21,23 No presente estudo, 31 indivíduos (46,3%) tiveram alguma outra deficiência associada, como: cegueira cortical, atraso global, atraso do desenvolvimento, deficiência intelectual, paralisia cerebral, epilepsia, hemiparesia esquerda, dificuldade visual, prematuridade, encefalopatia, retardo motor importante, polimicrogiria, gliose, atraso do desenvolvimento. Achados semelhantes foram relatados anteriormente, indicaram que o TEA pode ser parte de um quadro mais amplo de deficiência múltipla.11,20,21,23 O desenvolvimento da linguagem e da comunicação oral pode não ser uma meta realista para esse público. Há uma grande chance de que haja outras deficiências associadas a essas condições que podem agravar o desenvolvimento da linguagem e da comunicação oral. São necessárias pesquisas que busquem instrumentos que possam medir de forma mais sensível o desenvolvimento de indivíduos com TEA e surdez que receberam IC.
Considerando a qualidade das evidências analisadas pelo Sistema GRADE, os resultados sugerem que o IC favorece a linguagem expressiva e receptiva de pessoas com TEA grave e/ou com perda auditiva profunda, mesmo que não desenvolvam a linguagem na mesma proporção que indivíduos que usam IC sem TEA, apesar de um dos estudos não seguir a mesma linha de resultados dos outros selecionados. Assim, existe uma recomendação para IC em pacientes com TEA que apresentam perda auditiva severa e/ou profunda associada.
Pontos fortes e limitaçõesAs limitações desta RS foram a reduzida disponibilidade de artigos que atendessem a todos os critérios de inclusão e exclusão da questão de pesquisa e a diversidade de metodologias, medidas e critérios de avaliação usados nos artigos encontrados. Esses fatos impossibilitaram a elaboração da metanálise devido à falta de padronização.
Como estratégia para superar essas limitações, foi apresentada uma descrição detalhada dos sujeitos do estudo, permite uma discussão qualificada dos dados com a literatura pesquisada. A falta de uniformidade nos testes de avaliação de desempenho dos sujeitos após o IC e a diversidade na apresentação dos resultados dificultaram a compreensão da evolução da comunicação, da interação social de forma satisfatória e dos padrões de comportamento restritos, repetitivos e estereotipados.
ConclusãoEssa RS mostrou que o IC pode favorecer o desenvolvimento auditivo, a linguagem e a interação social em crianças com transtorno do espectro autista (TEA) com perda auditiva severa e/ou profunda associada.
Como estratégia para superar as limitações encontradas na elaboração desta RS e avançar na área, estudos futuros devem buscar formas de avaliar o desenvolvimento qualitativo da comunicação em indivíduos com TEA e deficiência auditiva submetidos ao IC. Os protocolos de pesquisa devem considerar a percepção dos parentes, cuidadores e profissionais que acompanham o desenvolvimento dessas crianças. No entanto, os protocolos devem ser padronizados para permitir a comparação dos resultados em diferentes amostras.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Tavares FS, Azevedo YJ, Fernandes LM, Takeuti A, Pereira LV, Ledesma AL, et al. Cochlear implant in patients with autistic spectrum disorder – a systematic review. Braz J Otorhinolaryngol. 2021;87:601–19.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.