Recently it has been reported that a high preoperative neutrophil–lymphocyte ratio and platelet–lymphocyte ratio may be related to increased recurrence risk, tumor aggressiveness, and worsened prognosis in various malignancies.
ObjectiveThe objective of this research is to explore whether neutrophil–lymphocyte ratio and platelet–lymphocyte ratio in parotid tumors may or may not be used as a cancer marker.
MethodsThis retrospective research has been conducted on a total of 228 patients consisting of 83 healthy persons and 145 patients with a mass in the parotid gland, who applied to a tertiary referral center and underwent surgery. Patients have been divided into two groups by their histopathological findings as malignant or benign parotid tumor. A third group consisting of healthy people has been defined as the control group. Also the malignant parotid tumor group has been divided into two subgroups as early stage and advanced stage. The groups have been compared in terms of neutrophil–lymphocyte ratio, platelet–lymphocyte ratio and other laboratory data.
ResultsThe average neutrophil–lymphocyte ratio values of malignant parotid tumor, benign parotid tumor, healthy control groups were 2.51, 2.01, 1.79 respectively and the difference was statistically significant (p<0.001). There was no significant difference between advanced stage and early stage parotid tumor groups in terms of average neutrophil–lymphocyte ratio value (p=0.782). In dual comparisons, the platelet–lymphocyte ratio value of patients in the malignant group was found out to be statistically significantly higher than that of benign and control groups (p<0.001 and p=0.001 respectively).
ConclusionTo the best of our knowledge our research is the first in the medical literature comparing neutrophil–lymphocyte ratio and platelet–lymphocyte ratio in patients with parotid tumor. neutrophil–lymphocyte ratio and platelet–lymphocyte ratio can serve as cost‐effective, repeatable, easily accessible, and helpful inflammatory markers in order to distinguish patients with malignant parotid tumor from healthy people.
Recentemente, tem sido relatado que as relações neutrófilo‐linfócito e plaqueta‐linfócito aumentadas no pré‐operatório podem estar relacionadas ao aumento do risco de recorrência e agressividade do tumor e pior prognóstico em várias neoplasias malignas.
ObjetivoInvestigar se as relações neutrófilo‐linfócito e plaqueta‐linfócito em tumores da parótida podem ou não serem utilizadas como marcadores de câncer.
MétodoEsta pesquisa retrospectiva foi conduzida com 228 indivíduos, 83 saudáveis e 145 com tumor de parótida, os quais foram encaminhados a um centro de referência terciária e operados. Os pacientes foram divididos em dois grupos de acordo com os achados histopatológicos de malignidade e benignidade. O terceiro grupo foi composto por indivíduos saudáveis, foi definido como o grupo controle. Além disso, o grupo com tumores malignos da parótida foi dividido em dois subgrupos, um com pacientes em estágio inicial da doença e o outro com pacientes em estágio avançado. Os grupos foram comparados em termos das relações neutrófilo‐linfócito e plaqueta‐linfócito e outros dados laboratoriais.
ResultadosOs valores médios da relação neutrófilo‐linfócito do tumor maligno de parótida, do tumor benigno de parótida e do grupo controle foram de 2,51, 2,01 e 1,79, respectivamente, com uma diferença estatisticamente significante (p <0,001). Não houve diferença estatística entre os grupos em estágio avançado e em estágio inicial em termos de valor médio da relação neutrófilo‐linfócito (p=0,782). Em comparações duplas, o valor da relação plaqueta‐linfócito dos pacientes do grupo do grupo com tumor maligno foi estatisticamente maior do que nos grupos com tumor benigno e controle (p <0,001 e p=0,001, respectivamente).
ConclusãoQue seja de nosso conhecimento, nosso estudo é o primeiro na literatura médica a comparar a relação neutrófilo‐linfócito e a relação plaqueta‐linfócito em pacientes com tumor de parótida. As relações neutrófilo‐linfócito e plaqueta‐linfócito podem servir como marcadores inflamatórios de baixo custo, reproduzíveis, de fácil acesso e úteis, a fim de distinguir os pacientes com tumor maligno de parótida de pessoas saudáveis.
Todas as células da resposta imune são formadas a partir da diferenciação das células‐tronco hematopoiéticas pluripotentes da medula óssea. A célula progenitora mieloide comum, que é uma célula precursora inicial, diferencia‐se primeiro em células do tipo granulócitos/macrófagos e subsequentemente em células dendríticas, granulócitos (neutrófilos, eosinófilos, basófilos e mastócitos); as células do tipo monócitos/macrófagos estão incluídas em vários estágios de diferenciação na imunidade natural. A resposta imunológica desencadeada contra vários componentes e a estrutura antigênica de microrganismos e células tumorais pode proteger o organismo ou causar resultados prejudiciais.1
Neutrófilos e trombócitos fornecem fatores de crescimento angiogênico, epitelial e estromal que causam a progressão do tumor.2,3 Portanto, a combinação de neutrófilos, trombócitos e linfócitos, que são marcadores inflamatórios do hospedeiro, é considerada um fator prognóstico independente em diferentes neoplasias malignas.4,5 Vários estudos demonstraram que a proteína C‐reativa (PCR), nível de albumina, relação neutrófilo‐linfócito (RNL) e relação plaqueta‐linfócito (RPL) estão relacionados com os estágios do câncer e acredita‐se que são o resultado da resposta imune causada pelas células cancerígenas.4‐10 Atualmente, presume‐se que a reação inflamatória do hospedeiro contra o tumor e a inflamação causada indiretamente pelo tumor aumentam a angiogênese danificam o DNA e facilitam a proliferação de tumores e metástases ao evitar a apoptose.11
Os tumores de glândulas salivares são observados em 3% a 10% dos cânceres de cabeça e pescoço. O mais comum deles é o de parótida, com um percentual de 80%.12‐14 Embora pesquisas sugiram que a RNL pode ser usada como biomarcador de malignidade do câncer de glândula salivar, não há estudo direcionado exclusivamente para os tumores da parótida. Portanto, em nosso estudo, procuramos explorar a utilidade da RNL e da RPL pré‐operatórias como marcadores de previsão de malignidade em tumores da parótida.
MétodoEsta pesquisa foi aprovada pelo comitê de ética local e foi conduzida de acordo com os princípios éticos da Declaração de Helsinque (projeto n° E‐18‐1838). O estudo incluiu 179 pacientes de 18 a 80 anos submetidos à cirurgia para remoção de tumor da parótida em nossa clínica entre janeiro de 2010 e janeiro de 2018. Examinamos os prontuários dos pacientes, retrospectivamente, para obtenção de dados clínicos, histopatológicos e laboratoriais. Foram analisados: RNL pré‐operatória, volume plaquetário médio (VPM), amplitude de distribuição de plaquetas (PDW), contagem total de leucócitos (WBC, do inglês white blood cells), contagem de plaquetas, neutrófilos e linfócitos e características demográficas e dados histopatológicos dos pacientes. Pacientes com doenças infecciosas inflamatórias, autoimunes, agudas ou crônicas, distúrbios hematológicos, diabetes, hipertensão, apneia obstrutiva do sono, histórico de corticoterapia ou insuficiência renal crônica foram excluídos da pesquisa (34 pacientes).
Dados do hemograma completo foram coletados na semana anterior à cirurgia de parotidectomia, antes de os pacientes receberem qualquer tratamento. A RNL foi calculada como uma razão simples entre a contagem absoluta de neutrófilos e a contagem absoluta de linfócitos. Um contador automático de células sanguíneas (Beckman Coulter Analyzer, Califórnia, EUA) foi usado para o hemograma completo (CBC, do inglês complete blood count). As análises do CBC foram feitas duas horas após a coleta do sangue venoso.
Os pacientes incluídos na pesquisa foram divididos em três grupos. O primeiro foi composto por pacientes com diagnóstico de doença maligna da parótida, o segundo por pacientes com diagnóstico de tumor benigno da parótida e o terceiro por pessoas de idade e gênero semelhantes atendidas no departamento de otorrinolaringologia do nosso hospital para check‐up, sem quaisquer queixas ou distúrbios adicionais. Além disso, com base nas observações da cirurgia e prontuário clínico detalhado, os pacientes com diagnóstico de tumor maligno da parótida foram divididos em dois grupos: um composto por pacientes no estágio inicial da doença e outro por pacientes no estágio avançado, de acordo com o American Joint Committee on Cancer (AJCC) TNM‐8. Os dados do CBC foram comparados entre os grupos.15
O programa Statistical Package for the Social Sciences for Windows, versão 21.0 (SPSS, Chicago, IL, EUA) foi usado para análise estatística. Os dados descritivos foram expressos como média ±desvio‐padrão, números e porcentagens. O teste de análise de variância unidirecional (ANOVA One‐Way) foi usado para determinar se havia diferença entre os grupos ou não. O teste t para amostras independentes foi usado para determinar as diferenças entre os grupos; o valor de p <0,05 foi aceito como estatisticamente significativo.
ResultadosNo primeiro grupo havia 42 pacientes com tumor maligno de parótida, 22 deles (52%) eram do sexo masculino e 20 (48%) do feminino. No segundo grupo, havia 103 pacientes com diagnóstico de tumor benigno da parótida, 53 deles (51%) eram do sexo masculino e 50 (49%) do feminino. O terceiro grupo (grupo controle) incluiu 83 pessoas, 42 (51%) do sexo masculino e 41 (49%) do feminino. Foram incluídos na pesquisa 228 pacientes. A idade média nos grupos com tumor maligno, benigno e grupo controle foi de 54,3, 50,6, 49,66 anos, respectivamente. Não houve diferença estatisticamente significante entre os grupos em relação à idade (p <0,05)
Os tipos de tumores malignos e benignos da parótida são mostrados na tabela 1.
Distribuição dos tipos histológicos de tumores da glândula parótida benignos e malignos
| Benigno | Paciente (n) | Maligno | Paciente (n) |
|---|---|---|---|
| Adenoma pleomórfico | 58 | Carcinoma mucoepidermoide de alto grau | 6 |
| Tumor de Warthin | 33 | Carcinoma mucoepidermóide de baixo grau | 11 |
| Adenoma basocelular | 5 | Carcinoma adenoide cístico | 3 |
| Mioepitelioma | 5 | Carcinoma de células acinares | 3 |
| Oncocitoma | 2 | Carcinoma ex‐adenoma pleomórfico | 2 |
| Carcinoma de ducto salivar | 3 | ||
| Carcinoma de células escamosas | 13 | ||
| Carcinoma mioepitelial | 1 | ||
| Total | 103 | 42 |
O estadiamento dos tumores no grupo de pacientes malignos foi o seguinte: 11 (26,1%) apresentavam tumores no estágio T1, 14 (33,3%) no T2, 11 (26,1%) no T3 e 6 (14,5%) no T4. Vinte e cinco (40,4%) pacientes estavam no estágio inicial (estágios 1–2) e 17 (59,6%) apresentavam câncer em estágio avançado (estágios 3–4).
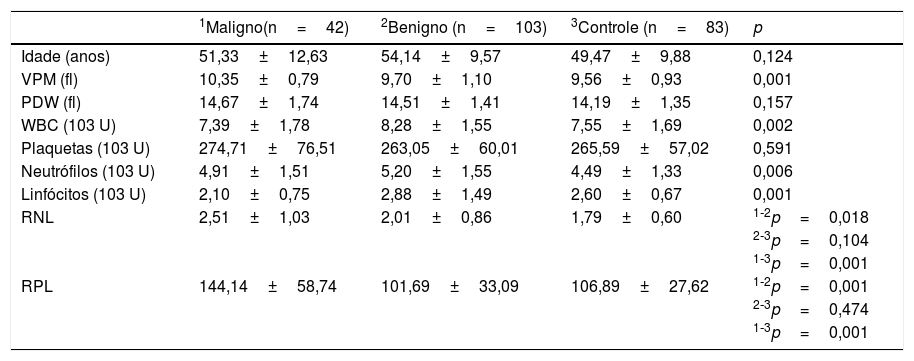
A comparação dos dados do CBC entre os grupos com tumores malignos, benignos e o grupo controle é mostrada na tabela 2.
Características demográficas e variáveis estudadas nos grupos
| 1Maligno(n=42) | 2Benigno (n=103) | 3Controle (n=83) | p | |
|---|---|---|---|---|
| Idade (anos) | 51,33±12,63 | 54,14±9,57 | 49,47±9,88 | 0,124 |
| VPM (fl) | 10,35±0,79 | 9,70±1,10 | 9,56±0,93 | 0,001 |
| PDW (fl) | 14,67±1,74 | 14,51±1,41 | 14,19±1,35 | 0,157 |
| WBC (103 U) | 7,39±1,78 | 8,28±1,55 | 7,55±1,69 | 0,002 |
| Plaquetas (103 U) | 274,71±76,51 | 263,05±60,01 | 265,59±57,02 | 0,591 |
| Neutrófilos (103 U) | 4,91±1,51 | 5,20±1,55 | 4,49±1,33 | 0,006 |
| Linfócitos (103 U) | 2,10±0,75 | 2,88±1,49 | 2,60±0,67 | 0,001 |
| RNL | 2,51±1,03 | 2,01±0,86 | 1,79±0,60 | 1‐2p=0,018 |
| 2‐3p=0,104 | ||||
| 1‐3p=0,001 | ||||
| RPL | 144,14±58,74 | 101,69±33,09 | 106,89±27,62 | 1‐2p=0,001 |
| 2‐3p=0,474 | ||||
| 1‐3p=0,001 |
| Grupo de tumor maligno | Estágio inicial (n=25) | Estágio avançado (n=17) | p |
|---|---|---|---|
| RNL | 2,58±1,00 | 2,48±1,06 | 0,782 |
| RPL | 134,69±30,09 | 149,39±69,81 | 0,444 |
Os valores da RNL nos grupos de tumor maligno, benigno e grupo controle foram de 2,51 (± 1,03), 2,01 (± 0,86), 1,79 (± 0,60), respectivamente. Uma diferença estatisticamente significante foi observada entre os grupos para a RNL (p<0,001). Nas comparações duplas, a RNL foi mais alta no grupo de tumor maligno do que nos grupos benigno e controle (p=0,018 e p<0,001, respectivamente). Nenhuma diferença significante foi observada entre os grupos benigno e controle (p=0,104) (tabela 2).
Quando os pacientes com tumor maligno da parótida foram avaliados em relação aos estágios tumorais, não foi observada diferença estatisticamente significante para a RNL entre pacientes com tumor em estágio inicial e pacientes com tumor em estágio avançado (p=0,782) (tabela 2).
Foi encontrada uma diferença estatisticamente significante para a RPL entre os grupos com tumor maligno, benigno e o grupo controle (p <0,001). Nas comparações duplas, o valor da RPL dos pacientes no grupo com tumor maligno foi considerado estatisticamente superior aos dos grupos benigno (101,69) e controle (106,89) (p <0,001 e p=0,001, respectivamente). Nenhuma diferença significante foi observada para a RPL entre os grupos com tumor benigno e controle (p=0,474) (tabela 2).
DiscussãoEm nosso estudo, indicamos que os valores pré‐operatórios da RNL e RPL são maiores em pacientes com tumor maligno de parótida do que em pacientes com tumor benigno. Não observamos diferença estatisticamente significante em relação à RNL e RPL quando comparamos pacientes com tumor maligno entre si de acordo com os seus estágios da doença.
Tumores malignos das glândulas salivares (TMGS) não são tumores comuns, representam menos de 5% de todos os cânceres de cabeça e pescoço. Seus espectros clinicopatológicos variam histologicamente de tumores de baixo grau a tumores de alto grau e mostram importantes diferenças prognósticas. Atualmente, a nomenclatura “tumor de parótida” representa uma grande diversidade diagnóstica clínica e patológica. Ainda há muitas dificuldades no diagnóstico do câncer de parótida e no manejo do tumor.16
A conexão entre inflamação e carcinogênese foi estabelecida primeiramente por Rudolf Virchow em 1863.17 A interação entre as células tumorais e o estroma relacionado representa uma forte relação que afeta o início e a progressão da doença e o prognóstico do paciente.17 Sinais de tumores que crescem em resposta a condições ambientais e oncogênicas alteram o microambiente durante a progressão do tumor, o que afeta o processo metastático de forma contínua. Primeiramente, os tumores atraem as células inflamatórias para o seu microambiente e então controlam e modulam as atividades dessas células para ajudar o crescimento do tumor. As células tumorais podem manter a construção de seu próprio nicho.18 A IL‐6 e TNF‐α aumentam devido ao câncer e acredita‐se que esse aumento induza a ativação dos neutrófilos.19‐22
Armadilhas extracelulares de neutrófilos (NETs, do inglês Neutrophil extracellular traps) são agregados de DNA extracelular associados a enzimas citotóxicas produzidas por neutrófilos para capturar e destruir microrganismos.23 A literatura indica que as células cancerosas ativam os leucócitos através de NETs.24 A infecção bacteriana sistêmica iniciada experimentalmente contribui substancialmente para o tumor metastático que se dissemina para o fígado e para o tecido pulmonar por meio de aderências que aumentam devido à presença de NETs.24 Por um lado, o papel exato dos neutrófilos no microambiente tumoral ainda permanece controverso; por outro, os neutrófilos associados ao tumor (TANs, do inglês Tumor Associated Neutrophils) parecem contribuir para a progressão do tumor, angiogênese e tolerância imunológica. A agregação de células imunes e tumorais no microambiente permite a imunoprecipitação e lá as células tumorais medeiam o fator de crescimento e a tolerância imunológica via TANs. Os TANs também são estimulados para liberar proteases no microambiente do tumor, o que facilita a invasão e a metástase nodal.25‐27 Todas essas alterações na resposta imune causam um aumento na quantidade de neutrófilos e, consequentemente, na RNL. O aumento da RNL relatada em vários tipos de lesões malignas na literatura está de acordo com os mecanismos fisiopatológicos mencionados acima.18
Foi mostrado que o aumento da RNL está fortemente associado à diminuição da taxa de sobrevida em pacientes com câncer de cabeça e pescoço. Essas informações são apresentadas consistentemente na literatura no câncer de cabeça e pescoço em diferentes regiões, como cavidade oral, nasofaringe, orofaringe, laringe e hipofaringe.23 Em pesquisas feitas em pacientes com câncer colorretal e câncer gástrico, observou‐se que a relação entre o número de plaquetas e a taxa de linfócitos está correlacionada com o tempo de vida pós‐operatório.28,29 O estudo de Rassoli et al. mostrou que os marcadores inflamatórios sistêmicos da relação neutrófilo‐linfócito e da relação plaqueta‐linfócito são fatores prognósticos independentes no carcinoma de células escamosas de cabeça e pescoço.30 As pesquisas mais recentes mostraram uma correlação entre o nível de resposta inflamatória sistêmica e resultados nos vários tumores.31
Em um estudo que incluiu 209 pacientes com lesão na laringe, a RNL de 3 grupos de lesões, benignas, pré‐cancerosas e malignas, foi analisada, observou‐se uma RNL estatisticamente significante nas lesões malignas.32
Em um estudo de metanálise em pacientes com carcinoma de células escamosas bucais (CCEB), foram incluídos 10 estudos feitos com 2.135 pacientes. Foi relatado que uma RNL mais alta é um marcador negativo, tanto para a sobrevida geral como para a sobrevida doença‐específica.33
Em uma metanálise que incluiu 19 estudos conduzidos em 3.770 pacientes com câncer de cabeça e pescoço, observou‐se que a RNL alta apresentava um impacto negativo no tempo de sobrevida livre de doença.34
Na metanálise feita por Mascarella et al., foram incluídos 6.479 pacientes com câncer de cavidade oral, nasofaringe, laringe e hipofaringe. Observou‐se uma RNL alta, estatisticamente significante, em pacientes com câncer. O câncer de parótida não foi examinado em relação à RNL nessa pesquisa.18 A porcentagem média de neutrófilos em pacientes com tumor de glândula salivar (TGS) maligno foi significantemente alta em comparação com pacientes com TGS benigno. Foi relatado que a porcentagem média de linfócitos e a RNL eram significantemente diferentes em tumores malignos de glândulas salivares de baixo e alto grau. Todas as glândulas salivares, menores e maiores, foram incluídas nessa pesquisa.12
Na pesquisa de Mao et al., foram comparados 899 pacientes com câncer de laringe em relação à RPL, de acordo com os estágios tumorais.35 Eles observaram que, no estágio avançado do câncer de laringe, a RPL é alta, de maneira estatisticamente significante. Em nossa pesquisa, a RPL é mais alta, de maneira estatisticamente significante, no grupo de pacientes com tumor maligno da parótida do que nos grupos benigno e controle. Em nossa pesquisa, também não observamos qualquer diferença significante na RPL quando avaliamos os estágios tumorais dentro do grupo com tumores malignos.
ConclusãoNossa pesquisa é a primeira a comparar exclusivamente os tumores da parótida em relação à RNL e RPL para os grupos com tumor maligno, benigno e grupo controle. A RNL e RPL podem ser usadas como marcadores de baixo custo, reproduzíveis e úteis na distinção entre pacientes com tumor maligno da parótida e pacientes com tumor benigno. As limitações da nossa pesquisa são os seguintes: é uma pesquisa retrospectiva e unicêntrica; neutrófilos e linfócitos relacionados ao tumor não foram avaliados na pesquisa e não houve seguimento clínico prospectivo dos pacientes. São necessários mais estudos prospectivos e multicêntricos em um número maior de pacientes neste campo de pesquisa, a fim de identificar de forma abrangente os pacientes com resposta inflamatória que estão sob alto risco de piores resultados.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Kuzucu İ, Güler İ, Kum RO, Baklacı D, Özcan M. Increased neutrophil lymphocyte ratio and platelet lymphocyte ratio in malignant parotid tumors. Braz J Otorhinolaryngol. 2020;86:105–10.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.