Obstrutive sleep apnea syndrome is characterized by repeated episodes of upper airway obstruction, associated with intermittent hypoxia and hypercapnia, and the main risk factor in childhood is adenotonsillar hypertrophy. The lymphocytes in these structures are responsible for local and systemic immune responses.
ObjectiveVerify the levels of the inflammatory markers, IL‐1β, IL‐4, IL‐6, IL‐8, IL‐10, IL‐15, TNF‐α, CRP and α1‐GP, in the tonsils of children with and without obstructive sleep apnea syndrome.
MethodsThis cross‐sectional prospective study included 34 children with complains of snoring, difficulty breathing during sleep or recurrent tonsillitis. Patients underwent to a complete otorhinolaryngological examination, nasal endoscopy and polysomnography and were divided into two groups with 17 children each: obstructive sleep apnea syndrome group and control group. All underwent an adenotonsillectomy. Cytokines were measured in the collected tonsils (ELISA and Multiplex methods).
ResultsStatistically significant increasing were observed between IL‐8 and IL‐10 cytokines of patients with obstructive sleep apnea when compared to the control group; also between c‐reactive protein and α1‐GP of the tonsils cortical region in children with obstructive sleep apnea syndrome when compared with the medullary region. There were no statistically significant differences for the remaining inflammatory mediators.
ConclusionAfter the analysis of the levels of pro and anti‐inflammatory markers (IL‐1β, IL‐4, IL‐6, IL‐8, IL‐10, Il‐15, TNF‐α, CRP, α1‐GP) in the tonsils, we observed higher levels of markers IL‐8 and IL‐10 in pediatric patients with obstructive sleep apnea syndrome.
A síndrome da apneia obstrutiva do sono é caracterizada por episódios repetidos de obstrução das vias aéreas superiores, associados a hipóxia intermitente e hipercapnia, e o principal fator de risco na infância é a hipertrofia adenotonsilar. Os linfócitos nessas estruturas são responsáveis por respostas imunes locais e sistêmicas.
ObjetivoDosar os marcadores inflamatórios, IL‐1β, IL‐4, IL‐6, IL‐8, IL‐10, IL‐15, TNF‐α, PCR e α1‐GP, nas tonsilas de crianças com e sem síndrome da apneia obstrutiva do sono.
MétodoEstudamos prospectivamente 34 crianças que se queixavam de ronco, dificuldade para respirar durante o sono ou tonsilites recorrentes. Os pacientes foram submetidos a exame otorrinolaringológico completo, endoscopia nasal e polissonografia e foram divididos em dois grupos com 17 crianças cada: síndrome de apneia obstrutiva do sono e controle. Todos foram submetidos à adenotonsilectomia. As citocinas foram medidas nas tonsilas coletadas (métodos ELISA e Multiplex).
ResultadosCom diferenças estatisticamente significantes, observou‐se aumento das citocinas IL‐8 e IL‐10 em pacientes com apneia obstrutiva do sono em comparação ao grupo controle, assim como aumento dos níveis de proteína C reativa e de α1‐GP na região cortical das tonsilas de crianças portadoras de síndrome da apneia obstrutiva do sono em comparação com a região medular. Não houve diferenças estatisticamente significantes para o restante dos mediadores inflamatórios.
ConclusãoApós a análise dos níveis de marcadores pró e anti‐inflamatórios (IL‐1β, IL‐4, IL‐6, IL‐8, IL‐10, Il‐15, TNF‐α, PCR, α1‐GP) nas tonsilas, observamos níveis mais altos de marcadores IL‐8 e IL‐10 em pacientes pediátricos com síndrome da apneia obstrutiva do sono.
A síndrome da apneia obstrutiva do sono (SAOS) é um dos distúrbios respiratórios do sono (DRS), definidos como episódios repetidos de obstrução das vias aéreas superiores, associados a hipóxia e hipercapnia intermitente.1 Os DRS incluem ronco primário, síndrome de resistência das vias aéreas superiores e a SAOS, como a condição mais importante.2 Os DRS são muito comuns na infância e estima‐se que 3% a 26% das crianças pequenas apresentam ronco habitual e 1,2% a 5,7% têm SAOS.3–5
Sugere‐se que a SAOS possa induzir uma resposta pró‐inflamatória sistêmica e que sua magnitude possa estar envolvida na morbidade final.6 Alberti et al.7 mediram os níveis das citocinas pró‐inflamatórias IL‐1β, IL‐6 e TNF‐α e as citocinas anti‐inflamatórias IL‐10 e TGF‐β em pacientes com SAOS. Observou‐se aumento do TNF‐α e IL‐6, quando comparados ao grupo controle. Recentemente, foi demonstrado que a produção espontânea de TNF‐α por monócitos está aumentada em pacientes adultos com SAOS moderada ou grave e que essa regride após o tratamento com pressão positiva contínua nas vias aéreas (CPAP, do inglês Continuous Positive Airway Pressure).8 Gozal et al.9 demonstraram que o tratamento cirúrgico da SAOS (tratamento padrão dessa condição em crianças) resultou em reduções significativas nos níveis de TNF‐α, com prolongamento recíproco da latência do sono. Além disso, foi demonstrado que a proteína c‐reativa (PCR) está relacionada à morbidade cognitiva mediada pela SAOS.10
O aumento dos níveis séricos de PCR, IL‐6 e TNF‐α é importante fator de risco para aterosclerose, acidente vascular cerebral (AVC) e doenças cardiovasculares11 e seus níveis estão aumentados na SAOS.12–14 É possível que a SAOS afete não apenas as citocinas pró‐inflamatórias, mas também bloqueie a expressão das citocinas anti‐inflamatórias, como a IL‐10, que inibe uma ampla gama de respostas pró‐inflamatórias, incluindo aquelas que afetam a parede dos vasos.15–17
Os principais fatores de risco para SAOS na infância são hipertrofia adenotonsilar, obesidade, doenças neuromusculares e alterações craniofaciais.18 Além desses fatores, a hipertrofia das tonsilas palatinas e faríngea destacam‐se como as principais etiologias.19–21 O mecanismo exato subjacente à proliferação e à hiperplasia linfoide folicular permanece pouco compreendido. Em adultos, existem várias linhas de evidência que sugerem que a inflamação local e sistêmica das vias aéreas superiores está relacionada à fisiopatologia da disfunção mecânica das vias aéreas superiores. Tem sido demonstrado que o número de células do sistema imunológico se encontra significativamente aumentado na mucosa e no músculo de adultos com SAOS.22 Aumentos similares em marcadores inflamatórios sistêmicos e regionais também foram relatados em crianças com SAOS.10 Portanto, conclui‐se que a proliferação celular no tecido das tonsilas palatinas de crianças com SAOS é diferente daquela em crianças com tonsilite recorrente, reflete possivelmente os mecanismos patológicos e os tipos de células envolvidas na proliferação do tecido linfoide das vias aéreas superiores nessas duas situações.23 Considerando‐se tais fatos, o objetivo do presente estudo foi avaliar o impacto da SAOS no padrão inflamatório das tonsilas palatinas de crianças.
MétodoPopulação do estudoTrinta e quatro pacientes atendidos em uma clínica de otorrinolaringologia pediátrica, entre 3 e 12 anos, de ambos os sexos, submetidos a tonsilectomia de outubro de 2013 a junho de 2014 devido a SAOS, ronco primário ou tratamento de tonsilite recorrente, foram avaliados prospectivamente.
Considerou‐se presença de SAOS quando os parâmetros da polissonografia demonstraram índice de apneia obstrutiva (IA) ≥ 1 evento por hora ou índice de apneia‐hipopneia (IAH) ≥ 1,5 evento por hora e saturação mínima de oxigênio (SpO2min) ≤ 92%. Assim, SAOS foi considerada ausente quando os parâmetros da polissonografia demonstraram IA <1 evento por hora ou IAH <1,5 evento por hora e a SpO2min >92%. O ronco primário foi considerado como presença de ronco habitual e ausência de SAOS confirmada por polissonografia. A tonsilite recorrente foi considerada de acordo com os critérios de Paradise24 na ausência de SAOS confirmada por polissonografia.
Critérios de inclusão:
- ‐
Idade inferior a 12 anos;
- ‐
Indicação cirúrgica de tonsilectomia devido a SAOS, ronco primário ou tonsilite recorrente;
- ‐
Tonsilectomia feita entre outubro de 2013 e junho de 2014;
- ‐
Crianças ou pais/responsáveis que aceitaram participar do estudo.
Critérios de exclusão:
- ‐
Síndrome estabelecida ou sob investigação com alterações orofaciais;
- ‐
Doenças pulmonares ou cardíacas e obesidade;
- ‐
Doenças estabelecidas ou sob investigação de origem metabólica ou miopática;
- ‐
Infecção das vias aéreas superiores no momento da cirurgia;
- ‐
Imunodeficiência;
- ‐
Tonsilectomia prévia;
- ‐
Não entendimento das instruções iniciais;
- ‐
Não ter passado pelas avaliações em períodos pré‐determinados de acordo com o protocolo do estudo.
Este estudo foi aprovado pelo conselho de ética e pesquisa institucional sob o número de protocolo 97.863 e o consentimento informado por escrito foi obtido de todos os pais e/ou responsáveis das crianças.
Tratou‐se de um estudo prospectivo transversal, baseado em dois grupos: grupo SAOS, formado por 17 crianças com SAOS e sem tonsilite de repetição, submetidas à tonsilectomia; e grupo controle, formado por 17 crianças sem SAOS, submetidas à tonsilectomia por ronco primário e/ou tonsilite recorrente.
Após critérios de inclusão e exclusão terem sido aplicados, as crianças foram submetidas à tonsilectomia bilateral (com ou sem adenoidectomia), sob anestesia geral, no centro cirúrgico do hospital universitário. As tonsilas palatinas foram removidas, juntamente com suas cápsulas, através de cirurgia com bisturi a frio, foram armazenadas rapidamente em um recipiente com gelo seco a ‐80°C e levadas para o laboratório para ser processadas. As tonsilas palatinas foram seccionadas em duas partes, zonas cortical e medular, e as seguintes concentrações de proteínas inflamatórias foram medidas: alfa‐1 glicoproteína ácida (α1‐GP), proteína c‐reativa (PCR), interleucina (IL) ‐1β, IL‐4, IL‐6, IL‐8, IL‐10, IL‐15 e fator de necrose tumoral (TNF)‐α.
As concentrações dos mediadores inflamatórios foram comparadas entre zonas corticais e medulares para cada grupo e então as concentrações totais de cada grupo foram comparadas.
Análise imunológicaAs amostras de tonsila palatina foram seccionadas em duas partes, cortical e medular. Posteriormente, o tecido foi dissociado mecanicamente (TissueRuptor, Qiagen, Hilden, Alemanha) em tubo Eppendorf com 400μL de meio de cultura RPMI 1640 (Sigma‐Aldrich, St. Louis, MO, EUA). Subsequentemente, os fragmentos foram centrifugados durante 5 minutos a uma velocidade de 20,817g. Após a separação do extrato de proteína (fase sobrenadante), a quantificação da amostra de proteína foi feita com o Kit Pierce's BCA Protein Assay Reagent (Thermo Fisher Scientific, Waltham, MA, EUA) como descrito abaixo.
Uma curva‐padrão foi feita com o padrão de albumina BSA (Bovine Serum Albumin) para cada ponto da curva, em diluições seriadas. Para a quantificação, 2mL de reagente de trabalho (RT) foram usados em cada tubo Eppendorf. A mistura RT foi preparada como se segue: 50 partes de reagente ácido bicinconínico (BCA) Reagente A e 1 parte de BCA Reagente B (50: 1 Reagente A: B). Os tubos foram incubados por 30 minutos a 37°C no escuro e foram subsequentemente lidos em um espectrofotômetro (NanoDrop 2000 Thermo Fisher Scientific, Waltham, MA, EUA) a um comprimento de onda de 562nm. Com o objetivo de igualar a concentração de proteína avaliada em todas as amostras, foi padronizado que todas estavam a uma concentração de 3.000μg por mL.
Após ser subsequentemente colocadas em tubos cônicos de 2mL, essas amostras foram armazenadas a ‐80°C. α1‐GP foi analisada com um kit de leitura ELISA (USCN Life Science), a PCR pelo kit de leitura Milliplex‐Human CVD Panel 3 (MERK®) e IL‐1β, IL‐4, IL‐6, IL‐8, IL‐10, IL‐15 e TNF‐α com o kit de leitura de citocina/quimiocina Milliplex‐Human (MERK®), de acordo com os procedimentos e as recomendações de cada fabricante de kit.
Análise estatísticaA distribuição normal dos dados foi verificada pelo teste de Kolmogorov‐Smirnov. A comparação entre os mediadores inflamatórios encontrados nas zonas cortical e medular de cada grupo foi feita pelo teste t de Student para amostras dependentes ou pelo teste de Wilcoxon, dependeu da presença ou ausência de normalidade na distribuição dos dados, respectivamente. A comparação dos mediadores inflamatórios entre os grupos foi feita pelo teste t de Student para amostras independentes ou pelo teste U de Mann‐Whitney, também dependeu da normalidade da distribuição dos dados.
Para todas as análises estatísticas, os valores de p < 5% foram considerados significantes.
ResultadosTrinta e quatro pacientes foram incluídos neste estudo: 17 crianças no grupo SAOS e 17 no grupo controle. Quinze pacientes eram do sexo masculino. A média foi de 7,55 anos e mediana de 8,5 anos.
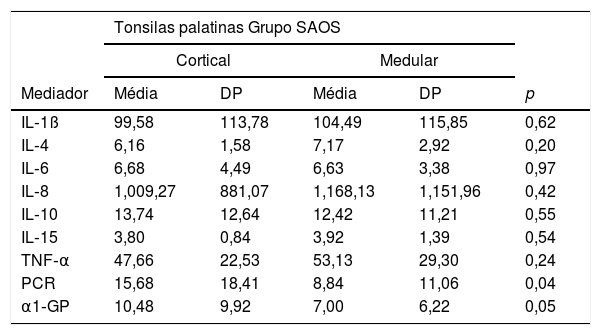
Apenas a PCR e a α1‐GP foram expressas diferentemente de forma significante entre as zonas cortical e medular do grupo SAOS. A zona cortical apresentou maiores níveis dessas proteínas (tabela 1).
Comparação entre os valores dos mediadores inflamatórios na zona cortical e medular das tonsilas palatinas do grupo SAOS expressos em pg/mL
| Tonsilas palatinas Grupo SAOS | |||||
|---|---|---|---|---|---|
| Cortical | Medular | ||||
| Mediador | Média | DP | Média | DP | p |
| IL‐1ß | 99,58 | 113,78 | 104,49 | 115,85 | 0,62 |
| IL‐4 | 6,16 | 1,58 | 7,17 | 2,92 | 0,20 |
| IL‐6 | 6,68 | 4,49 | 6,63 | 3,38 | 0,97 |
| IL‐8 | 1,009,27 | 881,07 | 1,168,13 | 1,151,96 | 0,42 |
| IL‐10 | 13,74 | 12,64 | 12,42 | 11,21 | 0,55 |
| IL‐15 | 3,80 | 0,84 | 3,92 | 1,39 | 0,54 |
| TNF‐α | 47,66 | 22,53 | 53,13 | 29,30 | 0,24 |
| PCR | 15,68 | 18,41 | 8,84 | 11,06 | 0,04 |
| α1‐GP | 10,48 | 9,92 | 7,00 | 6,22 | 0,05 |
α1‐GP, alfa1‐Glicoproteína; DP, desvio‐padrão; IL, interleucina; PCR, Proteína C‐Reativa; pg/mL, picograma por mililitro; SAOS, Síndrome da Apneia Obstrutiva do Sono; TNF, Fator de Necrose Tumoral.
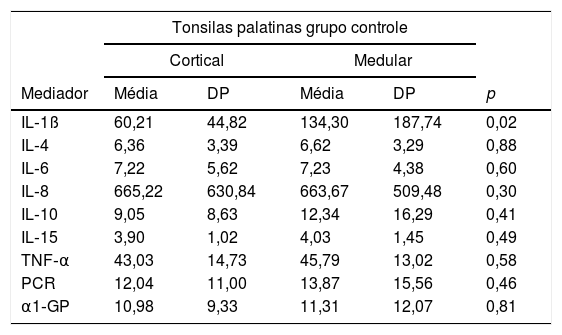
No grupo controle, apenas a IL‐1β foi expressa de forma diferente, apresentou níveis mais elevados na zona medular (tabela 2).
Comparação entre os valores dos mediadores inflamatórios na zona cortical e medular das tonsilas palatinas do grupo controle expressos em pg/mL
| Tonsilas palatinas grupo controle | |||||
|---|---|---|---|---|---|
| Cortical | Medular | ||||
| Mediador | Média | DP | Média | DP | p |
| IL‐1ß | 60,21 | 44,82 | 134,30 | 187,74 | 0,02 |
| IL‐4 | 6,36 | 3,39 | 6,62 | 3,29 | 0,88 |
| IL‐6 | 7,22 | 5,62 | 7,23 | 4,38 | 0,60 |
| IL‐8 | 665,22 | 630,84 | 663,67 | 509,48 | 0,30 |
| IL‐10 | 9,05 | 8,63 | 12,34 | 16,29 | 0,41 |
| IL‐15 | 3,90 | 1,02 | 4,03 | 1,45 | 0,49 |
| TNF‐α | 43,03 | 14,73 | 45,79 | 13,02 | 0,58 |
| PCR | 12,04 | 11,00 | 13,87 | 15,56 | 0,46 |
| α1‐GP | 10,98 | 9,33 | 11,31 | 12,07 | 0,81 |
α1‐GP, alfa1‐Glicoproteína; DP, desvio‐padrão; IL, interleucina; PCR, Proteína C‐Reativa; pg/mL, picograma por mililitro; SAOS, Síndrome da Apneia Obstrutiva do Sono; TNF, Fator de Necrose Tumoral.
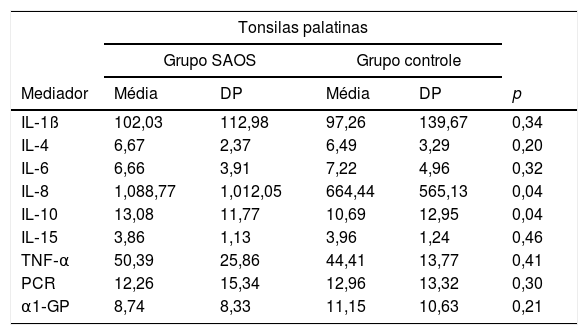
Ao comparar as concentrações dos mediadores inflamatórios totais nos grupos SAOS e controle, o grupo SAOS apresentou níveis significativamente mais elevados de IL‐8 e IL‐10 do que o grupo controle (tabela 3).
Comparação entre os valores dos mediadores inflamatórios totais das tonsilas palatinas de pacientes com e sem SAOS, expressos em pg/mL
| Tonsilas palatinas | |||||
|---|---|---|---|---|---|
| Grupo SAOS | Grupo controle | ||||
| Mediador | Média | DP | Média | DP | p |
| IL‐1ß | 102,03 | 112,98 | 97,26 | 139,67 | 0,34 |
| IL‐4 | 6,67 | 2,37 | 6,49 | 3,29 | 0,20 |
| IL‐6 | 6,66 | 3,91 | 7,22 | 4,96 | 0,32 |
| IL‐8 | 1,088,77 | 1,012,05 | 664,44 | 565,13 | 0,04 |
| IL‐10 | 13,08 | 11,77 | 10,69 | 12,95 | 0,04 |
| IL‐15 | 3,86 | 1,13 | 3,96 | 1,24 | 0,46 |
| TNF‐α | 50,39 | 25,86 | 44,41 | 13,77 | 0,41 |
| PCR | 12,26 | 15,34 | 12,96 | 13,32 | 0,30 |
| α1‐GP | 8,74 | 8,33 | 11,15 | 10,63 | 0,21 |
α1‐GP, alfa1‐Glicoproteína; DP, desvio‐padrão; IL, interleucina; PCR, Proteína C‐Reativa; pg/mL, picograma por mililitro; SAOS, Síndrome da Apneia Obstrutiva do Sono; TNF, Fator de Necrose Tumoral.
Diferenças estatisticamente significantes foram encontradas em relação à diferença nos valores dos mediadores IL‐8 e IL‐10.
DiscussãoA hipertrofia adenotonsilar é o principal mecanismo fisiopatológico subjacente à síndrome da apneia obstrutiva do sono (SAOS) em crianças. A literatura mostra que há aumento da expressão de vários mediadores da resposta inflamatória nas tonsilas de pacientes com SAOS.7,11,23 Essa ideia enfatiza a hipótese de que o aumento da inflamação local em crianças com apneia do sono pode promover a proliferação das tonsilas.23
No presente estudo, observou‐se que os níveis dos mediadores inflamatórios IL‐1β, IL‐4, IL‐6, IL‐15, TNF‐α, PCR e α1‐GP nas tonsilas de crianças com SAOS não apresentaram diferenças significantes quando comparados ao grupo sem SAOS. No entanto, aumento significante foi observado nos níveis de IL‐8 e IL‐10 em pacientes com SAOS, quando comparados com o grupo controle. Semelhantemente ao que foi descrito, outros autores relataram que níveis elevados de IL‐8, uma quimiocina que desempenha um papel‐chave na adesão de neutrófilos e monócitos ao endotélio vascular, foram demonstrados em pacientes com SAOS.13 Agren et al.25 encontraram um aumento na produção de IL‐8 e IL‐10 em tonsilas hipertróficas de crianças com SAOS. No entanto, esse achado também ocorreu nas tonsilas de crianças com tonsilite recorrente, mesmo sem sinais clínicos de infecção. Além disso, eles observaram aumento de outras citocinas, a seguir: IL‐2, IL‐4, IL‐6, TNF‐α, TNF‐β e IFN‐γ.
Outros resultados, diferentes dos encontrados neste estudo, foram descritos na literatura. Lindberg et al.26 avaliaram os marcadores IL‐1α, IL‐1β, IL‐2, IL‐4, IL‐6, IL‐8, IL‐10, TNF‐α e TNF‐β na suspensão de células de tonsilas hipertróficas com SAOS grave sem história de infecção vs. tonsilas com infecções recorrentes. Os níveis de IL‐1β, IL‐2 e IL‐6 mostraram um aumento significante no grupo de tonsilite recorrente quando comparados ao grupo de hipertrofia. Yokoe27 relatou que os níveis de IL‐6 e PCR estavam elevados em pacientes com SAOS quando comparados a um grupo controle obeso, mostraram que houve uma redução nesses níveis após o tratamento com CPAP. Foi sugerido que a inflamação sistêmica da SAOS poderia existir independentemente da obesidade. Andersson et al.28 demonstraram um aumento na produção de 19 marcadores inflamatórios (incluindo IL‐4, IL‐6 e IL‐8) em tonsilas humanas com infecção crônica e encontraram diferentes padrões de citocinas no grupo de tonsilite recorrente quando comparado com um grupo com mononucleose infecciosa. Eles raramente observaram IL‐1β e TNF‐α no grupo de tonsilite recorrente. Por outro lado, outros autores identificaram altas concentrações de IL‐1β, IL‐6 e TNF‐α em tecidos adenotonsilares, acreditaram ser uma expressão de superprodução local devido à ativação de monócitos‐macrófagos resultante de estímulos repetidos de agentes patogênicos.29 Kim et al.23 observaram que tanto a expressão quanto a liberação de citocinas pró‐inflamatórias, como IL‐1β, IL‐6 e TNF‐α, estavam aumentadas em culturas de células de crianças com SAOS.
Embora esses estudos mostrem alterações nos níveis de muitas citocinas avaliadas neste estudo, não é possível identificar um consenso em relação à diferença entre pacientes com SAOS e pacientes com tonsilite recorrente. Uma condição que pode ter contribuído para o fato de que a maioria das citocinas avaliadas não mostrou diferença significante entre os grupos (caso e controle) é a possibilidade de que tanto a apneia quanto a infecção recorrente alterem os níveis dos marcadores inflamatórios. Talvez um estudo que compare esses grupos em crianças sem SAOS, tonsilite recorrente ou mesmo tonsilas obstrutivas possa responder essa questão.
Considerando os resultados atuais – predominância de IL‐8 e IL‐10 em tonsilas palatinas de pacientes com SAOS – pode‐se deduzir que as tonsilas palatinas não parecem ser o fator determinante na fisiopatologia inflamatória da SAOS, principalmente considerando que a IL‐10 é uma citocina anti‐inflamatória.
Outro fator importante a ser discutido é a comparação das medidas de marcadores inflamatórios entre as regiões cortical e medular das tonsilas. Os níveis de PCR e α1‐GP foram maiores na região cortical das tonsilas de pacientes com apneia do sono quando comparados à região medular, um resultado não observado em tonsilas de crianças sem SAOS. O aumento dos níveis séricos de PCR nas crianças com SAOS seria evidência da presença de um processo inflamatório sistêmico, que também poderia contribuir para o aumento da proliferação do tecido linfoide nas vias aéreas superiores.30 Essa diferença demonstrada entre as regiões cortical e medular pode estar relacionada a essa proliferação.
Alguns estudos sobre SAOS e citocinas diferenciam os grupos de acordo com o IAH ou mesmo com o grau de apneia do sono. Um estudo feito em 2012 associou os níveis elevados de PCR em pacientes com apneia do sono com sua gravidade, independentemente da obesidade.30 Muitos estudos associaram aumento dos níveis séricos de TNF‐α com a gravidade da SAOS.31 Outros demonstraram que o aumento dos níveis de TNF‐α e IL‐6 eram acompanhados por um aumento no IAH em pacientes com apneia do sono.9 Entretanto, Chu e Li32 concluíram que os aumentos de TNF‐α e IL‐6 são principalmente influenciados pelo fator obesidade. O presente estudo excluiu todas as crianças obesas ou com alguma doença metabólica/endócrina, mas a gravidade da SAOS não foi considerada.
Outro viés é que a sensibilização alérgica não foi especificada. Estudos anteriores relataram uma alta prevalência de alergia em crianças com SAOS.33,34 Além disso, o uso de corticosteroides tópicos em alguns pacientes pode ter alterado os níveis de citocinas, embora a biodisponibilidade da maioria dos corticosteroides nasais seja muito baixa.
Por último, embora apenas as tonsilas palatinas tenham sido incluídas no presente estudo, as tonsilas faríngeas também desempenham um papel importante na fisiopatologia da SAOS em pacientes pediátricos e podem estar associadas aos marcadores inflamatórios envolvidos nos distúrbios do sono. Portanto, estudos futuros e mais específicos devem avaliar essas questões e esclarecer o papel das citocinas na SAOS versus tonsilites recorrentes.
ConclusãoTonsilas palatinas de pacientes com SAOS apresentaram maior expressão de PCR e α1‐GP na zona cortical do que na medular, enquanto nas tonsilas palatinas em pacientes sem SAOS houve maior expressão de IL‐1β na zona medular do que na cortical. A SAOS promoveu diferentes padrões de inflamação nas tonsilas palatinas, com predominância de IL‐8 e IL‐10 em comparação aos controles. Ainda não é possível identificar um consenso sobre a diferença entre pacientes com SAOS e pacientes com amigdalite recorrente.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Chen VG, Fonseca VM, Amaral JB, Camargo‐Kosugi CM, Moreira G, Kosugi EM, et al. Inflammatory markers in palatine tonsils of children with obstructive sleep apnea syndrome. Braz J Otorhinolaryngol. 2020;86:23–9.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.