As membranas laríngeas congênitas são raras, podem estar associadas a outras anormalidades das vias aéreas e ser uma das muitas características da microdeleção 22q11. A avaliação cuidadosa é imprescindível na decisão de qual técnica cirúrgica deve ser usada. A escolha do stent apropriado pode ser decisiva para evitar sinéquia persistente da comissura anterior e maus resultados vocais.
ObjetivoRelatar os resultados das abordagens cirúrgicas abertas e endoscópicas no tratamento das membranas laríngeas congênitas e os desafios que podem ser encontrados ao aplicar a classificação atual e decidir a melhor opção de tratamento.
MétodoRevisão retrospectiva de prontuários médicos e cirúrgicos de membranas laríngeas congênitas tratadas em dois centros universitários terciários.
ResultadosSete pacientes foram incluídos, de acordo com a classificação de Cohen: três membranas do tipo II, uma delas com sinéquia posterior atípica, duas membranas do tipo III e duas membranas do tipo IV. Seis pacientes foram submetidos à reconstrução laringotraqueal e um foi tratado por abordagem endoscópica. Descrição precisa do envolvimento glótico e subglótico e opções cirúrgicas personalizadas são apresentadas. O stent utilizado foi o LT mold® e o período variou entre 40 e 60 dias. Todos os pacientes foram decanulados com boa qualidade de voz e o seguimento foi superior a um ano, não houve complicações associadas às cirurgias.
ConclusãoAs membranas laríngeas congênitas devem ser suspeitadas e avaliadas minuciosamente na presença de disfonia neonatal e laringite de início precoce. Os otorrinolaringologistas devem estar familiarizados com lesões associadas e condições genéticas que podem estar associadas a membranas laríngeas congênitas. As membranas laríngeas congênitas são tratadas com sucesso em idades precoces. A escolha da técnica cirúrgica após avaliação meticulosa dos componentes glóticos e subglóticos da membrana, presença de lesões concomitantes e uso do stent adequado é imprescindível para evitar cicatrizes persistentes e má qualidade da voz.
As membranas laríngeas congênitas são anormalidades raras e representam 5% das anomalias congênitas da laringe, a despeito da informação de prevalência de Cohen, que é de um caso em 1.200 nascimentos no Children's Hospital de Los Angeles.1 Elas são consideradas uma falha na recanalização da laringe primitiva, que deve ocorrer entre a 8ª e a 10ª semana de embriogênese. Outras malformações congênitas podem ocorrer simultaneamente, como estenose subglótica congênita, fístulas traqueoesofágicas e algumas síndromes.2,3 Embora um gene não tenha sido identificado como a causa dessa malformação genética, a investigação e o aconselhamento são imperativos,3,4 devido à associação relativamente frequente com a microdeleção 22q11.
Tradicionalmente, as membranas laríngeas são classificadas em quatro subtipos propostos por Cohen.1 As membranas do tipo I compreendem menos de 35% do envolvimento glótico, geralmente são finas e não se estendem à região subglótica. Pacientes com membranas do tipo II, embora ainda finas ou moderadamente espessas, apresentam um envolvimento glótico de 35% a 50% e podem apresentar estenose subglótica isolada concomitante. As membranas do tipo III apresentam‐se com envolvimento glótico em 50% a 75% dos casos, são espessas e potencialmente têm um envolvimento cartilaginoso da região subglótica adjacente. As membranas do tipo IV são uniformemente espessas e envolvem de 75% a 90% da área glótica com extensão subglótica cartilaginosa.1,2 As cordas vocais são geralmente visíveis através das membranas dos tipos I e II, enquanto a delimitação das cordas vocais pode ser difícil nos tipos III e IV.1
As manifestações clínicas variam de acordo com a extensão do envolvimento e a obstrução glótica. As membranas mais curtas são responsáveis por disfonia percebida como um choro fraco e também podem ser causa de desconforto respiratório, depende do grau de obstrução ou da vigência de infecções das vias aéreas superiores. Nos pacientes com membranas dos tipos III e IV, o desconforto respiratório é geralmente perceptível desde o nascimento.5,6
O tratamento cirúrgico em lactentes dependerá da extensão da membrana e dos sintomas de obstrução das vias aéreas. Em membranas de tipos III e IV, a traqueostomia pode ser necessária como medida de emergência para proteger as vias aéreas durante os primeiros dias e/ou meses de vida. Devido a riscos perioperatórios e dificuldades técnicas de um procedimento cirúrgico em uma via aérea pequena, o tratamento cirúrgico definitivo não é aconselhado sistematicamente antes dos 6 a 12 meses de idade.7
O objetivo deste estudo é relatar os resultados das abordagens cirúrgicas abertas e endoscópicas no tratamento das membranas laríngeas congênitas e os desafios que podem ser encontrados ao aplicar a classificação atual e decidir a melhor opção de tratamento.
MétodoTodas as crianças (até 14 anos) submetidas ao tratamento cirúrgico de membranas laríngeas entre 2014 e 2018 foram incluídas no estudo. O critério de exclusão foi duração do seguimento de menos de 6 meses. Prontuários médicos e cirúrgicos de crianças tratadas para membranas laríngeas em dois centros de saúde universitários terciários foram descritos em relação a sintomas, classificação, malformações associadas das vias aéreas, necessidade de traqueostomia, tipo de cirurgia, tipo e tempo de uso do stent e resultados para voz e sintomas de vias aéreas. O estudo foi aprovado para sua aplicação em ambas as instituições sob o protocolo CAAE 17322619.8.0000.5404.
Uma busca sistemática de dados foi feita nos bancos de dados PubMed, Cochrane e Lilacs para revisar e comparar procedimentos e resultados cirúrgicos com aqueles descritos em outros centros.
ResultadosSete pacientes foram submetidos à reconstrução laringotraqueal devido a membranas laríngeas congênitas em duas instituições de saúde de 2014 a 2018, com seguimento mínimo de 6 meses. A média da idade no momento da cirurgia foi de 20 meses. A idade dos pacientes variou de 14 meses a 3 anos no momento da cirurgia.
A apresentação clínica, o tempo de traqueostomia, a classificação de Cohen e o tipo de cirurgia feita podem ser vistos na tabela 1.
Revisão de pacientes pediátricos com membrana laríngea operada
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | |
|---|---|---|---|---|---|---|---|
| Sexo | Masculino | Feminino | Feminino | Feminino | Masculino | Feminino | Masculino |
| Sintomas | Rouquidão, laringite recorrente, estridor bifásico | Angústia respiratória neonatal e laringite recorrente | Rouquidão, laringite recorrente, dificuldade respiratória | Estridor neonatal e dificuldade respiratória | Rouquidão, laringite recorrente | Estridor neonatal e angústia respiratória | Estridor neonatal e angústia respiratória |
| Idade no diagnóstico | 12 meses | 11 meses | 12 meses | 1 mês | 4 meses | 12 meses | Alguns dias de vida |
| Traqueostomia antes do tratamento | Não | Sim | Não | Sim | Sim | Sim | Sim |
| Classificação de Cohen | II | II | II atípico (membrana posterior, subglote normal) | III | III | IV | IV |
| Idade na cirurgia | 14 meses | 22 meses | 18 meses | 36 meses | 18 meses | 19 meses | 18 meses |
| Tipo de cirurgia | Secção endoscópica da membrana(1° procedimento) | RLT + EA (2T) | Excisão endoscópica da membrana anterior e posterior + dilatação por balão | RLT + EA (2T) | RLT + EA (2T) | RLT + EP (2T) | RLT + EAP(2T) |
| RLT + EA (2T)(2nd procedure) | |||||||
| Duração do stent | 60 dias | 60 dias | 42 dias | 60 dias | 60 dias | 60 dias | 45 dias |
| Microdeleção 22q11.2 associada | Sim | Sim | Sem investigação | Sim | Sem investigação | Sem investigação | Sim |
| Desfecho das vias aéreas | Decanulação | Decanulação | Decanulação | Decanulação | Decanulação | Decanulação | Decanulação |
| Tempo para decanulação após a remoção do stent | Ao mesmo tempo | 6 meses | 21 dias | 30 dias | 30 dias | Ao mesmo tempo | 40 dias |
RLT, Reconstrução laringotraqueal; EA, Enxerto anterior; EAP, Enxerto anterior e posterior; EP, Enxerto posterior; 2T, 2 tempos.
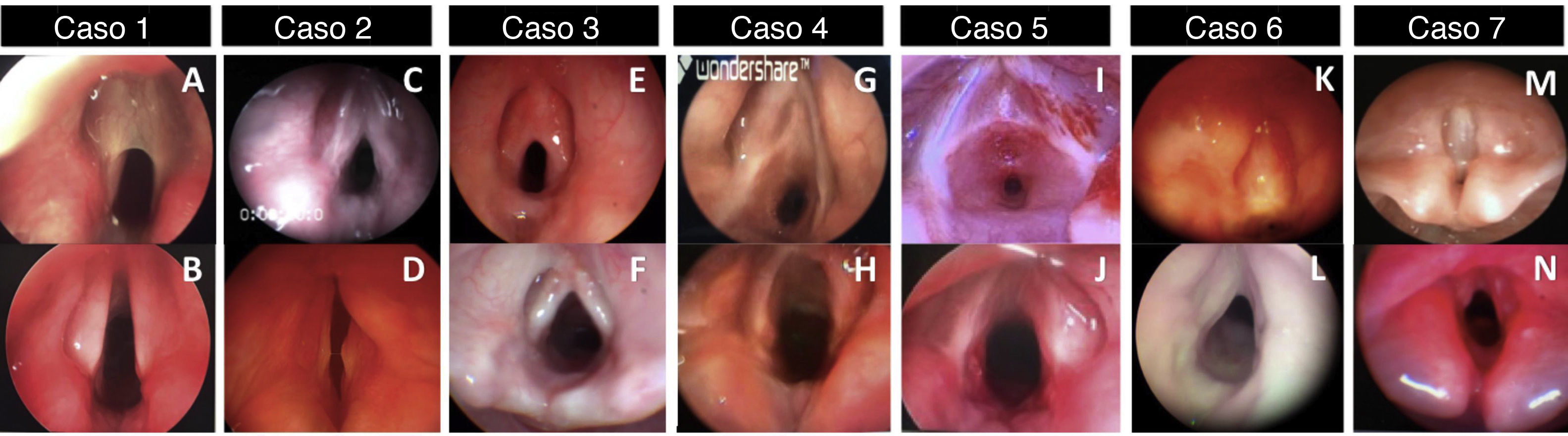
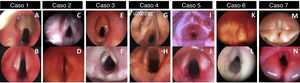
Após o mapeamento pré‐operatório com microlaringoscopia e broncoscopia (MLB) sob anestesia geral, as membranas laríngeas foram classificadas de acordo com a classificação de Cohen como: membranas tipo II em três pacientes (fig. 1A ‐ caso 1, 1C ‐ caso 2 e 1E ‐ caso 3), membrana tipo III em dois pacientes (fig. 1G ‐ caso 4 e 1I ‐ caso 5) e membranas do tipo IV em dois casos (fig. 1K ‐ caso 6 e 1M ‐ caso 7). Em ambas as instituições, afastador de cordas vocais e dimensionamento das vias aéreas com tubos traqueais apropriados à idade fizeram parte do mapeamento de rotina das vias aéreas. Uma das membranas do tipo II (fig. 1E ‐ Caso 3) apresentou sinéquia interaritenóidea atípica, sem histórico de intubação prévia. Nenhuma das membranas do tipo II tinha um histórico de intubação anterior. O caso 1 (fig. 1A) era de uma membrana laríngea do tipo II, uma membrana fina sem extensão subglótica adjacente, mas área subglótica elíptica, considerada do tamanho de uma estenose subglótica grau II. O caso 5 (fig. 1I) apresentou estenose subglótica adquirida adicional relacionada a uma única intubação recente, anterior àquela que levou à traqueostomia.
Quase todos os casos dos tipos III e IV (casos 4, 6 e 7) foram submetidos a traqueostomia durante os primeiros dias de vida devido à dificuldade respiratória. O caso 5 teve uma traqueostomia feita aos 14 meses de idade após a intubação, depois de um episódio de “laringite”. A queixa principal dos três casos do tipo II (1, 2 e 3) foi voz fraca e laringite recorrente, mas um deles necessitou de traqueostomia antes da reconstrução laringotraqueal devido à gravidade dos episódios obstrutivos e à logística do momento da cirurgia reconstrutiva (caso 2).
Quatro pacientes (57%) apresentavam características fenotípicas e o diagnóstico de microdeleção 22q11 foi confirmado após encaminhamento ao geneticista (casos 1, 2, 4 e 7). Os outros três pacientes não concluíram a investigação genética, embora nenhum deles apresentasse características fenotípicas.
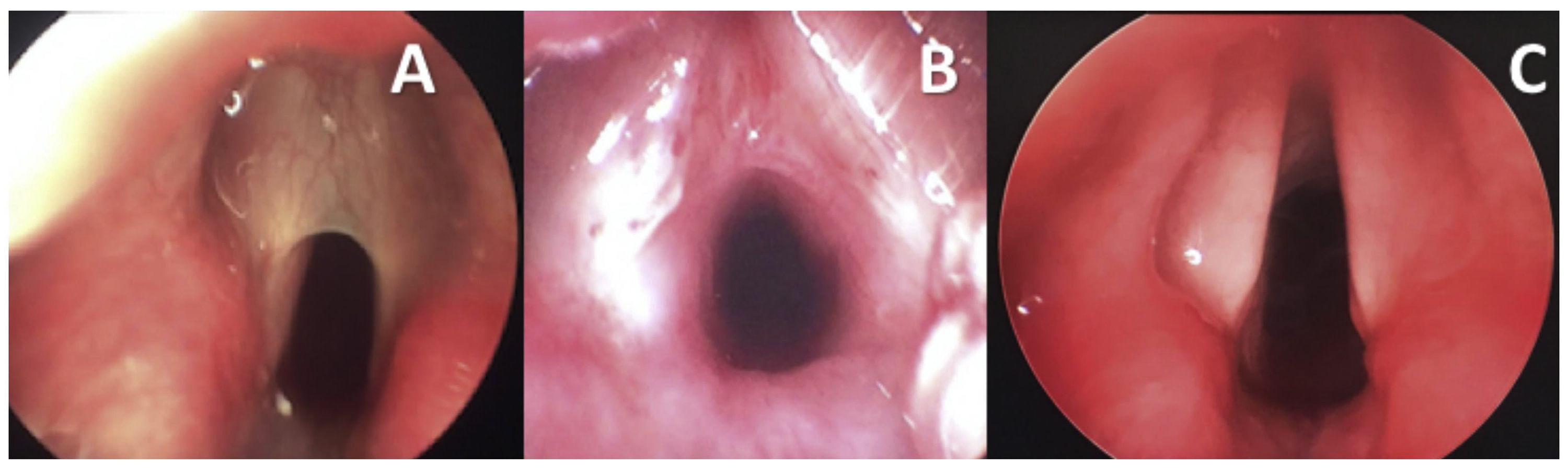
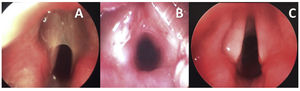
Seis pacientes foram submetidos à reconstrução laringotraqueal (RLT) e um foi tratado com abordagem endoscópica. O caso 1 apresentava uma membrana muito fina do tipo II (fig. 1A e fig. 2A), que foi inicialmente dividida endoscopicamente com instrumentação a frio. As vias aéreas foram dimensionadas com um tubo endotraqueal e revelaram uma estenose subglótica (ESG) de baixo grau II (fig. 2B). Foi feita uma tentativa de extubar o paciente sem tratamento adicional da ESG Grau II, mas falhou e a reconstrução laringotraqueal foi feita 48 horas depois com um enxerto anterior (fig. 2C). A membrana do tipo II tratada por abordagem endoscópica (caso 3) apresentou um componente supraglótico/glótico posterior atípico. Após a secção por via endoscópica da membrana e da “sinéquia posterior”, a via aérea foi dimensionada e revelou uma subglote de tamanho normal. Por esse motivo, optou‐se pela colocação endoscópica do stent (LT‐Mold) e prosseguir apenas com a traqueostomia.
Em todos os casos, o componente subglótico cartilaginoso da membrana ou estenose foi avaliado e o remodelamento submucoso com uma broca de diamante ou bisturi a frio foi feito antes da expansão do enxerto cartilaginoso, conforme descrito por Trey et al. 2
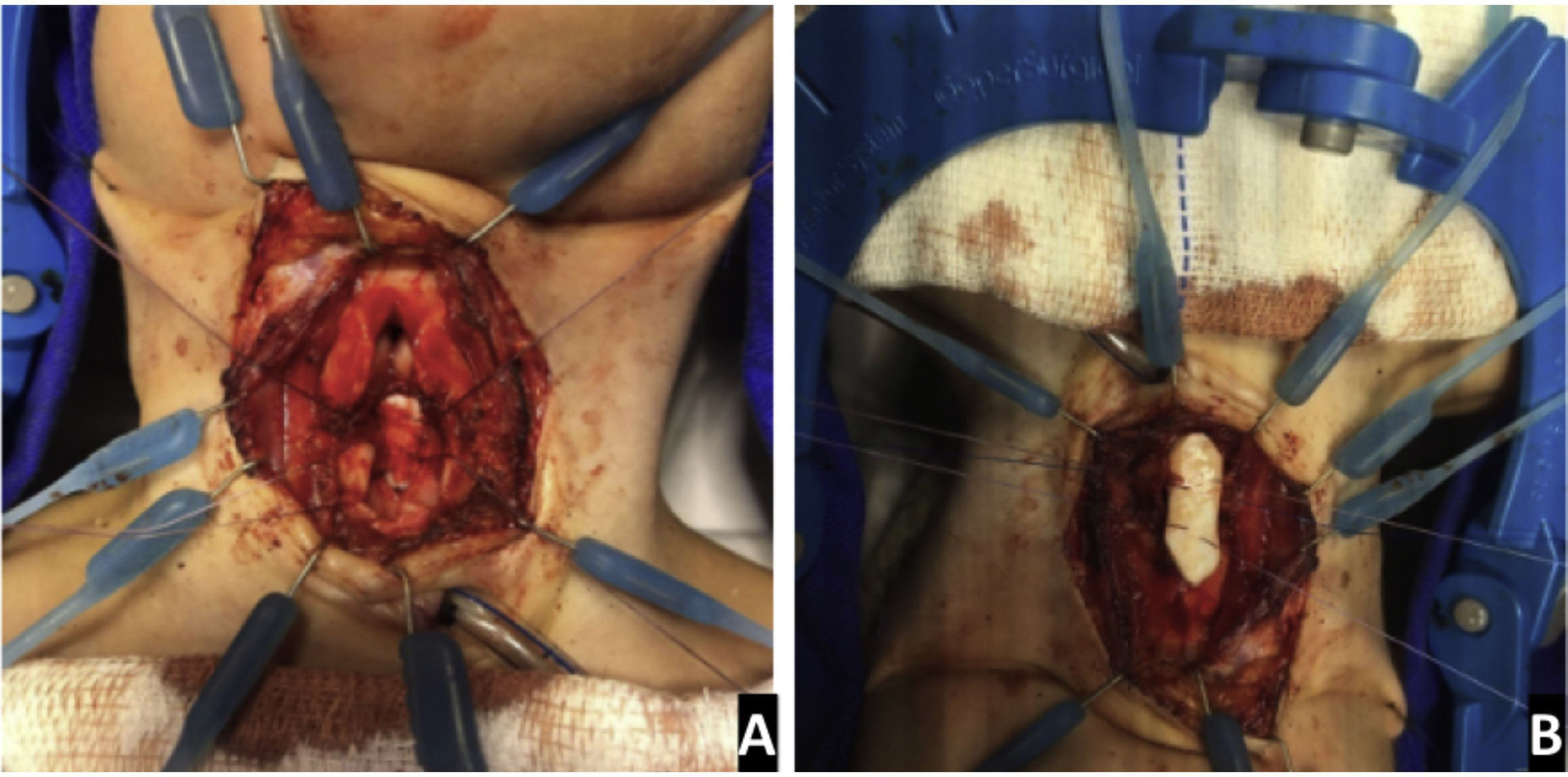
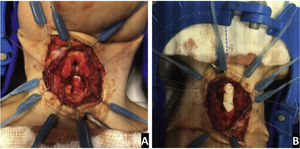
Os enxertos de cartilagem da costela foram usados para expandir as vias aéreas (fig. 3). A decisão de usar enxertos anteriores e/ou posteriores dependeu tanto da avaliação endoscópica e do tamanho das vias aéreas quanto da configuração anatômica da área cricoide e subglótica no intraoperatório.
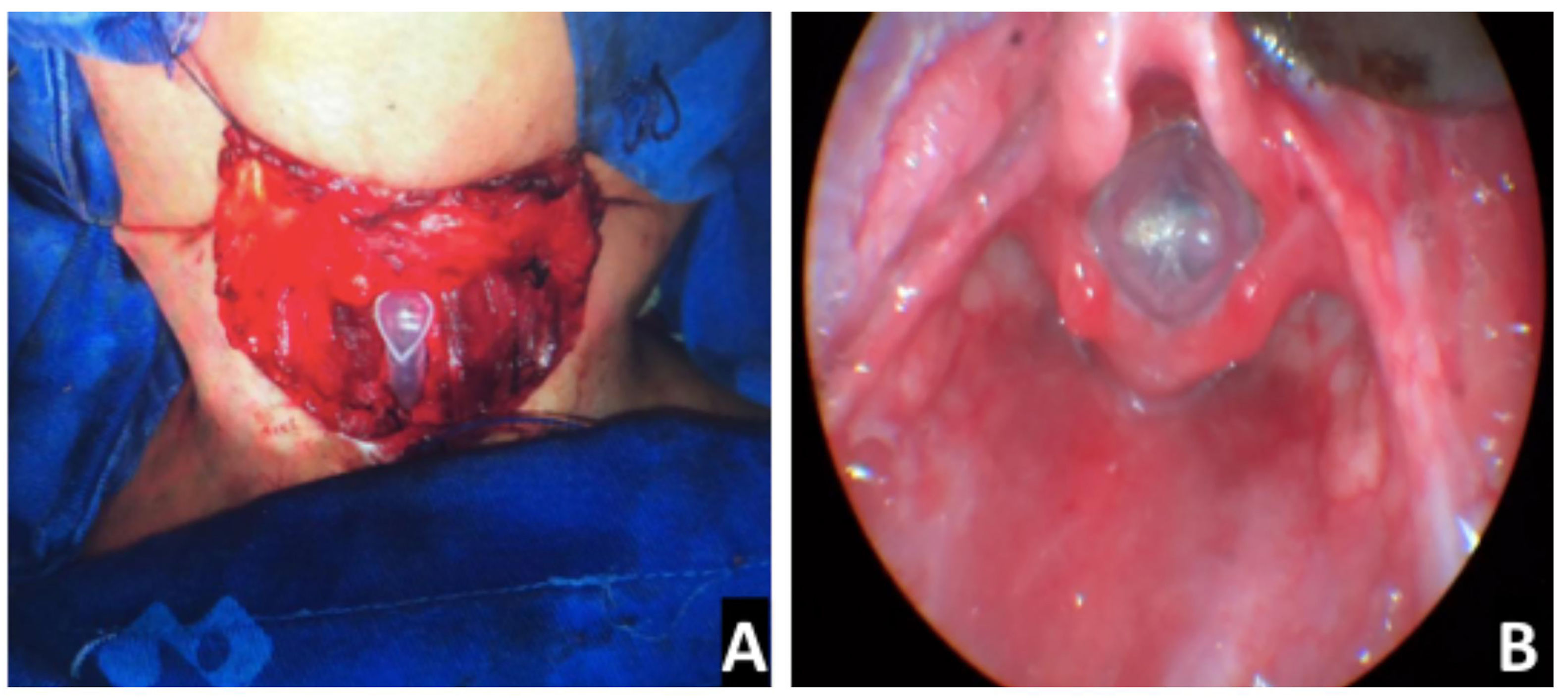
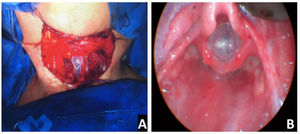
Os stents LT‐mold® de Monnier foram usados em todos os procedimentos (fig. 4). A duração do uso do stent variou de 42 a 60 dias, com média de 55 dias. A decanulação foi possível em média 43 dias após a remoção do stent.
Nenhum dos pacientes apresentou complicações e, no seguimento, não houve queixa de episódios respiratórios recorrentes ou laringite, dispneia ou disfonia. O tempo de seguimento foi superior a um ano e todos os pacientes foram decanulados com boa qualidade de voz, descrita por todos os pais como “melhor do que antes da cirurgia”. As vozes foram consideradas inteligíveis e satisfatórias para a comunicação com parentes e estranhos, apesar dos problemas de fala e linguagem, particularmente nos casos em que a microdeleção 22q11.2 foi confirmada. A imagem pré e pós‐operatória da laringoscopia pode ser vista na figura 1.
Uma busca sistemática dos dados disponíveis sobre o tema das opções de tratamento para as membranas laríngeas em crianças identificou apenas cinco artigos após a revisão com estratégias de inclusão específicas para evitar disparidades e viés de seleção, como listados na tabela 2.
Resultados da pesquisa nos bancos de dados de artigos sobre o tratamento cirúrgico da membrana laríngea. Pesquisa feita em maio de 2020
| Banco de dados | Estratégia de busca | Artigos encontrados na primeira pesquisa | Artigos encontrados na segunda pesquisaa | Artigos consideradosb | Artigos incluídosc |
|---|---|---|---|---|---|
| PUBMED | (laryngeal diseases/congenital) AND (laryngeal diseases/surgery)(laryngeal membrane) OR (laryngeal atresia) OR (laryngeal web) OR (laryngeal webs) AND (children) | 232 | 44 | 10 | 5 |
| LILACS | (laryngeal) AND (congenital malformations) | 5 | − | 0 | 0 |
A disfonia ao nascer deve sempre levantar suspeitas em relação a membranas laríngeas. Todos os sete pacientes apresentaram disfonia ao nascimento. Embora nem todos apresentassem estridor neonatal, os que não apresentaram tiveram episódios de laringite durante os primeiros seis meses. A disfonia persistente e a laringite recorrente ou laringite que ocorre em idade atípica devem ser investigadas e encaminhadas a um otorrinolaringologista experiente para avaliação.
Recém‐nascidos com disfonia e/ou dificuldade respiratória devem ser submetidos a uma nasofibroscopia com o paciente acordado, que será conclusiva para o diagnóstico.2 No entanto, a microlaringoscopia e a broncoscopia (MLB) sob anestesia geral são imprescindíveis para avaliar a extensão da membrana para a área subglótica, dimensionar a via aérea com tubos endotraqueais apropriados e procurar outras anomalias concomitantes das vias aéreas.4 Isso é importante para evitar intubação “cega” e cicatrizes adicionais em uma laringe anormal, como visto no caso 5.
No presente relato, um dos casos apresentava malformação associada das vias aéreas (tabela 1). Como originalmente descrito por Cohen, a estenose subglótica isolada pode ser encontrada1 nas membranas laríngeas tipo II, como ocorreu no caso 1. A sinéquia interaritenóidea sem histórico de intubação, como encontrada no caso 2, não foi descrita e isso mostra quão variadas as membranas congênitas podem ser, o que reforça a necessidade de um exame meticuloso.
A classificação de Cohens é muito útil e mostra uma correlação muito boa com os sintomas, as membranas dos tipos I e II são menos sintomáticas e os tipos III e IV mais sintomáticas.1 Entretanto, particularmente nas membranas do tipo II, no qual ambas as abordagens endoscópicas e abertas podem ser boas opções, pode haver uma grande variação na apresentação, conforme ilustrado por esses casos. As membranas do tipo II podem ser muito finas, com boa delimitação das cordas vocais, um pouco mais espessas, com extensão subglótica ou não, ou até mesmo associadas a ESG isolada (como no caso 1), e, em cada caso, uma abordagem diferente pode ser considerada. A restauração da melhor voz e das vias aéreas pode ser alcançada pela meticulosa correção submucosa da malformação cartilaginosa, expansão das vias aéreas com enxerto de cartilagem, preservação da mucosa e uso de um stent adequado que possa sustentar a comissura anterior em forma de V. Não se deve confiar apenas nessa classificação para predizer a melhor abordagem cirúrgica e, principalmente nas cirurgias da membrana tipo II, elas devem ser adaptadas a cada paciente caso a caso.
A incidência de microdeleção 22q11 em pacientes que apresentam membranas laríngeas é de até 65%.2,8 Lawlor et al., na maior série de casos publicada até hoje em um período de observação de 22 anos, relatou 10 das 16 membranas congênitas (62%) com microdeleção 22q11. Esse distúrbio genético, também conhecido como síndrome de Di George ou síndrome de Shprintzen, é causada pela microdeleção 22q11, que é testada por hibridização fluorescente in situ (FISH) ou sequenciamento direto.5,6,8 Nem todos os pacientes com microdeleção 22q11 apresentam a mesma ou toda a gama de malformações, como alterações cardíacas, portanto a avaliação genética é imprescindível. Essa é a microdeleção mais frequente em humanos e o conhecimento sobre suas diferentes apresentações tem aumentado.9 As frequências da insuficiência velofaríngea, imunodeficiência, atraso na fala e problemas de aprendizado são particularmente altas e é importante que sejam abordadas em um estágio inicial. Quatro (57%) dos pacientes relatados apresentaram resultado positivo e três não concluíram a investigação, mas não apresentam características fenotípicas.
A cirurgia endoscópica com incisão na membrana, com instrumentos a frio ou laser, é uma opção de tratamento muito popular, especialmente se não houver extensão subglótica.10 No entanto, existe um potencial de formação de sinéquias na comissura anterior.5,6 Alguns autores sugerem o uso de quilhas em casos endoscópicos para evitar a sinéquia anterior. O uso de quilhas deve ser visto com cautela em crianças pequenas, uma vez que podem ocorrer insuficiência respiratória e cicatrizes na área da glote. Diferentemente dos adultos, o uso de quilhas em crianças pequenas exige uma traqueostomia para proteger as vias aéreas. Um dos pacientes relatados foi inicialmente submetido à cirurgia endoscópica, uma com incisão simples da membrana, seguida de RLT após falha na extubação, e outro foi tratado com um único procedimento endoscópico, que consistiu em incisão na membrana, dilatação com balão e uso de stent com endoprótese LT‐mold®. A mitomicina C não foi usada.
Em todos os casos atuais, o LT‐mold® de Monnier foi usado para o stenting na área glótica. Sua forma triangular no nível da glote ajuda a apoiar a comissura anterior e expande a área subglótica ao mesmo tempo durante a reepitelização.2 Embora outros materiais e stents possam ser adaptados, particularmente nas pequenas vias aéreas, o uso de um stent adequado que se encaixa perfeitamente na forma da laringe dos lactentes deve ajudar a prevenir o tecido de granulação secundária e as cicatrizes.2 Os cirurgiões devem ter muito cuidado ao adaptar os stents e, principalmente, as quilhas nas pequenas vias aéreas, pois a obstrução das vias aéreas pode ocorrer mesmo sem a formação visível de tecido de granulação. Não há consenso quanto ao tempo em que o stent deve ser deixado no local.11 O tempo de permanência do stent nas cirurgias relatadas variou de 42 a 60 dias. Infelizmente, o LT‐mold® atualmente não está disponível comercialmente.
O tratamento bem‐sucedido deve envolver uma via aérea funcional patente e uma qualidade de voz satisfatória. Pacientes com membranas laríngeas tipo III e IV apresentam maior risco de baixa qualidade vocal e estenose subglótica residual devido ao extenso envolvimento glótico e malformação subglótica associada.2
A qualidade da voz descrita neste relato foi subjetiva e é necessário um seguimento mais longo para concluir que as necessidades vocais continuam satisfatórias a longo prazo até a idade adulta e adolescente.
A busca sistemática da literatura revelou cinco artigos que relatam especificamente o tratamento cirúrgico das membranas laríngeas e desfechos. Com exceção do grupo de Lausanne relatado por Trey et al.,2 os relatos de casos são bastante heterogêneos. O grupo de Lausanne relata membranas laríngeas mais graves dos tipos III e IV. Rodriguez et al. relataram oito casos, um dos quais uma membrana do tipo I sem tratamento cirúrgico necessário e outra membrana do tipo III para a qual nenhum tratamento cirúrgico foi descrito, exceto uma traqueostomia.5,7
Goudy et al. relataram em 2010 uma série de 18 casos em 25 anos.12 Lawlor et al. recentemente relataram 37 casos, mas apenas 16 congênitos em 22 anos e mais da metade dos casos era de membranas laríngeas de grau I, ambas congênitas e adquiridas.9 A experiência cirúrgica em ambas as séries provavelmente variou bastante, seconsiderarmos o período durante o qual os casos foram tratados, o número de cirurgiões e a experiência em evolução. Apesar do número relativamente grande desses dois estudos, Lawlor et al. trataram apenas duas membranas de grau IV9 e Goudy et al. apenas uma membrana de grau IV.12 No estudo atual, o período foi consideravelmente mais curto, apenas dois cirurgiões fizeram todas as cirurgias e nenhum dos casos havia sido tratado anteriormente. Apesar de a maioria dos pacientes ter membranas de grau III e IV, o número de procedimentos e o tempo para decanulação foram consideravelmente menores. Nos últimos anos, o entendimento dessas lesões mostrou que as membranas laríngeas de grau III e IV são mais bem tratadas com abordagens abertas.2,12 Isso pode explicar por que não foram observadas complicações e os resultados foram tão satisfatórios com os pacientes decanulados após um período máximo de 6 meses do pós‐operatório. Lawlor et al. descreveram 8 membranas laríngeas congênitas de grau III e 2 de grau IV e apenas uma cirurgia aberta foi indicada antes de qualquer outra tentativa endoscópica.9 Esses autores encontraram uma taxa de recorrência de 45% que levou a múltiplos procedimentos nas membranas laríngeas de grau III e IV, enquanto na série atual os pacientes eram assintomáticos após um procedimento. A escolha inicial para uma abordagem endoscópica no tratamento dessas membranas laríngeas de alto grau pode ter contribuído para cicatrizes adicionais e tratamento subótimo das vias aéreas.
O estudo de Trey et al. é o único que descreve especificamente os resultados da voz, também de maneira subjetiva.2 O grupo deles descreve uma melhor qualidade de voz no pós‐operatório em 91% dos 14 casos, mais de 50% dos casos apresentaram boa qualidade de voz no pós‐operatório ou levemente disfônica. Esse grupo também usou o LT‐mold® como stent e seus resultados de voz relativamente bons, apesar do tratamento de membranas laríngeas graves, também podem se correlacionar com o uso de um stent anatomicamente mais favorável, juntamente com a meticulosa técnica cirúrgica.
A identificação de malformação congênita da cricoide é muito importante antes e no intraoperatório da RLT. O remodelamento submucoso da cartilagem cricoide nesses casos pode permitir a reconstrução meticulosa da área subglótica, conforme descrito pelo grupo de Lausanne.2 Os casos relatados neste estudo seguiram os princípios da aproximação da mucosa após a remodelação da cartilagem e o implante de stent atraumático, o que pode ter sido responsável por menos cicatrizes e resultados favoráveis da voz.
Embora esse seja um número limitado de casos, as membranas laríngeas congênitas são muito raras e os relatos cirúrgicos são escassos, principalmente em relação aos resultados pós‐operatórios. Os resultados objetivos da voz são desafiadores em crianças pequenas, como os apresentados nesta série; entretanto, o relato dos pais de qualidade satisfatória da voz no pós‐operatório em uma criança anteriormente disfônica não pode ser subestimado.
Estudos futuros devem se concentrar no seguimento em longo prazo da qualidade e do desempenho da voz em crianças tratadas para membranas laríngeas, particularmente para membranas tipo II com pouco comprometimento das vias aéreas cujas cirurgias possam eventualmente ser adiadas. A comparação dos resultados em grupos homogêneos maiores seria ideal; isso pode ser alcançado com grupos multicêntricos, se seguirmos protocolos precisos de classificação e resultado.
ConclusãoA membrana laríngea congênita deve ser suspeitada e avaliada minuciosamente na presença de disfonia neonatal e início precoce da laringite. Os otorrinolaringologistas devem estar familiarizados com lesões associadas e condições genéticas que podem estar associadas a membranas laríngeas congênitas. As membranas laríngeas congênitas são tratadas com sucesso em idade precoce. A escolha da técnica cirúrgica após avaliação meticulosa dos componentes glóticos e subglóticos da membrana, a presença de lesões concomitantes e o uso de um stent adequado são imprescindíveis para evitar cicatrizes persistentes e má qualidade da voz.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao professor Philippe Monnier por seus generosos ensinamentos e doação do LT‐mold®.
Como citar este artigo: Avelino MA, Pazinatto DB, Rodrigues SO, Maunsell R. Congenital laryngeal webs: from diagnosis to surgical outcomes. Braz J Otorhinolaryngol. 2022;88:497–504.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.