Chronic rhinosinusitis with nasal polyps, a prevalent disease affecting around 2% of the world population, is characterized by symptomatic inflammation of the nasal mucosa and impairment of quality of life. Chronic rhinosinusitis with nasal polyps has a multifactorial etiology, involving a dysfunctional host response to environmental factors. Thus, inflammatory models may be useful to shed light on the pathophysiology of this disease. Micronucleus count has been used to screen DNA damage in various tissues.
ObjectiveTo investigate the association between frequency of micronucleus in exfoliated cells from the nasal cavity of patients with chronic rhinosinusitis with nasal polyps and disease severity.
MethodsThis cross‐sectional study included 21 patients with chronic rhinosinusitis with nasal polyps and 19 controls without disease. None of the participants were smokers.
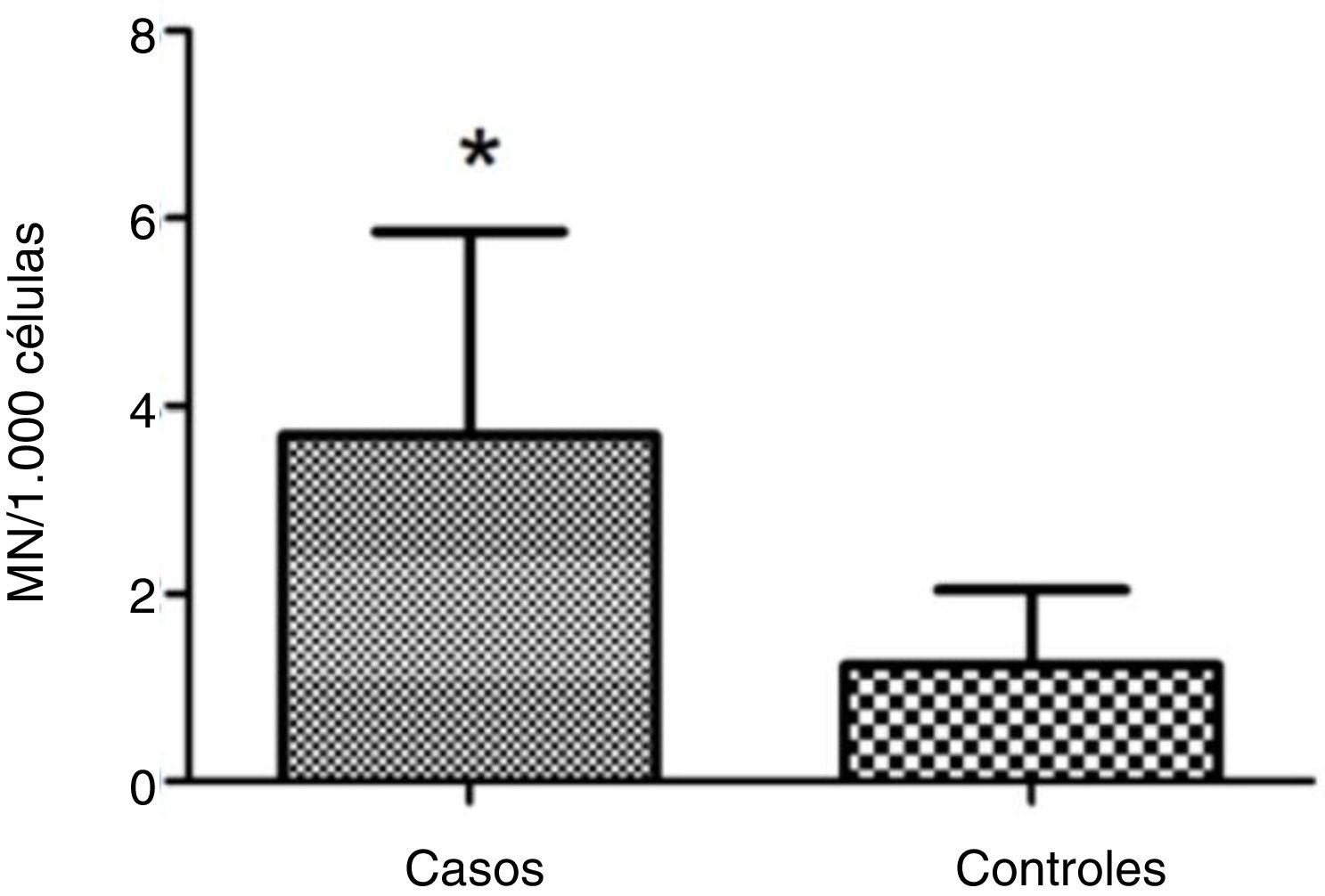
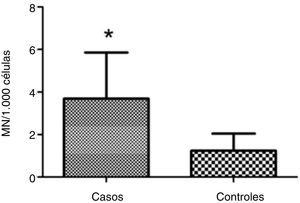
ResultsMean micronucleus count was 3.690 per 1000 cells (±2.165) in individuals with vs. 1.237 per 1000 cells (±0.806) in controls; (Student's t test = 4.653, p < 0.001). Nasal surgery in the past 5 years and aspirin‐exacerbated respiratory disease were not associated with nicronucleus count (p = 0.251).
ConclusionMicronucleus count seems to be linked to chronic rhinosinusitis with nasal polyps, providing a new perspective for the evaluation of this disorder.
A rinossinusite crônica com pólipos nasais, doença prevalente que afeta cerca de 2% da população mundial, é caracterizada por inflamação sintomática da mucosa nasal e comprometimento da qualidade de vida. A rinossinusite crônica com pólipos nasais tem etiologia multifatorial, envolvendo resposta disfuncional do hospedeiro a fatores ambientais. Assim, modelos inflamatórios podem ser úteis para esclarecer a fisiopatologia dessa doença. A contagem de micronúcleos tem sido usada para rastrear danos no DNA em vários tecidos.
ObjetivoInvestigar a associação entre a frequência de micronúcleos em células esfoliadas da cavidade nasal de pacientes com rinossinusite crônica com pólipos nasais e a gravidade da doença.
MétodoEstudo transversal que incluiu 21 pacientes com rinossinusite crônica com pólipos nasais e 19 controles sem doença. Nenhum dos participantes era fumante.
ResultadosA contagem média de micronúcleos foi de 3,690 por 1.000 células (± 2,165) nos indivíduos doentes e 1,237 por 1.000 células (± 0,806) nos controles (teste t de Student = 4,653; p < 0,001). A cirurgia nasal nos últimos 5 anos e a doença respiratória exacerbada por aspirina não foram associadas à contagem de micronúcleos (p = 0,251).
ConclusãoA contagem de micronúcleos parece estar ligada à rinossinusite crônica com pólipos nasais, proporcionando uma nova perspectiva para a avaliação dessa doença.
A rinossinusite crônica com pólipos nasais (RSCcPN) é caracterizada por inflamação sintomática persistente (12 semanas ou mais) da mucosa nasal e dos seios paranasais, com o desenvolvimento de pólipos nasais.1 Estima‐se que a prevalência mundial de RSCcPN varie de 2% a 5%.2,3 Em alguns pacientes, a RSCcPN está associada a uma pioria significativa na qualidade de vida, comparável àquela resultante da artrite reumatoide e da diabetes mellitus.4
Uma etiologia multifatorial foi estabelecida para a RSCcPN, possivelmente envolve uma resposta disfuncional do hospedeiro a fatores ambientais, bem como contribuições genéticas e epigenéticas para aumentar a suscetibilidade individual.5 Sabe‐se que o tratamento clínico e/ou cirúrgico adequado da RSCcPN melhora significativamente a qualidade de vida.6 No entanto, por razões desconhecidas, em alguns pacientes a RSCcPN é refratária ao tratamento, leva à persistência dos sintomas e à recorrência de difícil manejo. Até o presente momento, não há recursos laboratoriais disponíveis para distinguir entre os diferentes tipos de anormalidades ou estabelecer o prognóstico de pacientes com RSCcPN.
Em alguns distúrbios respiratórios, como asma e bronquiolite viral aguda,7 micronúcleos (MN) foram identificados como marcadores úteis de dano celular. Os MN são capazes de sinalizar eventos associados à genotoxicidade celular e molecular, fornecem apoio para uma melhor compreensão da etiologia e da patogênese e, consequentemente, para o estabelecimento de estratégias de prevenção.8 Assim, a identificação de MN em células esfoliativas de indivíduos com RSCcPN pode ser uma ferramenta útil para esclarecer os mecanismos subjacentes à RSCcPN.9
O objetivo do presente estudo foi investigar a associação entre a frequência de MN em células esfoliadas da cavidade nasal de pacientes com RSCcPN e a gravidade da doença.
MétodoUm estudo transversal controlado foi feito no ambulatório de otorrinolaringologia da Santa Casa de Porto Alegre. Com uma técnica de amostragem consecutiva, foram selecionados pacientes ≥ 18 anos, com diagnóstico clínico de RSCcPN, que passaram por consulta no serviço de otorrinolaringologia nos meses de julho e agosto de 2015. Fumantes atuais e pacientes com infecções ativas foram excluídos.
Um grupo controle foi escolhido por amostragem de conveniência na enfermaria cirúrgica do hospital. Funcionários e parentes/acompanhantes de pacientes cirúrgicos foram convidados a participar. Os mesmos critérios de exclusão usados para os pacientes foram aplicados ao grupo controle. Além disso, aqueles com doença ativa das vias aéreas superiores também foram excluídos. Indivíduos com ≥ 18 anos que concordaram em participar do estudo foram incluídos no grupo controle.
Todos os participantes forneceram consentimento informado por escrito antes do início do estudo. O protocolo foi aprovado pelo comitê de ética em pesquisa da Santa Casa de Porto Alegre (8064/2015).
Protocolo do estudoApós entrevista médica e exame otorrinolaringológico, os pacientes com evidências de RSCcPN foram convidados a participar do estudo. Aqueles que concordaram em participar assinaram o termo de consentimento livre e esclarecido e responderam a um questionário de saúde padronizado, administrado a todos os participantes por um dos pesquisadores (RLD), que também fez a coleta de células esfoliativas da mucosa nasal para contagem de MN. As células esfoliadas foram coletadas com o paciente na posição sentada.
O procedimento de coleta e análise de amostras baseou‐se no protocolo descrito por Thomas et al.10 Resumidamente, os espécimes foram coletados a partir do meato médio com uma escova citológica (cytobrush) e armazenados a 4°C em solução de Methacarn (metanol 3:1 ácido acético) para fixação (não superior a 14 dias). No laboratório, os microtubos foram centrifugados por 5 minutos a 19°C e 1.000 RPM. Após cada etapa de centrifugação, os espécimes foram lavados três vezes e ressuspensos. Após a última etapa de centrifugação, alíquotas de 0,5mL de suspensão de células foram transferidas para lâminas (duas lâminas por indivíduo) para coloração.
As lâminas foram coradas sequencialmente: etanol 50% por 1min, seguido por etanol 20% por 1min e enxaguado com água destilada por 2 minutos. Os espécimes foram então imersos em solução de HCl 5M (40mL HCI e 60mL de água destilada), enxaguados com água destilada por 2 minutos e corados com reagente de Schiff por 80 minutos em ambiente escuro. Após esse período, as amostras foram lavadas com água corrente por 5 minutos e com água destilada por um minuto, seguido de contracoloração com solução verde rápido a 0,2% por 2 minutos. Finalmente, as amostras foram enxaguadas com água destilada durante 2 minutos.
As amostras foram analisados com um microscópio óptico com aumento de 400x. Apenas células basais e diferenciadas foram consideradas para análise. O número de micronúcleos foi contado em 1.000 células por lâmina. Os resultados foram expressos como média±desvio‐padrão. A normalidade de distribuição foi confirmada pelo teste de Shapiro‐Wilk. O teste t de Student foi usado para comparação das médias e a associação entre as variáveis foi determinada pelo teste de qui‐quadrado. Foi adotado um nível de significância de 95% (p <0,05). As análises foram feitas no SigmaPlotTM (versão 13, 2012).
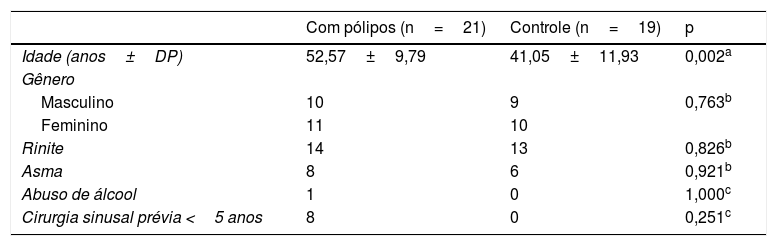
ResultadosA amostra incluiu 40 participantes, distribuídos em dois grupos de acordo com a presença de pólipos: 21 pacientes com pólipos e 19 controles sem pólipos. Não houve diferenças entre os grupos quanto aos aspectos demográficos, com exceção da idade, que foi maior nos pacientes com RSCcPN (tabela 1). Como a tríade de Samter (também conhecida como síndrome de Widal ou doença respiratória exacerbada por aspirina, DREA) tem sido associada a um mau prognóstico para doença sinusal (1), verificamos a associação entre contagem de MN e DREA. Não houve aumento de MN em pacientes com DREA (p=0,310). Também não houve associação entre cirurgia nasal nos últimos 5 anos e contagem de MN (p=0,251).
Características dos indivíduos com e sem pólipos nasais (controles)
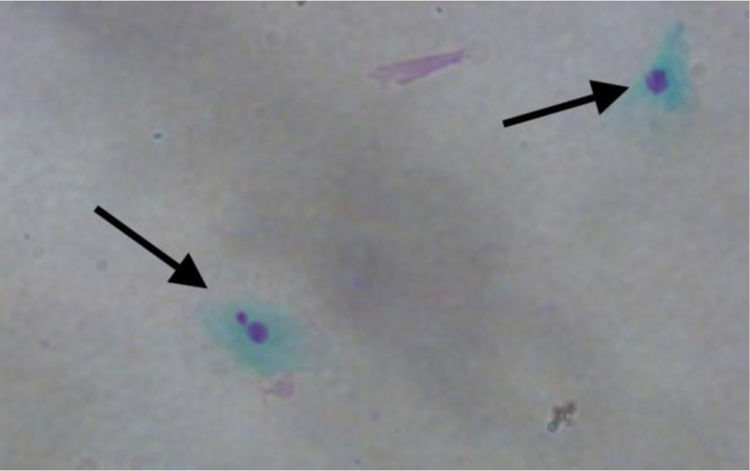
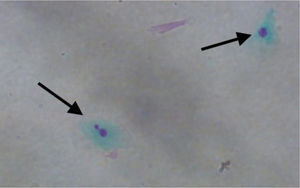
A contagem de MN foi aproximadamente três vezes maior nas células esfoliativas de pacientes com pólipos vs. controles: 3,690±2,165 MN por 1.000 células vs. 1,237±0,806 MN por 1.000 células, respectivamente (p <0,001) (fig. 1). A figura 2 mostra uma fotomicrografia de MN em células esfoliadas nasais.
A contagem de MN em células da mucosa nasal, obtidas de portadores de RSCcPN e controles por técnica esfoliativa, foi factível, simples e segura. A coleta de células esfoliativas permite a avaliação direta do órgão alvo;11 por essa razão, tem sido usada em estudos que enfocam uma variedade de doenças.12 Os MN têm sido considerados como biomarcadores carcinogênicos há muito tempo. Nas últimas décadas, os MN também foram usados como biomarcadores de danos cromossômicos, instabilidade genômica e risco de câncer.13 Mais recentemente, os MN têm sido usados para avaliar danos à mucosa nasal, através da investigação de genotoxicidade tecidual em estudos de monitoramento ambiental.14
No presente estudo, a diferença entre os participantes com e sem pólipos na contagem de MN – que foi aproximadamente três vezes maior em indivíduos com pólipos – sugere dano celular (genotoxicidade) em pacientes com RSCcPN. Até o momento, não há estudos que avaliem a contagem de MN em pacientes com polipose nasal; no entanto, outros tipos de dano celular têm sido associados a pólipos nasais. 15,16 Além disso, os presentes achados convergem com dados descritos na literatura para outras doenças, nas quais uma maior contagem de MN foi descrita nas células‐alvo de pacientes, em comparação a controles livres de doença.11 Mandard et al.17 encontraram uma contagem de MN duas vezes mais alta na mucosa oral de pacientes com doenças do trato digestivo vs. controles; Chakrabarti e Dutta18 relataram um aumento na contagem de MN proporcional ao grau de malignidade detectado em esfregaços cervicais de rotina; Herrström et al. observaram aumento na contagem de MN em amostras de sangue de jovens asmáticos.19 Estudos recentes também mostram que a contagem de MN é útil para o biomonitoramento de vários estágios da doença, inclusive triagem de genotoxicidade, detecção de malignidades, doença paraneoplásica e efeitos da radioterapia.11 No entanto, alguns autores apontam para a necessidade de estabelecer padrões de normalidade na contagem de MN em diferentes tecidos,20 o que facilitaria a comparação de resultados entre estudos de todo o mundo.
Não foi possível determinar uma correlação entre os fatores considerados de impacto negativo no prognóstico, como DREA e cirurgia nos últimos 5 anos, com o aumento da contagem de MN em amostras esfoliativas. Acreditamos que isso seja consequência do pequeno tamanho da amostra, uma vez que autores anteriores relataram que a contagem de MN varia em diferentes estágios da doença, com diminuição na contagem de MN nas células da bexiga após tratamento da esquistossomose 21, bem como após o uso de agentes protetores de DNA, como betacaroteno e vitamina A.22
Nosso estudo tem algumas limitações, como o pequeno tamanho de amostra. A incapacidade de determinar as diferenças entre os grupos, especialmente em relação aos fatores prognósticos, pode ser resultado do baixo poder amostral, levar ao erro do tipo II. Além disso, a diferença de idade entre pacientes com pólipos e controles pode também ter introduzido algum viés. Entretanto, ambos os grupos incluíram pacientes com o mesmo status biológico, a maioria dos quais era de adultos ou adultos mais velhos.23 Estudos recentes24,25 sugeriram que a contagem de MN está aumentada em adultos mais velhos. Por outro lado, investigadores como Calderon‐Garciduenas et al.26 não observaram diferenças na contagem de MN associadas à idade. Assim, estudos mais extensos podem contribuir para esclarecer o papel da idade na prevalência de MN.
ConclusãoA contagem de MN em células esfoliativas da mucosa nasal de pacientes com RSCcPN foi factível, simples e segura. Essa técnica não requer recursos laboratoriais sofisticados e pode ser facilmente feita em ambientes experimentais e clínicos. Acreditamos que a contagem aumentada de MN encontrada em nossos pacientes com RSCcPN fornece uma nova perspectiva para a avaliação desse distúrbio, cuja fisiopatologia ainda não foi totalmente compreendida.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Drummond RL, Rhoden CR, Lubianca Neto JF, Fleck AS, Padoin RC, Amantéa SL. Micronucleus count in nasal epithelial cells from patients with chronic rhinosinusitis and polyps. Braz J Otorhinolaryngol. 2020;86:743–7.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.