O nível sérico da proteína de alta mobilidade do grupo Box‐1 está relacionado com a gravidade da apneia obstrutiva do sono.
ObjetivoAvaliar o uso do nível sérico da proteína de alta mobilidade do grupo Box‐1 como um marcador biológico em pacientes com apneia obstrutiva do sono.
MétodoGeramos um modelo murino de hipóxia intermitente crônica que imita a apneia obstrutiva do sono em humanos. Pacientes com apneia obstrutiva do sono que fizeram polissonografia foram incluídos prospectivamente. Amostras de soro foram obtidas de camundongos e pacientes com apneia obstrutiva do sono e o nível sérico da proteína de alta mobilidade do grupo Box‐1 foi medido por enzyme‐linked immunosorbent assay.
ResultadosO nível sérico da proteína de alta mobilidade do grupo Box‐1 foi 56,16± 30,33 ng/mL em hipóxia intermitente crônica e 18,63± 6,20 ng/mL em camundongos controle (p <0,05). Os valores médios do índice de apneia‐hipopneia e do índice de distúrbio respiratório nos pacientes com apneia obstrutiva do sono foram 50,35±27,96 e 51,56±28,53, respectivamente, e o nível médio da proteína de alta mobilidade do grupo Box‐1 foi 30,13±19,97 ng/mL. O índice de apneia‐hipopneia e o índice de distúrbio respiratório não foram significantemente associados com o nível da proteína de alta mobilidade do grupo Box‐1 p> 0,05). Em vez disso, esse nível de proteína foi significantemente associado com o valor mais baixo da concentração arterial de oxigênio (SaO2) (p <0,05).
ConclusãoA proteína de alta mobilidade do grupo Box‐1 pode estar envolvida na patogênese da apneia obstrutiva do sono e a possibilidade de que essa proteína possa ser um marcador biológico útil na apneia obstrutiva do sono deve ser avaliada mais detalhadamente.
A apneia obstrutiva do sono (AOS), caracterizada por episódios recorrentes de interrupção ou redução da respiração durante o sono, é o distúrbio respiratório relacionado ao sono mais comum.1 A AOS induz à falta da quantidade de oxigênio necessária durante o sono e resulta em aumento do estresse oxidativo. Portanto, o estresse oxidativo foi sugerido como um dos patomecanismos subjacentes que explicam a relação entre a AOS e as complicações relacionadas à AOS, como hipertensão, disfunção endotelial e cardiopatia isquêmica.2 Por exemplo, a hipóxia intermitente induzida por AOS causou influxo de radicais livres e espécies reativas de oxigênio (ROS) e o nível aumentado de ROS induziu danos diretos ao miocárdio. O aumento de ROS durante o sono também é responsável pela up‐regulação das moléculas de adesão que podem danificar o endotélio.3 Foi ainda demonstrado que o tratamento da AOS diminuiu o estresse oxidativo, conforme comprovado pela diminuição do nível de marcadores de estresse oxidativo no plasma.4 Embora os mecanismos moleculares que levam ao estresse oxidativo na AOS não tenham sido adequadamente elucidados, a hipóxia e o aumento dos níveis de ROS são provavelmente responsáveis pelo dano oxidativo em pacientes com AOS.2
A proteína de alta mobilidade do grupo Box‐1 (HMGB1) é uma proteína ubíqua, abundante e evolutivamente conservada em eucariotos, que medeia a ligação e funções do DNA como uma molécula chaperona de DNA não histônica no núcleo. A HMGB1 foi redescoberta como um produto tardio de macrófagos estimulados por endotoxinas que podem ser secretados na área extracelular de forma passiva ou ativa através do citoplasma.5 Na área extracelular, a HMGB1 se liga a receptores, como o Toll‐Like Receptor 2 (TLR2) e TLR4, e transfere sinais inflamatórios. Portanto, os mecanismos de translocação da HMGB1 são considerados importantes para o controle da atividade imunológica. Recentemente, descobriu‐se que o estresse oxidativo é um fator crítico na determinação da função de citocina da HMGB1.6,7 ROS induzidas por hipóxia são relatadas como importantes para a translocação da HMGB1 para a área extracelular.8 Além disso, o estado redox da HMGB1 determina sua função na qual as proteínas HMGB1 reduzidas e oxidadas têm funções opostas.7 Esse achado de estresse oxidativo induzido por eventos hipóxicos ser um mecanismo importante tanto na patogênese da AOS quanto na função da HMGB1 nos levou a vincular a HMGB1 com a AOS.
Um relato anterior demonstrou que o nível sérico de HMGB1 era maior em pacientes com AOS do que em controles e o nível sérico de HMGB1 estava correlacionado com o índice de distúrbio respiratório (IDR). Após o tratamento com pressão positiva contínua nas vias aéreas (CPAP), o nível de HMGB1 voltou ao normal.9 No entanto, não houve outro estudo que avaliasse o nível sérico de HMGB1 em pacientes com AOS.
Nossa hipótese é que a HMGB1 pode ser usada como um parâmetro relevante na avaliação da AOS porque o estresse oxidativo está fortemente associado a ela.10,11 Neste estudo, nosso objetivo foi avaliar a relação entre os níveis de HMGB1 e os achados polissonográficos (PSG) e apoiar ainda mais nossa hipótese com um modelo murino de hipóxia intermitente crônica (HIC).
MétodoModelo murino de HICO modelo murino de HIC foi criado de acordo com o protocolo descrito anteriormente (fig. 1 suplementar).12 O HIC é desenvolvido como um modelo animal de AOS para investigar a patogênese essencial das complicações relacionadas à AOS, porque a exposição crônica à hipóxia‐reoxigenação é um distúrbio importante que demonstrou aumentar significativa e independentemente tanto a morbidade quanto a mortalidade de pacientes com AOS.13 Camundongos C57BL/ 6J machos adultos (8 semanas de idade) foram divididos aleatoriamente em dois grupos, com seis camundongos em cada um, que foram colocados em câmaras idênticas. O grupo HIC foi exposto a 4 semanas de HIC (12 horas de luz do dia por dia), enquanto o grupo controle foi mantido em condições normais de oxigenação. Os camundongos foram transferidos para uma câmara de HIC personalizada que foi conectada a um sistema de entrega de gás controle (Live Cell Instrument, Seul, Coreia do Sul) durante o HIC. Cada ciclo de 120 s incluiu um estágio em que o O2 na câmara foi mantido em um ponto mais baixo de concentração de 5%, seguido pela restauração para 21%.
Os camundongos foram eutanasiados no dia seguinte à exposição final à hipóxia e amostras de sangue foram coletadas por punção cardíaca. A eutanásia dos camundongos antes da detecção dos níveis séricos de HMGB1 foi feita em estudos anteriores, não afetou significativamente os resultados do experimento.8 O soro foi centrifugado imediatamente e as amostras de soro foram obtidas e mantidas a ‐70°C até o seu uso nos procedimentos experimentais. Os níveis de HMGB1 foram avaliados com as amostras de soro obtidas.
PacientesO protocolo para coleta de dados humanos foi aprovado pelo conselho de ética institucional do Yonsei University College of Medicine (4‐2018‐0304, 4‐2014‐0246). O consentimento informado foi obtido de todos os participantes. Pacientes entre 19 e 70 anos que procuraram o serviço de otorrinolaringologia do Severance Hospital foram incluídos neste estudo.
Todos os participantes foram avaliados por PSG. Todas os registros receberam escores com base em épocas de 30 segundos de acordo com os critérios da American Academy of Sleep Medicine (AASM).14 Os estágios do sono receberam escores que usaram os critérios‐padrão. A apneia foi definida como a interrupção do fluxo de ar por 10 s e a hipopneia foi definida como uma redução de 30% do fluxo de ar ou dos movimentos respiratórios acompanhada por uma diminuição de 3% na saturação de oxigênio no sangue arterial e/ou seguida por um despertar. O índice de apneia‐hipopneia (IAH) foi calculado para todos os pacientes e somente aqueles com IAH>5 foram incluídos. Pacientes com IAH de 5 a 15 foram colocados no grupo de AOS leve, aqueles com IAH de 16 a 30 no grupo de AOS moderada e aqueles com IAH> 30 no grupo de AOS grave, de acordo com um estudo anterior.15
As amostras de sangue foram coletadas em tubos com EDTA e tubos sem anticoagulante e imediatamente centrifugadas a 2500g por 5min. As amostras de soro separadas foram coletadas e armazenadas a ‐80°C até serem usadas na feitura de Elisa.
Medida do nível sérico de HMGB1Os níveis séricos de HMGB1 foram medidos por enzyme‐linked immunosorbent assay (Elisa) com o kit HMGB1 Elisa (Shino‐Test Corp., Tóquio, Japão) de acordo com o protocolo do fabricante. O teste Elisa foi feito de acordo com o procedimento de “faixa normal”, com sensibilidade de 0 a 80 ng/mL.
Análise estatísticaAs análises estatísticas foram feitas com o software SPSS 23.0 (IBM Corp., Armonk, NY, EUA). Os dados foram apresentados como média±desvio‐padrão. O teste de Spearman foi usado para análise de correlação entre variáveis contínuas. As análises de regressão univariada e multivariada foram feitas para determinar os fatores que se associaram significantemente com o nível de HMGB1; valores de p iguais a ou menores do que 0,05 foram considerados estatisticamente significantes.
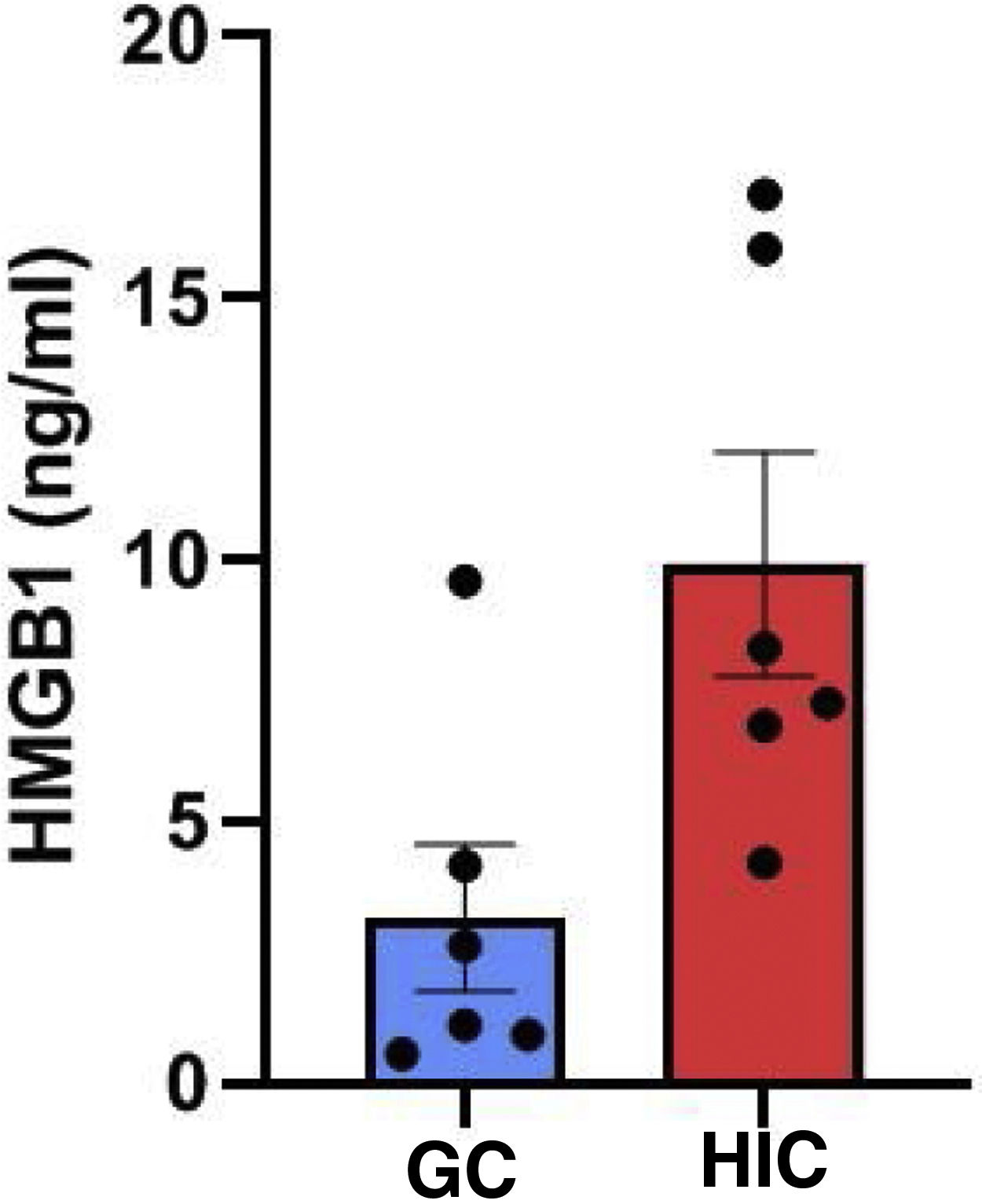
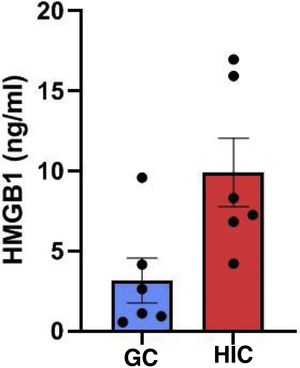
ResultadosModelo murino de HICGeramos um modelo murino de HIC e um grupo de controle (n=6, em cada). Amostras de soro foram obtidas de ambos os grupos e comparadas. O nível sérico de HMGB1 foi significantemente maior no grupo HIC (9,91±5,25 ng/mL) do que no grupo controle (3,16±3,42 ng/mL) (fig. 1).
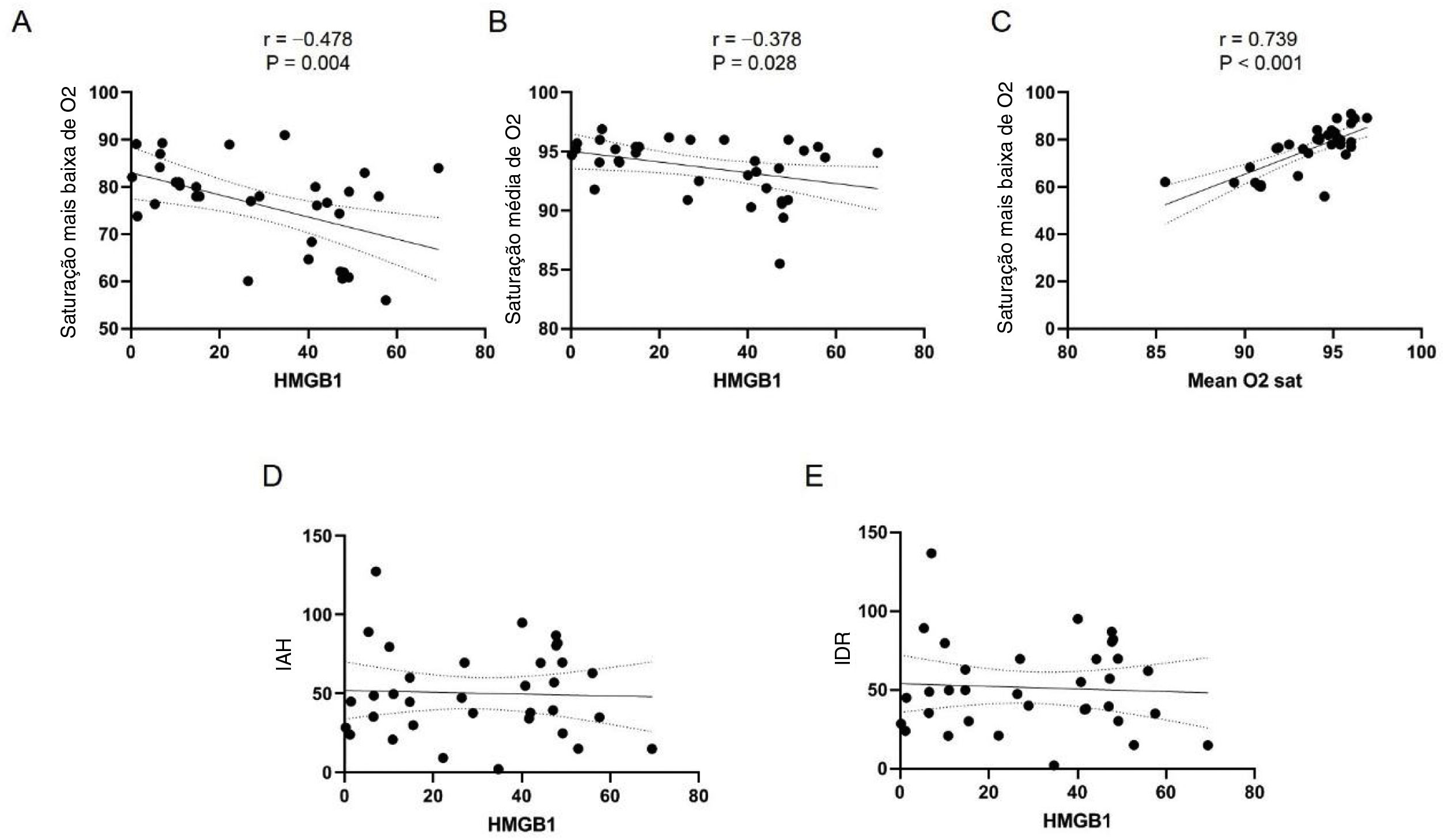
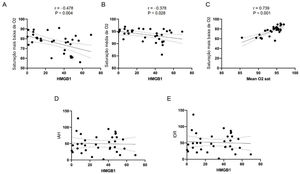
Sujeitos humanosNa etapa seguinte, recrutamos prospectivamente pacientes humanos com AOS, nos quais a PSG foi feita. Foram incluídos no estudo 34 pacientes (32 homens e 2 mulheres) com AOS. A média de idade foi de 41,85±15,30 anos. Oito pacientes (23,52%, /34) foram diagnosticados com hipertensão e quatro foram diagnosticados com diabetes (11,76%, 4/34). O nível sérico médio de HMGB1 foi de 30,13±19,97 ng/mL (tabela 1). O IAH médio foi de 50,35±27,96 e o IDR médio de 51,56±28,53 (tabela 2). As concentrações média e mais baixa de oxigênio arterial (SaO2) foram 93,66%±2,47% e 75,97%±9,70%, respectivamente. A maioria dos pacientes incluídos tinha AOS grave (26 de 34 pacientes) e dois pacientes tinham AOS leve. A média de SaO2 mínima foi de 96,1% no grupo de AOS leve, 95,01%±0,59% no grupo de AOS moderada e 73,26%±9,30% no grupo de AOS grave. A análise estatística com o nível sérico de HMGB1 e os resultados da PSG mostraram que o nível sérico de HMGB1 foi significativamente correlacionado com a SaO2 média e com o seu valor mais baixo (fig. 2 A e B) e a SaO2 média também foi associada com a SaO2 mais baixa (fig. 2C). Entretanto, o nível sérico de HMGB1 não foi correlacionado com IAH e o índice de distúrbio respiratório (IDR) (fig. 2 D e E). Nas análises de regressão univariada e multivariada dos fatores clínicos e PSG avaliados, o valor mais baixo de SaO2 foi o único fator que se manteve significativamente associado ao nível sérico de HMGB1 (tabela 3).
Características clínicas dos indivíduos estudados
| Parâmetro | Valor |
|---|---|
| n | 34 |
| Sexo, masculino/feminino | 32/2 |
| Idade, anos | 41,85±15,30 |
| Índice de massa corporal, kg/m2 | 26,73±3,48 |
| Presença de hipertensão | 23,52% (8/34) |
| Presença de diabetes | 11,76% (4/34) |
| História de tabagismo | |
| Fumante atual | 23,52% (8/34) |
| Ex‐fumante | 26,47% (9/34) |
| Não‐fumante | 50,0% (17/34) |
| HMGB1 (ng/mL) | 30,13±19,97 |
Resultados do estudo do sono nos indivíduos estudados
| Parâmetro | Valor |
|---|---|
| IAH, vezes/h | 50,35±27,96 |
| IDR, vezes/h | 51,56±28,53 |
| ID, vezes/h | 31,09±25,06 |
| SaO2 média, % | 93,66±2,47 |
| Valor mais baixo de SaO2, % | 75,97±9,70 |
| Eficiência do sono, % | 86,58±12,20 |
| Maior duração da apneia, s | 64,11±34,10 |
| Maior duração da hipopneia, s | 55,39±224,22 |
| Duração média da apneia, s | 28,80±9,66 |
| Duração média da hipopneia, s | 27,42±9,86 |
| Escore médio da ESS | 8,54±4,69 |
ID, Índice de despertares; ESS, Epworth sleepiness scale.
Associação entre os níveis de HMGB1 e SaO2, IAH e IDI. (A) O valor mais baixo e (B) o valor médio da SaO2 foram associados negativamente ao nível sérico de HMGB1. (C) O valor mais baixo de SaO2 e o valor médio foram associados entre si. (D) O IAH e (E) IDI não foram associados com o nível sérico de HMGB1.
Análises de regressão linear univariada e multivariada para identificar fatores associados ao nível sérico de HMGB1
| Variáveis | Univariada | Multivariada | ||
|---|---|---|---|---|
| β (EP) | p‐valor | β (EP) | p‐valor | |
| Idade | ‐0,093 (0,230) | 0,601 | ‐0,140 (0,210) | 0,389 |
| Sexo | ‐0,084 (14,773) | 0,637 | ‐0,100 (13,421) | 0,537 |
| IMC | 0,0140 (1,024) | 0,935 | ‐0,100 (0,949) | 0,544 |
| IAH | ‐0,043 (0,126) | 0,809 | ||
| IDR | ‐0,064 (0,125) | 0,723 | ||
| ID | 0,089 (0,144) | 0,089 | ||
| SaO2 média | ‐0,378 (1,359) | 0,028 | ||
| Valor mais baixo de SaO2 | ‐0,478 (0,322) | 0,004 | ‐0,512 (0,340) | 0,004 |
| Maior duração de apneia | 0,137 (0,103) | 0,441 | ||
| Escore da ESS | 0,118 (0,799) | 0,526 | ||
EP, Erro‐padrão; IMC, Índice de massa corporal.
As alterações na fisiologia normal devido à disfunção metabólica e endócrina, inflamação crônica, ao estresse e à hipóxia em pacientes com AOS estão associadas a alterações nos níveis séricos de várias moléculas.16 Entre essas alterações, nos concentramos nos eventos de hipoxemia e nos níveis de HMGB1. Condições de hipóxia aumentam o nível de ROS e estresse oxidativo induzido por ROS. O estresse oxidativo é um mecanismo importante na translocação extracelular de HMGB1 e um estudo anterior comprovou a correlação do nível sérico de HMGB1 com IDR em pacientes com AOS.9 O principal achado do presente estudo é que o nível sérico de HMGB1, que é um DAMP (padrões moleculares associados a dano) e mediador da imunidade inata, estava elevado no modelo murino de HIC, mas não se correlacionou com o IAH e IDR. Em vez disso, o nível mais baixo de SaO2 foi significantemente associado aos níveis de HMGB1 no soro.
Várias reações inflamatórias estão comprovadamente associadas à AOS. Por exemplo, a ativação de monócitos17 e a ativação e proliferação de linfócitos T18 foram demonstradas na AOS. Além disso, as células B periféricas e as células T natural‐killer (NKT) estavam reduzidas em pacientes com AOS.19 Essas células imunes e marcadores de células imunes foram associados com o IAH e os valores médio e mais baixo de SaO2.20 A HMGB1 é uma proteína ubíqua que está presente em vários tipos de células e pode ser liberada na área extracelular após estimulação. Na área extracelular, a HMGB1 funciona como um DAMP, também conhecido como alarmina, que sinaliza o dano celular e ativa o sistema imunológico inato.21 Neste estudo, verificamos que o nível extracelular de HMGB1 estava significativamente elevado no soro de camundongos com HIC, sugeriu que os eventos de hipóxia durante o sono aumentaram o nível extracelular de HMGB1. Isso está de acordo com nossos achados anteriores de que as condições de hipóxia aumentam o nível de ROS e a secreção de HMGB1 na área extracelular, sugere que a HMGB1 é um marcador útil para estimar o nível de estresse oxidativo.8 Como a HMGB1 extracelular pode funcionar como um DAMP, o nível sérico elevado de HMGB1 pode estar associado a eventos inflamatórios sistêmicos durante a patogênese da AOS. Portanto, mais estudos são necessários para identificar a ligação entre AOS e HMGB1 extracelular. Curiosamente, foi relatado que o nível de marcadores de estresse oxidativo na saliva foi associado à gravidade da AOS e que o tratamento com CPAP diminuiu significativamente as concentrações matinais desses marcadores na saliva.2 Como a coleta de sangue é invasiva, monitorar o nível de HMGB1 na saliva e sua variação diurna seria outra abordagem na avaliação da HMGB1 como um biomarcador que reflete o nível de estresse oxidativo na AOS.
Que seja de nosso conhecimento, somente um estudo anterior avaliou o nível sérico de HMGB1 em pacientes com AOS.9 Naquele estudo, o nível sérico de HMGB1 correlacionou‐se positivamente com o IDR, o que não é corroborado por nossos achados. As características dos indivíduos incluídos em relação ao número de sujeitos, composição de gênero e média de idade foram semelhantes às do presente estudo. Essa discrepância significa que um grande estudo de base populacional deve ser feito para estabelecer o nível sérico de HMGB1 como um marcador biológico importante na AOS.
A novidade de nosso estudo é que avaliamos os níveis séricos de HMGB1 tanto em humanos quanto em um modelo murino. Como a HIC é considerada o mecanismo da via principal na AOS, os modelos murinos HIC são amplamente usados para estudar a AOS. Nosso achado de que camundongos com HIC tinham um nível mais alto de HMGB1 sérica apoia a ideia de que a HMGB1 extracelular no soro pode desempenhar um papel na patogênese da AOS. Neste estudo, seguimos nosso modelo de HIC anterior, que inclui 4 semanas de HIC. Existe a possibilidade de que a duração da HIC possa afetar o nível de HMGB1 e a diferença do nível de HMGB1 no modelo de camundongo com durações de HIC mais longas requer um exame mais aprofundado.
O presente estudo tem várias limitações. Em primeiro lugar, não estabelece uma relação causal entre HMGB1 e AOS. Isso limita nossas descobertas como um estudo preliminar e estudos adicionais devem ser feitos sobre como o nível sérico de HMGB1 pode ter valor clínico como um biomarcador. Em segundo lugar, este estudo é baseado em uma pequena população e não inclui indivíduos humanos normais. Existe a possibilidade de que a idade, o sexo e a presença de hipertensão subjacente possam afetar de maneira diferente o nível de HMGB1 sérico. Foi relatado que os níveis séricos de HMGB1 diminuem significativamente com a idade em indivíduos saudáveis.22 Além disso, como a maioria dos pacientes incluídos neste estudo tinha AOS grave, nossos achados podem não estar de acordo com a AOS leve. Terceiro, não avaliamos a relação entre o índice de dessaturação de oxigênio (ODI, do inglês oxygen desaturation index) ou a porcentagem do tempo total de sono com a dessaturação de oxigênio e o nível sérico de HMGB1. Estudos recentes sugerem que pacientes com IAH semelhante podem apresentar fisiopatologia diferente de acordo com a hipóxia noturna, como tempo total de sono com saturação de oxigênio <90% ou ODI. Mais estudos são necessários para avaliar a relação entre a hipóxia noturna e o nível de HMGB1.23 Por fim, avaliamos apenas o nível de HMGB1 e não avaliamos outras moléculas representativas do estresse oxidativo em pacientes com AOS.
ConclusãoEmbora um estudo anterior mostrasse que o nível sérico de HMGB1 reflete a gravidade da doença em pacientes com AOS, observamos que o nível sérico de HMGB1 não estava associado ao IAH e o IDR. Em vez disso, verificamos que a HMGB1 sérica estava significantemente elevada em camundongos com HIC e que a concentração sérica de HMGB1 estava significantemente associada ao nível mais baixo de SaO2 em pacientes com AOS. Novos estudos com uma população maior ajudariam a avaliar a utilidade da HMGB1 como marcador biológico da AOS e suas consequências pela elevação do nível de HMGB1.
Contribuição dos autoresH.J. Min escreveu o manuscrito. J.S. Park, M. Kang e J.H. Seo fizeram os experimentos in vitro e in vivo. K.S. Kim avaliou os dados de indivíduos humanos com AOS. J.H. Yoon e C.H. Kim revisaram o manuscrito. H.J. Cho projetou os procedimentos experimentais e é o responsável pelo manuscrito.
Fontes de financiamentoBolsa da National Research Foundation of Korea (NRF) financiada pelo governo coreano (NRF‐2017R1A1A1A05000760 to H.J. Min). Parcialmente financiado por uma bolsa de pesquisa do Biomedical Research Institute, Chung‐Ang University Hospital (2018). Apoio do Basic Science Research Program por meio da NRF da Coreia, financiado pelo Ministério da Educação (NRF‐2018R1D1A1A02049236 para H.J. Cho).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Medical Illustration & Design, uma parte dos serviços de apoio à pesquisa médica da Yonsei University College of Medicine, por seu apoio artístico relacionado a este trabalho.
Como citar este artigo: Min HJ, Park JS, Kim KS, Kang M, Seo JH, Yoon J‐H, et al. Serum high‐mobility group box 1 protein level correlates with the lowest SaO2 in patients with sleep apnea: a preliminary study. Braz J Otorhinolaryngol. 2022;88:875–81.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.