Os nuócitos desempenham um papel importante na imunidade do tipo 2. No entanto, a contribuição das interleucinas ILC2s na rinite alérgica ainda precisa ser elucidada.
ObjetivoAvaliar o papel dos nuócitos de linfonodos mesentéricos nas respostas alérgicas em camundongos.
MétodoApós a administração intraperitoneal de interleucina (IL)‐25 e IL‐33 em camundongos do tipo selvagem e camundongos Il17br‐/‐Il1rl1‐/‐ com deficiência dupla, os nuócitos foram purificados do tecido linfoide associado a mucosa nasal e linfonodos mesentéricos. Em seguida, avaliamos as produções de IL‐5 e IL‐13 em culturas de nuócitos. Finalmente, transferimos adotivamente os nuócitos derivados de linfonodos mesentéricos de camundongos do tipo selvagem e camundongos Il17br‐/‐Il1rl1‐/‐ para o modelo murino de rinite alérgica para avaliar seu papel nas respostas alérgicas nasais.
ResultadosMostramos que os nuócitos nos linfonodos mesentéricos de camundongos do tipo selvagem estavam up‐regulados após a aplicação de IL‐25 e IL‐33 e foram induzidos a produzir IL‐5 e IL‐13. Os espirros e fricção nasal, bem como os eosinófilos, aumentaram após a transferência adotiva de nuócitos do tipo selvagem. As concentrações de IL‐5, IL‐13, IL‐25 e IL‐33 no líquido da lavagem nasal de camundongos alérgicos também estavam aumentadas. Entretanto, os nuócitos de camundongos Il17br‐/‐Il1rl1‐/‐ não aumentaram os espirros e a fricção nasal ou eosinofilia e up‐regularam as citocinas acima no líquido de lavagem nasal.
ConclusãoOs achados demonstram que os nuócitos dos linfonodos mesentéricos de camundongos selvagens promovem respostas alérgicas em um modelo de camundongo.
A rinite alérgica (RA) é um distúrbio imunológico mediado pela imunoglobulina E (IgE) induzido pela exposição a alérgenos, caracterizado por uma inflamação polarizada tipo 2 T Helper (TH2). As citocinas do tipo Th2 como a interleucina (IL)‐5 e IL‐13 são os fatores patogênicos essenciais no início e no desenvolvimento de condições alérgicas.1 A IL‐5 acelera a eosinofilia da mucosa nasal e promove a up‐regulação do número de eosinófilos ativados. A IL‐13 regula a hiperresponsividade das vias aéreas, a metaplasia das células mucosas e a fibrose tecidual.1
Embora a célula Th2 seja uma fonte essencial de citocinas do tipo 2 na resposta imune adaptativa, muitos estudos demonstraram que a célula linfoide inata (ILC, Innate Lymphoid Cell) fornece outra fonte a mais de citocinas desse tipo, como a IL‐5 e a IL‐13.2 As populações de ILC foram categorizadas em três grupos de acordo com uma nomenclatura proposta.3 Embora existam diferenças entre esses tipos de células, elas têm em comum a produção de IL‐5 e IL‐13 em resposta ao membro da família IL‐17 IL‐25 (IL‐17E) e ao membro da família IL‐1 IL‐33 produzido a partir de células epiteliais das vias aéreas.3
Os nuócitos pertencem às ILCs do tipo 2 (ILC2), identificadas como linhagem (linfócitos, macrófagos, células dendríticas, basófilos, eosinófilos, mastócitos e células exterminadoras naturais [NK] negativas e coestimulador indutível [ICOS, inducible co‐stimulatory] positivas).4 Essas células expressam o receptor de IL‐25 (IL‐17BR) e o receptor de IL‐33 (IL1RL1 ou T1/ST2) e aumentam in vivo em resposta às citocinas indutoras de tipo 2, IL‐25 e IL‐33.4 Os nuócitos representam a fonte inicial predominante de IL‐13 durante infecção por helmintos. Na ausência combinada de sinalização de IL‐25 e IL‐33, os nuócitos não conseguem aumentar, resultam em um defeito grave na expulsão dos vermes, que é resgatado pela transferência adotiva de nuócitos do tipo selvagem cultivados in vitro.4 Apesar da proliferação através dessas duas citocinas, os nuócitos são induzidos a secretar IL‐5 e IL‐13, mas pouca IL‐4 por IL‐25 e IL‐33 durante uma infecção por Nippostrongylus brasiliensis no intestino. Além da expulsão dos parasitas, os nuócitos inatos produtores de IL‐13 surgem durante a inflamação alérgica do pulmão e contribuem para a hiper‐reatividade das vias aéreas.5
Uma pesquisa anterior mostrou que os nuócitos podiam ser induzidos por Ovalbumina (OVA) no tecido linfoide associado a mucosa nasal (NALT – Nasal Associated Lymphoid Tissue) do modelo murino de RA e podiam produzir IL‐5 e IL‐13 após a administração de IL‐25 recombinante (rm).6 Esse estudo indicou que os nuócitos podem desempenhar um papel pró‐inflamatório no estado alérgico dos modelos de camundongos.6 Outro estudo nosso avaliou a expressão de Orai1 em nuócitos, o componente principal do canal de Ca2+ ativado por liberação de Ca2+ na membrana plasmática de várias células,7 e a função dessa proteína em nuócitos (dados não publicados). No presente estudo, objetivamos avaliar o papel dos nuócitos de linfonodo mesentérico (mLN) nas respostas alérgicas em camundongos.
MétodoCamundongosCamundongos BALB/c fêmeas (6‐8 semanas de idade) foram adquiridos no Chinese Academy of Sciences Shanghai Laboratory Animal Center de Xangai. Camundongos com deficiência dupla Il17br‐/‐Il1rl1‐/‐ com uma base genética BALB/c (6‐8 semanas de idade) foram adquiridos da Cyagen US Inc. Santa Clara, CA, EUA. Os camundongos foram mantidos em cabines de fluxo laminar horizontal e receberam alimentos e água estéreis em uma instalação específica livre de patógenos. Os estudos em animais foram aprovados pelo Comitê Institucional de Cuidado e Uso de Animais da Fudan University (número ético: 201808001Z). Esses camundongos foram divididos aleatoriamente em cinco grupos (n = 12 para cada grupo).
Alergia nasal em modelos animaisDe acordo com os procedimentos publicados,8 esses camundongos receberam 0,5mg/mL de ovalbumina (OVA) (grau V; Sigma‐Aldrich, St. Louis, Missouri) e 20mg/mL de hidróxido de alumínio (Alúmen) (Sinopharm Chemical Reagent Co Ltd., Xangai, China) em solução salina normal na dose de 0,2mL por camundongo através de injeção intraperitoneal. A sensibilização foi repetida três vezes em intervalos semanais (dias 1, 8 e 15). Em seguida, os camundongos foram submetidos a teste de provocação através da instilação diária de gotículas de solução de OVA (40mg/mL em solução salina normal) nas narinas (0,02mL por camundongo) com uma micropipeta nos dias 22 a 29 (fig. 1). Como controle negativo, um grupo de camundongos recebeu o teste de provocação de tratamento com solução salina normal isoladamente (grupo normal). Dois grupos de camundongos alérgicos (grupo selvagem [Wild]: tratamento de camundongos alérgicos com nuócitos de camundongos do tipo selvagem; grupo Il17br‐/‐Il1rl1‐/‐: tratamento de camundongos alérgicos com nuócitos de camundongos Il17br‐/‐Il1rl1‐)‐) receberam o transferência adotiva de nuócitos de camundongos do tipo selvagem ou camundongos Il17br‐/‐Il1rl1‐/‐ cultivados in vitro por via intravenosa na veia da cauda em dias de teste de provocação, respectivamente, enquanto outro grupo de camundongos alérgicos não foi tratado com nuócitos (grupo RA). Além disso, outro grupo de camundongos Il17br‐/‐Il1rl1‐/‐ recebeu a transferência adotiva de nuócitos de camundongos do tipo selvagem cultivados in vitro por via intravenosa na veia da cauda em dias de teste de provocação. Os sintomas nasais relevantes foram avaliados contando o número de espirros e fricções nasais durante 10 minutos imediatamente após o último teste de provocação intranasal com OVA no dia 29.
Preparação de células NALT e mLNFoi administrado diariamente por 3 dias por via intraperitoneal 0,4μg por dose de rmIL‐25 de camundongo (R&D Systems, Inc., Minneapolis, MN, EUA) e rmIL‐33 (R&D Systems, Inc., Minneapolis, MN, EUA) em solução salina tamponada com fosfato (PBS). Os animais de controle receberam apenas PBS. Os camundongos foram sacrificados 24 horas depois e os dentes da frente foram removidos. A mandíbula inferior e os músculos da bochecha foram removidos e o NALT foi exposto removendo‐se cuidadosamente a placa. O NALT estava localizado na parte posterior da placa e foi retirado com agulhas de seringa em meio de cultura RPMI 1640 gelado, suplementado com 10% de FBS. Também foram obtidos tecidos de mLN. Todos esses tecidos foram picados com tesoura estéril em pedaços de aproximadamente <2mm e digeridos com 200μL de colagenase tipo III 200 U/mL (Sigma – Aldrich, St. Louis, MO, EUA) e 200μL de DNase Tipo IV 200μg/mL (Sigma – Aldrich, St. Louis, MO, EUA) e depois passados através de um filtro de células Falcon® 70μm. Os glóbulos vermelhos foram lisados em solução de cloreto de amônio tamponado com Tris (NH4Cl a 0,83% e 20mM Tris/Cl).
Análise por citometria de fluxoAs suspensões de células NALT e mLN de camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ foram centrifugadas por 10min a 200 ×g a 4°C e as células foram colhidas para análise por citometria de fluxo. Essas células foram lavadas com 200μL de meio de citometria de fluxo [FCM, 1% de BSA e 0,1% de azida de sódio em PBS] e incubadas com 50μL de soro de coelho por 5min à temperatura ambiente para bloquear o receptor Fcγ. Essas células foram então lavadas três vezes com FCM e coradas com 50μL de anticorpos monoclonais contra as seguintes moléculas de superfície a 4°C por 30min a 1 × 108 células/mL: CD3, CD4, CD8, CD11b, CD11c, CD19, FcɛR1, IL17BR; todos os anticorpos foram adquiridos de MyBioSource, Inc., San Diego, CA, EUA ou BioLegend, San Diego, CA, EUA e conjugados com isotiocianato de fluoresceína e anticorpo monoclonal ICOS (adquirido de MyBioSource, Inc., San Diego, CA e conjugado com ficoeritrina). Eles foram lavados novamente e incubados com 50μL de anticorpo secundário (IgG de coelho anticamundongo conjugado com biotina; Dako Denmark A/S, Glostrup, Dinamarca), seguido de 50μL de estreptavidina conjugada com R‐ficoeritrina (RPE‐estreptavidina; Dako Denmark A/S, Glostrup, Dinamarca). Após a coloração, as células foram ressuspensas em tampão de coloração com dicloridrato de 4’,6‐diamidino‐2‐fenilindole (DAPI) para exclusão de células mortas. Os controles para análise de cor única foram feitos incubando células com um anticorpo primário do mesmo isotipo, mas com especificidade irrelevante em concentrações correspondentes seguidas por reagentes secundários, como descrito acima. As amostras foram coletadas em um citômetro de fluxo LSR II equipado com o software FACSDIVA (BD Biosciences, Mountain View, CA, EUA) e analisadas com FlowJo versão 10 (Tree Star, Inc., Ashland, OR). A configuração do instrumento foi feita visualmente e a seleção do anticorpo de controle do isotipo estava de acordo com o anticorpo primário da espécie hospedeira, o isotipo e o formato de conjugação.
Culturas de nuócitosNuócitos de NALT e mLN de camundongos de tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ foram todos classificados e purificados como células CD3CD4CD8CD19CD11bCD11cFcɛR1 (linhagem)‐ICOS+ a uma concentração máxima de 6 × 107 células / mL. Eles foram cultivados por 6 dias em RPMI com 10% de FCS, 1% de penicilina/estreptomicina, 0,1% de β‐Mercaptoetanol, 10 ng/mL de rmIL‐7 de camundongo (BioLegend, San Diego, CA, EUA) e 10 ng/mL de rmIL‐33 de camundongo (BioLegend, San Diego, CA, EUA).
Então, as células do mLN dos camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ foram incubadas com 100 ng/mL de rmIL‐25 (BioLegend, San Diego, CA, EUA) e 100 ng/mL de rmIL‐33 (BioLegend, San Diego, CA, EUA) nas culturas. As culturas foram mantidas por 3 dias. Os sobrenadantes celulares foram usdos para medir a produção de IL‐5 e IL‐13 com o ensaio de imunoabsorção enzimática (Elisa) e as células foram usadas para avaliar o conteúdo dos RNAs mensageiros (mRNA) de IL‐5 e IL‐13 por reação em cadeia da polimerase – transcriptase reversa (RT‐PCR). Depois disso, os nuócitos de camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ ou nuócitos de camundongos do tipo selvagem foram ressuspensos em solução salina normal e transferidos adotivamente para camundongos RA ou Il17br‐/‐Il1rl1‐/‐ a 100μL por rato por via intravenosa na veia da cauda em dias de testes de provocação nasal.
Imunocitoquímica e microscopia confocalNuócitos de mLN de camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ foram semeados em lamínulas de vidro e cultivados por 48 horas. As células aderentes foram lavadas duas vezes com PBS e fixadas com paraformaldeído a 4% por 5min à temperatura ambiente; depois, lavadas três vezes com PBS com 0,2% de Triton X‐100 (PBS‐T) e bloqueadas com albumina sérica bovina a 3% (em PBS) por 30min. As amostras foram então incubadas durante a noite à temperatura ambiente com anticorpos primários contra IL‐13. Após a lavagem com PBS (3 x 5 minutos), as amostras foram incubadas por uma hora à temperatura ambiente com anticorpos secundários conjugados com isotiocianato de fluoresceína no escuro. As lamínulas foram então lavadas duas vezes com PBS‐T antes da coloração do núcleo com 10mg/mL de DAPI por 5min à temperatura ambiente. Finalmente, as lamínulas foram lavadas três vezes com PBS‐T e duas vezes com PBS antes de serem montadas com Vectashield (Vector Laboratories, Burlingame, CA, EUA). Como controles negativos, as amostras de células foram incubadas com o anticorpo secundário isolado ou com o anticorpo primário pré‐adsorvido com um peptídeo bloqueador específico (1: 5 p/ p). As imagens foram obtidas com um microscópio confocal de varredura a laser Leica TCS SP5 com o Leica Confocal Software (LCS) 2.61 (Leica Microsystems, Wetzlar, Alemanha). As imagens foram analisadas pelo software LCS Lite (Leica). Para permitir a comparação, todas as imagens foram adquiridas com os mesmos parâmetros de potência do laser e sensibilidade do fotomultiplicador. As imagens mostradas são representativas de pelo menos três experimentos separados em cada condição e foram processadas com valores idênticos de contraste e brilho.
Líquido de lavagem nasal (LLN)Após a eutanásia dos camundongos, uma agulha de calibre 18 foi apontada em direção às cabeças de uma parte de camundongos para o LLN. Foi aplicada uma injeção de 2000μL de solução salina normal e o líquido foi coletado com um tubo sob ambas as narinas para o LLN. Uma parte do LLN foi centrifugada por 10 minutos a 150g a 4°C. Os sobrenadantes foram armazenados a ‐70°C para ensaios de IL‐5 e IL‐13. Outra parte do LLN foi coletada para detecção de eosinófilos e contagens diferenciais de células foram feitas em 150 células com uma citocentrífuga cytospin (Cytospin 4 Shandon Ltd., Runcorn, Reino Unido) coradas com Giemsa.9
Análise por ElisaA IL‐5 na cultura e o LLN foram medidos com uma microplaca de 96 poços revestida com 1μg/mL de anticorpo de coelho IL‐5. A microplaca foi incubada em albumina de soro bovino a 3% a 37°C por 1h. Amostras na diluição de 1:10 foram então adicionadas seguidas de incubação a 37° C por 1h. Após a lavagem, o anticorpo anti‐IL‐5 (R&D Systems, Inc., Minneapolis, MN, EUA) foi biotinilado com um kit de biotinilação (American Qualex International Inc, San Clemente, CA, EUA); a amostra foi então adicionada a 1μg/mL e incubada a 25° C por 1h. Após a lavagem, foi adicionado 1,5μg/mL de estreptavidina peroxidase, seguido de incubação a 25°C por 1h. Após a lavagem, substrato de tetrametilbenzidina (TMB) (12,5mL de tampão fosfato cítrico, 200μL de solução‐estoque TMB [6mg/mL em dimetilsulfóxido], 100μL de 1% de peróxido de hidrogênio; FlukaChemical Co, Ronkonkoma, NY, EUA) foi adicionado para produzir uma reação de cor. A reação foi terminada pela adição de ácido sulfúrico 6N. A densidade óptica foi determinada a 450nm com um leitor de microplacas (Microplate Reader MTP‐32; Corona Electric, Ibaraki, Japão). As concentrações de IL‐13 na cultura e IL‐13, IL‐25 e IL‐33 no LLN foram avaliadas com os kits Elisa correspondentes (adquiridos da R&D Systems, Inc., Minneapolis, MN, EUA, ou MyBioSource, Inc. San Diego, CA, EUA).
Análise RT‐PCR em tempo realOs mRNAs de IL‐5 e IL‐13 nas culturas de nuócitos foram analisados por RT‐PCR em tempo real. O RNA total de uma parte das amostras foi extraído com Trizol (Invitrogen, Carlsbad, CA, EUA) e tratado com DNase livre de RNase. Para a transcrição reversa, 2μg do RNA acima foram transcritos reversamente com hexâmeros aleatórios (Invitrogen, Carlsbad, CA, EUA) e o cDNA foi amplificado de acordo com as instruções do fabricante. Os primers foram projetados com o software Primer Express (ABI) a partir de sequência disponível no Genbank e foram sintetizados (Geneland Biotech, Xangai, China). A RT‐PCR em tempo real foi usada para detectar mRNAs de IL‐5 e IL‐13. Os primers da IL‐5 foram: primerforward, 5’‐TCACCGAGCTCTGTTGACAA‐3’ e reverse, 5’‐CCACACTTCTCTTTTTGGCG‐3’. Os primers da IL‐13 foram: forward, 5’‐AGACCAGACTCCCCTGTGCA‐3’ e reverse, 5’‐TGGGTCCTGTAGATGGCATTG‐3’. O mRNA de GAPDH também foi examinado para controlar a variação amostra a amostra no isolamento e na integridade do RNA com um par de primers: forward 5’‐ACCACAGTCCATGCCATCAC‐3’ e reverse 5’‐TCCACCACCCTGTTGCTGTA‐3’. Após a desnaturação inicial a 95°C por 10min, o perfil de amplificação foi de 15s de desnaturação a 95°C, 1min de pareamento ou annealing e extensão a 60°C por 45 ciclos. As misturas de reação de controle negativo de RT não continham transcriptase reversa e nenhum cDNA nas misturas de amplificação por PCR. Para a medida, 2μL de cDNA diluídos foram amplificados em um volume total de reação de 20μL com um sistema de 7500 PCR em tempo real (Applied Biosystems, Foster City, CA, EUA) com 20×SYBR green mix (Invitrogen, Carlsbad, CA, EUA). A especificidade dos produtos de PCR foi avaliada por análise da curva de melting e pelo tamanho em géis de agarose. Com três diluições de cDNA, a linearidade da amplificação por PCR foi controlada. A avaliação dos dados foi feita pelo método ΔCT com GAPDH como padrão interno.
Análise estatísticaUma análise estatística foi feita com um software estatístico disponível comercialmente GraphPad Prism, 6.0 (GraphPad Software Inc., San Diego, CA, EUA). Os dados foram analisados com o teste t de Student não pareado±correção de Welch e apresentados como média±EPM (erro‐padrão da média). A significância de uma diferença foi aceita ao nível de confiança de 5%; p <0,05 foi considerado estatisticamente significativo.
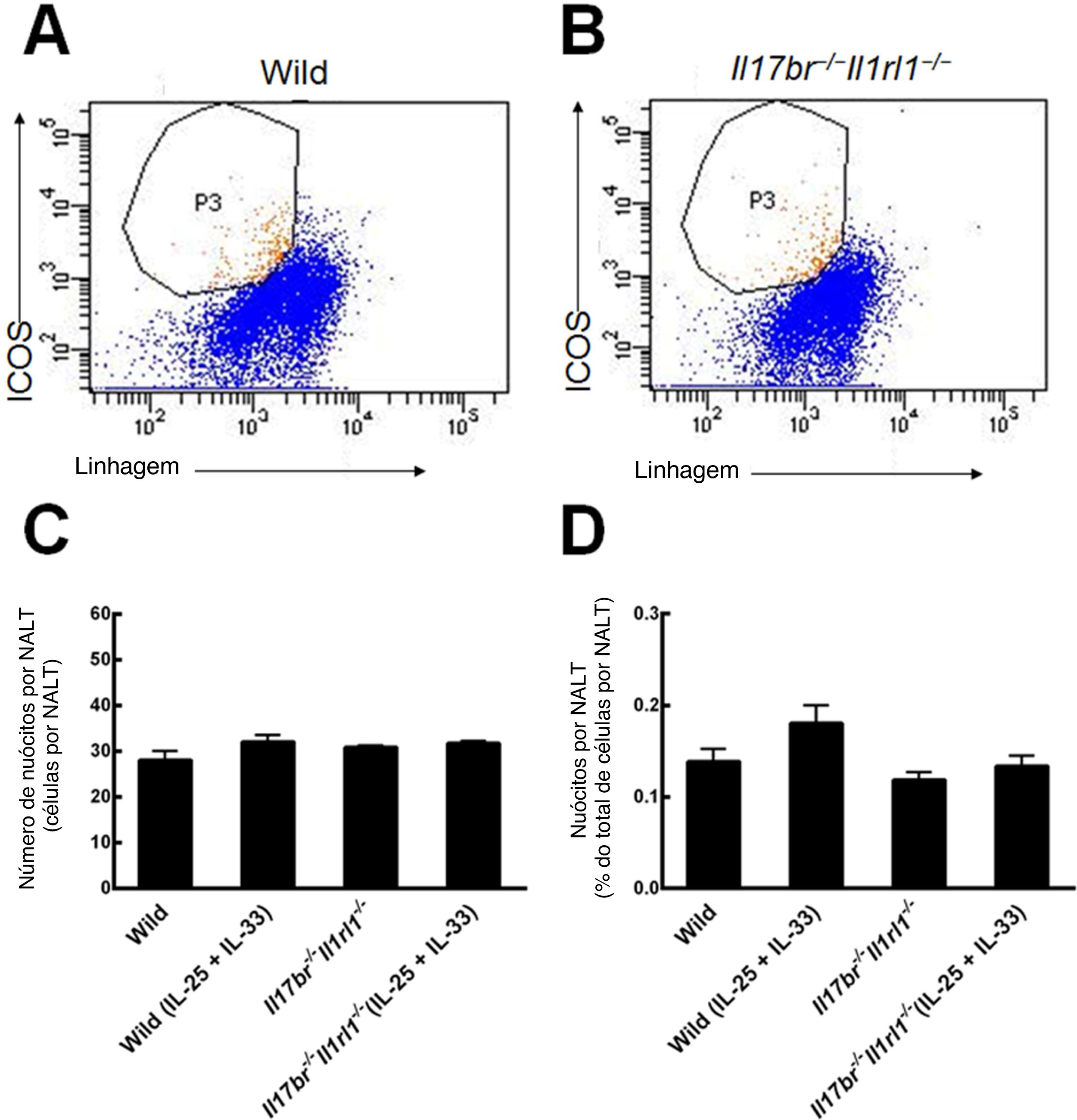
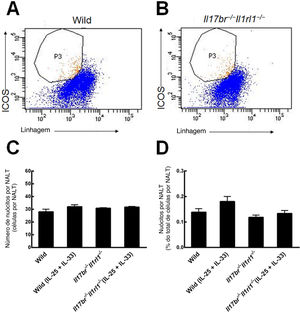
ResultadosNuócitos no NALT de camundongosNuócitos do NALT de camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ foram classificados e purificados como células de linhagem ‐ICOS+ (fig. 2 A e B).6 As comparações entre o número e a porcentagem de nuócitos do tipo selvagem indicaram que seu número e porcentagem total não estavam aumentados estatisticamente no NALT em resposta ao tratamento intraperitoneal com rmIL‐25 e rmIL‐33 (fig. 2C e D). Quanto aos camundongos Il17br‐/‐Il1rl1‐/‐, o número e a porcentagem de nuócitos também não apresentaram aumento significativo após a administração de rmIL‐25 e rmIL‐33 (fig. 2C e D). Além disso, não houve diferenças estatísticas entre os nuócitos de tipo selvagem e Il17br‐/‐Il1rl1‐/‐ no número e porcentagem por NALT antes e após o tratamento com rmIL‐25 e rmIL‐33 (fig. 2C e D). A partir dos resultados, concluímos que a administração intraperitoneal de rmIL‐25 e rmIL‐33 não influencia a proliferação de nuócitos localizados no NALT.
Nuócitos de NALT. A, Nuócitos de camundongos do tipo selvagem. B, Nuócitos de camundongos Il17br‐/‐Il1rl1‐/‐. C, Número de nuócitos. D, Porcentagem de nuócitos. Cada valor representa a média (EPM) de 6 camundongos em cada grupo. Wild, camundongos do tipo selvagem; Wild (IL‐25+IL‐33), camundongos do tipo selvagem com o tratamento de rmIL‐25+rmIL‐33; Il17br‐/‐Il1rl1‐/‐, camundongos Il17br‐/‐Il1rl1‐/‐; Il17br‐/‐Il1rl1‐/‐ (IL‐25+IL‐33), camundongos (IL‐25+IL‐33), Il17br‐/‐Il1rl1‐/‐ com tratamento de rmIL‐25+rmIL‐33.
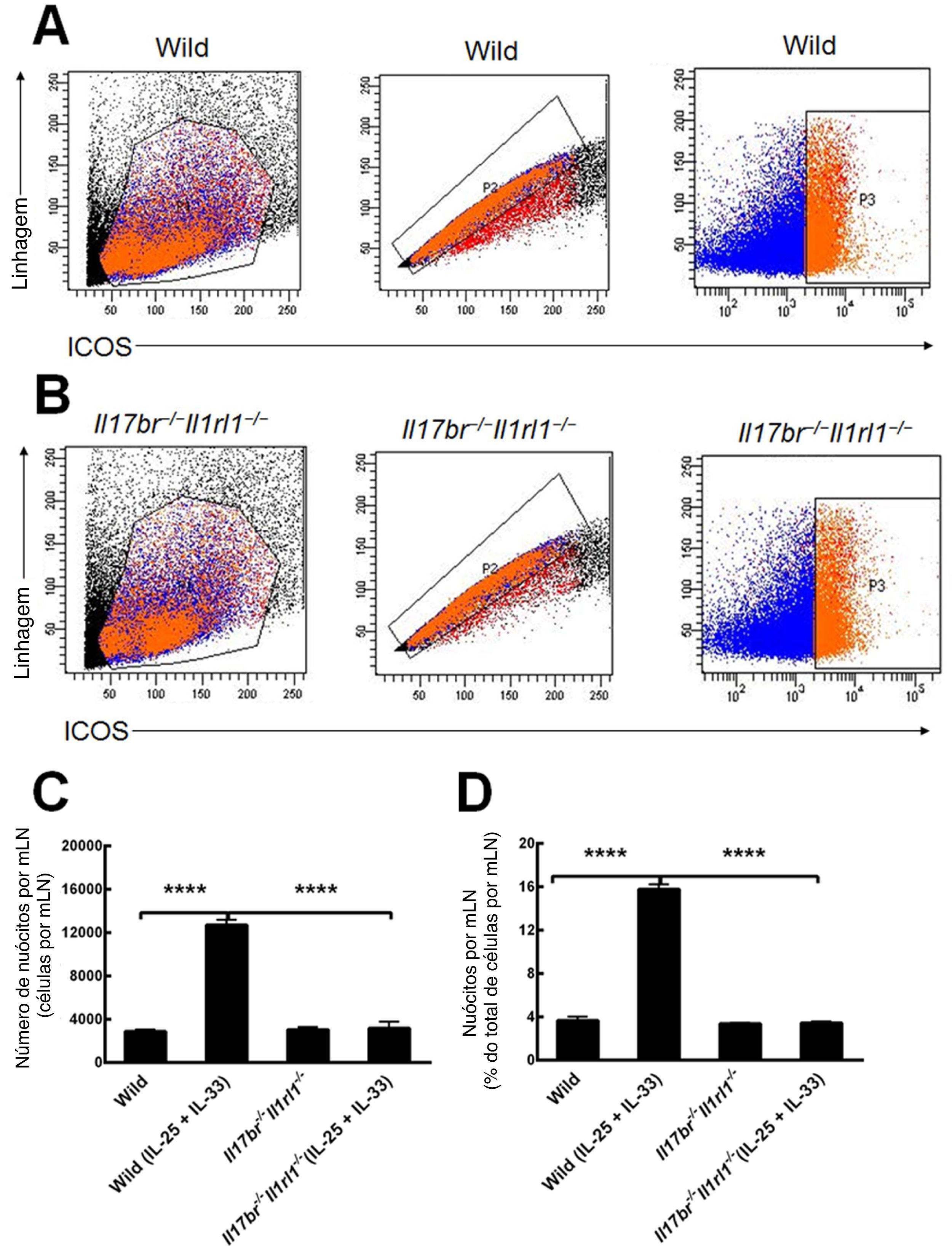
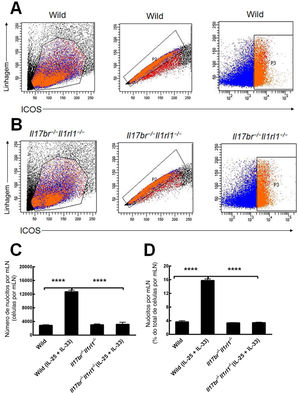
Nuócitos de mLN de camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ também foram classificados e purificados como células da linhagem ‐ICOS+ (fig. 3 A e B).4 Comparações do número e porcentagem de nuócitos do tipo selvagem (Wild) demonstraram que o número total e a porcentagem estavam aumentados estatisticamente no mLN em resposta ao tratamento intraperitoneal com rmIL‐25 e rmIL‐33 (fig. 3C e D). Nos camundongos Il17br‐/‐Il1rl1‐/‐, o número e a porcentagem de nuócitos não indicaram aumento significativo após a aplicação de rmIL‐25 e rmIL‐33 (fig. 3C e D). Além disso, não houve diferenças estatísticas entre nuócitos de tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ no número e porcentagem por mLN antes do tratamento com citocinas e grandes diferenças após o tratamento com citocinas (fig. 3C e D). Os dados demonstram que os nuócitos não aumentam nos camundongos combinados Il17br‐/‐Il1rl1‐/‐ no mLN em resposta a rmIL‐25 e rmIL‐33,4 e IL‐25 e IL‐33 são necessários para a geração de nuócitos durante a inflamação do tipo 2.
Nuócitos do linfonodo mesentérico (mLN). A, Nuócitos de camundongos do tipo selvagem. B, Nuócitos de camundongos Il17br‐/‐Il1rl1‐/‐. C, Número de nuócitos por mLN. D, Porcentagem de nuócitos por mLN. Cada valor representa o erro‐padrão da média (EMP) de 6 camundongos em cada grupo. Wild, camundongos do tipo selvagem; Wild (IL‐25 + IL‐33), camundongos do tipo selvagem com o tratamento de rmIL‐25 + rmIL‐33; Il17br‐/‐Il1rl1‐/‐, camundongos Il17br‐/‐Il1rl1‐/‐; Il17br‐/‐Il1rl1‐/‐ (IL‐25+IL‐33), camundongos Il17br‐/‐Il1rl1‐/‐ com o tratamento de rmIL‐25 + rmIL‐33. **** p < 0,0001 vs. Wild (IL‐25 + IL‐33).
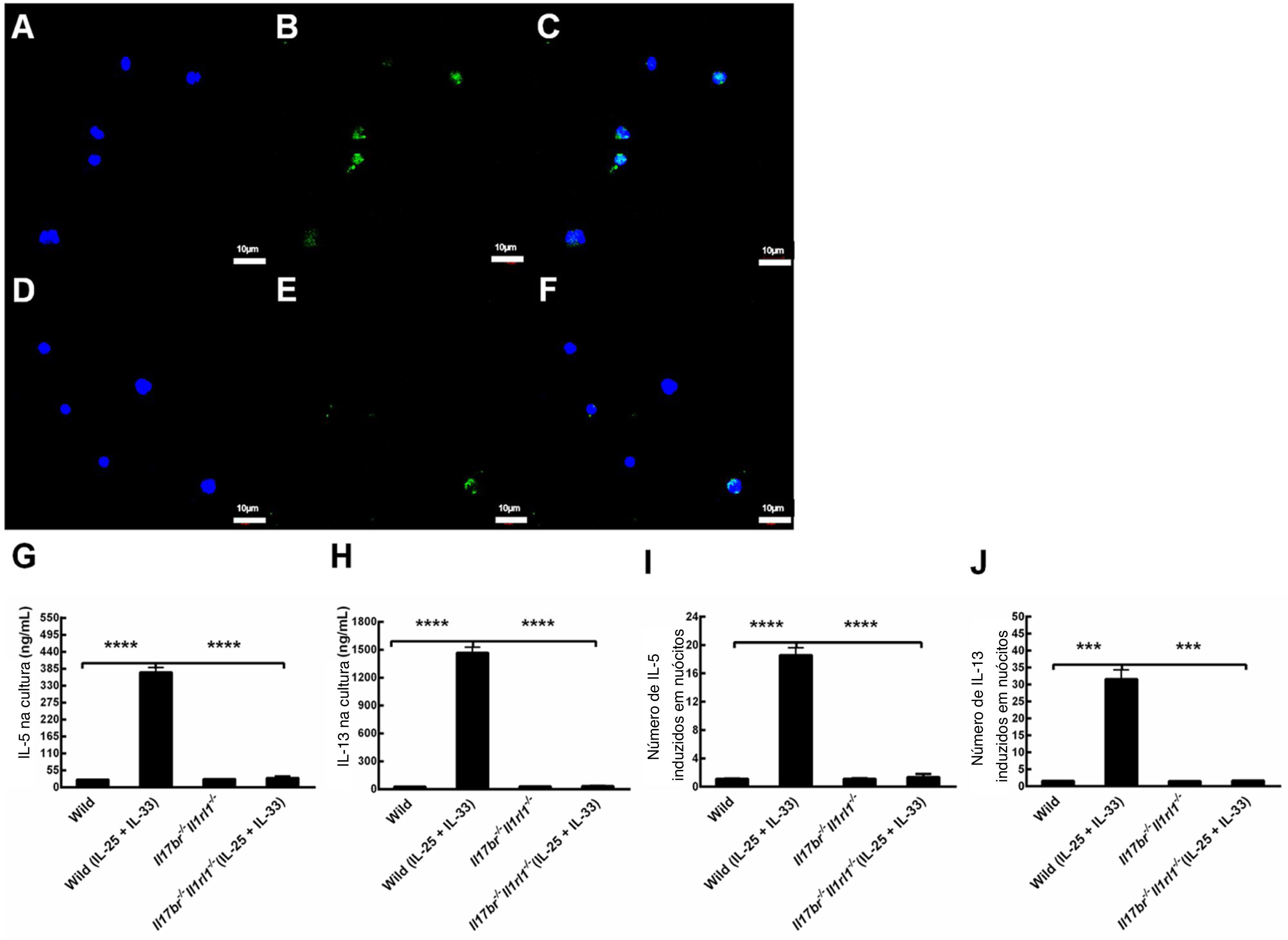
Para investigar se os nuócitos derivados de mLN produzem citocinas tipo 2 em camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐, determinamos a expressão de IL‐13 com imunocitoquímica e microscopia confocal e avaliamos o conteúdo de IL‐5 e IL‐13 em resposta a rmIL‐25 e rmIL‐33 na cultura com Elisa e RT‐PCR em tempo real. A IL‐13 foi expressa em nuócitos do tipo selvagem e Il17br‐/‐Il1rl1‐/‐, de acordo com a análise de imunofluorescência (fig. 4 A – F). Não houve diferenças estatísticas em proteínas e mRNAs de IL‐5 e IL‐13 entre esses dois tipos de nuócitos antes do tratamento com rmIL‐25 e rmIL‐33 (fig. 4 G‐J). As expressões de IL‐5 e IL‐13 estavam aumentadas significativamente após a administração dessas duas citocinas em nuócitos do tipo selvagem (Wild), seja em proteína ou mRNA; entretanto, houve diferenças significativas entre esses dois tipos de nuócitos nas expressões dessas citocinas do tipo 2 (fig. 4 G‐J). Entretanto, as concentrações de IL‐5 e IL‐13 não estavam up‐reguladas nos nuócitos Il17br‐/‐Il1rl1‐/‐ após o tratamento acima (fig. 4 G, H, I e J). Os achados indicam que o knockout combinado Il17br‐/‐Il1rl1‐/‐ em camundongos priva os nuócitos de respostas à IL‐25 e IL‐33, o que contribui para a falta de up‐regulação de IL‐5 e IL‐13.4
Expressão de IL‐13 em nuócitos e respostas de nuócitos derivados de linfonodos mesentéricos (mLN) à interleucina (IL)‐25 e IL‐33 recombinante de camundongo (rm) na cultura. A, IL‐13 em camundongos do tipo selvagem (Wild) [Dicloridrato de 4’,6‐diamidino‐2‐fenilindole (DAPI)]. B, IL‐13 em camundongos do tipo selvagem (Wild) (isotiocianato de fluoresceína). C, IL‐13 em camundongos do tipo selvagem (Wild) (mesclagem). D, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (DAPI). E, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (Isotiocianato de fluoresceína). F, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (mesclagem). G, IL‐5 na cultura. H, IL‐13 na cultura. I, mRNA de IL‐5 em nuócitos. J, RNAm de IL‐13 em nuócitos. Barras de escala: 10μm. Ampliação original: × 400. Cada valor representa a média (EPM) de 6 camundongos em cada grupo. Wild, camundongos do tipo selvagem; Wild (IL‐25 + IL‐33), camundongos do tipo selvagem com o tratamento de rmIL‐25 + rmIL‐33; Il17br‐/‐Il1rl1‐/‐, camundongos Il17br‐/‐Il1rl1‐/‐; Il17br‐/‐Il1rl1‐/‐ (IL‐25+IL‐33), camundongos Il17br‐/‐Il1rl1‐/‐ com o tratamento de rmIL‐25 + rmIL‐33. ****p < 0,0001 vs. Wild (IL‐25 + IL‐33). ***p < 0,001 vs. Wild (IL‐25+IL‐33).
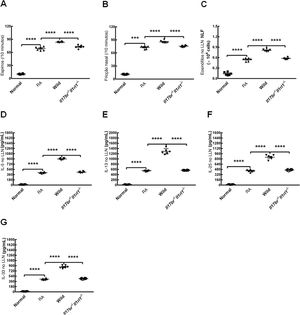
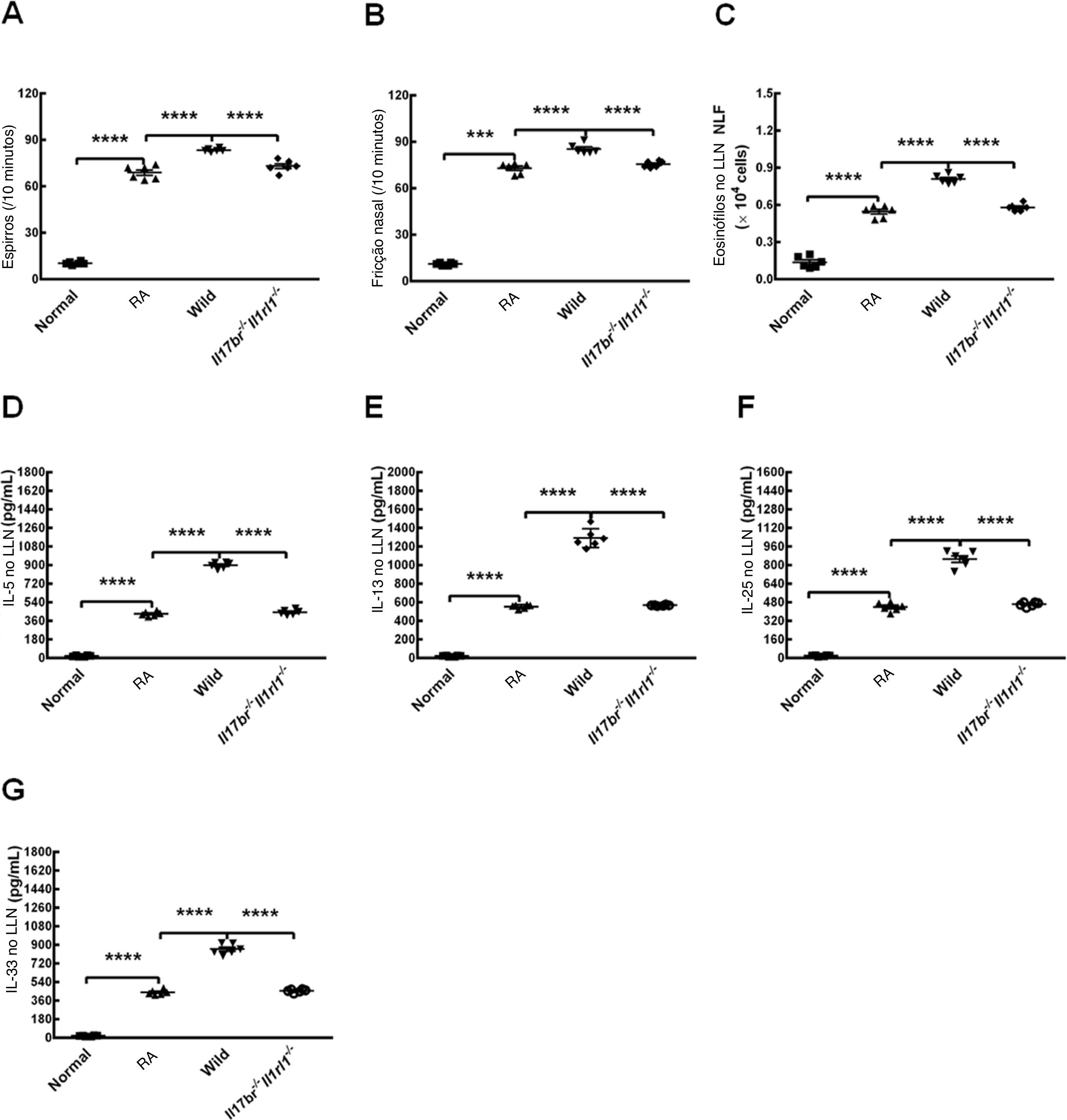
Para avaliar as reações alérgicas em modelos de camundongos do tipo selvagem estabelecidos por OVA, espirros e fricção nasal foram contados após o último teste de provocação. Os camundongos RA mostraram número estatisticamente maior de espirros e fricção nasal em comparação com os camundongos normais (fig. 5 A e B). O número de eosinófilos distribuídos no LLN e o conteúdo de IL‐5, IL‐13, IL‐25 e IL‐33 no LLN de camundongos RA também apresentaram aumento em comparação com os de camundongos normais (fig. 5C). Os resultados sugerem claramente que o modelo murino de RA foi estabelecido com sucesso. A transferência adotiva de nuócitos de mLN de camundongos do tipo selvagem (Wild) por via intravenosa na veia da cauda aumentou o número de espirros, fricção nasal e eosinófilos e as concentrações de IL‐5, IL‐13, IL‐25 e IL‐33 no LLN em comparação com camundongos RA (fig. 5 A‐G). Além disso, houve diferenças estatísticas entre os tratamentos com nuócitos do tipo selvagem e com os nuócitos Il17br‐/‐Il1rl1‐/‐, seja em relação ao número de espirros, fricções nasais e eosinófilos, ou níveis de citocinas do tipo 2 no LLN (fig. 5 A‐G). No entanto, todos os parâmetros acima mostraram‐se inalterados estatisticamente após a transferência adotiva de nuócitos Il17br‐/‐Il1rl1‐/‐ em camundongos RA (fig. 5 A‐G). Esses achados demonstram que os nuócitos pioram a resposta alérgica em camundongos com RA, possivelmente através das expressões up‐reguladas de IL‐5 e IL‐13 por IL‐25 e IL‐33 produzidas a partir do epitélio da mucosa nasal10 e pelo maior aumento da produção de IL‐25 e IL‐33 por células epiteliais após a estimulação de nuócitos.
Pioria da inflamação alérgica em modelos de camundongos por nuócitos do tipo selvagem (Wild) do linfonodos mesentéricos (mLN). A, espirros. B, Fricção nasal. C, Eosinófilos no líquido de lavagem nasal (LLN). D, interleucina (IL)‐5 no LLN. E, IL‐13 no LLN. F, IL‐25 no LLN. G, IL‐33 no LLN. Cada valor representa a média (EPM) de 6 camundongos em cada grupo. Normal, grupo normal; RA, grupo RA; Wild, tratamento de camundongos alérgicos com nuócitos derivados de mLN de camundongos do tipo selvagem (Wild); Il17br‐/‐Il1rl1‐/‐, tratamento de camundongos alérgicos com nuócitos derivados de mLN de camundongos Il17br‐/‐Il1rl1‐/‐.
**** p < 0,0001 vs. RA ou Wild. *** p < 0,001 vs. RA.
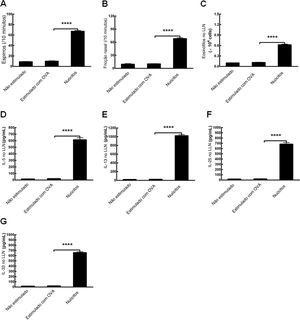
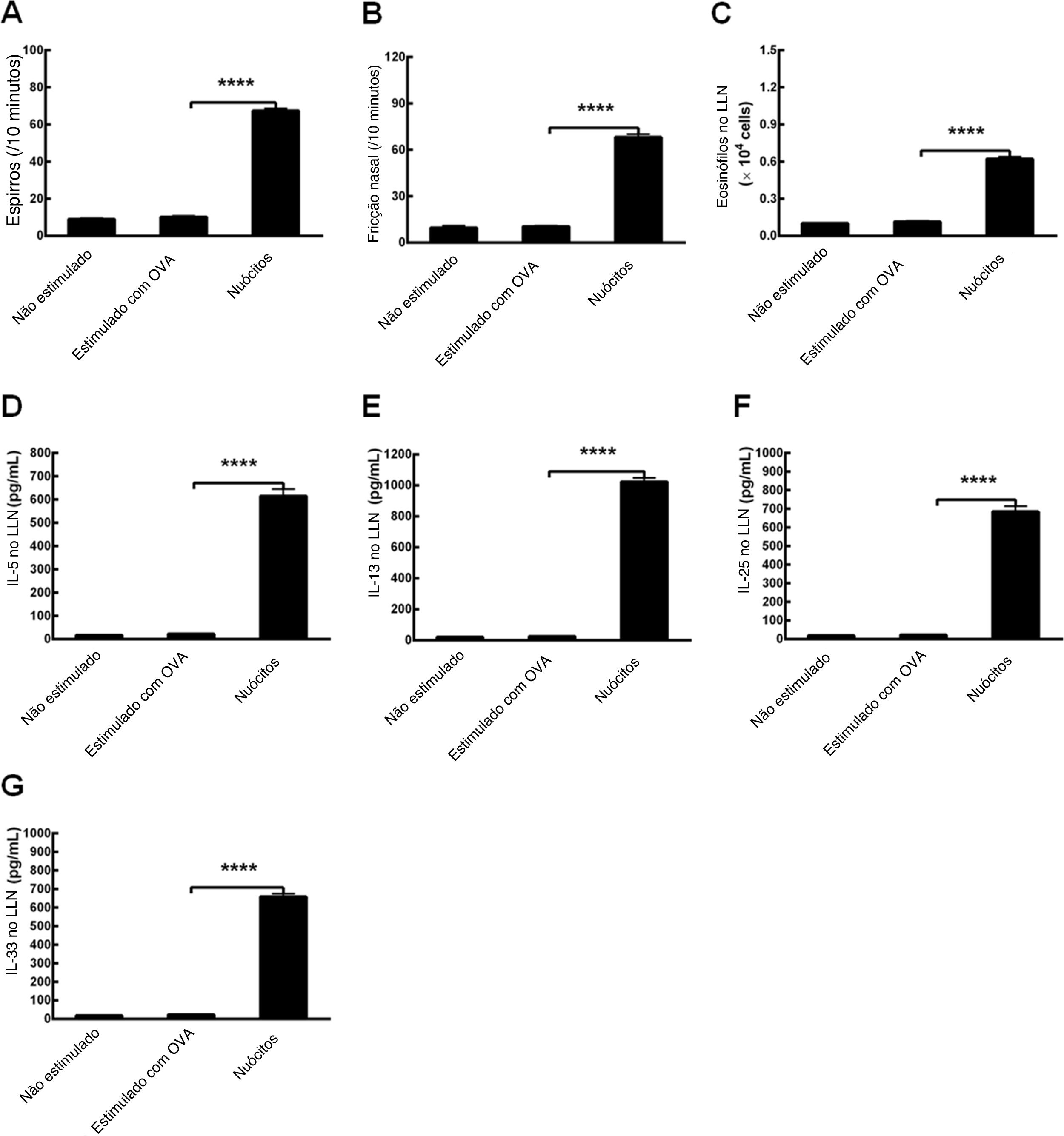
Para determinar se a OVA poderia estabelecer modelos de RA em camundongos Il17br‐/‐Il1rl1‐/‐, fizemos os protocolos com o alérgeno e alúmen de acordo com os mesmos procedimentos.8 Surpreendentemente, não houve diferenças significativas no número de espirros, fricções nasais e eosinófilos, ou nos níveis de citocinas tipo 2 no LLN entre camundongos não estimulados (tratamento sem OVA) e camundongos Il17br‐/‐Il1rl1‐/‐ estimulados com OVA (tratamento com OVA) (fig. 6 A‐G). No entanto, após a transferência adotiva de nuócitos do tipo selvagem (Wild) para os camundongos Il17br‐/‐Il1rl1‐/‐ combinados, esse último tipo mostrou uma up‐regulação estatisticamente acima dos parâmetros (fig. 6 A‐G). Enquanto isso, modelos de camundongos com RA foram estabelecidos com sucesso e as respostas alérgicas foram restauradas. Os resultados sugerem que ILC2s e citocinas inatas do tipo 2 são indispensáveis para o estágio inicial da condição alérgica.
Restauração da inflamação alérgica em modelos combinados de camundongos Il17br‐/‐Il1rl1‐/‐. A, Espirros. B, Fricção nasal. C, Eosinófilos no líquido de lavagem nasal (LLN). D, Interleucina (IL) ‐5 no LLN. E, IL‐13 no LLN. F, IL‐25 no LLN. G, IL‐33 no LLN. Cada valor representa a média (EPM) de 6 camundongos em cada grupo. Não estimulado, tratamento sem ovalbumina (OVA); Estimulado com OVA, tratamento com OVA; Nuócitos, tratamento de camundongos Il17br‐/‐Il1rl1‐/‐ com nuócitos derivados de mLN de camundongos do tipo selvagem (Wild). **** p < 0,0001 vs. Estimulado com OVA.
Avanços recentes em nossa compreensão de citocinas pró‐alérgicas e ILC2s indicam seus papéis essenciais em distúrbios mediados pela imunidade do Tipo 2, como doenças nasais alérgicas, asma e dermatite atópica.11 Citocinas pró‐alérgicas como IL‐25, IL‐33 e linfopoietina do estroma tímico são liberadas das células epiteliais nos tecidos inflamados e direcionam a inflamação alérgica, atuam no sistema imunológico inato e adaptativo.12 ILC2s, como os nuócitos,4 células natural helpers13 e células helpers inatas do Tipo 214 são uma população imune inata que responde às citocinas pró‐alérgicas IL‐25 e IL‐33 ao produzir citocinas do tipo 2.
Estudos mostram que as citocinas IL‐25 e IL‐33 são importantes iniciadores da inflamação do tipo 2. O tratamento de camundongos com IL‐25 ou IL‐33 provoca forte indução de IL‐5, IL‐13 e patologia de tipo 2.15,16 Os camundongos com deficiência dupla de IL‐25 e IL‐33 também exibem um atraso ou redução da resposta antígeno‐específica de tipo 2.17,18 Além disso, embora IL‐25 e IL‐33 pertençam a diferentes famílias de citocinas, IL‐17 e IL‐1, respectivamente, elas levam a reações semelhantes.
Os nuócitos, identificados como ILC2s, representam um novo leucócito efetor inato que age como mediador da imunidade do tipo 2 e produz IL‐5 e IL‐13 em resposta a IL‐25 e IL‐33.4 As células foram descritas como um elemento crítico para iniciar a inflamação do tipo 2 durante a infecção por N. brasiliensis.4 Além disso, também foi demonstrado que esse tipo de célula induz a hiper‐reatividade das vias aéreas na ausência de células Th2 produtoras de IL‐13 na inflamação alérgica pulmonar.5 No entanto, a contribuição dos nuócitos na RA ainda não está bem definida. Estudos indicaram que o número de ILC2s aumentou nos pólipos de pacientes com rinossinusite crônica com pólipos nasais (RSCcPN) em comparação com a mucosa nasal de pacientes com rinossinusite crônica sem pólipos nasais (RSCsPN) ou em controles saudáveis.19 Isto é, as ILC2s desempenham um papel nas doenças alérgicas das vias aéreas superiores. No entanto, estudos demonstraram que a ILC2s sozinha não leva aos sintomas da RA, inclusive eosinofilia tecidual, que pode ser induzida apenas pela ativação da ILC2s nos pulmões.20
Um de nossos estudos anteriores relatou que as respostas alérgicas podem ser exacerbadas por nuócitos induzidos por OVA em um modelo murino de RA.6 Nesse estudo atual, administramos rmIL‐25 e rmIL‐33 por via intraperitoneal em camundongos do tipo selvagem (Wild) e Il17br‐/‐Il1rl1‐/‐ e separamos e purificamos nuócitos do NALT e mLN dos camundongos. Observamos que não houve crescimento de nuócitos no NALT desses dois tipos de camundongos após aplicações de rmIL‐25 e rmIL‐33. Entretanto, um estudo demonstrou a proliferação dessas células no pulmão com administração intranasal de rmIL‐25 ou rmIL‐33,5 o que ilustra diferentes significâncias da imunidade local e sistêmica. Os resultados em nosso estudo indicaram aumento de nuócitos no mLN de camundongos do tipo selvagem (Wild) e nenhum crescimento nos camundongos Il17br‐/‐Il1rl1‐/‐, o que indica o papel indispensável da IL‐25 e IL‐33 na geração e ativação de nuócitos, assim como demonstrado em outros estudos.4
De acordo com nossos dados, os nuócitos derivados de mLN de camundongos do tipo selvagem (Wild) expressaram mais IL‐13 em comparação com as células dos camundongos Il17br‐/‐Il1rl1‐/‐ e as células do tipo selvagem foram induzidas a secretar mais IL‐5 e IL‐ 13 pelo rmIL‐25 e rmIL‐33 de camundongos na cultura. No entanto, as concentrações de proteínas IL‐5 e IL‐13 e mRNAs não estavam aumentadas nos nuócitos de camundongos Il17br‐/‐Il1rl1‐/‐ após o tratamento com duas citocinas. Esses achados sugerem que o knockout combinado de Il17br‐/‐Il1rl1‐/‐ em camundongos priva completamente os nuócitos de respostas a IL‐25 e IL‐33.
Também verificamos que a transferência adotiva de nuócitos derivados de mLN de camundongos do tipo selvagem (Wild) para o modelo murino de RA exacerbou a condição alérgica, assim como outro estudo nosso.6 O número de espirros, fricção nasal e eosinófilos invasores e os níveis de IL‐5, IL‐13, IL‐25 e IL‐33 no LLN aumentaram significantemente quando comparados aos dos camundongos RA. No entanto, os parâmetros acima não foram alterados estatisticamente quando os nuócitos Il17br‐/‐Il1rl1‐/‐ foram transferidos para modelos de RA. Os desfechos revelam que os nuócitos pioram o estado alérgico em modelos de camundongos com RA através das expressões aumentadas de IL‐5 e IL‐13 por IL‐25 e IL‐33 produzidas pelo epitélio da mucosa nasal10 e as produções mais up‐reguladas de IL‐25 e IL‐33 por células epiteliais após a estimulação de nuócitos. Quanto às relações entre os nuócitos e o epitélio nasal, mais estudos devem ser feitos.
Para avaliar a influência dos nuócitos nos mecanismos etiológicos da RA, determinamos se o alérgeno poderia estabelecer modelos de RA em camundongos Il17br‐/‐Il1rl1‐/‐ através de OVA e Alúmen, de acordo com os procedimentos publicados.8 Digno de nota, observamos que não houve diferenças significantes, seja em números de espirros, fricções nasais e eosinófilos infiltrantes ou nos níveis de citocinas tipo 2 no LLN entre camundongos Il17br‐/‐Il1rl1‐/‐ não estimulados e estimulados com OVA. No entanto, após a transferência adotiva de nuócitos do tipo selvagem (Wild) para os camundongos Il17br‐/‐Il1rl1‐/‐ com dupla deficiência, os parâmetros acima foram up‐regulados estatisticamente. Como resultado, os modelos de RA foram estabelecidos com sucesso e a condição alérgica na mucosa nasal foi recuperada. Os dados sugerem que as ILC2s como os nuócitos e citocinas inatas do Tipo 2, como IL‐25 e IL‐33, são absolutamente necessárias para o início do estado alérgico em um modelo de camundongo com RA.
ConclusãoO estudo mostrou que a administração intraperitoneal de IL‐25 e IL‐33 contribuiu para o aumento de nuócitos no mLN de camundongos do tipo selvagem (Wild). Nuócitos do tipo selvagem derivados de mLN foram induzidos a produzir IL‐5 e IL‐13 por IL‐25 e IL‐33 in vitro e pioraram as respostas alérgicas em camundongos RA in vivo. Esses achados indicam que os nuócitos podem desempenhar um papel pró‐inflamatório no estágio inicial do modelo murino de RA e as células podem se tornar um novo alvo potencial na futura terapia para RA.
FinanciamentoNational Natural Science Foundation of China (concessão n° 81371076), Shanghai Suburb Tertiary Hospital Clinical Capacity Building Project (concessão n° SHDC12015905) e Initial Funding of Huashan Hospital North of Fudan University (concessão n° 2015102).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Lin Lin e Xinyue Tang contribuiram de forma igual como co-autores.
Como citar este artigo: Lin L, Tang X, Chen Z, Wei J, Dai F, Sun G. Nuocytes from mesenteric lymph node promote allergic responses in a mouse model. Braz J Otorhinolaryngol. 2021;87:661–70.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.




![Expressão de IL‐13 em nuócitos e respostas de nuócitos derivados de linfonodos mesentéricos (mLN) à interleucina (IL)‐25 e IL‐33 recombinante de camundongo (rm) na cultura. A, IL‐13 em camundongos do tipo selvagem (Wild) [Dicloridrato de 4’,6‐diamidino‐2‐fenilindole (DAPI)]. B, IL‐13 em camundongos do tipo selvagem (Wild) (isotiocianato de fluoresceína). C, IL‐13 em camundongos do tipo selvagem (Wild) (mesclagem). D, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (DAPI). E, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (Isotiocianato de fluoresceína). F, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (mesclagem). G, IL‐5 na cultura. H, IL‐13 na cultura. I, mRNA de IL‐5 em nuócitos. J, RNAm de IL‐13 em nuócitos. Barras de escala: 10μm. Ampliação original: × 400. Cada valor representa a média (EPM) de 6 camundongos em cada grupo. Wild, camundongos do tipo selvagem; Wild (IL‐25 + IL‐33), camundongos do tipo selvagem com o tratamento de rmIL‐25 + rmIL‐33; Il17br‐/‐Il1rl1‐/‐, camundongos Il17br‐/‐Il1rl1‐/‐; Il17br‐/‐Il1rl1‐/‐ (IL‐25+IL‐33), camundongos Il17br‐/‐Il1rl1‐/‐ com o tratamento de rmIL‐25 + rmIL‐33. ****p < 0,0001 vs. Wild (IL‐25 + IL‐33). ***p < 0,001 vs. Wild (IL‐25+IL‐33). Expressão de IL‐13 em nuócitos e respostas de nuócitos derivados de linfonodos mesentéricos (mLN) à interleucina (IL)‐25 e IL‐33 recombinante de camundongo (rm) na cultura. A, IL‐13 em camundongos do tipo selvagem (Wild) [Dicloridrato de 4’,6‐diamidino‐2‐fenilindole (DAPI)]. B, IL‐13 em camundongos do tipo selvagem (Wild) (isotiocianato de fluoresceína). C, IL‐13 em camundongos do tipo selvagem (Wild) (mesclagem). D, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (DAPI). E, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (Isotiocianato de fluoresceína). F, IL‐13 em camundongos Il17br‐/‐Il1rl1‐/‐ (mesclagem). G, IL‐5 na cultura. H, IL‐13 na cultura. I, mRNA de IL‐5 em nuócitos. J, RNAm de IL‐13 em nuócitos. Barras de escala: 10μm. Ampliação original: × 400. Cada valor representa a média (EPM) de 6 camundongos em cada grupo. Wild, camundongos do tipo selvagem; Wild (IL‐25 + IL‐33), camundongos do tipo selvagem com o tratamento de rmIL‐25 + rmIL‐33; Il17br‐/‐Il1rl1‐/‐, camundongos Il17br‐/‐Il1rl1‐/‐; Il17br‐/‐Il1rl1‐/‐ (IL‐25+IL‐33), camundongos Il17br‐/‐Il1rl1‐/‐ com o tratamento de rmIL‐25 + rmIL‐33. ****p < 0,0001 vs. Wild (IL‐25 + IL‐33). ***p < 0,001 vs. Wild (IL‐25+IL‐33).](https://static.elsevier.es/multimedia/25300539/0000008700000006/v2_202111120832/S2530053921001383/v2_202111120832/pt/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/7hLX2FbBoxC1192i158SI=)