This study presents the effect of cypermethrin on the cochlear function in Wistar rats post‐ subchronic inhalation exposure. Worldwide several pesticides are described as causing health disorders. Cypermethrin is currently one of the most commonly used, however, little is known about its harmful effects, especially related to hearing. Human studies have associated pesticides with hearing disorders, but they present limited conclusions due to the multiple factors to which the population is exposed, such as noise.
ObjectiveMimic human exposure to cypermethrin and to verify the effects on cochlear function.
MethodsIt is a subchronic inhalation animal study (6 weeks, 4 hours/day), using 36 male Wistar aged 60 day. Rats were randomly assigned into three groups: Control (12 rats exposed to inhalation of water); Positive Control for auditory lesion (12 rats administrated with 24 mg/kg intraperitoneal cisplatin); Experimental (12 rats exposed to inhalation of cypermethrin – 0.25 mg/L). Animals were evaluated by distortion product otoacoustic emissions pre‐ and post‐exposure.
ResultsThe frequencies of 8, 10 and 12 kHz in both ears (right p = 0.003; 0.004; 0.008 and left 0.003; 0.016; 0.005 respectively) and at frequencies 4 and 6 in the right ear (p = 0.007 and 0.015, respectively) in the animals exposed to cypermethrin resulted in reduction.
ConclusionSubchronic inhalation exposure to cypermethrin provided ototoxicity in rats.
Este estudo apresenta o efeito da cipermetrina sobre a função coclear em ratos Wistar após exposição por inalação subcrônica. Em todo o mundo, vários pesticidas são descritos como causadores de distúrbios de saúde. A cipermetrina é atualmente um dos mais utilizados, porém pouco se conhece sobre seus efeitos deletérios, principalmente relacionados à audição. Estudos em humanos associaram pesticidas a alterações auditivas, mas apresentaram conclusões limitadas devido aos múltiplos fatores aos quais a população está exposta, como, por exemplo, o ruído.
ObjetivoMimetizar a exposição humana à cipermetrina e verificar os seus efeitos na função coclear.
MétodoEstudo de inalação subcrônica em animais (6 semanas, 4 horas/dia), 36 ratos machos Wistar com 60 dias. Os ratos foram distribuídos aleatoriamente em três grupos: controle (12 ratos expostos à inalação de água); controle positivo para lesão auditiva (12 ratos com administração de 24mg/kg de cisplatina intraperitoneal); e experimental (12 ratos expostos a inalação de cipermetrina – 0,25mg/L). Os animais foram avaliados por emissões otoacústicas por produto de distorção, pré e pós‐exposição.
ResultadosAs frequências de 8, 10 e 12kHz em ambas as orelhas (direita p = 0,003; 0,004; 0,008 e esquerda 0,003; 0,016; 0,005 respectivamente) e frequências 4 e 6 na orelha direita (p = 0,007 e 0,015, respectivamente) apresentaram redução nos animais expostos à cipermetrina.
ConclusãoA exposição subcrônica por inalação à cipermetrina resultou em ototoxicidade em ratos.
A cipermetrina (RS)‐α‐cyano‐3‐phenoxybenzyl(1RS,3RS;1RS,3SR)‐3‐(2,2‐dichlorovinyl)‐2,2‐dimethylcyclopropanecarboxylate é uma substância piretroide sintética usada na produção agrícola, em animais, campanhas de saúde no controle de vetores, é também de uso doméstico.1,2 Essa substância tem alta fotoestabilidade, não apresenta persistência no ambiente e produz menor toxicidade para uso humano, o que a torna amplamente aplicável.2,3 Recentemente, a cipermetrina tornou‐se um dos pesticidas dominantes, substituiu os carbamatos e organofosfatos, considerados mais tóxicos.4
De acordo com a Organização Mundial de Saúde (OMS), há mais de 18,2 por 100.000 casos de intoxicação aguda por pesticidas em trabalhadores agrícolas por ano. Provavelmente o número de casos subagudos é ainda maior, mas há dificuldades para documentar esses dados. Além disso, nem todos os efeitos dos pesticidas são conhecidos. De fato, existe a preocupação de que diferentes substâncias químicas possam causar danos auditivos, tais como os pesticidas.5–7
Estudos em humanos indicam que a exposição a agrotóxicos pode causar danos ao sistema auditivo.6,8–11 No entanto, essas pesquisas apresentam limitações e o número de estudos é ainda pequeno. Em modelos animais, as pesquisas usam diferentes modalidades de administração da substância. Muitas vezes, a modalidade de exposição não está correlacionada com a exposição ocupacional e a avaliação auditiva é feita sob anestesia.8 Além disso, a maioria das pesquisas que relacionaram agrotóxicos com perda auditiva é de relatos de casos ou estudos em seres humanos, que estão expostos a máquinas ruidosas e a outros fatores que também podem causar danos auditivos.8,10,12–18
Um estudo experimental com organofosforados na Guiné14 mostrou alterações morfológicas cocleares, com lesões nas células ciliadas externas concomitantemente à presença de emissões otoacústicas.14 Entretanto, ainda não está clara a relação dos pesticidas com danos auditivos devido à exposição humana a múltiplos fatores. Portanto, nosso estudo em modelos animais expostos apenas à cipermetrina, livre do viés do ruído, permite caracterizar os efeitos de um pesticida no sistema auditivo. Assim, o objetivo deste estudo foi avaliar os efeitos ototóxicos da exposição subcrônica por inalação de cipermetrina em ratos Wistar através de emissões otoacústicas por produto de distorção.
MétodoEstudo experimental baseado no teste de toxicidade por inalação subcrônica, número 413, das Diretrizes para Testes de Produtos Químicos da Organização para Cooperação e Desenvolvimento Econômico (OECD, Organization for Economic Cooperation and Development).19 Todos os procedimentos que envolveram animais foram aprovados pelo Comitê de Ética no uso de animais sob o n° 323/15.
AnimaisForam usados nos experimentos 36 ratos Wistar machos (Rattus norvegicus) com 60 dias de idade (peso corporal de aproximadamente 300 ± 50g). Os animais foram mantidos sob condições controladas no biotério, ciclo claro/escuro de 12 horas, receberam água e ração ad libitum, exceto durante a exposição. Foram selecionados para o experimento apenas animais sem sinais de doenças da orelha externa e emissões otoacústicas por produto de distorção (EOAPD) presentes em todas as frequências testadas (4, 6, 8, 10 e 12kHz). Os ratos foram randomizados para três grupos: controle (n = 12), controle positivo (n = 12) e experimental (n = 12). Todos os animais foram expostos ao mesmo nível de ruído de fundo, mantido abaixo de 60dB em todos os momentos.
SubstânciasA formulação comercialmente disponível de cipermetrina (piretróide tipo II) foi dissolvida em água destilada a uma concentração de 0,25mg/L (CL50 1/10 inalação rato). A cisplatina, um medicamento antineoplásico, foi usada como controle positivo para ototoxicidade, total de 24mg/kg. Cada animal recebeu 8mg/kg por via intraperitoneal, por dia, diluído em 10mL/kg de solução salina.
Emissões otoacústicas por produto de distorçãoAs EOAPD foram registradas com o OtoreadClinical®, da Interacoustics®. Dois tons (f1 e f2) foram usados ??como estímulos acústicos (relação f1/f2, f2:f1 fixada em 1,22). Os tons f1 e f2 foram apresentados a um nível de estímulo de 65 e 55dB NPS (Nível de Pressão Sonora). Os testes de EOAPD foram feitos com uma sonda auditiva pediátrica colocada no canal auditivo externo do rato e testada nas frequências de 4, 6, 8, 10 e 12 sem o uso de anestesia. As emissões otoacústicas por produto de distorção foram feitas nos grupos controle e experimental antes (pré‐exposição) e após (pós‐exposição) o período de exposição (0 e 42 dias) e no controle positivo antes da 1ª administração e 24 horas após a 3ª administração.
ExposiçõesEm nosso protocolo de exposição por inalação, usamos câmaras de 56 litros. As câmaras foram ligadas a nebulizadores ultrassônicos (evitando ruído) como fluxo de entrada e ao sistema de exaustão. Esse sistema foi criado para evitar‐se a exposição ao ruído através de isolamento acústico.
Os animais foram adaptados ao nosso protocolo durante 5 dias. Eles foram treinados para a habituação, inicialmente com a sonda usada para avaliação auditiva e com o som que ocorre durante as EOAPD, bem como para adaptação na câmara de exposição, inicialmente por 1h (primeiro dia), no segundo dia por 2h, no terceiro por 3h e no 4° dia por 4h (apenas com fluxo de ar). No 5° dia foi usado fluxo de ar com vapor de água durante 4 horas.
O grupo controle foi exposto à inalação de água (veículo para diluição da formulação) por 4h, 5 vezes por semana, por 6 semanas. O grupo experimental foi exposto à inalação de cipermetrina na concentração de 0,25mg/L, por 4h, 5 vezes por semana, por 6 semanas. Esse protocolo foi criado e usado pelo nosso grupo para exposição por inalação de pesticidas.
Os 12 ratos do grupo de controle positivo foram tratados com 8mg/kg de cisplatina por via intraperitoneal, uma vez ao dia, por 3 dias consecutivos (total de 24mg/kg).8
Análise estatísticaFoi feita com o pacote estatístico SPSS (SPSS versão 21.0 para Windows, SPSS Inc., Chicago, IL, EUA). As variáveis numéricas foram especificadas como mediana (percentil 25 – percentil 75). O teste U de Mann‐Whitney foi usado para comparar os grupos (avaliação pós‐exposição em relação à pré‐exposição de cada grupo) e o de Kruskal‐Wallis (comparação das variações da avaliação pós menos exposição pré entre os grupos). Os dados paramétricos foram apresentados como média e erro‐padrão da média e as variáveis que apresentaram distribuição normal foram avaliadas pelo teste t de Student (massa corporal relativa, massa orgânica relativa). O valor da significância estatística foi considerado como p < 0,05.
ResultadosVerificou‐se que o efeito da cipermetrina nas EOAPD é essencialmente o mesmo em toda a faixa das frequências de 4, 6, 8, 10 e 12kHz.
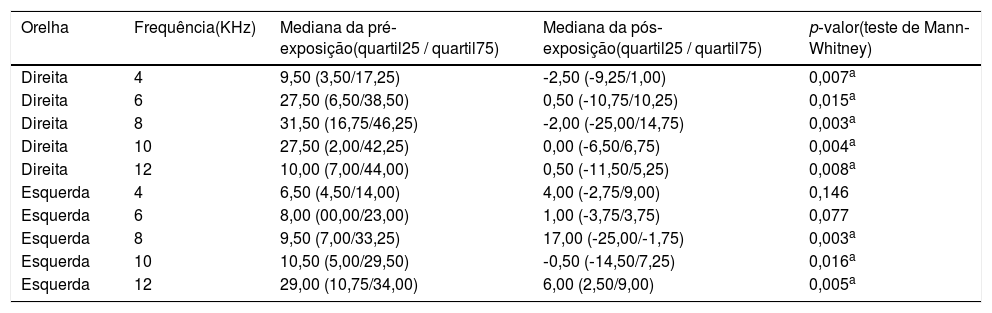
A exposição à cipermetrina mostrou redução significante das EOAPD (p <0,05, teste de Mann‐Whitney) em comparação às medidas pré‐exposição (tabela 1) nas frequências de 8, 10 e 12kHz em ambas as orelhas (direita p = 0,003; 0,004; 0,008 e esquerda 0,003; 0,016; 0,005, respectivamente) e nas frequências 4 e 6 na orelha direita (p = 0,007 e 0,015, respectivamente).
Mediana e intervalos interquartis das amplitudes das EOAPD pré e pós‐exposição por inalação subcrônica à cipermetrina (grupo experimental)
| Orelha | Frequência(KHz) | Mediana da pré‐exposição(quartil25 / quartil75) | Mediana da pós‐exposição(quartil25 / quartil75) | p‐valor(teste de Mann‐Whitney) |
|---|---|---|---|---|
| Direita | 4 | 9,50 (3,50/17,25) | ‐2,50 (‐9,25/1,00) | 0,007a |
| Direita | 6 | 27,50 (6,50/38,50) | 0,50 (‐10,75/10,25) | 0,015a |
| Direita | 8 | 31,50 (16,75/46,25) | ‐2,00 (‐25,00/14,75) | 0,003a |
| Direita | 10 | 27,50 (2,00/42,25) | 0,00 (‐6,50/6,75) | 0,004a |
| Direita | 12 | 10,00 (7,00/44,00) | 0,50 (‐11,50/5,25) | 0,008a |
| Esquerda | 4 | 6,50 (4,50/14,00) | 4,00 (‐2,75/9,00) | 0,146 |
| Esquerda | 6 | 8,00 (00,00/23,00) | 1,00 (‐3,75/3,75) | 0,077 |
| Esquerda | 8 | 9,50 (7,00/33,25) | 17,00 (‐25,00/‐1,75) | 0,003a |
| Esquerda | 10 | 10,50 (5,00/29,50) | ‐0,50 (‐14,50/7,25) | 0,016a |
| Esquerda | 12 | 29,00 (10,75/34,00) | 6,00 (2,50/9,00) | 0,005a |
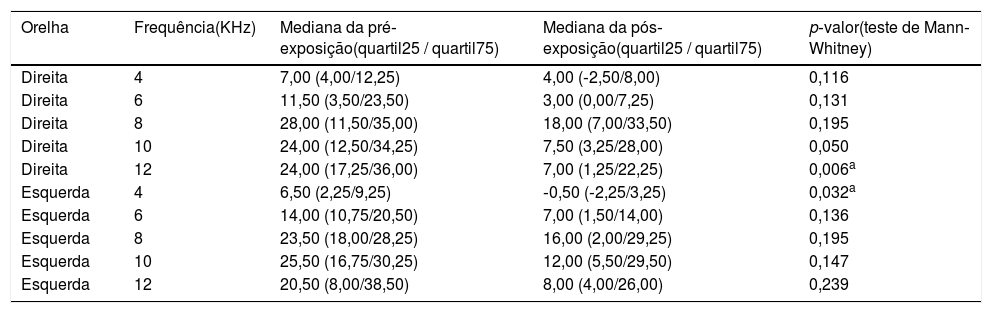
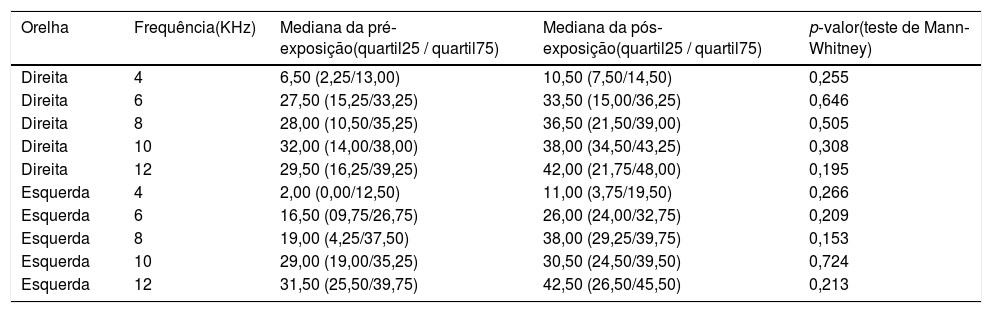
O mesmo EOAPD significantemente reduzido foi observado no grupo cisplatina (tabela 2), nas frequências de 12kHz (p = 0,006) na orelha direita e 4kHz na orelha esquerda (p = 0,032). O grupo controle não apresentou diferença significante (p>0,05; teste de Mann‐Whitney) nas medidas pós‐exposição (tabela 3), confirmou a padronização do modelo experimental.
Mediana e intervalos interquartis das amplitudes das EOAPD pré e pós‐tratamento com cisplatina (controle positivo)
| Orelha | Frequência(KHz) | Mediana da pré‐exposição(quartil25 / quartil75) | Mediana da pós‐exposição(quartil25 / quartil75) | p‐valor(teste de Mann‐Whitney) |
|---|---|---|---|---|
| Direita | 4 | 7,00 (4,00/12,25) | 4,00 (‐2,50/8,00) | 0,116 |
| Direita | 6 | 11,50 (3,50/23,50) | 3,00 (0,00/7,25) | 0,131 |
| Direita | 8 | 28,00 (11,50/35,00) | 18,00 (7,00/33,50) | 0,195 |
| Direita | 10 | 24,00 (12,50/34,25) | 7,50 (3,25/28,00) | 0,050 |
| Direita | 12 | 24,00 (17,25/36,00) | 7,00 (1,25/22,25) | 0,006a |
| Esquerda | 4 | 6,50 (2,25/9,25) | ‐0,50 (‐2,25/3,25) | 0,032a |
| Esquerda | 6 | 14,00 (10,75/20,50) | 7,00 (1,50/14,00) | 0,136 |
| Esquerda | 8 | 23,50 (18,00/28,25) | 16,00 (2,00/29,25) | 0,195 |
| Esquerda | 10 | 25,50 (16,75/30,25) | 12,00 (5,50/29,50) | 0,147 |
| Esquerda | 12 | 20,50 (8,00/38,50) | 8,00 (4,00/26,00) | 0,239 |
Medianas e intervalos interquartis das amplitudes das EOAPD pré e pós‐exposição à inalação subcrônica de água (controle)
| Orelha | Frequência(KHz) | Mediana da pré‐exposição(quartil25 / quartil75) | Mediana da pós‐exposição(quartil25 / quartil75) | p‐valor(teste de Mann‐Whitney) |
|---|---|---|---|---|
| Direita | 4 | 6,50 (2,25/13,00) | 10,50 (7,50/14,50) | 0,255 |
| Direita | 6 | 27,50 (15,25/33,25) | 33,50 (15,00/36,25) | 0,646 |
| Direita | 8 | 28,00 (10,50/35,25) | 36,50 (21,50/39,00) | 0,505 |
| Direita | 10 | 32,00 (14,00/38,00) | 38,00 (34,50/43,25) | 0,308 |
| Direita | 12 | 29,50 (16,25/39,25) | 42,00 (21,75/48,00) | 0,195 |
| Esquerda | 4 | 2,00 (0,00/12,50) | 11,00 (3,75/19,50) | 0,266 |
| Esquerda | 6 | 16,50 (09,75/26,75) | 26,00 (24,00/32,75) | 0,209 |
| Esquerda | 8 | 19,00 (4,25/37,50) | 38,00 (29,25/39,75) | 0,153 |
| Esquerda | 10 | 29,00 (19,00/35,25) | 30,50 (24,50/39,50) | 0,724 |
| Esquerda | 12 | 31,50 (25,50/39,75) | 42,50 (26,50/45,50) | 0,213 |
p < 0,05 (Mann‐Whitney).
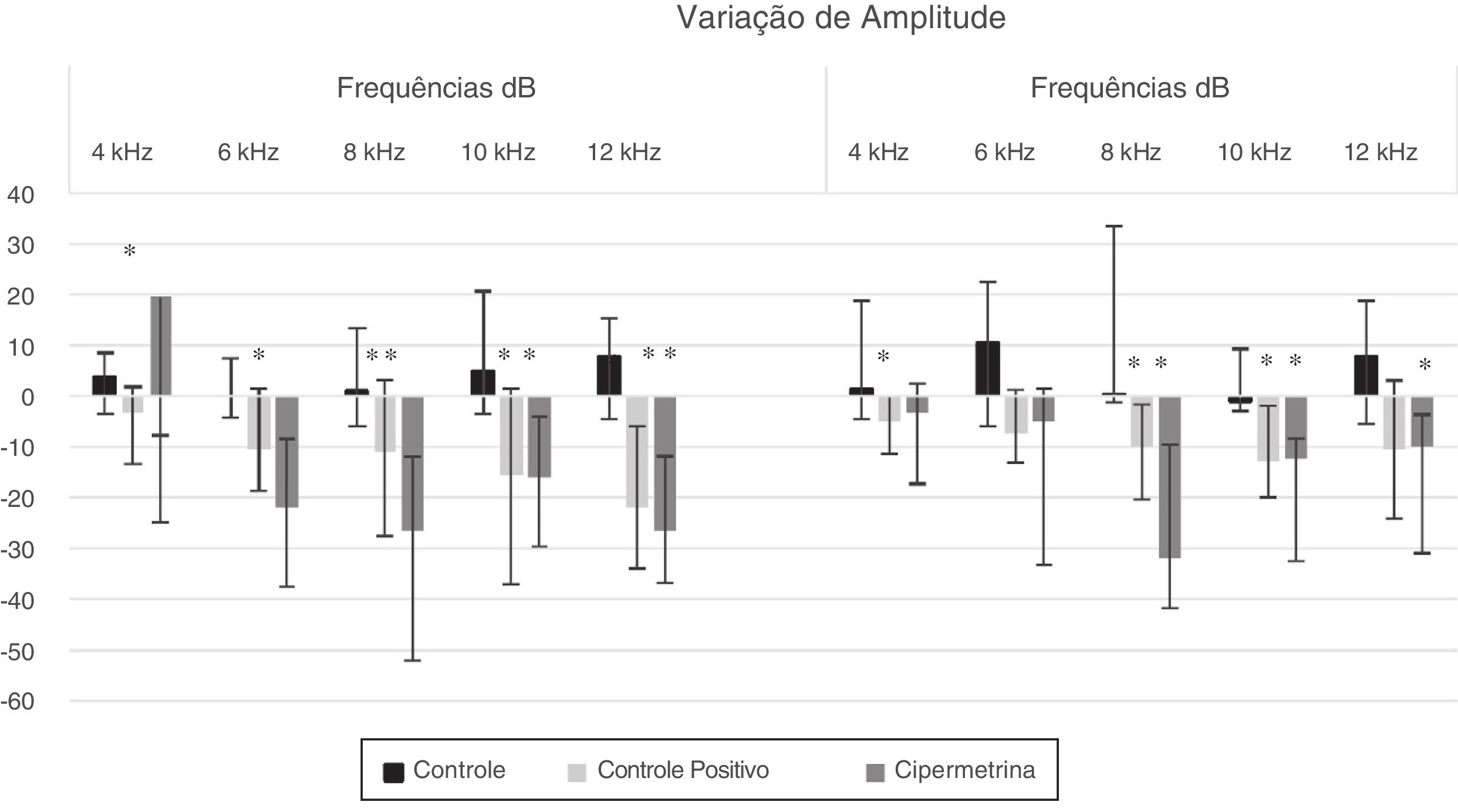
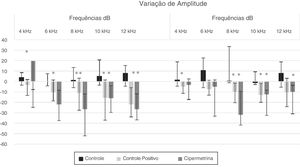
Os grupos apresentaram diferença estatística (p < 0,05; Kruskal Wallis) em relação à variação das medianas pós‐exposição menos pré‐exposição (fig. 1).
Houve diferenças significantes entre os grupos na orelha direita, nas frequências de 4, 6, e 8kHz (cipermetrina versus controle) e 12kHz (a cipermetrina e a cisplatina foram diferentes do grupo controle; p < 0,005; teste de Kruskal‐Wallis). Na orelha esquerda, houve diferença significante entre os grupos nas frequências de 8 e 10kHz (a cipermetrina e a cisplatina foram diferentes do grupo controle; p < 0,005, teste de Kruskal‐Wallis). Em todos os casos, as alterações observadas nos animais expostos à cipermetrina foram semelhantes às do grupo cisplatina, considerou‐se uma substância ototóxica.
O ganho relativo de massa corporal (média ± erro‐padrão) no período foi semelhante (p = 0,270; teste t de Student) entre o controle (145,33% ± 5,91%) e a cipermetrina (156,00% ± 6,75%).
Portanto, a maioria dos animais demonstrou sinais clínicos transitórios, como piloereção, dispneia e prurido. Os sinais clínicos foram mais evidentes no início da exposição (entre 30 e 240 minutos) e nas duas primeiras semanas.
Não encontramos alterações macroscópicas nos órgãos dos animais usados no protocolo experimental.
DiscussãoEm nosso estudo, demonstramos a ototoxicidade pela exposição por inalação subcrônica de cipermetrina em ratos Wistar. Os resultados da exposição à cipermetrina demonstraram redução na amplitude das EOAPD.
A cipermetrina é considerada menos tóxica do que outros pesticidas, embora seja conhecida como uma substância neurotóxica que também pode afetar o sistema auditivo.16–18 Estudos têm demonstrado o impacto neurológico da cipermetrina em modelos animais. Os ratos apresentaram tremores, convulsões, contorções e salivação, bem como comportamento de escavação com exposição à cipermetrina em doses baixas.18,20
Na população humana, a cipermetrina está mais associada a efeitos tóxicos agudos e alérgicos ou respiratórios.3
Pesquisadores apontaram o impacto na audição de humanos expostos a pesticidas, embora a maioria desses estudos tenha sido feita com trabalhadores agrícolas que estão em sua maioria expostos a mais de um tipo de pesticida e a outras causas de impacto auditivo.6,8 Além disso, alguns estudos relataram associação entre exposição a organofosforados e redução da audição, mas nenhum deles trata da exposição a apenas uma substância, como a cipermetrina.8–11,21
A literatura sugere que a exposição a pesticidas pode danificar o sistema auditivo; entretanto, em estudos em humanos, diferentes fatores podem influenciar o resultado.8 Além disso, alguns estudos não apresentam a modalidade de exposição e duração definidas.8,10,21,22 Nenhum desses artigos descritos na literatura fez uma exposição por inalação, como nosso estudo, para avaliar a função coclear.8,10
Neste estudo, usamos as EOAPD para avaliar o impacto na função coclear. As EOAPD são amplamente usadas como método de triagem para avaliar recém‐nascidos em muitos países.23 Em alguns estudos, as EOAPD foram usadas como triagem para substâncias ototóxicas, pois permitem avaliar as altas frequências, conhecidas como as primeiras frequências afetadas pela maioria das substâncias consideradas ototóxicas. Demonstramos que esse teste pode ser feito sem anestesia, uma vez que os ratos estejam treinados.6,10,24 Então, a diminuição da amplitude pela exposição à cipermetrina observada em nosso estudo pode ser diretamente correlacionada.
Que seja de nosso conhecimento, é a primeira vez que a exposição à cipermetrina é avaliada sem anestesia. Ao contrário de estudos anteriores que usaram pesticidas7,8,10,11,14 considerados mais tóxicos do que a cipermetrina, mimetizamos a exposição humana. Alguns anestésicos podem interferir nos resultados dos estudos, alterar a latência e amplitude das ondas.5,24 Neste estudo, foi possível avaliar os animais sem anestesia, devido à aclimatação prévia aos instrumentos.
Além disso, a ototoxicidade é descrita como um dano reversível ou irreversível das funções da orelha interna pela exposição a substâncias químicas.22,25 A ototoxicidade causada pela cipermetrina pode ter impacto na qualidade de vida dos trabalhadores agrícolas diariamente expostos a ela. Como resultado da ototoxicidade em humanos, a cipermetrina é referida na literatura como agente tóxico sistêmico de baixo grau e nosso estudo mostra que não foram observadas alterações sistêmicas.
Nesta pesquisa, avaliamos os efeitos da inalação subcrônica de cipermetrina na função coclear de ratos Wistar e desenvolvemos um protocolo animal que eliminou os fatores de confusão associados à perda auditiva em pesquisas com seres humanos. Além disso, nossos achados foram consistentes, uma vez que ambos os grupos controle (controle positivo e controle) responderam como relatado na literatura. Os animais manifestaram poucos sinais clínicos, o que indica que a ototoxicidade associada à exposição à cipermetrina estava presente mesmo sem toxicidade sistêmica.
Houve limitações para este estudo, com base na dificuldade de explicar o mecanismo de dano na função coclear e nas células internas. Acreditamos que a cipermetrina pode danificar outras estruturas e, para futuros estudos, sugerimos a análise histopatológica das células internas, bem como a avaliação do sistema auditivo central.
A ototoxicidade deve ser considerada durante o diagnóstico de perda auditiva, especialmente em trabalhadores agrícolas ou que possam estar expostos a pesticidas. Esses indivíduos são expostos a múltiplos fatores e constituem uma população vulnerável à perda auditiva. Na prática clínica, podemos considerar a associação de estudos experimentais e humanos, devido à importância do entendimento do mecanismo das substâncias às quais nossos pacientes estão expostos, bem como os efeitos dessas substâncias na clínica audiológica. A maioria dos estudos sobre ototoxicidade no PubMed está relacionada ao uso de medicamentos, como cisplatina e antibióticos.7
Mesmo assim, este é um estudo experimental devido à ausência de literatura que associe o uso de medicamentos e a exposição a substâncias químicas com efeitos auditivos. É necessário correlacionar estudos clínicos com estudos experimentais.
ConclusãoEste estudo fornece evidências de que a exposição subcrônica por inalação a baixas concentrações de cipermetrina induziu ototoxicidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) pelo apoio financeiro e a Dora Saul e Marina Tuerlinckx, estudantes que nos ajudaram com apoio técnico.
Como citar este artigo: Cunha EO, Reis A, Macedo MB, Machado MS, Dallegrave E. Ototoxicity of cypermethrin in Wistar rats. Braz J Otorhinolaryngol. 2020;86:587–92.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.