Embora os papilomas invertidos nasossinusais sejam lesões benignas, eles são localmente agressivos e apresentam uma potencial transformação maligna que varia de 5% a 15%, com alta taxa de recorrência.
ObjetivoDescrever a taxa de recorrência e transformação maligna em pacientes com diagnóstico de papiloma invertido submetidos à cirurgia em um hospital terciário em São Paulo.
MétodoAnálise retrospectiva dos pacientes diagnosticados com papiloma nasossinusal submetidos a cirurgia em um hospital terciário em São Paulo, entre agosto de 1998 e agosto de 2017. Uma revisão de prontuários dos pacientes foi realizada para avaliar dados demográficos, características dos tumores, consultas de seguimento, recorrência e malignidade. Os papilomas invertidos foram analisados e classificados de acordo com o sistema de estadiamento de Krouse.
ResultadosForam realizadas 69 cirurgias em pacientes com diagnóstico de papiloma nasossinusal. O papiloma invertido foi o subtipo mais prevalente (49 casos – 80,33%), seguido pelo papiloma exofítico (6 casos – 9,84%) e pelo papiloma oncocítico (6 casos – 9,84%). A taxa de recidiva foi de 34,09% para o papiloma invertido (15/44) e o tempo médio de recorrência foi de 24,6 meses. Transformação maligna ocorreu em seis pacientes (13,64%); três desses pacientes apresentaram carcinoma na primeira cirurgia e três pacientes desenvolveram carcinoma durante o seguimento.
ConclusãoA alta taxa de recorrência e o potencial de malignidade nos permitem considerar os papilomas invertidos como tumores agressivos. Em um hospital terciário de São Paulo, a taxa de recorrência foi de 34,09% e o tempo médio de recorrência de 24,6 meses. A recorrência após 10 anos implica na necessidade de acompanhamento a longo prazo. É possível que a alta taxa de recorrência e a alta taxa de transformação maligna que encontramos sejam devidas à grande extensão dos tumores (a maioria deles nos estágios T3 e T4), decorrente do acesso precário ao sistema de saúde nos países em desenvolvimento.
Papilomas nasossinusais são tumores benignos originários da mucosa schneideriana que reveste a cavidade nasal e os seios paranasais. De acordo com a Organização Mundial de Saúde, os papilomas são classificados em três subtipos diferentes: exofítico (escamoso), invertido e oncocítico (ou de células cilíndricas).1 Eles são relativamente raros, com uma incidência de 0,75 a 1,5/100.000 indivíduos por ano e o papiloma invertido é o subtipo mais prevalente.2
Embora o papiloma invertido nasossinusal (PIN) seja uma lesão benigna, ela é localmente agressiva e apresenta um potencial de transformação maligna que varia de 5% a 15%, com alta taxa de recorrência (até 78%).3 O objetivo deste artigo é descrever a taxa de recorrência e transformação maligna em pacientes com diagnóstico de PIN submetidos a tratamento cirúrgico em um hospital terciário em São Paulo.
MétodoFoi realizada análise retrospectiva de pacientes diagnosticados com papiloma nasossinusal e submetidos a cirurgia em um hospital terciário em São Paulo, entre agosto de 1998 e agosto de 2017. Este estudo foi submetido ao comitê de ética do hospital e aprovado sob n° 2.395.820. Uma revisão de prontuários foi feita para avaliar dados como idade, sexo, histórico médico, exposição ao álcool e tabaco, número de cirurgias sinusais anteriores, tipo de cirurgia realizada, localização do tumor, subtipo histopatológico, estadiamento, consultas de acompanhamento, recorrência e malignidade.
Os papilomas invertidos foram classificados segundo o sistema de estadiamento de Krouse (tabela 1), baseado na extensão da lesão identificada nas tomografias computadorizadas (TC) de seios paranasais, ressonâncias magnéticas (RM) de face e achados intraoperatórios.4 As imagens de TC foram analisadas pelos autores e, nos casos em que o tumor não pudesse ser adequadamente diferenciado de espessamento mucoso ou secreções retidas, as imagens de ressonância magnética eram então analisadas. Os achados intraoperatórios foram revisados para confirmar a extensão do papiloma.
Sistema de estadiamento de Krouse4
| T | Localização do tumor |
|---|---|
| T1 | Tumor restrito à cavidade nasal, sem extensão aos seios paranasais. |
| T2 | Tumor que envolve o complexo ostiomeatal e o seio etmoidal e/ou a porção medial do seio maxilar, com ou sem envolvimento da cavidade nasal. |
| T3 | Tumor que envolve as paredes lateral, anterior, posterior, inferior ou superior do seio maxilar, seio esfenoidal e/ou seio frontal, com ou sem critérios para T2. |
| T4 | Tumor com extensão extranasal/extrassinusal, que envolve estruturas contíguas adjacentes, como a órbita, o compartimento intracraniano ou o espaço pterigomaxilar ou tumores associados a malignidade. |
Após a cirurgia, os pacientes foram avaliados uma vez por semana durante um mês, aos três meses, aos seis meses, um ano de pós‐operatório e, após, anualmente. Em cada visita, os pacientes foram questionados sobre seus sintomas e um exame endoscópico foi realizado para avaliar a recorrência do papiloma. Pacientes com sintomas nasais recorrentes (obstrução nasal, rinorreia, cefaleia, epistaxe) ou com lesões suspeitas identificadas no exame endoscópico foram submetidos a nova tomografia computadorizada e biópsia.
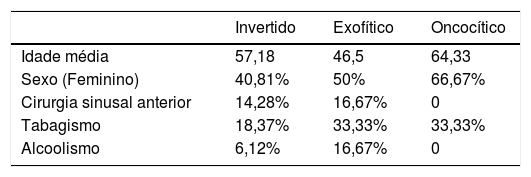
ResultadosForam feitas 69 cirurgias em pacientes com diagnóstico de papiloma nasossinusal entre agosto de 1998 e agosto de 2017. Oito pacientes foram excluídos por falta de dados nos prontuários, resultando em um total de 61. O papiloma invertido foi o subtipo mais prevalente, correspondendo a 49 casos (80,33%), seguido pelo papiloma exofítico (seis casos – 9,84%) e pelo papiloma oncocítico (seis casos – 9,84%). Três pacientes com o subtipo de papiloma invertido foram diagnosticados com carcinoma espinocelular (CEC) no momento da primeira cirurgia em nosso hospital. A tabela 2 resume os dados demográficos em cada subtipo de papiloma.
Cirurgia endoscópica endonasal isolada foi realizada em 43 pacientes (70,49%), abordagem combinada endoscópica e acesso externo (Calldwel‐Luc ou rinotomia lateral ou cirurgia de Lynch) foi realizada em 15 pacientes (24,59%) e acesso externo isolado foi realizado em três (4,92%). Não houve complicações maiores.
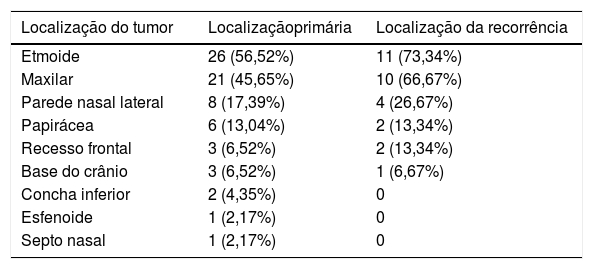
A classificação de Krouse foi aplicada a todos os PINs. Um paciente (2,04%) foi classificado no estágio T1, 14 no estágio T2 (28,57%), 29 no estágio T3 (59,18%) e cinco no estágio T4 (10,20%). A maioria dos PINs originava‐se dos seios etmoidais (56,52%), seguidos pelo seio maxilar (45,65%), parede nasal lateral (17,39%), papirácea (13,04%), recesso frontal (6,52%), base do crânio (6,52%), concha nasal inferior (4,35%), esfenoide (2,17%) e septo nasal (2,17%).
Quatro pacientes perderam o seguimento e um paciente foi encaminhado para um serviço oncológico para ser submetido à quimioterapia e radioterapia, pois o resultado anatomopatológico mostrou presença de CEC e o tumor não pôde ser completamente removido no momento da cirurgia. Considerando os 44 pacientes que continuaram a ser assistidos, o tempo médio de seguimento neste estudo foi de 35,56 meses.
A taxa de recorrência foi de 34,09% para o papiloma invertido (15/44) e o tempo médio de recorrência foi de 24,6 meses (variando de um a 128). Considerando os papilomas invertidos recorrentes, 12 se encontravam no estágio T3 (80%) no momento da cirurgia, dois no estágio T4 (13,34%) e um no estágio T2 (6,67%). A maioria das lesões recorrentes tinha múltiplas inserções. O seio etmoidal foi o local de origem em 73,34% dos casos recorrentes, seguido pelo maxilar em 66,67%. A tabela 3 mostra o local de origem das lesões primárias e recorrentes.
Localização do tumor primário e recorrente
| Localização do tumor | Localizaçãoprimária | Localização da recorrência |
|---|---|---|
| Etmoide | 26 (56,52%) | 11 (73,34%) |
| Maxilar | 21 (45,65%) | 10 (66,67%) |
| Parede nasal lateral | 8 (17,39%) | 4 (26,67%) |
| Papirácea | 6 (13,04%) | 2 (13,34%) |
| Recesso frontal | 3 (6,52%) | 2 (13,34%) |
| Base do crânio | 3 (6,52%) | 1 (6,67%) |
| Concha inferior | 2 (4,35%) | 0 |
| Esfenoide | 1 (2,17%) | 0 |
| Septo nasal | 1 (2,17%) | 0 |
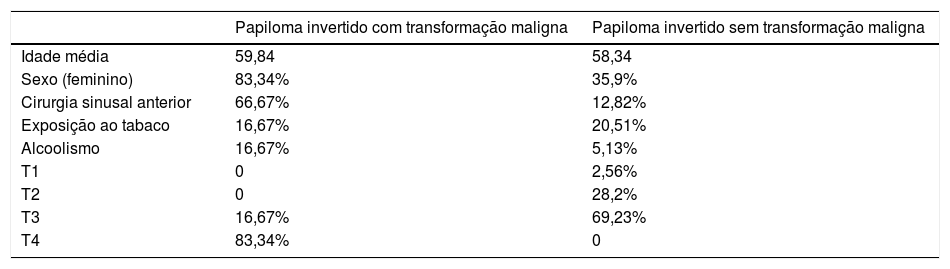
Transformação maligna ocorreu em seis pacientes (13,64%). Três desses pacientes apresentaram CEC na primeira cirurgia (malignidade síncrona) e três desenvolveram carcinoma durante o seguimento, 11, 48 e 54 meses após a primeira cirurgia em nosso serviço (malignidade metácrona). Cinco desses pacientes eram do sexo feminino (83,34%), cinco foram classificados como Estágio T4 (83,34%) e um foi classificado como Estágio T3 (16,67%). Quatro pacientes com lesões malignas já haviam sido submetidos a cirurgia sinusal anterior (66,67%) (tabela 4).
Dados demográficos da população com e sem transformação maligna
| Papiloma invertido com transformação maligna | Papiloma invertido sem transformação maligna | |
|---|---|---|
| Idade média | 59,84 | 58,34 |
| Sexo (feminino) | 83,34% | 35,9% |
| Cirurgia sinusal anterior | 66,67% | 12,82% |
| Exposição ao tabaco | 16,67% | 20,51% |
| Alcoolismo | 16,67% | 5,13% |
| T1 | 0 | 2,56% |
| T2 | 0 | 28,2% |
| T3 | 16,67% | 69,23% |
| T4 | 83,34% | 0 |
O papiloma invertido é o subtipo mais frequentemente diagnosticado de papiloma nasossinusal, representando mais de 50% dos casos, seguido pelo subtipo exofítico, com prevalência semelhante. O papiloma oncocítico é raro e corresponde a 3% a 5% dos casos.5 Neste estudo, encontramos uma maior prevalência de papiloma invertido, correspondendo a 80,33% de todos os papilomas. O subtipo exofítico foi encontrado em apenas 9,84% dos casos de papiloma nasossinusal, assim como o subtipo oncocítico.
A média de idade dos pacientes com PIN foi de 57,18 anos e a razão sexo masculino/feminino foi de 1,45:1. Esses dados condizem com a literatura atual, que aponta que o PIN afeta principalmente pacientes em sua quinta década de vida e apresenta predominância em homens.6,7 O papiloma exofítico ocorre frequentemente em pacientes mais jovens, em sua quarta década de vida,5 e o papiloma oncocítico geralmente ocorre em pacientes mais velhos.8 Nossos achados corroboram esses dados, com média de idade de 46,5 anos para o subtipo exofítico e de 64,33 anos para o papiloma oncocítico.
O seio etmoidal foi o principal local de origem do PIN, seguido pelo seio maxilar. Esses achados diferem da literatura atual, na qual o seio maxilar é descrito como o local de inserção mais comum do papiloma invertido.9–11
A patogênese do PIN não é completamente conhecida. Algumas teorias o associam à infecção pelo vírus do papiloma humano (HPV), porém isso ainda é controverso. Uma metanálise de 2013 por Syrianen e Syrianen encontrou uma prevalência de 38,5% de infecção por HPV em pacientes com papiloma nasossinusal e uma positividade de 37,8% para HPV em papilomas invertidos, sem diferença estatisticamente significante com base no método de detecção do HPV.12 Uma revisão de 2014 por Govindaraj e Wang também demonstrou uma associação entre a infecção por HPV e o papiloma invertido e sugeriu que o vírus desempenharia um papel na patogênese do tumor e em sua progressão para displasia e carcinoma espinocelular.6 Zhao et. al. encontraram associação estatisticamente significante entre a infecção por HPV e a transformação maligna em papilomas invertidos.13 Em contraste, Mohajeri et. al., em um estudo recente, analisaram 76 pacientes com PIN e detectaram uma positividade de 13,2% para o HPV, através de polimerase chain reaction (PCR), sugerindo que o HPV não estaria envolvido no desenvolvimento tumoral. Além disso, encontraram ausência de positividade para o HPV entre os pacientes com CEC, indicando que o vírus não seria fator contribuinte para a transformação maligna.14
Os PINs estão associados à malignidade, com uma taxa de transformação maligna variando de 1,9% a 15%.5,7,15–17 O CEC é o tipo histológico predominantemente desenvolvido, mas o carcinoma mucoepidermoide e o carcinoma indiferenciado nasossinusal também já foram descritos.5,16 A taxa de transformação maligna neste estudo foi de 13,64% (todos os casos com CEC), sendo que todos esses pacientes apresentaram classificação em estágios T3 ou T4 de Krouse, o que sugere que a extensão do tumor pode estar associada à transformação maligna.
A possibilidade de malignidade deve ser considerada quando há um rápido crescimento tumoral, invasão de estruturas adjacentes ou sangramento nasal.7 Não há consenso sobre o papel da infecção pelo HPV no processo de malignização. Alguns autores encontraram taxa de detecção semelhante de infecção por HPV no carcinoma ex‐papiloma e papiloma schneideriano sem malignidade.16–20 No entanto, existem alguns estudos que sugerem que a infecção pelo HPV‐16 e HPV‐18 possa ter um papel indutor de malignidade, uma vez que há uma alta taxa de detecção desses subtipos em papilomas invertidos com displasia moderada a grave ou CEC. Além disso, uma metanálise de 2016 sugeriu uma associação estatisticamente significante entre HPV de alto risco (especialmente HPV‐18) e papiloma maligno.13
Alterações genéticas relacionadas a fatores pró‐apoptóticos como p53, p21, p27, p16, genes inflamatórios (COX‐2), fatores anti‐apoptóticos (p63, bcl‐2) e moléculas de adesão intercelular (desmogleína 3, e‐caderina, catenina, fascina) podem ter um papel na transformação maligna do PIN.17 Recentemente, Undager et. al. identificaram genótipos de EGFR (receptor do fator de crescimento epidérmico) idênticos em pares combinados de PIN e CEC associado ao PIN, fornecendo evidência genética de uma ligação entre esses tumores e sugerindo um papel da ativação de mutações do EGFR na patogênese de PIN do CEC associado ao PIN.21
A mediana de sobrevida dos pacientes com carcinoma espinocelular ex‐papiloma é de 62,2 meses e a taxa de sobrevida em cinco anos é de 72,5%.22 Yu e Liu observaram que esses pacientes com CEC apresentaram maior sobrevida em cinco anos quando submetidos a tratamento combinado (cirurgia e radioterapia) em comparação com pacientes que receberam um único tipo de tratamento (cirurgia ou radioterapia).22
O tratamento do PIN consiste na excisão completa do tumor e remoção da mucosa adjacente e mucoperiósteo no local da origem tumoral.23,24 Focos microscópicos das células do papiloma podem estar ocultas no osso subjacente, portanto, o broqueamento para raspagem do osso no local de origem do tumor pode contribuir para reduzir o risco de recorrência5 A taxa de sucesso da cirurgia endoscópica para ressecção do papiloma é descrita como aproximadamente de 95%, com menor morbidade em comparação à abordagem externa.23
A taxa de recorrência do papiloma invertido tem sido descrita em até 78%3 na literatura e alguns fatores de risco para recorrência foram identificados, como exposição ao tabaco, tamanho do tumor, alta hiperqueratose, hiperplasia escamosa, alto número de mitoses, positividade para HPV, bilateralidade e localização tumoral.5–7 Na maioria dos casos, a recorrência ocorre nos três primeiros anos após a cirurgia, embora haja relatos de recorrência após 10 anos.5–7,12 Neste estudo, a taxa de recorrência para o papiloma invertido foi de 34,09% e o tempo médio de recorrência foi de 24,6 meses, consistente com os achados de outros hospitais terciários.24
Não há consenso sobre a capacidade do sistema de estadiamento de Krouse de estimar a taxa de recorrência do papiloma invertido. Lisan et. al. encontraram um risco 51% maior de recorrência para PIN estágio T3 de Krouse comparado ao estágio T2. Em nosso estudo, 80% das lesões recorrentes foram classificadas como Estágio T3, o que é consistente com esse achado. 25 Entretanto, um estudo recente que comparou diferentes sistemas de estadiamento verificou que os sistemas que classificam o PIN com base no envolvimento de seios paranasais não têm boa capacidade para avaliar recorrência. 11 Meng et. al. propuseram um novo sistema baseado no sítio de origem para classificar o PIN e encontraram uma boa correlação entre o estágio do PIN e a taxa de recorrência.26
Tumores recorrentes têm sido descritos como mais agressivos e com maior taxa de recidiva, em comparação com lesões primárias.9 Essa tendência foi encontrada neste estudo, se observarmos que 66,67% dos papilomas que sofreram transformação maligna ocorreram em pacientes submetidos a cirurgia nasossinusal prévia. Observamos que o local de origem dos papilomas recorrentes parece ter a mesma distribuição que as lesões primárias. Isso pode sugerir que a recorrência pode resultar da remoção incompleta do tumor original, o que também foi demonstrado em estudos anteriores.9,10
ConclusãoEmbora os papilomas nasossinusais sejam lesões benignas, a alta taxa de recorrência e o potencial de malignidade nos permitem considerá‐los tumores agressivos. Em um hospital terciário em São Paulo, a taxa de recorrência foi de 34,09% e o tempo médio de recorrência foi de 24,6 meses, condizente com a literatura atual. Recorrência após 10 anos, como encontramos neste estudo, implica na necessidade de acompanhamento a longo prazo. As altas taxas de recorrência e transformação maligna observadas podem ser devidas à grande extensão dos tumores (a maioria deles nos estágios T3 e T4), decorrentes do acesso precário da população ao sistema de saúde, nos países em desenvolvimento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sbrana MF, Borges RF, Pinna FR, Brandão Neto D, Voegels RL. Sinonasal inverted papilloma: rate of recurrence and malignant transformation in 44 operated patients. Braz J Otorhinolaryngol. 2021;87:80–4.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.