A disfonia pós‐operatória é causada principalmente por cicatrizes nas pregas vocais. Tem sido relatado que o manejo cuidadoso da cirurgia das pregas vocais reduz o risco de formação de cicatriz. No entanto, a depender da lesão da prega vocal, o tratamento da disfonia pós‐operatória pode ser desafiador.
ObjetivoDesenvolver uma nova abordagem regenerativa profilática para o tratamento de pregas vocais lesionadas após a cirurgia, com microesferas biodegradáveis de hidrogel de gelatina como sistema de administração de medicamentos para o Fator Básico de Crescimento de Fibroblastos (bFGF).
MétodoA cirurgia laríngea videoendoscópica foi feita para criar lesão nas pregas vocais em 14 coelhos. Imediatamente após esse procedimento, microesferas biodegradáveis de hidrogel de gelatina com bFGF foram injetadas na prega vocal. Duas semanas após a injeção, as laringes foram excisadas para avaliação da histologia das pregas vocais e do movimento da mucosa.
ResultadosA presença de função vibratória deficiente foi confirmada nas pregas vocais lesionadas. A histologia e a análise de imagem digital demonstraram que as pregas vocais lesionadas injetadas com microesferas de hidrogel de gelatina com bFGF apresentaram menor formação de cicatriz, em comparação com as pregas vocais lesionadas injetadas apenas com microesferas de hidrogel de gelatina ou aquelas sem injeção.
ConclusãoUma injeção profilática de microesferas biodegradáveis de hidrogel de gelatina com bFGF demonstra um potencial regenerativo para pregas vocais lesionadas em um modelo de coelho.
O tratamento da disfonia após lesões nas pregas vocais secundárias à cirurgia, trauma e inflamação pós‐infecção permanece um desafio.1 Relatos sugerem que a disfonia pós‐operatória é causada principalmente por cicatrizes nas pregas vocais.2 Dailey e Ford relataram que algumas das causas mais comuns do distúrbio provavelmente são pós‐cirúrgicas e iatrogênicas.3 Benninger et al. relataram que um manejo cuidadoso nos períodos pré‐operatório, operatório e pós‐operatório na cirurgia das pregas vocais pode reduzir o risco de formação de cicatriz.4 Entretanto, a depender da extensão e profundidade da lesão nas pregas vocais, a prevenção de cicatrizes pode não ser tratável durante o processo natural de cicatrização.5
Inúmeros estudos sobre o tratamento de cicatrizes nas pregas vocais, inclusive estudos experimentais em animais6,7 e de aplicações clínicas,8,9 têm sido feitos para resolver o problema da formação de cicatrizes não tratáveis; no entanto, um consenso para o tratamento efetivo da formação de cicatrizes ainda não foi alcançado. As abordagens de tratamento para cicatrizes nas pregas vocais podem ter um certo efeito positivo, embora sua capacidade regenerativa possa ser insuficiente para substituir completamente as cicatrizes crônicas das pregas vocais. Portanto, são necessárias novas abordagens regenerativas para o tratamento de cicatrizes nas pregas vocais.
Uma abordagem em potencial para a presença de cicatrizes de pregas vocais associada à cirurgia é a recuperação do local com formação de cicatrizes com estratégias de medicina regenerativa, que se concentram na regeneração de células, tecidos ou órgãos humanos para restaurar a função prejudicada. As estratégias regenerativas incluem o uso de fatores de crescimento, células e estruturas de suporte de tecidos.10 Uma das abordagens regenerativas mais esperadas é o transplante de células. Várias fontes de células têm sido usadas para o tratamento de cicatrizes nas pregas vocais, a fim de elucidar o mecanismo de reparo das pregas vocais. Diversos estudos anteriores relataram o uso de fibroblastos,11 células‐tronco mesenquimais,12 células‐tronco derivadas de tecido adiposo,13 células‐tronco embrionárias14 e células‐tronco pluripotentes induzidas15 com um efeito positivo na presença de cicatrizes das pregas vocais. No entanto, o transplante clínico de células requer um manejo rigoroso da segurança e é caro. Além disso, a possibilidade de rejeição dos transplantes limita o uso de aplicações de engenharia de tecidos em humanos. Uma abordagem opcional para o tratamento de pregas vocais com cicatrizes é a aplicação de uma combinação de fator de crescimento e estrutura de suporte. Estudos anteriores in vivo relataram o potencial terapêutico de uma combinação de fator de crescimento de hepatócitos em hidrogel e estrutura de suporte de colágeno‐gelatina com o Fator Básico de Crescimento de Fibroblastos (bFGF); entretanto, não foi possível obter uma recuperação completa.16,17 A recuperação completa de cicatrizes crônicas e maduras das pregas vocais associadas à cirurgia é, portanto, um desafio.
Outra possível solução para cicatrizes das pregas vocais associadas à cirurgia é uma abordagem preventiva. A eficácia da prevenção de cicatrizes nas pregas vocais pela aplicação local de soro fisiológico com bFGF já foi demonstrada;18 entretanto, nesse estudo, a injeção foi feita antes do procedimento cirúrgico para reduzir o risco de vazamento da área lesionada. Em teoria, o bFGF pode aumentar potencialmente a vascularização, o fluxo sanguíneo e o crescimento do tumor.19 Portanto, para minimizar o risco desnecessário de crescimento tumoral, é desejável determinar a aplicação da injeção de bFGF não antes do procedimento cirúrgico, mas depois de observar a extensão e a profundidade do dano à prega vocal. Além disso, como o bFGF é um fator de crescimento com uma meia‐vida curta,8,20 são necessárias múltiplas injeções para obter os efeitos regenerativos.21 No presente estudo, microesferas de hidrogel de gelatina, cuja viscosidade é diferente da salina, com bFGF, foram selecionadas para reduzir o vazamento e o uso como estrutura de suporte do bFGF, com liberação lenta do mesmo nas pregas vocais, no período após a injeção, como uma abordagem preventiva. Do ponto de vista de reparo das feridas, as células e os eventos bioquímicos podem ser divididos nos seguintes estágios: reação inflamatória (estágio inflamatório – alguns dias), proliferação celular e síntese de elementos que compõem a matriz extracelular (estágio proliferativo – 14 dias) e o período posterior, denominado remodelação (estágio de remodelação), que pode durar um ano ou mais.22 Nossa hipótese foi que o tratamento das pregas vocais lesionadas com uma única injeção profilática de bFGF com microesferas de hidrogel de gelatina como um sistema de administração de medicamento, imediatamente após a criação de uma lesão, iria interagir e influenciar as células locais das pregas vocais que modulam o ambiente da ferida, impedir a pioria da lesão na prega vocal na fase inicial do reparo tecidual, com menor formação de cicatrizes em potencial. A fim de avaliar o efeito precoce de uma injeção profilática de microesferas de hidrogel de gelatina com bFGF no reparo tecidual, avaliamos a histologia das pregas vocais e o movimento da mucosa por duas semanas após a criação da lesão, pois esse período corresponde ao estágio proliferativo, acima mencionado, em que o bFGF deveria melhorar a cicatrização de feridas de forma eficaz. O objetivo do presente estudo foi desenvolver uma nova abordagem regenerativa para o tratamento de pregas vocais lesionadas após a cirurgia, com microesferas biodegradáveis de gelatina de hidrogel como um sistema de administração de medicamentos para o Fator Básico de Crescimento de Fibroblastos (bFGF).
MétodoEste estudo foi aprovado pelo Conselho de Revisão Institucional da Fukushima Medical University em 30 de novembro de 2015 (Número de confirmação: #238), conforme diretrizes da política local, leis nacionais e da Declaração da Associação Médica Mundial de Helsinque.
Preparação do material injetávelDois tipos de material injetável, microesferas de hidrogel de gelatina com bFGF e microesferas de hidrogel de gelatina sem bFGF, foram preparados como se segue. A gelatina com um ponto isoelétrico de 4,9 foi isolada do colágeno de osso bovino através de um processo alcalino. Através de reticulação com glutaraldeído, a gelatina foi preparada como hidrogel e preservada em uma forma liofilizada até o seu uso. O tamanho das microesferas variou de 10 a 70μm no estado intumescido. Usamos um bFGF recombinante humano (200μg/mL) com um ponto isoelétrico de 9,6 e o aplicamos nas microesferas. O tempo de degradação do hidrogel foi de 14 dias.23 O bFGF foi carregado nas microesferas para liberação lenta nas pregas vocais durante o período pós‐injeção.
Procedimento cirúrgicoOs cuidados com o animal, o alojamento e os procedimentos cirúrgicos foram feitos de acordo com as diretrizes do Comitê de Experimentação Animal da Fukushima Medical University.
Foram adquiridos 16 coelhos brancos japoneses (machos, 11 semanas de idade, peso corporal de 2,0 a 2,4kg) da Japan SLC, Inc. (Shizuoka, Japão). Dois tipos de material injetável foram administrados em 14 coelhos brancos japoneses. Dois coelhos foram colocados no grupo de pregas vocais não lesionadas como controles. Os coelhos foram anestesiados por administração intramuscular de um coquetel de cloridrato de medetomidina (0,2mg/kg; Nippon Zenyaku Kogyo Co, Ltd, Fukushima, Japão), midazolam (1,0mg/kg; Astellas Pharma, Inc, Tóquio, Japão) e tartarato de butorfanol (0,2mg/kg; Meiji Seika Pharma Co, Ltd, Tóquio, Japão). As pregas vocais foram visualizadas com um abridor de boca de aço e um endoscópio de 0 grau com diâmetro de 1,9mm (Olympus Co, Ltd, Tóquio, Japão), conectado a uma fonte de luz externa e monitor de vídeo. Foi feito um registro em vídeo dos procedimentos cirúrgicos. Cada procedimento cirúrgico foi executado por um cirurgião com 14 anos de experiência em cirurgia laríngea humana e oito anos de experiência em cirurgia laríngea animal, mais um assistente. A profundidade e a consistência da lesão foram confirmadas por dois observadores experientes em cirurgia da laringe.
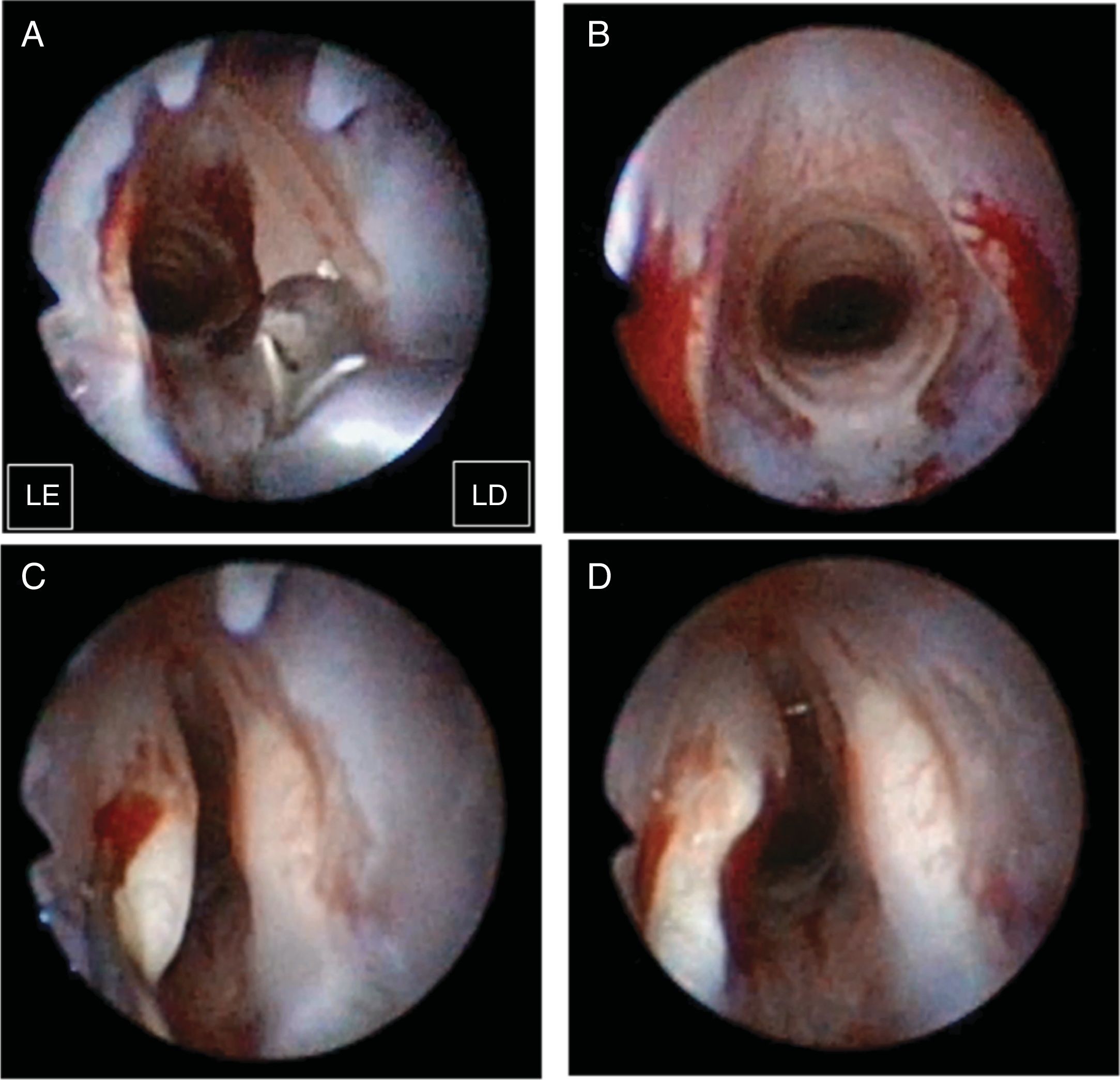
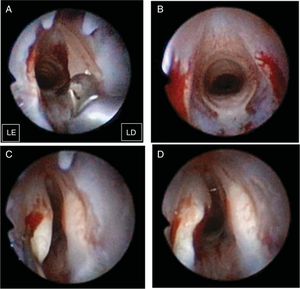
A lesão bilateral das pregas vocais foi criada com o uso de micropinças para remover a camada mucosa e superficial do músculo (fig. 1A). Após confirmação da consistência da lesão (fig. 1B), 100μL de microesferas de hidrogel de gelatina sem bFGF, ou as mesmas microesferas com bFGF, foram injetadas aleatoriamente nas pregas vocais lesionadas à direita ou à esquerda com uma agulha de calibre 22 e uma seringa de 1mL. Para evitar o vazamento das microesferas de hidrogel de gelatina, as deixamos de 4 a 5 minutos para atingir a gelificação após a mistura. Em seguida, injetamos o material de gelificação na lâmina própria (fig. 1C). Se o tempo de gelificação fosse prolongado, a conclusão do procedimento resultaria em entupimento da agulha ou dificuldade de aplicar a injeção. Observamos abaulamento das pregas vocais durante cada injeção (fig. 1D). O volume máximo de materiais injetáveis testado foi 100μL sem causar protuberância excessiva de tecido que pudesse comprometer as vias aéreas dos coelhos. Dois dos 14 coelhos foram sacrificados devido à inconsistência da lesão, condição avaliada por dois observadores. Uma decisão sobre lesão inconsistente precisou de discussão e da concordância entre os referidos observadores. Foram usados 12 coelhos (seis em cada grupo de tratamento [microesferas de hidrogel de gelatina sem bFGF {grupo não bFGF} e microesferas de hidrogel de gelatina com bFGF {grupo bFGF}]) para análise dos dados. Dois coelhos foram colocados no grupo de pregas vocais não lesionadas, sem tratamento, como controle.
Procedimento cirúrgico. A lesão bilateral da prega vocal foi criada com um microfórceps (A). Após a confirmação da lesão consistente bilateral (B), um volume de 100μL de microesferas de hidrogel de gelatina sem bFGF ou microesferas de hidrogel de gelatina com bFGF foi injetado nas pregas vocais lesionadas à direita ou à esquerda (C). Foi observado um abaulamento da prega vocal durante todas as injeções (D). LD e LE indicam lado direito e lado esquerdo, respectivamente.
No 14° dia após a cirurgia, os coelhos foram sacrificados por injeção intraperitoneal de pentobarbital sódico (Kyoritsu Seiyaku Corporation, Tóquio, Japão) e as laringes foram excisadas para avaliação da histologia das pregas vocais e movimento da mucosa.
Exame histológicoAs laringes ressecadas foram fixadas com paraformaldeído a 4% em solução salina tamponada com fosfato (pH 7,4) e embebidas em parafina. As laringes foram cortadas em seções de 4μm e submetidas a coloração com Hematoxilina e Eosina (H&E), bem como a coloração Elastica‐van Gieson (EVG), para observação microscópica de luz (BX‐51; Olympus). A coloração de H&E foi usada para análise morfológica; o conteúdo de colágeno foi visualizado com coloração EVG. A análise histológica foi feita por um patologista independente cego.
Exame vibratório das laringes excisadas e análise da vibração e forma das pregas vocais por laringologistasAs vibrações das pregas vocais foram examinadas com um sistema de imagem digital de alta velocidade antes da fixação com paraformaldeído a 4% em solução salina tamponada com fosfato. O exame vibratório foi feito 60 minutos após a excisão das laringes para evitar a influência do rigor mortis. Para visualização do movimento da mucosa das pregas vocais, foram removidas a epiglote e as falsas pregas vocais. O fluxo de ar (90 litros/minuto) foi gerado através de um tubo para o exame de vibração. Para registrar as vibrações das pregas vocais, um sistema de imagem digital de alta velocidade (FASTCAM mini UX50; Photron, Tóquio, Japão) foi montado acima da laringe e as imagens foram gravadas a uma taxa de quadros de 5.000 quadros/s (fig. 2A).
Exame vibratório. Para registrar as vibrações das pregas vocais, um sistema de imagem digital de alta velocidade foi montado acima da laringe e as imagens foram gravadas a uma taxa de 5000 quadros/s (A). Calculamos o quociente de abertura das pregas vocais (Qa), que é influenciado pela formação de cicatrizes nas pregas vocais. Usou‐se a seguinte equação: Qa=área do gap glótico/comprimento anteroposterior da glote (B).
Neste experimento, calculamos o Índice de abertura de prega vocal (IVFO, do inglês Index of Vocal Fold Opening) com o uso do comprimento anteroposterior da glote e a área do gap glótico, conforme estudos anteriores.21,24 O IVFO é influenciado pela formação de cicatriz das pregas vocais e acredita‐se que represente a recuperação funcional. Nosso estudo‐piloto mostrou que a abertura passiva da prega vocal gerada pelo fluxo de ar dependia da gravidade da cicatriz. Assim, foi usada a seguinte equação: IVFO=área do gap glótico/comprimento anteroposterior da glote (fig. 2B).
Foram examinadas 12 pregas vocais lesionadas sem tratamento, seis pregas vocais do grupo não bFGF e seis pregas vocais do grupo bFGF. Cada abertura da prega vocal foi examinada no momento abdutivo máximo. A área do gap glótico e o comprimento anteroposterior da glote foram medidos com o software ImageJ. Pequenas diferenças morfológicas e assimetrias, geralmente difíceis de distinguir por meio de avaliação mecânica, foram analisadas nos vídeos de vibração das pregas vocais por dois laringologistas seniores independentes cegos: o Avaliador 1 e o Avaliador 2 são especialistas em laringologia com vasta experiência em fonocirurgia e experimentação animal, respectivamente. A vibração e a forma das pregas vocais foram avaliadas com uma escala de cinco graus referente a uma folha de avaliação estroboscópica da The Larynx 2ndedition (Massachusetts Eye and Ear Infirmary Voice and Speech Laboratory). Cada item foi pontuado como: 1=diferença completa em comparação às pregas vocais normais; 2=diferença grave em comparação às pregas vocais normais; 3=diferença moderada em comparação às pregas vocais normais; 4=diferença leve comparada às pregas vocais normais e 5=nenhuma diferença comparada às pregas vocais normais.
Análise estatísticaO IVFO foi comparado entre o grupo de pregas vocais lesionadas e os grupos não bFGF e bFGF através do teste U de Mann‐Whitney e correção post hoc de Bonferroni. A vibração e a forma da prega vocal foram avaliadas por dois laringologistas independentes cegos, com a escala de cinco graus descrita na seção Material e Métodos. Os escores médios de vibração e forma foram comparados entre os grupos não bFGF e bFGF com o teste U de Mann‐Whitney. Todas as análises foram feitas no software SPSS Statistics 23.0. Um valor de p <0,05 foi considerado estatisticamente significativo.
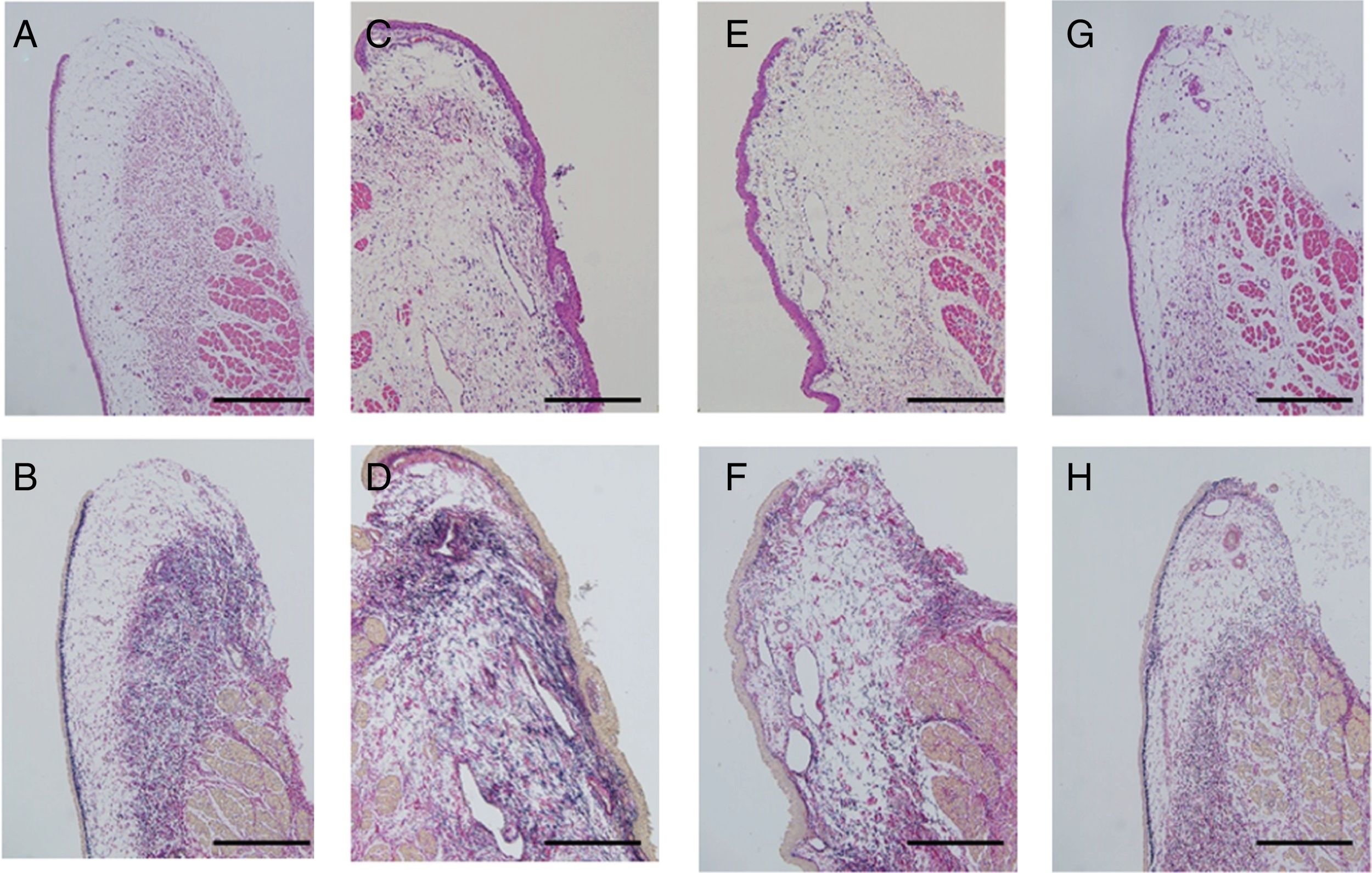
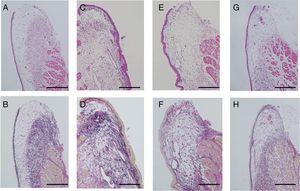
ResultadosExame histológicoA lesão das pregas vocais foi avaliada através da avaliação da deformação morfológica e densidade das fibras colágenas. Pregas vocais não lesionadas foram preparadas como controle. A superfície da mucosa parecia plana e coberta por epitélio escamoso fino. As fibras de colágeno estavam organizadas ordenadamente como uma camada na lâmina própria profunda (fig. 3A e B). As pregas vocais lesionadas apresentavam superfície irregular e deformada, com epitélio espesso. As fibras de colágeno estavam difusamente depositadas em toda a camada da mucosa (fig. 3C e D) e as pregas vocais lesionadas do grupo não bFGF mostraram elevação irregular da superfície da mucosa com deformação. A densidade de colágeno estava ligeiramente diminuída em relação às pregas vocais lesionadas; no entanto, a distribuição das fibras de colágeno não se apresentava em camadas, ao contrário da mucosa não lesionada. O epitélio ainda era espesso comparado aos das pregas vocais não lesionadas (fig. 3E e F). As pregas vocais lesionadas do grupo bFGF mostraram superfície plana com epitélio escamoso fino. A coloração EVG exibiu deposição em camadas das fibras de colágeno semelhante à da mucosa dos controles (fig. 3G e H). Os achados histológicos mostraram homogeneidade em todos os grupos.
Exame histológico. As seções foram coradas com Hematoxilina e Eosina (H&E), bem como Elastica van Gieson (EVG). Pregas vocais não lesionadas foram preparadas como controles (A e B). A superfície das pregas vocais lesionadas é irregular, com deformação acentuada coberta por epitélio espesso. As fibras de colágeno estão difusamente distribuídas na lâmina própria (C e D). Nas amostras com injeção de microesferas de hidrogel de gelatina sem bFGF, observou‐se elevação irregular da superfície da mucosa com deformação. A densidade de colágeno diminuiu ligeiramente em relação às pregas vocais lesionadas (E e F). As amostras que receberam a injeção de microesferas de hidrogel de gelatina com bFGF mostraram recuperação da estrutura normal das pregas vocais, composta por uma superfície plana e uma camada de colágeno arranjada de forma ordenada (G e H); (Barra de escala de 200μm) (A, C, E e G foram corados com H&E, e B, D, F e H com EVG).
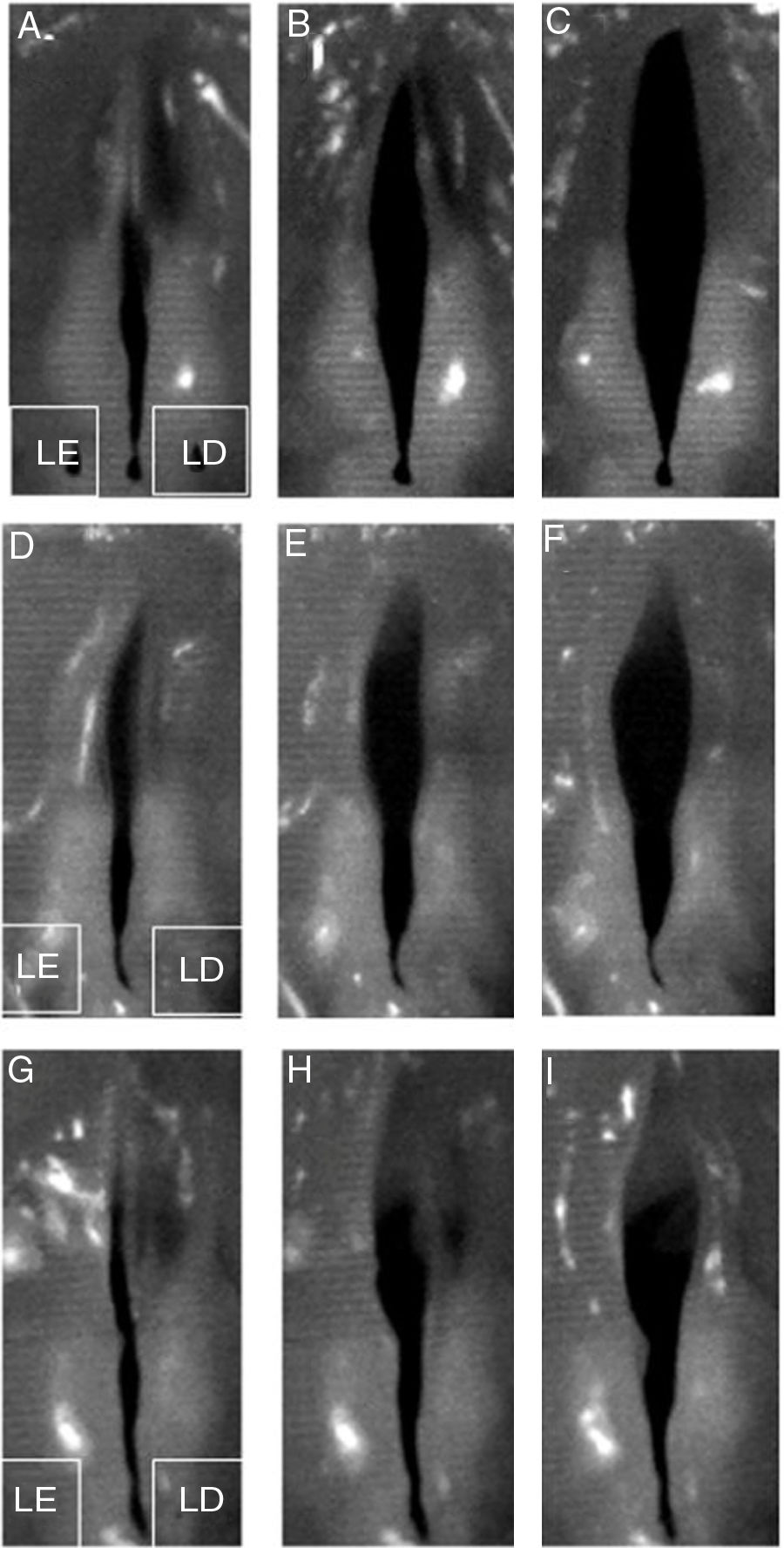
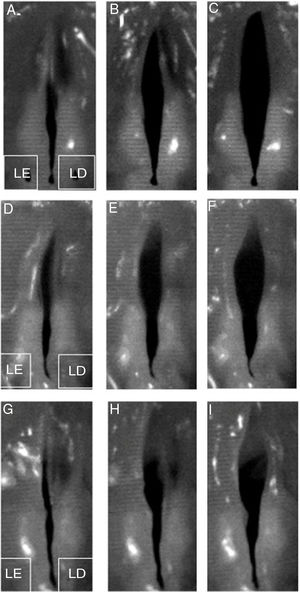
Imagens digitais de alta velocidade demonstraram ondas mucosas simétricas das pregas vocais não lesionadas (fig. 4A, B e C). Todas as pregas vocais lesionadas apresentaram ondas mucosas e aberturas nas pregas vocais limitadas quando comparadas com as pregas vocais não lesionadas (fig. 4 D‐I). As pregas vocais direitas do grupo não bFGF tinham ondas mucosas e aberturas nas pregas vocais limitadas; entretanto, as vibrações e aberturas foram melhores em comparação com a prega vocal esquerda lesionada sem injeção de microesferas de hidrogel de gelatina (fig. 4 D‐F). As pregas vocais direitas do grupo bFGF exibiram melhores vibrações e aberturas nas pregas vocais; no entanto, as vibrações e aberturas eram limitadas em comparação com as pregas vocais não lesionadas (fig. 4 G‐I).
Exame vibratório das laringes excisadas. Imagens digitais representativas de alta velocidade demonstraram ondas mucosas simétricas nas pregas vocais não lesionadas (A, B e C). Todas as pregas vocais lesionadas mostradas no lado esquerdo revelaram ondas mucosas e aberturas nas pregas vocais limitadas (D‐I). As microesferas de hidrogel de gelatina sem bFGF injetadas nas pregas vocais vistas no lado direito demonstraram ondas mucosas e aberturas nas pregas vocais limitadas. A vibração e as aberturas foram melhores em comparação com a prega vocal lesionada (D‐F). As microesferas de hidrogel de gelatina com bFGF injetadas nas pregas vocais no lado direito revelaram melhor vibração e abertura nas pregas vocais. A vibração e as aberturas ainda eram limitadas em comparação com a prega vocal não lesionada (G‐I). LD e LE indicam lado direito e lado esquerdo, respectivamente.
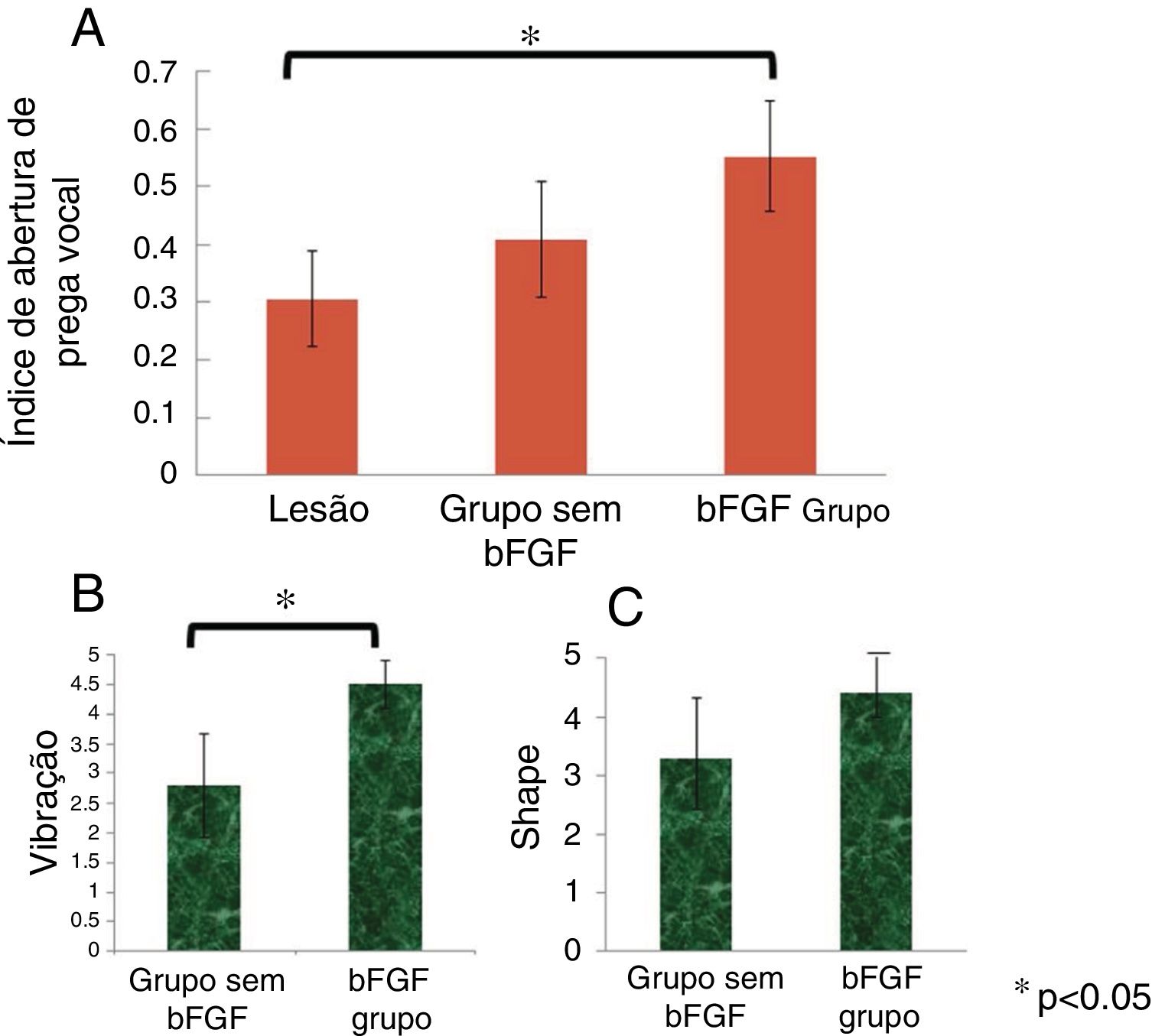
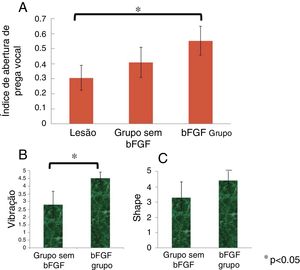
Os IVFOs médios das pregas vocais não lesionadas, pregas vocais lesionadas, pregas vocais com injeção de microesferas de hidrogel de gelatina sem bFGF e pregas vocais com injeção de microesferas de hidrogel de gelatina com bFGF foram 0,47, 0,31, 0,41 e 0,55, respectivamente. Houve uma diferença significativa no IVFO entre as pregas vocais lesionadas e as pregas vocais do grupo bFGF (p=0,003). O grupo não bFGF apresentou IVFO maior em comparação ao grupo com prega vocal lesionada e o grupo bFGF apresentou IVFO maior em comparação ao grupo não bFGF; no entanto, os resultados não foram estatisticamente significativos (p=0,871 e p=0,078, respectivamente) (fig. 5A).
Análise digital de IVFO. Os IVFOs das pregas vocais lesionadas, com microesferas de hidrogel de gelatina sem bFGF injetadas nas pregas vocais e microesferas de hidrogel de gelatina com bFGF injetadas nas pregas vocais, foram 0,31, 0,41 e 0,55, respectivamente. Houve diferenças significativas no IVFO entre as pregas vocais lesionadas e aquelas injetadas com microesferas de hidrogel de gelatina com bFGF (A). Os escores médios de vibração nas pregas vocais injetadas com microesferas de hidrogel de gelatina sem bFGF e aquelas injetadas com microesferas de hidrogel de gelatina com bFGF foram de 2,8 e 4,5, respectivamente. Houve uma diferença significativa no escore médio de vibração entre as pregas vocais injetadas com microesferas de hidrogel de gelatina sem bFGF e as pregas vocais injetadas com microesferas de hidrogel de gelatina com bFGF (B). Os escores médios de forma das pregas vocais injetadas com microesferas de hidrogel de gelatina com bFGF e aquelas injetadas com microesferas de hidrogel de gelatina com bFGF foram de 3,3 e 4,4, respectivamente. O resultado não foi estatisticamente significativo (C).
Não houve diferenças significativas na IVFO entre os grupos não bFGF e bFGF. Dois laringologistas treinados, com a escala de cinco graus descrita anteriormente, avaliaram a vibração e o formato das pregas vocais. A diferença entre examinadores para cada medida foi menor do que um. Os escores médios de vibração nos grupos não bFGF e bFGF foram 2,8 e 4,5, respectivamente. Houve diferença significativa no escore médio de vibração entre os grupos (p=0,032) (fig. 5B). Os escores médios da forma nos grupos não bFGF e bFGF foram 3,3 e 4,4, respectivamente. Houve um escore médio mais alto da forma no grupo bFGF em comparação com o grupo não bFGF, embora o resultado não tenha sido estatisticamente significativo (p=0,190) (fig. 5C).
DiscussãoO potencial regenerativo do fator básico de crescimento de fibroblastos contido nas microesferas de hidrogel de gelatina biodegradável, usadas como um sistema de administração de medicamento aplicado imediatamente após a lesão das pregas vocais, foi demonstrado através de exame histológico. Imagens digitais de alta velocidade de melhores ondas mucosas também sugerem um efeito positivo nas pregas vocais lesionadas.
Dois tipos de material injetável, microesferas de hidrogel de gelatina sem bFGF e microesferas de hidrogel de gelatina com bFGF, foram testados neste estudo. O bFGF é um potente mitógeno e quimioatraente para células endoteliais e fibroblastos, estimula a angiogênese, o metabolismo, a deposição da matriz extracelular e o movimento de células derivadas mesodérmicas.25 Devido aos efeitos preventivos favoráveis do bFGF no modelo de lesão de prega vocal em ratos,18 levantamos a hipótese de que a injeção de microesferas de hidrogel de gelatina com bFGF, imediatamente após a criação da lesão, levaria à interação com as células da prega vocal local que modulam o ambiente da ferida, resultaria em benefícios profiláticos para a lesão. Vários estudos abordaram a eficácia de uma combinação de hidrogel de gelatina biodegradável com liberação controlada de bFGF para a regeneração de tecidos ou órgãos danificados, inclusive osso do crânio,26 membros,27 nervos faciais,28 membrana timpânica29 e nervos laríngeos.30 Não foram observados efeitos colaterais devido ao uso do hidrogel de gelatina biodegradável com bFGF em diversos estudos anteriores, como aqueles focados em defeitos ósseos em coelhos,26 diabetes induzida por estreptozotocina em ratos31 e úlceras na pele em camundongos.32 Não há relatos do uso de microesferas de hidrogel de gelatina biodegradável com bFGF nas pregas vocais imediatamente após procedimentos cirúrgicos. Kobayashi et. al. relataram os efeitos do uso de bFGF com hidrogel de gelatina para restaurar cicatrizes agudas de pregas vocais. No entanto, o efeito regenerativo na cicatrização aguda da prega vocal foi limitado.21 Uma possível razão para isso é que a injeção na prega vocal com cicatriz foi feita um mês após a cirurgia. Suzuki et al. relataram que a aplicação local de bFGF tem o potencial de evitar cicatrizes nas pregas vocais de ratos; no entanto, nesse estudo, a injeção de soro fisiológico com bFGF foi aplicada antes do procedimento cirúrgico para reduzir o risco de vazamento.18 A injeção imediata de bFGF após a cirurgia é tecnicamente desafiadora. Portanto, no presente estudo, microesferas de gelatina com hidrogel foram selecionadas para reduzir o vazamento. A viscosidade do material de gelificação é diferente da solução salina, que vaza facilmente da área lesionada após a injeção. Os materiais de gelificação injetados em tempo hábil podem reduzir o vazamento da prega vocal lesionada. De acordo com o desenho do estudo atual, o tratamento das pregas vocais lesionadas pode contribuir para os efeitos sinérgicos do bFGF nas microesferas de hidrogel de gelatina e células residentes nas pregas vocais. Entretanto, uma investigação adicional pode ser necessária, inclusive um grupo com solução salina adicional apenas com bFGF, para caracterizar os efeitos do bFGF.
Os resultados do nosso estudo indicam os efeitos excepcionais das microesferas de hidrogel de gelatina com bFGF nas pregas vocais lesionadas. No entanto, as pregas vocais reparadas não retornaram à condição normal, como as pregas vocais não lesionadas. Nossos resultados podem ser melhorados com a determinação de uma dose adequada de bFGF. Foi relatado que o implante isquêmico de retalho livre aumenta a taxa de sobrevida de maneira dose‐dependente.33 No presente estudo, pregas vocais lesionadas, injetadas com 20μg de bFGF de liberação controlada, mostraram significativamente menos formação de cicatriz, demonstraram que a dose era adequada para o tratamento de pregas vocais lesionadas. Em relação à aplicação de bFGF para pregas vocais, Nagai et al. relataram a eficácia de 1μg de bFGF para paralisia de prega vocal de rato com o uso de fáscia autóloga e hidrogel de gelatina.34 Além disso, Tamura et al. relataram a eficácia de 1μg de bFGF com tecido adiposo no aumento da prega vocal humana para manter o volume do tecido adiposo.35 Entretanto, outro relato sugeriu que uma dose inadequada de bFGF produz tecido de granulação.30 Komura et al. relataram a eficácia da injeção intratraqueal com uma concentração de 200μg/mL de bFGF para o crescimento da cartilagem traqueal e nenhuma alteração na condição respiratória ou formação de tecido de granulação no exame histológico foi observada em quaisquer dos coelhos em seu estudo.36 Como a traqueia e a laringe são estruturas contínuas que formam as vias aéreas, determinamos uma concentração de 200μg/mL de bFGF como uma concentração segura para injeção intralaríngea para a prevenção de asfixia causada por efeitos colaterais do bFGF. No presente estudo, um período de duas semanas de observação após a injeção nas pregas vocais de microesferas de hidrogel de gelatina com 200μg/mL de bFGF foi usado com segurança, sem a formação de tecido de granulação. Para determinar a concentração mais eficaz de bFGF no tratamento de pregas vocais lesionadas são necessários estudos de dose‐resposta.
Demonstramos diferenças significativas no IVFO entre pregas vocais lesionadas e pregas vocais injetadas com microesferas de hidrogel de gelatina com bFGF. Não foram observadas diferenças significativas no IVFO entre os grupos não bFGF e bFGF. Como relatado anteriormente, os hidrogéis biocompatíveis têm a capacidade de modular e melhorar a resposta de cicatrização de feridas nas pregas vocais lesionadas.37 Devido ao risco de crescimento tumoral, o bFGF nem sempre é aplicável à cirurgia de prega vocal.19 Portanto, levantamos a hipótese de que se o efeito de simplesmente injetar microesferas de hidrogel de gelatina fosse comparável ao da injeção das microesferas, mas com bFGF, o uso do material seria clinicamente facilitado. Para provar essa hipótese, os grupos não bFGF e bFGF foram novamente comparados por um laringologista experiente com os vídeos de vibração de prega vocal. As avaliações demonstraram que houve uma diferença significativa no escore médio de vibração entre os grupos não bFGF e bFGF. A hipótese de que o efeito da injeção simples de microesferas de hidrogel de gelatina é comparável ao efeito da injeção de microesferas de hidrogel de gelatina com bFGF não foi demonstrada pelo presente estudo. Devido às diferenças identificáveis no exame histológico nas pregas vocais lesionadas, a vibração das pregas vocais lesionadas foi excluída da avaliação. Entretanto, a avaliação da vibração das pregas vocais lesionadas pode fornecer informações úteis para futuras investigações, para melhor quantificar a formação de cicatrizes nas mesmas.
A limitação deste estudo foi a falta de um período de observação de longo prazo após a cirurgia. Isso ocorreu porque nosso objetivo não era a recuperação após a formação de cicatrizes crônicas das pregas vocais, mas avaliar os efeitos iniciais de uma injeção profilática de microesferas de hidrogel de gelatina com bFGF no reparo tecidual. Avaliamos a histologia das pregas vocais e o movimento da mucosa por duas semanas após a criação da lesão, pois esse período corresponde ao estágio proliferativo22 e o tecido pode ser alterado drasticamente. Além disso, como a inflamação ativa na lesão das pregas vocais é resolvida em duas semanas5 e o tempo de degradação do hidrogel é de 14 dias,23 definimos o período de observação como de duas semanas. Estudos anteriores sobre os efeitos preventivos semelhantes ao do hidrogel injetável na lesão das pregas vocais relataram que os efeitos do tratamento observados no 21° dia do pós‐operatório foram mantidos durante o estágio crônico por 6 meses.6,38 Entretanto, uma observação em longo prazo após a cirurgia pode ser usada para confirmar alterações nas características das pregas vocais lesionadas na fase crônica.
ConclusõesUma nova injeção profilática de microesferas de hidrogel de gelatina biodegradável com bFGF como um sistema de administração de medicamento demonstra um potencial regenerativo para pregas vocais lesionadas após a cirurgia em um modelo de coelho.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Este estudo foi parcialmente apoiado por um Subsídio para Jovens Cientistas (B) da Sociedade Japonesa para a Promoção da Ciência.
Como citar este artigo: Imaizumi M, Nakamura R, Nakaegawa Y, Dirja BT, Tada Y, Tani A, et al. Regenerative potential of basic fibroblast growth factor contained in biodegradable gelatin hydrogel microspheres applied following vocal fold injury: Early effect on tissue repair in a rabbit model. Braz J Otorhinolaryngol. 2021;87:274–82.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.