Clinicians rely on clinical presentations to select therapeutic agents for acute bacterial rhinosinusitis. Streptococcus pneumoniae and Haemophilus influenzae are common in acute bacterial rhinosinusitis. Drug resistant Streptococcus pneumoniae and Haemophilus influenzae require different antibiotics.
ObjectiveThis study aimed to evaluate the associations between clinical features of acute bacterial rhinosinusitis and pathogenic bacteria.
MethodsSixty‐four patients with acute bacterial rhinosinusitis were enrolled. Clinical features including nasal obstruction, discolored discharge, facial pain, smell disturbance, fever and laboratory findings of patients with acute bacterial rhinosinusitis were collected. The bacterial cultures of endoscopic middle meatal swabs were used as a reference.
ResultsSerum C‐reactive protein level elevation correlated with the bacterial species (p=0.03), by which was increased in 80.0% of Haemophilus influenzae rhinosinusitis and 57.1% of Streptococcus pneumoniae rhinosinusitis. The elevated C‐reactive protein was the significant predictor for Haemophilus influenzae rhinosinusitis with the Odds Ratio of 18.06 (95% CI 2.36–138.20). The sensitivity of serum C‐reactive protein level elevation for diagnosing Haemophilus influenzae rhinosinusitis was 0.80 (95% CI 0.49–0.94).
ConclusionElevation of serum C‐reactive protein level was associated with and predicted acute bacterial rhinosinusitis caused by Haemophilus influenzae.
Os médicos se baseiam nas características clínicas para a escolha dos agentes terapêuticos para o tratamento da rinossinusite bacteriana aguda. Streptococcus pneumoniae e Haemophilus influenzae são agentes comuns na rinossinusite bacteriana aguda. Streptococcus pneumoniae e Haemophilus influenzae resistentes a antibióticos requerem medicamentos diferentes.
ObjetivoAvaliar as associações entre as características clínicas da rinossinusite bacteriana aguda e bactérias patogênicas.
MétodoO estudo incluiu 64 pacientes com rinossinusite bacteriana aguda. Foram coletadas e registradas as características clínicas, inclusive obstrução nasal, secreção com cor alterada, dor facial, distúrbios do olfato, febre e achados laboratoriais de pacientes com rinossinusite bacteriana aguda. As culturas bacterianas obtidas por swab endoscópico do meato médio foram usadas como referência.
ResultadosA elevação do nível sérico de proteína C‐reativa estava correlacionada com a espécie bacteriana (p=0,03); ela estava aumentada em 80,0% das rinossinusites por Haemophilus influenzae e em 57,1% das rinossinusites por Streptococcus pneumoniae. A proteína C‐reativa elevada foi um significativo fator preditor de rinossinusite por Haemophilus influenzae, com razão de probabilidade de 18,06 (IC 95% 2,36‐138,20). A sensibilidade da elevação dos níveis séricos de proteína C‐reativa para o diagnóstico de rinossinusite por Haemophilus influenzae foi de 0,80 (IC 95% 0,49±0,94).
ConclusãoA elevação dos níveis séricos de proteína C‐reativa é um preditor de rinossinusite bacteriana aguda causada por Haemophilus influenzae.
Antibióticos não devem ser rotineiramente prescritos em casos de rinossinusite aguda (RSA), porque a maioria das RSA é causada por vírus e quase 70% dos casos de rinossinusite bacteriana aguda (RSBA) podem se resolver espontaneamente, sem o uso de antibióticos.1 Os patógenos comumente responsáveis pelas RSBA são: Streptococcus pneumoniae (20%–45%), Haemophilus influenzae (20%–43%), Moraxella catarrhalis (14%–28%)2,3 e Staphylococcus aureus (8%–11%).4 Nos casos em que antibióticos sejam indicados, devem ser prescritos aqueles de curto espectro com vistas aos patógenos comuns. No entanto, os mecanismos de resistência a medicamentos dos dois patógenos mais comuns, o Streptococcus pneumoniae e o Haemophilus influenzae, são diferentes e requerem tratamentos antibióticos diferentes. O mecanismo de resistência do Streptococcus pneumoniae aos antibióticos β‐lactâmicos é a mutação do DNA. Ela danifica a transformação homóloga nas proteínas de ligação à penicilina,5 o que reduz a afinidade dessas proteínas e desequilibra a capacidade do antibiótico de inibir a biossíntese das paredes celulares bacterianas. Esse mecanismo requer o aumento da dose de penicilina.6 Por outro lado, o mecanismo de resistência à penicilina do Haemophilus influenzae é o gene de resistência à ampicilina, que produz a enzima β‐lactamase, que por sua vez hidrolisa o anel beta‐lactâmico dos antibióticos. Nesse caso, recomenda‐se o uso de inibidores da beta‐lactamase, como o ácido clavulânico.7,8 Portanto, um regime escolhido aleatoriamente pode não ser apropriado para ambos os mecanismos de resistência a antibióticos; ainda existem controvérsias quanto ao antibiótico de primeira linha no tratamento da RSBA. Não há consenso entre as diretrizes internacionais quanto aos medicamentos de primeira linha. A Infectious Diseases Society of America recomenda o uso de amoxicilina‐clavulanato,9 enquanto a American Academy of Otolaryngologic Head and Neck Surgery Foundation recomenda a amoxicilina, com ou sem clavulanato.10
Embora a cultura e a identificação das bactérias que causam RSBA com sensibilidade aos antibióticos sejam úteis, elas não são práticas. A endoscopia nasal e a punção do seio maxilar devem ser feitos por um especialista; esses procedimentos não estão disponíveis na maioria dos centros de atenção primária. Exames microbiológicos sofisticados são caros e geralmente não estão disponíveis. Portanto, os médicos se baseiam nas apresentações clínicas para selecionar os agentes terapêuticos apropriados. Até o momento, não existem dados baseados em evidências sobre as associações entre as características clínicas da RSBA e bactérias patogênicas. Diferentes bactérias podem causar quadros clínicos diferentes, de acordo com as características do patógeno e sua virulência. Não se sabe se as características clínicas podem predizer a bactéria patogênica. Este estudo teve como objetivo avaliar as associações entre as características clínicas e as bactérias patogênicas das RSAB e avaliar as características clínicas para a predição das duas bactérias patogênicas mais comuns: Streptococcus pneumoniae e Haemophilus influenzae.
MétodoEstudo transversal aprovado pelo Comitê de Ética Institucional da Faculdade de Medicina da Universidade Chulalongkorn (307/60). Todos os participantes assinaram um termo de consentimento informado antes de sua inclusão. Este estudo não recebeu fundos específicos de agências de financiamento de organizações públicas, comerciais ou sem fins lucrativos.
ParticipantesO estudo incluiu pacientes consecutivos com RSA, entre 18 e 65 anos, atendidos de junho de 2015 a setembro de 2016 em um hospital universitário em Bangkok (King Chulalongkorn Memorial Hospital) e em dois hospitais provinciais terciários (Sawanpracharak Hospital e Nakornpathom Hospital). Esses pacientes foram os mesmos que haviam sido recrutados prospectivamente para um estudo anterior11 que avaliou a sensibilidade e especificidade das diretrizes internacionais para o diagnóstico de RSAB. Os critérios diagnósticos da RSA seguiram a diretriz da rinossinusite em adultos da American Academy of Otolaryngology Head and Neck Surgery.10 Os critérios incluíam secreção nasal purulenta acompanhada de obstrução nasal, dor facial‐pressão‐plenitude auricular, ou ambos, com menos de quatro semanas de duração. A cultura bacteriana do meato médio foi coletada sob endoscopia e uma amostra de soro foi coletada de cada paciente na primeira visita. Os critérios de exclusão foram: 1) relatório de microbiologia negativo para bactérias; 2) uso de antibióticos ou anti‐inflamatórios (esteroides sistêmicos, esteroides tópicos ou AINEs) durante as duas semanas anteriores e 3) uso de antipiréticos nas últimas seis horas. Os pacientes foram diagnosticados com RSBA quando o relatório de microbiologia foi positivo para qualquer bactéria. A cultura foi definida como positiva quando o relatório quantitativo apontava ≥ 104 unidades formadoras de colônias por mililitro ou quando o relatório semiquantitativo apontava crescimento intenso ou numeroso.
Coleta dos dadosAs características clínicas de cada participante foram coletadas, inclusive obstrução nasal, secreção com cor alterada (relatada pelo paciente ou observada na endoscopia nasal), dor facial, alterações olfatórias, febre > 38°C (relatada pelo paciente ou medida), pioria clínica após melhoria inicial, sintomas persistentes > 10 dias, proteína C reativa (PCR) sérica, velocidade de hemossedimentação (VHS) e laudo microbiológico.
Análise estatísticaAs análises estatísticas foram feitas com SPSS v. 17.0 (Statistical Package for the Social Sciences, Chicago, IL). Todas as variáveis, inclusive febre, PCR sérica elevada e VHS sérica elevada, foram tratadas como variáveis dicotômicas. O teste qui‐quadrado de Pearson foi usado para avaliar a associação entre as características clínicas das RSAB e as bactérias patogênicas. Regressão logística univariada e regressão logística multivariada foram usadas para avaliar as características clínicas para predizer as duas bactérias patogênicas mais comuns: Streptococcus pneumoniae e Haemophilus influenzae. Foram calculadas as sensibilidade e especificidade de quaisquer preditores estatisticamente significativos. Valores de p inferiores a 0,05 foram considerados estatisticamente significantes.
ResultadosForam identificados 88 pacientes (67% mulheres) com RSA. Foram incluídos no estudo 64 participantes com cultura bacteriana do meato médio positiva. Desses, 41 eram do sexo feminino (64,1%). A idade média foi de 43,4 ± 14,8 anos. A duração média da RSBA foi de 16,1 ± 13,6 dias. Resultados positivos para crescimentos de múltiplas bactérias foram observados em 14 pacientes; no entanto, o foco de crescimento mais importante de cada paciente continha apenas uma espécie bacteriana. A espécie bacteriana identificada no foco maior de crescimento de cada paciente foi usada para análise posterior. A cultura bacteriana foi positiva para Streptococcus pneumoniae em sete pacientes (10,9%), Haemophilus influenzae em dez (15,6%), Moraxella catarrhalis em três (4,7%) e Staphylococcus aureus em seis (9,4%).
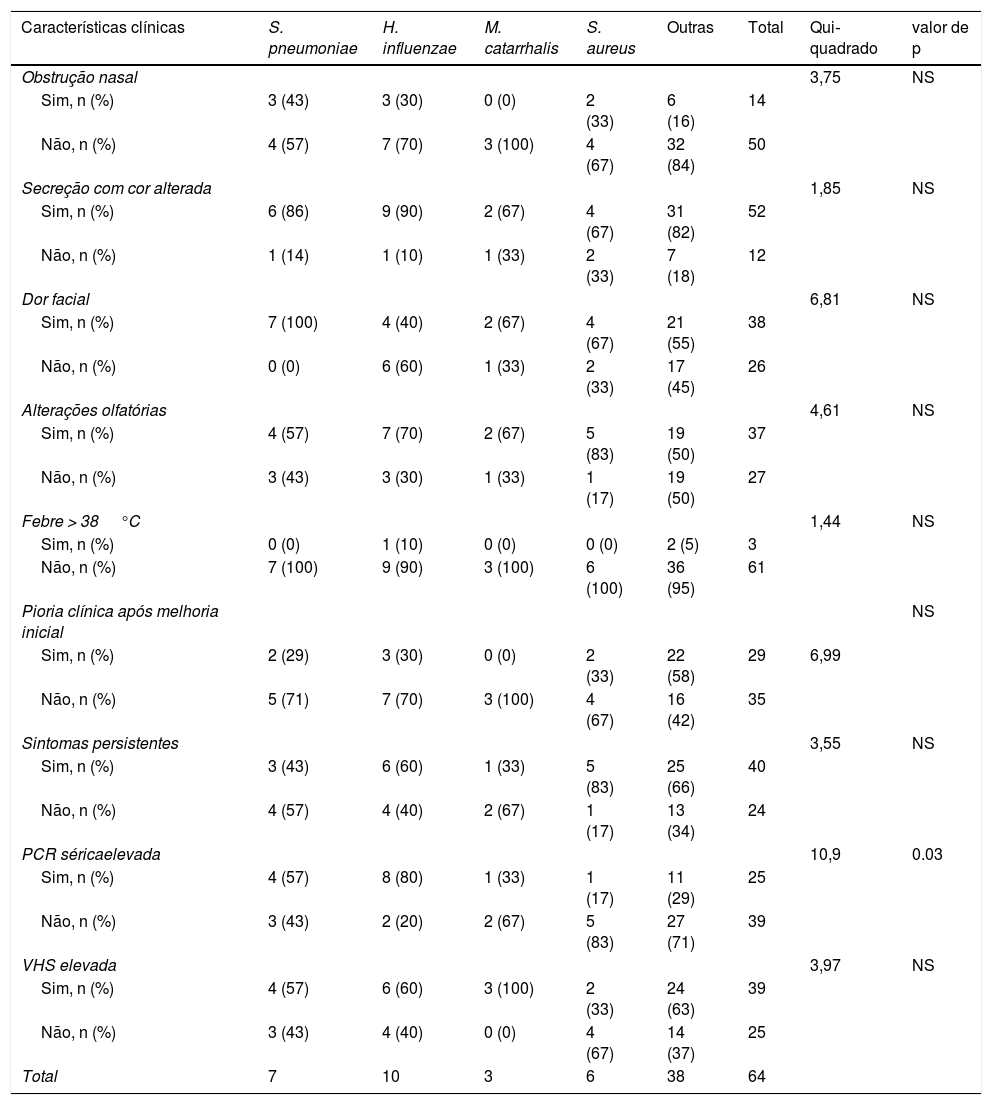
Associação entre as características clínicas da RSBA e bactérias patogênicasA tabela 1 mostra que a elevação dos níveis séricos de PCR está significativamente associada aos tipos de patógenos (χ2 = 10,9, p = 0,03). No presente estudo, 80% dos pacientes com infecção por Haemophilus influenzae e 57,1% dos pacientes com infecção por Streptococcus pneumoniae apresentaram elevação dos níveis séricos de PCR. A maioria dos pacientes com outras infecções bacterianas não apresentou elevação dos níveis séricos de PCR (tabela 1). Não foram observadas associações entre as espécies de bactérias patogênicas e outras características clínicas, inclusive obstrução nasal, secreção com cor alterada, dor facial, alterações olfatórias, febre, pioria clínica após melhoria inicial, sintomas persistentes > 10 dias e VHS sérica elevada.
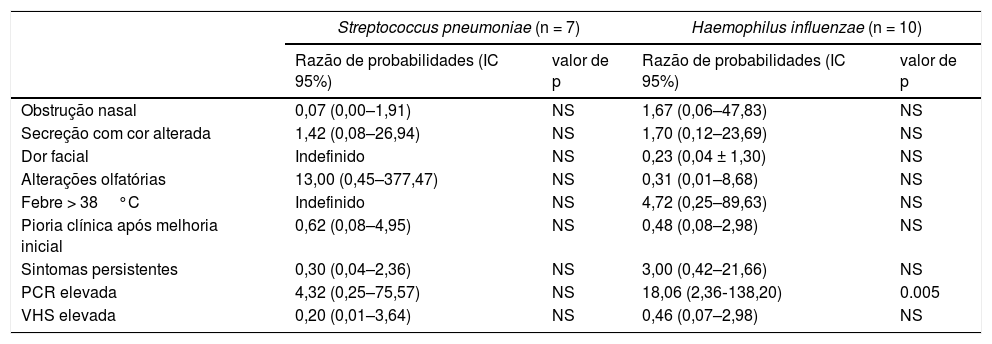
Características clínicas para predizer RSBA causada por Streptococcus pneumoniae e Haemophilus influenzaeNa regressão logística univariada feita para prever a rinossinusite por Streptococcus pneumoniae nenhuma das variáveis se mostrou estatisticamente significante. Na regressão logística univariada feita para prever a rinossinusite por Haemophilus influenzae a PCR elevada foi o único preditor significante, com razão de probabilidade de 8,71 (IC 95%: 1,67–45,44).
Resultados semelhantes foram observados na regressão logística multivariada. Nenhuma das variáveis foi capaz de prever rinossinusite por Streptococcus pneumoniae. A PCR elevada foi o único preditor significante de rinossinusite por Haemophilus influenzae, com razão de probabilidade de 18,06 (IC 95%: 2,36‐138,20). Todos os pacientes com rinossinusite por Streptococcus pneumoniae tinham dor facial e nenhum dos pacientes apresentava febre; assim, as razões de probabilidade e ICs dessas duas variáveis eram indefinidas (tabelas 1 e 2).
Associação entre tipo de bactérias causadoras da rinossinusite bacteriana aguda e características clínicas
| Características clínicas | S. pneumoniae | H. influenzae | M. catarrhalis | S. aureus | Outras | Total | Qui‐quadrado | valor de p |
|---|---|---|---|---|---|---|---|---|
| Obstrução nasal | 3,75 | NS | ||||||
| Sim, n (%) | 3 (43) | 3 (30) | 0 (0) | 2 (33) | 6 (16) | 14 | ||
| Não, n (%) | 4 (57) | 7 (70) | 3 (100) | 4 (67) | 32 (84) | 50 | ||
| Secreção com cor alterada | 1,85 | NS | ||||||
| Sim, n (%) | 6 (86) | 9 (90) | 2 (67) | 4 (67) | 31 (82) | 52 | ||
| Não, n (%) | 1 (14) | 1 (10) | 1 (33) | 2 (33) | 7 (18) | 12 | ||
| Dor facial | 6,81 | NS | ||||||
| Sim, n (%) | 7 (100) | 4 (40) | 2 (67) | 4 (67) | 21 (55) | 38 | ||
| Não, n (%) | 0 (0) | 6 (60) | 1 (33) | 2 (33) | 17 (45) | 26 | ||
| Alterações olfatórias | 4,61 | NS | ||||||
| Sim, n (%) | 4 (57) | 7 (70) | 2 (67) | 5 (83) | 19 (50) | 37 | ||
| Não, n (%) | 3 (43) | 3 (30) | 1 (33) | 1 (17) | 19 (50) | 27 | ||
| Febre > 38°C | 1,44 | NS | ||||||
| Sim, n (%) | 0 (0) | 1 (10) | 0 (0) | 0 (0) | 2 (5) | 3 | ||
| Não, n (%) | 7 (100) | 9 (90) | 3 (100) | 6 (100) | 36 (95) | 61 | ||
| Pioria clínica após melhoria inicial | NS | |||||||
| Sim, n (%) | 2 (29) | 3 (30) | 0 (0) | 2 (33) | 22 (58) | 29 | 6,99 | |
| Não, n (%) | 5 (71) | 7 (70) | 3 (100) | 4 (67) | 16 (42) | 35 | ||
| Sintomas persistentes | 3,55 | NS | ||||||
| Sim, n (%) | 3 (43) | 6 (60) | 1 (33) | 5 (83) | 25 (66) | 40 | ||
| Não, n (%) | 4 (57) | 4 (40) | 2 (67) | 1 (17) | 13 (34) | 24 | ||
| PCR séricaelevada | 10,9 | 0.03 | ||||||
| Sim, n (%) | 4 (57) | 8 (80) | 1 (33) | 1 (17) | 11 (29) | 25 | ||
| Não, n (%) | 3 (43) | 2 (20) | 2 (67) | 5 (83) | 27 (71) | 39 | ||
| VHS elevada | 3,97 | NS | ||||||
| Sim, n (%) | 4 (57) | 6 (60) | 3 (100) | 2 (33) | 24 (63) | 39 | ||
| Não, n (%) | 3 (43) | 4 (40) | 0 (0) | 4 (67) | 14 (37) | 25 | ||
| Total | 7 | 10 | 3 | 6 | 38 | 64 |
NS, não significativo; PCR, proteína C‐reativa;VHS, velocidade de hemossedimentação.
Características clínicas preditoras de infecção por Streptococcus pneumoniae e Haemophilus influenzae
| Streptococcus pneumoniae (n = 7) | Haemophilus influenzae (n = 10) | |||
|---|---|---|---|---|
| Razão de probabilidades (IC 95%) | valor de p | Razão de probabilidades (IC 95%) | valor de p | |
| Obstrução nasal | 0,07 (0,00–1,91) | NS | 1,67 (0,06–47,83) | NS |
| Secreção com cor alterada | 1,42 (0,08–26,94) | NS | 1,70 (0,12–23,69) | NS |
| Dor facial | Indefinido | NS | 0,23 (0,04 ± 1,30) | NS |
| Alterações olfatórias | 13,00 (0,45–377,47) | NS | 0,31 (0,01–8,68) | NS |
| Febre > 38°C | Indefinido | NS | 4,72 (0,25–89,63) | NS |
| Pioria clínica após melhoria inicial | 0,62 (0,08–4,95) | NS | 0,48 (0,08–2,98) | NS |
| Sintomas persistentes | 0,30 (0,04–2,36) | NS | 3,00 (0,42–21,66) | NS |
| PCR elevada | 4,32 (0,25–75,57) | NS | 18,06 (2,36‐138,20) | 0.005 |
| VHS elevada | 0,20 (0,01–3,64) | NS | 0,46 (0,07–2,98) | NS |
NS, não significativo.
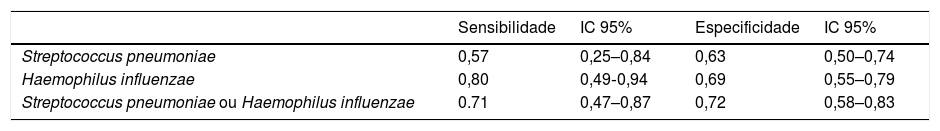
A PCR elevada, o único preditor significativo, foi analisada. A sensibilidade e a especificidade do nível sérico elevado de PCR na predição da infecção por Haemophilus influenzae foram 0,80 (IC 95%: 0,49–0,94) e 0,69 (IC 95%: 0,55–0,79), respectivamente. A sensibilidade e a especificidade do nível sérico elevado de PCR na predição da infecção por Streptococcus pneumoniae foram de 0,57 (IC 95%: 0,25‐0,84) e 0,63 (IC 95%: 0,50–0,74), respectivamente. A sensibilidade e a especificidade do nível sérico elevado de PCR na previsão das duas infecções bacterianas mais comuns; Streptococcus pneumoniae ou Haemophilus influenzae foram 0,71 (IC 95%: 0,47‐0,87) e 0,72 (IC 95%: 0,58–0,83), respectivamente (tabela 3).
Sensibilidade e especificidade da PCR sérica elevada para predizer RSBA causada por Streptococcus pneumoniae e/ou Haemophilus influenzae
| Sensibilidade | IC 95% | Especificidade | IC 95% | |
|---|---|---|---|---|
| Streptococcus pneumoniae | 0,57 | 0,25–0,84 | 0,63 | 0,50–0,74 |
| Haemophilus influenzae | 0,80 | 0,49‐0,94 | 0,69 | 0,55–0,79 |
| Streptococcus pneumoniae ou Haemophilus influenzae | 0.71 | 0,47–0,87 | 0,72 | 0,58–0,83 |
IC, intervalo de confiança; PCR, proteína C reativa; RSBA, rinossinusite bacteriana aguda.
Tanto quanto é do conhecimento dos autores, este é o primeiro estudo que avaliou os sinais e sintomas clínicos e dados laboratoriais básicos para prever as espécies de bactérias que causam RSAB. Os resultados do estudo indicaram uma associação entre a PCR sérica elevada e as bactérias patogênicas. A PCR sérica tem sido geralmente usada como um marcador de inflamação. Ela é sintetizada pelo fígado. A PCR sérica aumenta em resposta à inflamação, após a secreção de interleucina‐6 por macrófagos e células T.12,13 Em comparação com a VHS, a PCR é mais sensível na identificação do aumento das respostas inflamatórias.14 A VHS pode estar normal mesmo quando a PCR está elevada.
No presente estudo, observou‐se que níveis elevados de PCR estavam significantemente associados à rinossinusite por Haemophilus influenzae. Esse achado está de acordo com aqueles do estudo de Anttila et al.15 Quando o nível sérico de PCR foi monitorado diariamente em crianças com meningite por Haemophilus influenzae tipo B, o nível de PCR estava elevado quando a doença estava ativa, após recidivas e em casos com complicações neurológicas. Os níveis de PCR estavam normais no período de recuperação. Os resultados do presente estudo apontaram uma associação significante apenas entre a PCR elevada e Haemophilus influenzae, não Streptococcus pneumoniae ou outras bactérias. Thomas‐Rudolph et al.,16 em estudo com animais, observaram que a PCR sérica aumentava a resistência a infecções nasais causada por Streptococcus pneumoniae. O estudo animal de Mold et al.17 demonstrou que ratos que receberam PCR intravenosa não foram infectados após uma injeção viável de Streptococcus pneumoniae. A PCR liga‐se ao determinante da fosfocolina do polissacarídeo C da parede celular do Streptococcus pneumoniae e fornece defesa inata contra a infecção pneumocócica.
Antibióticos não devem ser rotineiramente administrados a pacientes com RSA, uma vez que a maioria dos casos é de origem viral. Com base nos resultados do presente estudo, a PCR sérica elevada parece ser útil na prática clínica. Pacientes com PCR elevada devem receber antibióticos para tratamento da rinossinusite por Haemophilus influenzae. Caso a área geográfica tenha alta prevalência de Haemophilus influenzae resistente a medicamentos, deve ser prescrita amoxicilina com inibidores de β‐lactamases, como ácido clavulânico. Pacientes com níveis séricos normais de PCR podem receber tratamento sintomático apenas. O uso de antibióticos no tratamento de Streptococcus pneumoniae deve ser considerado apenas após falha do tratamento conservador. Uma dose elevada de amoxicilina deve ser prescrita para o tratamento de Streptococcus pneumoniae resistente a medicamentos em regiões onde sua prevalência é elevada.
O teste de PCR sérica é simples e prático. O teste quantitativo leva cerca de 1h30, enquanto o teste rápido semiquantitativo leva apenas cinco minutos. Na Dinamarca e na Espanha, observou‐se redução significativa na taxa de uso de antibióticos para o tratamento de rinossinusite entre clínicos gerais que usaram o teste rápido de PCR.18,19 Um ensaio clínico randomizado e controlado conduzido por Cals et al. avaliou dois grupos de pacientes com rinossinusite. Os médicos usaram PCR na prescrição de antibióticos para o primeiro grupo; o segundo grupo recebeu o tratamento de rotina. Os resultados mostraram recuperação semelhante entre os grupos, mas a taxa de uso de antibióticos foi significantemente menor quando a PCR foi usada para auxiliar as decisões de prescrição.20
Em consonância com a literatura,10,21–24 no presente estudo observou‐se que Streptococcus pneumoniae e Haemophilus influenzae foram as duas principais bactérias causadoras de RSBA. No entanto, os percentuais dessas duas bactérias foram menores do que os apontados em outros estudos. A recente diretriz da American Academy of Otolaryngology‐Head and Neck Surgery Foundation10 indica que Streptococcus pneumoniae é isolado em 20% a 43% dos aspirados e Haemophilus influenzae, em 22% a 35%. As percentagens de Moraxella catarrhalis (2% a 10%) e Staphylococcus aureus (10%) no presente estudo foram semelhantes.
Este estudo teve um tamanho amostral limitado. Embora 88 pacientes com RSA tenham sido incluídos e 64 pacientes apresentassem culturas bacterianas positivas, apenas sete e dez pacientes apresentaram cultura positiva para Streptococcus pneumoniae e Haemophilus influenzae, respectivamente. Esses números podem ser muito pequenos e insuficientes para tirar conclusões. Os autores analisaram dados da mesma população que já estava inscrita em um estudo publicado anteriormente, sem o cálculo do tamanho da amostra.
Até o momento, os dados sobre o papel das bactérias anaeróbias na RSBA ainda são limitados. A outra limitação deste estudo foi o fato que a cultura bacteriana foi feita apenas em bactérias aeróbias, uma vez que a cultura de bactérias anaeróbias não está amplamente disponível fora dos principais hospitais. Portanto, pacientes com RBA causada por agentes anaeróbios não foram incluídos.
Este foi um estudo multicêntrico transversal. Os participantes foram recrutados em um hospital universitário e dois hospitais públicos provinciais. Mais estudos sobre os resultados do uso de PCR sérica para a seleção de antibióticos apropriados são necessários. Ensaios clínicos randomizados e bem conduzidos entre pacientes com RSBA que receberam amoxicilina ou amoxicilina com clavulanato ajudariam a esclarecer essa questão complexa. O nível sérico de PCR e sua relação com as taxas de cura e a melhoria dos sintomas de cada grupo devem ser avaliados.
ConclusãoA depender da virulência da bactéria patogênica, pacientes com RSBA podem ser tratados sintomaticamente ou podem requerer antibióticos. Quando antibióticos são prescritos, o profissional da saúde pode se beneficiar das informações para a seleção de altas doses de amoxicilina, adequado em casos de infecção por Streptococcus pneumoniae resistente a medicamentos, ou amoxicilina com clavulanato para Haemophilus influenzae produtor de β‐lactamase. O resultado deste estudo sugeriu que a elevação dos níveis séricos de PCR favorece o uso de amoxicilina com inibidores da β‐lactamase no tratamento de casos com suspeita de infecção por Haemophilus influenzae resistente a antibióticos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Suwannawong D, Seresirikachorn K, Aeumjaturapat S, Chusakul S, Kanjanaumporn J, Chitsuthipakorn W, et al. Predicting bacteria causing acute bacterial rhinosinusitis by clinical features. Braz J Otorhinolaryngol. 2020;86:281–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.