O processamento auditivo central refere‐se à eficiência e eficácia com que o sistema nervoso central usa informações auditivas e pode estar alterado em distúrbios neurológicos e lesões cerebrais, como acidentes vasculares cerebrais. No entanto, apesar das evidências de possíveis alterações na população pediátrica, as habilidades funcionais e as limitações pós‐acidente vascular cerebral ainda não estão bem documentadas na literatura.
ObjetivoAnalisar os achados das avaliações eletrofisiológicas e comportamentais do processamento auditivo central de crianças e adolescentes diagnosticados com acidente vascular cerebral em um ambulatório de referência, bem como investigar possíveis associações com as variáveis: tipo e localização do acidente vascular cerebral e faixa etária.
MétodoEstudo transversal comparativo. A amostra, por conveniência, incluiu indivíduos de 7 a 18 anos, divididos em dois grupos: grupo de estudo (GE), composto por indivíduos com diagnóstico de acidente vascular cerebral, e grupo controle (GC), composto por indivíduos com desenvolvimento típico. A avaliação consistiu nos seguintes procedimentos: anamnese, avaliação audiológica básica, avaliação comportamental do distúrbio de processamento auditivo (teste dichotic digit, dichotic consonant‐vowel, synthetic sentence identification/pediatric speech intelligibility, gaps in noise, pitch pattern sequence, masking level difference) e avaliação eletrofisiológica (P300 e mismatch negativity ‐).
ResultadosDezenove crianças e adolescentes foram incluídos no GE. O GC foi composto por 19 crianças e adolescentes com desenvolvimento típico. Na comparação entre os grupos, observa‐se pior desempenho para o GE em todos os testes avaliados, comportamentais e eletrofisiológicos. Na avaliação comportamental do processamento auditivo central, houve diferença estatística para todos os testes, exceto masking level difference e teste dichotic digit, na fase de separação binaural na orelha esquerda. Na avaliação eletrofisiológica, houve diferença estatística na latência do mismatch negativity e P300. Não foram encontradas associações entre os achados comportamentais e eletrofisiológicos e as variáveis localização do acidente vascular cerebral e faixa etária.
ConclusãoCrianças e adolescentes diagnosticados com acidente vascular cerebral apresentam pior desempenho nas avaliações eletrofisiológicas e comportamentais do processamento auditivo central quando comparados a um grupo controle.
A informação auditiva processada no cérebro é uma informação complexa que integra estímulos auditivos e operações cognitivo‐linguísticas simultânea e sequencialmente. O processamento auditivo central (PAC) refere‐se à eficiência e eficácia com as quais o sistema nervoso auditivo central (SNAC) usa informações auditivas.1
O PAC envolve uma gama complexa de estruturas e funções que necessitam da integridade do sistema auditivo periférico e maturação do sistema nervoso auditivo central.2 Assim, todas as estruturas do sistema auditivo, da orelha externa ao córtex auditivo, devem estar intactas para que as informações auditivas possam ser detectadas, transmitidas e interpretadas.3,4
O PAC pode ser acessado através de medidas comportamentais e eletrofisiológicas. Os testes comportamentais avaliam diferentes habilidades auditivas e têm como objetivo investigar como os indivíduos prestam atenção, organizam, memorizam e percebem detalhes de informações auditivas verbais e não verbais.5 Os testes eletrofisiológicos permitem medir a atividade neuroelétrica ao longo da via auditiva, fornecem mais informações sobre o funcionamento do SNAC. Portanto, o processamento de informações auditivas pode ser observado no domínio do tempo.6,7
O transtorno do processamento auditivo (TPA) pode ser causado por atraso na maturação das vias auditivas centrais, distúrbios neurológicos e lesões cerebrais.8 Portanto, considerando as alterações neurológicas como fator de risco para alterações no PAC, as crianças com diagnóstico de acidente vascular cerebral (AVC) fazem parte do grupo de risco.1
O AVC é definido como uma súbita oclusão ou ruptura de veias ou artérias cerebrais, com interrupção do fluxo sanguíneo para o cérebro, resulta em lesão cerebral focal e déficits neurológicos clínicos.9,10 Estudos recentes indicaram uma taxa de incidência de 1,2 a 13 casos por 100.000 crianças por ano.1–14 Em crianças, os mecanismos subjacentes à fisiopatologia do AVC ainda são pouco compreendidos.11,15,16 Além disso, a etiologia, apresentação, evolução e o resultado do AVC em crianças são diferentes das descritas em adultos.17
Na população pediátrica, as habilidades funcionais e as limitações pós‐AVC ainda não estão bem documentadas na literatura. Estudos anteriores relataram alterações neurológicas, como déficits motores, linguísticos e cognitivos.18,19 Embora dificilmente sejam investigados na população pediátrica, há evidências de comprometimento das habilidades auditivas do PAC em crianças diagnosticadas com AVC.20,21
Como há evidências de possíveis efeitos do AVC nas habilidades auditivas do PAC, esses efeitos devem ser levados em consideração na avaliação das crianças, devido às limitações funcionais que resultam dessas deficiências, principalmente na escola e no ambiente social.
Diante das considerações acima, o presente estudo tem como objetivo investigar os achados das avaliações comportamentais e eletrofisiológicas do processamento auditivo central de crianças e adolescentes diagnosticados com AVC em um ambulatório de referência. Outro objetivo foi investigar possíveis associações com as variáveis tipo de AVC, lado da lesão do AVC e faixa etária.
MétodoEstudo transversal comparativo, feito de acordo com as diretrizes para pesquisa em seres humanos e com a Resolução n° 466/12 e aprovado pelo comitê de ética em pesquisa com seres humanos da Universidade Federal do Rio Grande do Sul (UFRGS) sob o número de protocolo 77900517.2.0000.5334.
A amostra, por conveniência, incluiu indivíduos de 7 a 18 anos, divididos em dois grupos: grupo de estudo (GE), composto por indivíduos com diagnóstico de acidente vascular cerebral, acompanhados no ambulatório de doenças cerebrovasculares da unidade de neuropediatria do Hospital de Clínicas de Porto Alegre, Porto Alegre, Brasil, e o grupo controle (GC), composto por crianças e adolescentes com desenvolvimento típico. O GC foi composto por crianças com bom desempenho acadêmico, recrutadas em escolas públicas e privadas de Porto Alegre, Rio Grande do Sul, Brasil, pareadas por idade e sexo. Os participantes com menos de 12 anos foram considerados crianças e os de 12 a 18 anos foram considerados adolescentes. A coleta de dados ocorreu entre maio e dezembro de 2018.
Para ambos os grupos, os critérios de inclusão foram: crianças e adolescentes de 7 a 18 anos, presença de limiares auditivos normais22 e curva da timpanometria tipo A.23 Além disso, a presença de atividade do reflexo acústico bilateralmente, ausência de queixas otológicas e audiológicas ou queixas de dificuldades de aprendizagem na escola foram levadas em consideração para o grupo controle. Para os dois grupos, os critérios de exclusão foram: presença de sequelas neurológicas que impedissem avaliações audiológicas.
Todos os participantes foram submetidos a avaliação médica. A entrevista do histórico médico, avaliação audiológica básica (audiometria tonal e vocal e medidas de imitância acústica), avaliação comportamental do PAC e avaliação eletrofisiológica foram feitas nessa sequência. Os participantes foram encaminhados pelos seus neuropediatras assistentes.
A bateria escolhida para avaliar o PAC foi composta pelos seguintes testes: SSI (synthetic sentence identification) ou PSI (pediatric speech intelligibility), DD (teste dichotic digits), DCV (teste dichotic consonant‐vowel), GIN (gaps in noise), PPS (pitch pattern sequence) e MLD (masking level difference), de acordo com as recomendações da Academia Brasileira de Audiologia (2016).24 Os testes comportamentais foram feitos em uma cabine à prova de som, com um audiômetro Harp (Inventis), conectado a um notebook que continha os direcionamentos do teste comportamental.
O teste DD foi feito a 50 dBNS (nível de sensação de decibéis), com apresentação binaural para as etapas de integração binaural e separação binaural. O DCV foi feito a 55 dBNS. Os testes SSIe PSI foram feitos a 40 dBNS para a mensagem principal, com uma mensagem competitiva ipsilateral apresentada em duas condições (0 e ‐15dB). Os testes GIN, PPS e MLD foram feitos a 50 dBNS. A gravação e a análise foram feitas de acordo com as diretrizes dos testes. O cálculo da intensidade de apresentação (dBNS) foi baseado na média de três tons da via aérea nas frequências de 500, 1000 e 2000Hz. Todos os testes feitos foram previamente treinados com os pacientes para garantir que eles haviam entendido as tarefas.
A avaliação eletrofisiológica consistiu nos testes P300 e MMN (mismatch negativity). Esses potenciais foram registrados com os participantes sentados em uma cadeira confortável. A pele foi limpa com gaze umedecida com uma solução antisséptica. Em seguida, os eletrodos foram afixados com pasta condutora de EEG (eletroencefalograma) e fita adesiva: o eletrodo terra foi fixado à testa e o eletrodo ativo (Fz), próximo ao couro cabeludo; o eletrodo (M1) foi fixado à mastoide direita e o eletrodo (M2), à mastoide esquerda; finalmente, fones de ouvido (EarphoneTONE™ GOLD) foram colocados nas duas orelhas.
A avaliação foi iniciada apenas quando a impedância era menor ou igual a 5Ω (ohms). A varredura de EEG foi feita para verificar a presença de artefatos que pudessem interferir no teste. Uma varredura dos potenciais evocados auditivos do tronco encefálico (PEATE) foi feita a 80 dBNA para verificar a integridade da via auditiva.
O MMN foi obtido monoauralmente, com frequência de 1000Hz para o estímulo frequente e 2000Hz para o estímulo raro (50 ciclos cada), na intensidade de 70 a 80 dBNA para ambos os estímulos, com uma taxa de 1,8 estímulo por segundo. Foi calculada a média de 150 estímulos, com o paradigma do oddball (90% / 10%) e a polaridade alternada. A aquisição de dados usou escalas completas de 200μV, filtro passa‐alto de 1Hz, filtro passa‐baixo de 20Hz, Notch‐YES, janela de tempo de 500ms e amplitude de traço de até 7,5μV. Para fazer o MMN, as crianças assistiram a um vídeo (com o volume desligado) em um tablet para desviar a atenção dos estímulos auditivos.
Para o P300, os estímulos foram binaurais, com burst de tom e platô de 20ms e tempos de subida e descida de 5 m, nas frequências de 1000Hz para os estímulos frequentes (80% das apresentações) e 2000Hz para os raros (20% dos apresentações), a 80 dBNA para os dois. Com polaridade alternada, o ritmo de apresentação do estímulo ocorria em intervalos regulares de 0,8 pulso por segundo. Durante a aquisição dos dados, a escala completa foi de 200μV, filtro passa‐alto de 0,5Hz, filtro passa‐baixo de 20Hz, Notch‐YES e janela de leitura de 1000ms. As crianças foram orientadas a prestar atenção aos estímulos auditivos apresentados, inclusive os estímulos raros. A latência do P300 foi marcada no ponto de amplitude máxima da onda.
Antes do início da coleta dos dados eletrofisiológicos, todos os indivíduos foram informados sobre as etapas de execução dos testes, para que pudessem entender as instruções corretamente. O MMN foi feito antes do P300 para garantir a conclusão da tarefa solicitada, uma vez que no MMN nenhuma atenção deve ser dada ao estímulo, ao contrário do P300. Para aumentar a confiabilidade, os registros eletrofisiológicos foram analisados por dois avaliadores em momentos diferentes. É importante ressaltar que o MMN foi coletado com estímulos monoaurais e o P300 com estímulos binaurais, porque os mesmos parâmetros de coleta de dados foram mantidos para o grupo controle e essa coleta já havia sido iniciada. Foi usado o sistema Contronic® Masbe ATC Plus. Pelo menos duas amostras foram coletadas para cada onda, a fim de verificar a replicabilidade.
As variáveis quantitativas foram descritas por média e desvio‐padrão e as variáveis categóricas, por frequências absolutas e relativas. O teste t de Student foi usado para comparação das médias e os testes qui‐quadrado de Pearson ou exato de Fisher foram aplicados para comparação de proporções. O teste t de Student para amostras pareadas foi usado para comparação entre os lados direito e esquerdo. Os dados foram analisados com o softwarestatistical package for the social sciences (SPSS), versão 21.0 para Windows. Para os critérios de decisão estatística, foi adotado o nível de significância de 5%.
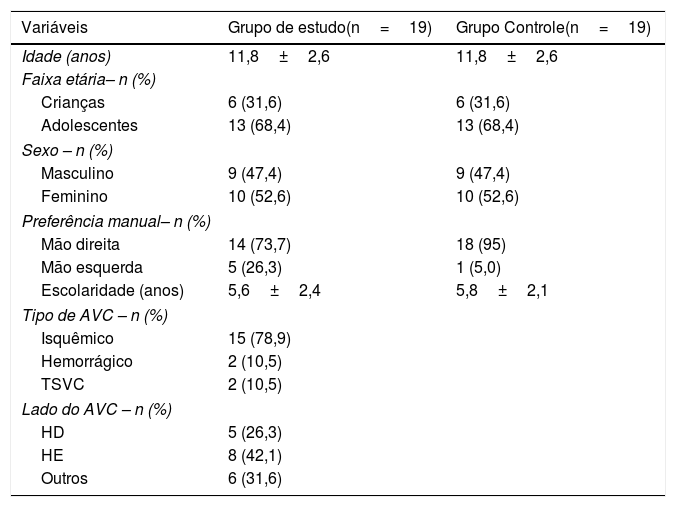
ResultadosTrinta e quatro crianças e adolescentes diagnosticados com AVC em um ambulatório de referência foram convidados a participar do estudo. Considerando os critérios de inclusão e exclusão, 19 crianças e adolescentes foram incluídas no GE. O GC foi composto por 19 crianças e adolescentes com desenvolvimento típico, pareados por idade e sexo. A tabela 1 mostra as características da amostra.
Caracterização da amostra
| Variáveis | Grupo de estudo(n=19) | Grupo Controle(n=19) |
|---|---|---|
| Idade (anos) | 11,8±2,6 | 11,8±2,6 |
| Faixa etária– n (%) | ||
| Crianças | 6 (31,6) | 6 (31,6) |
| Adolescentes | 13 (68,4) | 13 (68,4) |
| Sexo – n (%) | ||
| Masculino | 9 (47,4) | 9 (47,4) |
| Feminino | 10 (52,6) | 10 (52,6) |
| Preferência manual– n (%) | ||
| Mão direita | 14 (73,7) | 18 (95) |
| Mão esquerda | 5 (26,3) | 1 (5,0) |
| Escolaridade (anos) | 5,6±2,4 | 5,8±2,1 |
| Tipo de AVC – n (%) | ||
| Isquêmico | 15 (78,9) | |
| Hemorrágico | 2 (10,5) | |
| TSVC | 2 (10,5) | |
| Lado do AVC – n (%) | ||
| HD | 5 (26,3) | |
| HE | 8 (42,1) | |
| Outros | 6 (31,6) | |
AVC, acidente vascular cerebral; TSVC, trombose do seio venoso cerebral; HD, hemisfério direito; HE, hemisfério esquerdo; teste t para amostras independentes; p <0,05.
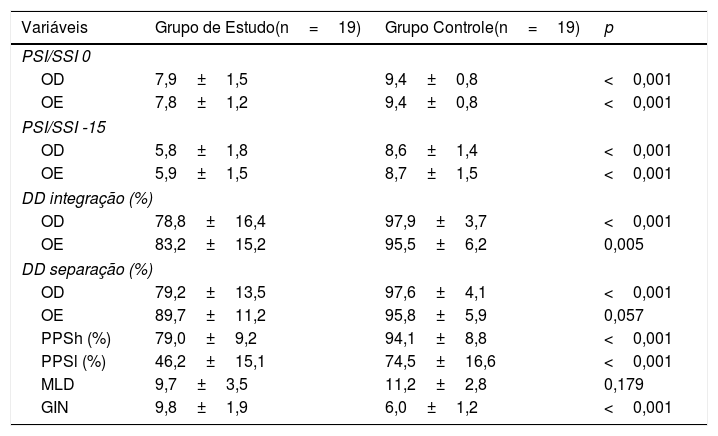
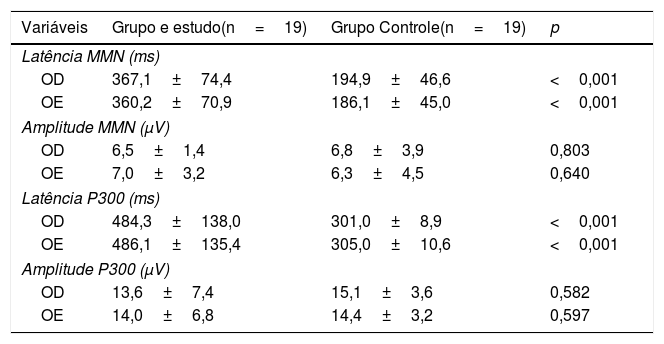
As tabelas 2 e 3 mostram os achados dos testes comportamentais para o PAC e a avaliação eletrofisiológica de ambos os grupos.
Comparação de testes comportamentais entre os grupos estudo e controle
| Variáveis | Grupo de Estudo(n=19) | Grupo Controle(n=19) | p |
|---|---|---|---|
| PSI/SSI 0 | |||
| OD | 7,9±1,5 | 9,4±0,8 | <0,001 |
| OE | 7,8±1,2 | 9,4±0,8 | <0,001 |
| PSI/SSI ‐15 | |||
| OD | 5,8±1,8 | 8,6±1,4 | <0,001 |
| OE | 5,9±1,5 | 8,7±1,5 | <0,001 |
| DD integração (%) | |||
| OD | 78,8±16,4 | 97,9±3,7 | <0,001 |
| OE | 83,2±15,2 | 95,5±6,2 | 0,005 |
| DD separação (%) | |||
| OD | 79,2±13,5 | 97,6±4,1 | <0,001 |
| OE | 89,7±11,2 | 95,8±5,9 | 0,057 |
| PPSh (%) | 79,0±9,2 | 94,1±8,8 | <0,001 |
| PPSl (%) | 46,2±15,1 | 74,5±16,6 | <0,001 |
| MLD | 9,7±3,5 | 11,2±2,8 | 0,179 |
| GIN | 9,8±1,9 | 6,0±1,2 | <0,001 |
Teste t para amostras independentes; p <0,05.
OD, orelha direita; OE, orelha esquerda; PSI, pediatric speech intelligibility; SSI, synthetic sentence identification; DD, teste dichotic digit; PPSh, pitch pattern sequence‐humming; PPSh, pitch pattern sequence‐labeling; MLD, masking level difference; GIN, gaps in noise.
Comparação de testes eletrofisiológicos entre os grupos estudo e controle
| Variáveis | Grupo e estudo(n=19) | Grupo Controle(n=19) | p |
|---|---|---|---|
| Latência MMN (ms) | |||
| OD | 367,1±74,4 | 194,9±46,6 | <0,001 |
| OE | 360,2±70,9 | 186,1±45,0 | <0,001 |
| Amplitude MMN (μV) | |||
| OD | 6,5±1,4 | 6,8±3,9 | 0,803 |
| OE | 7,0±3,2 | 6,3±4,5 | 0,640 |
| Latência P300 (ms) | |||
| OD | 484,3±138,0 | 301,0±8,9 | <0,001 |
| OE | 486,1±135,4 | 305,0±10,6 | <0,001 |
| Amplitude P300 (μV) | |||
| OD | 13,6±7,4 | 15,1±3,6 | 0,582 |
| OE | 14,0±6,8 | 14,4±3,2 | 0,597 |
Teste t para amostras independentes; p <0,05.
OD, orelha direita; OE, orelha esquerda; MMN, mismatch negativity; ms, milissegundos; μV, microvolts.
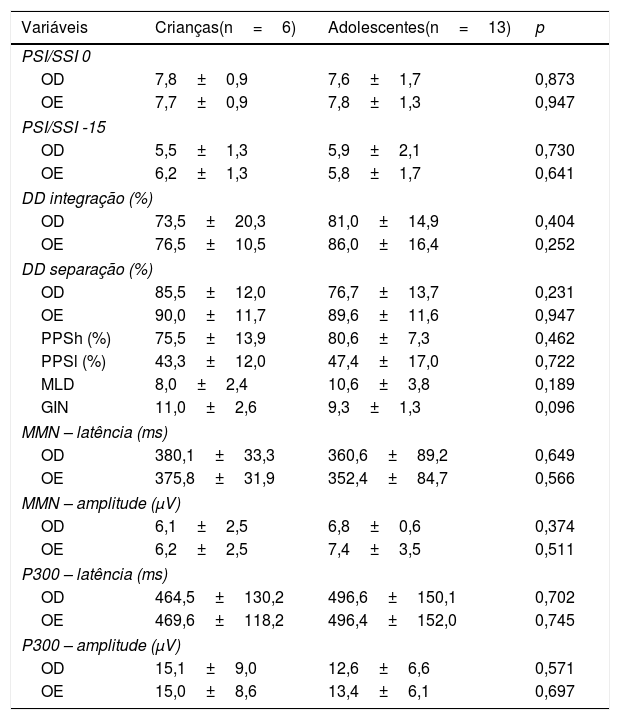
A tabela 4 mostra as comparações dos achados comportamentais e eletrofisiológicos entre as crianças e os adolescentes do GE.
Comparação dos testes entre as faixas etárias no GE
| Variáveis | Crianças(n=6) | Adolescentes(n=13) | p |
|---|---|---|---|
| PSI/SSI 0 | |||
| OD | 7,8±0,9 | 7,6±1,7 | 0,873 |
| OE | 7,7±0,9 | 7,8±1,3 | 0,947 |
| PSI/SSI ‐15 | |||
| OD | 5,5±1,3 | 5,9±2,1 | 0,730 |
| OE | 6,2±1,3 | 5,8±1,7 | 0,641 |
| DD integração (%) | |||
| OD | 73,5±20,3 | 81,0±14,9 | 0,404 |
| OE | 76,5±10,5 | 86,0±16,4 | 0,252 |
| DD separação (%) | |||
| OD | 85,5±12,0 | 76,7±13,7 | 0,231 |
| OE | 90,0±11,7 | 89,6±11,6 | 0,947 |
| PPSh (%) | 75,5±13,9 | 80,6±7,3 | 0,462 |
| PPSl (%) | 43,3±12,0 | 47,4±17,0 | 0,722 |
| MLD | 8,0±2,4 | 10,6±3,8 | 0,189 |
| GIN | 11,0±2,6 | 9,3±1,3 | 0,096 |
| MMN – latência (ms) | |||
| OD | 380,1±33,3 | 360,6±89,2 | 0,649 |
| OE | 375,8±31,9 | 352,4±84,7 | 0,566 |
| MMN – amplitude (μV) | |||
| OD | 6,1±2,5 | 6,8±0,6 | 0,374 |
| OE | 6,2±2,5 | 7,4±3,5 | 0,511 |
| P300 – latência (ms) | |||
| OD | 464,5±130,2 | 496,6±150,1 | 0,702 |
| OE | 469,6±118,2 | 496,4±152,0 | 0,745 |
| P300 – amplitude (μV) | |||
| OD | 15,1±9,0 | 12,6±6,6 | 0,571 |
| OE | 15,0±8,6 | 13,4±6,1 | 0,697 |
Teste t de Student; p <0,05.
OD, orelha direita; OE, orelha esquerda; PSI, pediatric speech intelligibility; SSI, synthetic sentence identification; DD, teste dichotic digit; PPSh, pitch pattern sequence‐humming; PPSh, pitch pattern sequence‐labeling; MLD, masking level difference; GIN, gaps in noise; MMN, mismatch negativity; ms, milissegundos; μV, microvolts.
Como a amostra de crianças e adolescentes diagnosticados com AVC e TSVC era pequena, não foi possível investigar possíveis associações com o tipo de AVC.
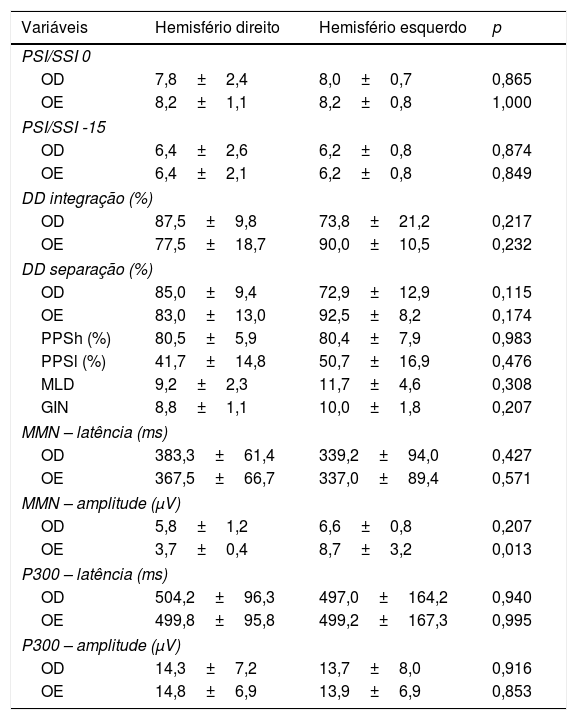
A tabela 5 mostra os achados comportamentais e eletrofisiológicos de acordo com o lado da lesão do AVC. Foram incluídos cinco participantes com diagnóstico de acidente vascular cerebral do lado direito e oito participantes com acidente vascular cerebral do lado esquerdo. Na comparação entre os locais, houve diferença significante apenas para a amplitude do MMN na OE.
Comparação de testes entre os hemisférios afetados
| Variáveis | Hemisfério direito | Hemisfério esquerdo | p |
|---|---|---|---|
| PSI/SSI 0 | |||
| OD | 7,8±2,4 | 8,0±0,7 | 0,865 |
| OE | 8,2±1,1 | 8,2±0,8 | 1,000 |
| PSI/SSI ‐15 | |||
| OD | 6,4±2,6 | 6,2±0,8 | 0,874 |
| OE | 6,4±2,1 | 6,2±0,8 | 0,849 |
| DD integração (%) | |||
| OD | 87,5±9,8 | 73,8±21,2 | 0,217 |
| OE | 77,5±18,7 | 90,0±10,5 | 0,232 |
| DD separação (%) | |||
| OD | 85,0±9,4 | 72,9±12,9 | 0,115 |
| OE | 83,0±13,0 | 92,5±8,2 | 0,174 |
| PPSh (%) | 80,5±5,9 | 80,4±7,9 | 0,983 |
| PPSl (%) | 41,7±14,8 | 50,7±16,9 | 0,476 |
| MLD | 9,2±2,3 | 11,7±4,6 | 0,308 |
| GIN | 8,8±1,1 | 10,0±1,8 | 0,207 |
| MMN – latência (ms) | |||
| OD | 383,3±61,4 | 339,2±94,0 | 0,427 |
| OE | 367,5±66,7 | 337,0±89,4 | 0,571 |
| MMN – amplitude (μV) | |||
| OD | 5,8±1,2 | 6,6±0,8 | 0,207 |
| OE | 3,7±0,4 | 8,7±3,2 | 0,013 |
| P300 – latência (ms) | |||
| OD | 504,2±96,3 | 497,0±164,2 | 0,940 |
| OE | 499,8±95,8 | 499,2±167,3 | 0,995 |
| P300 – amplitude (μV) | |||
| OD | 14,3±7,2 | 13,7±8,0 | 0,916 |
| OE | 14,8±6,9 | 13,9±6,9 | 0,853 |
Teste t para amostras independentes; p <0,05.
OD, orelha direita; OE, orelha esquerda; PSI, pediatric speech intelligibility; SSI, synthetic sentence identification; DD, teste dichotic digit; PPSh, pitch pattern sequence‐humming; PPSh, pitch pattern sequence‐labeling; MLD, masking level difference; GIN, gaps in noise; MMN, mismatch negativity; ms, milissegundos; μV, microvolts.
Os achados do teste DVC foram analisados de acordo com o lado da lesão do AVC. As respostas foram predominantes na orelha direita (OD) em 4 dos 5 indivíduos com acidente vascular cerebral do lado direito, mas na orelha esquerda (OE) em um indivíduo. As respostas foram predominantes na OE para 7 dos 8 indivíduos com acidente vascular cerebral do lado esquerdo, mas na OD para um indivíduo.
DiscussãoEmbora exista uma alta prevalência, bem como alto impacto funcional de deficiências no PAC, os déficits presentes em crianças e adolescentes com AVC ainda são pouco explorados.25,26 Em um estudo recente, Barros27 analisou os achados audiológicos de crianças com história de acidente vascular cerebral e concluiu que os pacientes não apresentavam comprometimento auditivo ao nível periférico, o que sugeriu a necessidade de avaliação do PAC.
De acordo com a literatura, as alterações neurológicas resultantes do acidente vascular cerebral variam de acordo com a localização e extensão da lesão. No presente estudo, crianças e adolescentes diagnosticados com AVC – isquêmico, hemorrágico ou trombose do seio venoso cerebral – foram avaliados. Segundo os registros médicos, os acidentes vasculares cerebrais foram classificados de acordo com o nível da lesão no sistema nervoso central. Devido à variação nos dados de localização e extensão, optamos por descrevê‐los apenas de acordo com a lateralização hemisférica – hemisfério direito ou esquerdo. Os casos em que o acidente vascular cerebral foi descrito em outro nível do SNC, eles foram classificados como “Outros”.
No presente estudo, as habilidades do PAC foram investigadas em crianças e adolescentes com AVC através de testes comportamentais e eletrofisiológicos.
Os testes comportamentais usados foram selecionados para avaliar a integração binaural e separação binaural, figura‐fundo, resolução e ordenação temporal e habilidades de interação binaural. Na análise dos achados, o GE apresentou pior desempenho em todas as tarefas, quando comparado ao GC. Os resultados foram significantes para os testes PSI /SSI, GIN e PPS, indicaram uma perda na figura‐fundo, resolução temporal e habilidades de ordenação. Para o teste DD, houve diferença estatística para o estágio de integração binaural, indicou comprometimento nessa capacidade. Na etapa de separação binaural, não houve diferença significante para a OE. Embora o GE tenha apresentado pior desempenho no teste MLD, não houve significância, indicou menor comprometimento na capacidade de interação binaural.
Embora os estudos com crianças diagnosticadas com AVC sejam escassos na literatura, eles relataram um comprometimento moderado das habilidades auditivas.20,21 Danos na escuta dicótica foram relatados em tarefas que requerem separação e integração de informações auditivas verbais e não verbais.20,28 No presente estudo, a escuta dicótica nas tarefas de integração e separação binaural foi avaliada pelo teste DD. Na comparação entre o GE e o GC, crianças e adolescentes com AVC apresentaram pior desempenho, o que corroborou achados na literatura.20,28 Não houve diferença estatística somente para a etapa de separação binaural (orelha esquerda).
Por se tratar de um teste dicótico verbal, o hemisfério dominante da linguagem (em geral, o hemisfério esquerdo) é necessário para a percepção verbal e caracterização de estímulos linguísticos. Assim, um bom desempenho na OD exige integridade das vias que atingem diretamente o hemisfério esquerdo (HE), enquanto um bom desempenho na OE exige integridade das vias que atingem o hemisfério direito (HD), além de eficiência do corpo caloso e integridade do HE.29 Isto é, em casos de lesão unilateral no HD, são esperados limiares auditivos mais baixos na OE, pois nos casos de lesão unilateral no HE são esperados limiares inferiores na OD ou nas duas orelhas. Nos casos de acidente vascular cerebral unilateral, esse padrão foi encontrado no presente estudo, com achados de limiares mais baixos na orelha contralateral à lesão. Esses achados estão alinhados com os de estudos anteriores.2,20,21,30
Murphy et al.,30 ao analisar os achados do DD em uma criança com história de acidente vascular cerebral unilateral no HE, encontraram 100% de desempenho na OE e 0% na OD. Os autores sugeriram que esses achados podem indicar reorganização e desenvolvimento da linguagem no HD, como resultado de forte plasticidade, geralmente ocorrem após lesão cerebral precoce.
No teste DCV, são esperadas respostas assimétricas, com predominância de respostas em uma das orelhas. Em geral, o HE é o hemisfério dominante para a linguagem e, portanto, costuma haver mais respostas para as sílabas ouvidas na OD.29 Nos casos de lesões neurológicas, essa assimetria pode mudar.20 No presente estudo, os achados foram analisados de acordo com o lado da lesão do AVC. Havia um padrão de respostas: quando a lesão ocorria no HD, as respostas eram predominantes na OD e quando a lesão estava presente no HE, a OE apresentava maior desempenho.
Em um estudo recente, ao usar o DCV para avaliação de crianças com AVC, os autores também encontraram tendência para mais respostas na OD quando a lesão estava no HD. No entanto, em crianças com lesões de HE, as respostas foram mais heterogêneas. Os autores se referem a esses achados como uma reorganização da linguagem após o evento vascular e podem estar associados a múltiplos fatores, inclusive localização, extensão e tipo de lesão.20
De acordo com a literatura, crianças com AVC também apresentam déficits significativos no processamento temporal.21 O processamento temporal é crítico para uma ampla gama de tarefas auditivas diárias, como discriminação de sinais sutis e discriminação de palavras semelhantes. Pode ser subdividido em duas habilidades: ordenação temporal e resolução temporal, avaliadas neste estudo pelos testes PPS e GIN, respectivamente.2
No presente estudo, houve diferença estatística entre os grupos para o teste PPS, em ambas as tarefas, humming e labeling (p <0,001). Essa diferença indica um déficit na capacidade de ordenação temporal. A ordenação temporal é baseada no princípio de que indivíduos com audição normal são capazes de perceber, associar e interpretar os padrões não verbais da mensagem recebida, por exemplo, ritmo, entonação e melodia. Como o PPS é um teste complexo, um bom desempenho requer integridade de ambos os hemisférios cerebrais. Como o estágio de humming não requer uma tarefa verbal, a distinção entre tons é mediada pelo hemisfério não dominante para a linguagem (geralmente o HD). A tarefa de labeling, por sua vez, depende não apenas do HD para fazer a análise e o reconhecimento do contorno acústico, mas também da eficiência do corpo caloso e do HE, para verbalização do padrão tonal.29,31
Em um estudo recente,30 os autores encontraram desempenho normal no teste PPS ao avaliar uma criança com história de acidente vascular cerebral no HE. Seus resultados são diferentes dos encontrados no presente estudo.
Na análise do GIN, o GE teve desempenho significantemente pior do que o GC (p <0,001), indicou um déficit na capacidade de resolução temporal. As alterações nessa capacidade podem causar dificuldade de identificar pequenas variações acústicas da fala e dificuldade de produzir sons corretamente ou em interpretar a mensagem ouvida.32
Segundo a literatura, achados de baixo desempenho nas avaliações comportamentais do PAC indicam funções auditivas comprometidas, o que pode impactar o desempenho de diversas atividades da vida diária, com implicações para o aprendizado e a socialização.21 Limitações funcionais podem ser observadas na dificuldade das pessoas de seguir instruções orais e entender a fala, mesmo na ausência de comprometimento auditivo periférico.30
Como a combinação de métodos objetivos e subjetivos aumentou a precisão do diagnóstico audiológico, as avaliações eletrofisiológicas do MMN e do P300 foram incluídas no presente estudo. Medidas eletrofisiológicas têm sido usadas para avaliar a eficiência das medidas comportamentais, bem como para verificar a integridade funcional e estrutural dos componentes neurais da via auditiva.1,7,33
Devido à sua demanda cognitiva, o P300 é crucial para capturar potenciais relacionados à cognição gerados no SNAC. Reflete essencialmente a atividade das áreas auditivas corticais responsáveis pelas habilidades de atenção, discriminação, integração e memória.34 O MMN, por sua vez, reflete a discriminação pré‐atentiva e a memória auditiva dos sujeitos avaliados e também se refere às habilidades de processamento e atenção involuntária.35–37
O P300 e o MMN são analisados quanto à latência, que representa a velocidade do processamento da informação, e a amplitude, que parece estar diretamente relacionada à quantidade de estrutura neuronal envolvida nas respostas. No entanto, por se tratar de um parâmetro altamente variável, poucos estudos até o momento incluíram uma análise deles.7,36,38,39 Achados de latência aumentada ou amplitude reduzida podem indicar um declínio na ativação neuronal e são considerados indicadores objetivos de alterações clínicas e subclínicas.40–42
No presente estudo, crianças e adolescentes com AVC apresentaram resultados de latência significativamente mais lentos para MMN e P300 quando comparados ao GC. Isso é indicativo de possíveis déficits nas habilidades avaliadas por esses potenciais. Quanto à amplitude, não houve diferença estatística entre os valores de amplitude do GE e do GC.
Devido à complexidade das áreas envolvidas, sabe‐se que o P300 é importante para fornecer informações adicionais sobre os processos neurais. Pode ser usado para medir e monitorar alterações neurofisiológicas no SNAC, especialmente em casos de déficit de processamento auditivo.43 No entanto, não foram encontrados outros estudos para incluir essa avaliação na população pediátrica pós‐AVC.
Os valores de latência e amplitude do MMN encontrados no presente estudo concordam com os da literatura. Em um estudo recente, foram analisados os achados do MMN de 18 crianças e adolescentes diagnosticados com AVC. Quando comparados a um grupo controle, foram encontrados valores maiores de latência para o grupo de estudo. Houve diferenças estatísticas, indicaram que habilidades de discriminação, atenção involuntária e memória sensorial podem estar comprometidas. Não foram encontradas diferenças estatísticas para amplitude entre os grupos.44
Outros estudos que incluíram avaliação eletrofisiológica nessa população não foram encontrados na literatura.
Como resultado do tamanho da amostra, a associação entre os achados comportamentais e eletrofisiológicos e o tipo de acidente vascular cerebral não pôde ser investigada. Além do tamanho da amostra, outras limitações do presente estudo incluem a heterogeneidade das características do AVC e sua apresentação clínica. Por essas razões, não foram encontradas associações entre os achados comportamentais e eletrofisiológicos e as diferentes faixas etárias do estudo, nem houve qualquer associação dos presentes achados com o lado da lesão do AVC como variável, exceto pela amplitude do MMN na OE, possivelmente devido à alta variabilidade, como mencionado acima.
Poucos estudos na literatura incluíram a avaliação do PAC em crianças e adolescentes diagnosticados com AVC, seja por testes comportamentais ou eletrofisiológicos. Assim, o presente estudo pode oferecer dados relevantes para estudos futuros nessa população.
ConclusãoPortanto, pode‐se concluir que crianças e adolescentes diagnosticados com AVC apresentam pior desempenho nas avaliações eletrofisiológicas e comportamentais do PAC quando comparadas a um grupo controle.
FinanciamentoCapes (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) e UFRGS (Universidade Federal do Rio Grande do Sul).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Berticelli AZ, Bueno CD, Rocha VO, Ranzan J, Riesgo RS, Sleifer P. Central auditory processing: behavioral and electrophysiological assessment of children and adolescents diagnosed with stroke. Braz J Otorhinolaryngol. 2021;87:512–20.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.