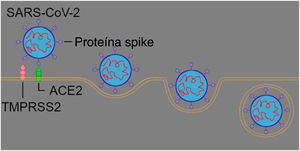
SARS‐CoV‐2 é o patógeno da Covid‐19. O vírus é composto pela proteína spike (espigão), a membrana e o envelope. No olfato fisiológico, as substâncias odoríferas se ligam a proteínas secretadas pelas células sustentaculares para serem processadas pelos neurônios receptores olfativos. O distúrbio olfativo é uma das principais manifestações da Covid‐19; entretanto, pesquisas ainda são necessárias para esclarecer o mecanismo envolvido na anosmia induzida pela SARS‐CoV‐2.
ObjetivosEste artigo tem como objetivo analisar as evidências científicas atuais destinadas a elucidar a relação fisiopatológica entre a Covid‐19 e a causa dos distúrbios olfativos.
MétodoAs bases de dados Pubmed, Embase, Scopus e ScienceDirect foram usadas para compor este artigo. A pesquisa foi feita em 24 de novembro de 2020. Foram incluídos artigos originais com estudos experimentais em seres humanos, animais e estudos in vitro, comunicações breves, pontos de vista, publicados na língua inglesa e entre 2019 e 2020, todos relacionados à relação fisiopatológica entre distúrbios olfativos e infecção por Covid‐19.
ResultadosAmbos os receptores de células humanas ACE2 e TMPRSS2 são essenciais para a penetração do SARS‐CoV‐2. Esses receptores estão presentes principalmente nas células do epitélio olfativo; portanto, a principal hipótese é que a anosmia é causada por lesão de células não neuronais que, a partir daí, afeta o metabolismo olfativo normal. Além disso, estudos de ressonância magnética mostram uma relação entre a redução do epitélio neuronal e a atrofia do bulbo olfatório. Danos às células não neuronais explicam o tempo médio de recuperação, que demora algumas semanas. Essa lesão pode ser exacerbada por uma resposta imune agressiva, que leva a danos às células neuronais e células‐tronco, induz uma anosmia persistente. A anosmia condutiva não é suficiente para explicar a maioria dos casos de anosmia induzida por Covid‐19.
ConclusãoDistúrbios olfativos como anosmia e hiposmia podem ser causados pela Covid‐19 e o principal mecanismo está associado à lesão do epitélio olfativo, tem como alvo células predominantemente não neuronais. Porém, células neuronais também podem ser afetadas, o que piora o quadro de perda olfativa.
O vírus SARS‐CoV‐2 surgiu no fim de 2019 na província de Wuhan, na China. Logo após, o vírus se disseminou pelo mundo, tornou‐se pandêmico. O SARS‐CoV‐2 contém como material genético uma hélice simples de RNA e é composto principalmente por três estruturas proteicas: a proteína spike (espigão), o envelope e a membrana. O espigão liga‐se ao receptor da enzima conversora da angiotensina 2 (ACE2) e tanto o envelope quanto a membrana envolvem o material genético.1
Embora o SARS‐CoV e o SARS‐CoV‐2 usem a mesma via de entrada, há duas diferenças cruciais no domínio de ligação do SARS‐CoV‐2 que permitem uma maior afinidade com o receptor ACE2 do hospedeiro e que, como consequência, aumentam sua virulência. Uma diferença reside na alteração de dois hotspots virais, hotspot 31 e hotspot 353. Essas pontes salinas tornaram‐se mais estabilizadas no sítio de ligação do SARS‐CoV‐2. A segunda diferença é uma mudança na estrutura de ligação da ACE2 causada por um motif de quatro resíduos, resulta em um contato mais compacto e mais forte.2
No olfato fisiológico, as moléculas são detectadas pelos neurônios receptores olfativos (ORN, do inglês Olfactory Receptor Neurons), que são neurônios bipolares com dendritos finos que contêm em sua extremidade um botão com 10 a 20 cílios, presente no epitélio pseudoestratificado localizado na cavidade nasal.3 Há também células não neuronais, como as células sustentaculares e as células de Bowman, responsáveis pela secreção de muco para a dissolução e detecção de substâncias odorantes. Na outra extremidade do neurônio, um fino axônio amielínico junta‐se a outros axônios e forma vários feixes que cruzam a lâmina submucosa e conectam‐se ao bulbo olfatório.1,3–5As substâncias odoríferas requerem ligação a proteínas específicas liberadas no espaço extracelular pelas células sustentaculares para serem processadas pelos neurônios receptores olfativos.3 Três funções principais dessas proteínas são sugeridas por estudos: introdução de substâncias odoríferas aos receptores olfativos, clivagem de ligantes hidrofóbicos para a fase aquosa e promoção da retirada de substâncias odoríferas dos receptores olfativos.3,5 A ativação do receptor leva a cascatas de transdução, que produzem potenciais de ação nos neurônios do receptor olfativo.3,6
Inicialmente, distúrbios olfativos, como anosmia (perda total do olfato) ou hiposmia (perda parcial do olfato),7 não foram considerados sintomas relevantes; no entanto, alguns estudos indicaram uma possível relação entre esses distúrbios e a Covid‐19.8,9 Após uma ampla propagação viral na Europa, logo se tornou evidente que anosmia e hiposmia eram meios importantes de diagnóstico da doença.10,11 Portanto, a Organização Mundial da Saúde (OMS) reconheceu as disfunções olfativas como sintomas primários de Covid‐19.
Este artigo tem como objetivo analisar as evidências científicas atuais destinadas a elucidar a relação fisiopatológica entre Covid‐19 e a causa dos distúrbios olfativos.
MétodoEsta revisão sistemática tem como objetivo o esclarecimento da seguinte pergunta: “Qual a relação fisiopatológica entre distúrbios olfativos e a doença Covid‐19?” Este artigo foi feito de acordo com a lista de verificação ‘Preferred Reporting Items for Systematic Reviews and Meta-Analyses Statement’ (Prisma).
Critérios de inclusãoForam incluídos artigos originais com estudos experimentais em seres humanos, animais e estudos in vitro, comunicações breves, pontos de vista, publicados na língua inglesa e entre 2019 e 2020, todos relacionados à relação fisiopatológica entre distúrbios olfativos e infecção por Covid‐19.
Critérios de exclusãoArtigos não relacionados à disfunção olfativa e SARS‐CoV‐2, ausência do mecanismo fisiopatológico da função olfativa, revisões e minirrevisões, relatos de caso, erratas, notícias, capítulos de livro, cartas ao editor, comentários, editoriais, artigos duplicados, perspectivas, artigos não revisados por pares, não acessíveis, publicados em um idioma diferente do inglês e antes de 2019 não foram incluídos.
Estratégia de pesquisa e seleção de estudosForam usadas as bases de dados Pubmed, Scopus, Embase e ScienceDirect. Na base de dados Pubmed, os termos indexados MeSH foram usados, bem como os termos indexados Emtree na plataforma Embase. Nas bases de dados ScienceDirect e Scopus foram usados termos livres. Todos os artigos foram reunidos em 24 de novembro de 2020, com as seguintes estratégias de pesquisa:
Pubmed: (“Covid‐19”[Supplementary Concept]) OR “coronavirus”[MeSH Terms]) AND “smell”[MeSH Terms] OR “olfaction disorders”[MeSH Terms]) NOT review[Filter] NOT systematic review[Filter] NOT editorial[Filter] NOT letter[Filter] NOT review[Title]) AND 2019:2021[dp]
Science Direct: (SARS‐CoV‐2 OR covid‐19) AND (“olfactory disorder” OR “smelling disorder” OR “olfactory dysfunction” OR “loss of smell”)
Ano: 2019‐2021
Título: NÃO revisão
Tipos de artigos: artigos de pesquisa; resumos de conferências; artigos de dados; estudos de replicação; comunicações breves; outros.
Embase: (’coronavirus disease 2019’/exp/mj) AND (’smelling disorder’/exp/mj) NOT (’review’:ti OR’editorial’:it OR’review’:it OR’erratum’:it OR’letter’:it OR’note’:it OR’case report’:it OR’case study’:it OR’systematic review’:it OR’interview’:it) AND [2019‐2021]/py
Scopus: (TITLE‐ABS‐KEY(Covid‐19 OR SARS‐CoV‐2) AND TITLE‐ABS‐KEY(smelling AND disorder)) AND PUBYEAR> 2018 AND NOT DOCTYPE (bk OR ch OR bz OR cr OR ed OR er OR le OR mm OR no OR pr OR rp OR tb OR re OR sh) AND NOT TITLE(review)
Todas as citações foram gerenciadas com o software Zotero™ de forma a eliminar duplicatas e organizar as etapas de seleção dos artigos de acordo com os critérios de inclusão e exclusão. Os títulos e resumos foram analisados por dois revisores independentes, descartaram‐se artigos não compatíveis com os critérios de inclusão. Consecutivamente, os textos foram lidos na íntegra e avaliados novamente por ambos os revisores de forma independente. As divergências foram discutidas para se chegar a um consenso. A avaliação da qualidade foi escrita de forma descritiva e imparcial. Não houve revisão cega dos autores e instituições dos estudos em análise.
Extração e análise de dadosA análise dos dados foi feita de forma descritiva. Os dados foram extraídos individualmente pelos revisores com questões‐chave padronizadas associadas à relação fisiopatológica entre distúrbios olfativos e infecção por Covid‐19, bem como mecanismos de dano epitelial olfativo e a duração desses distúrbios.
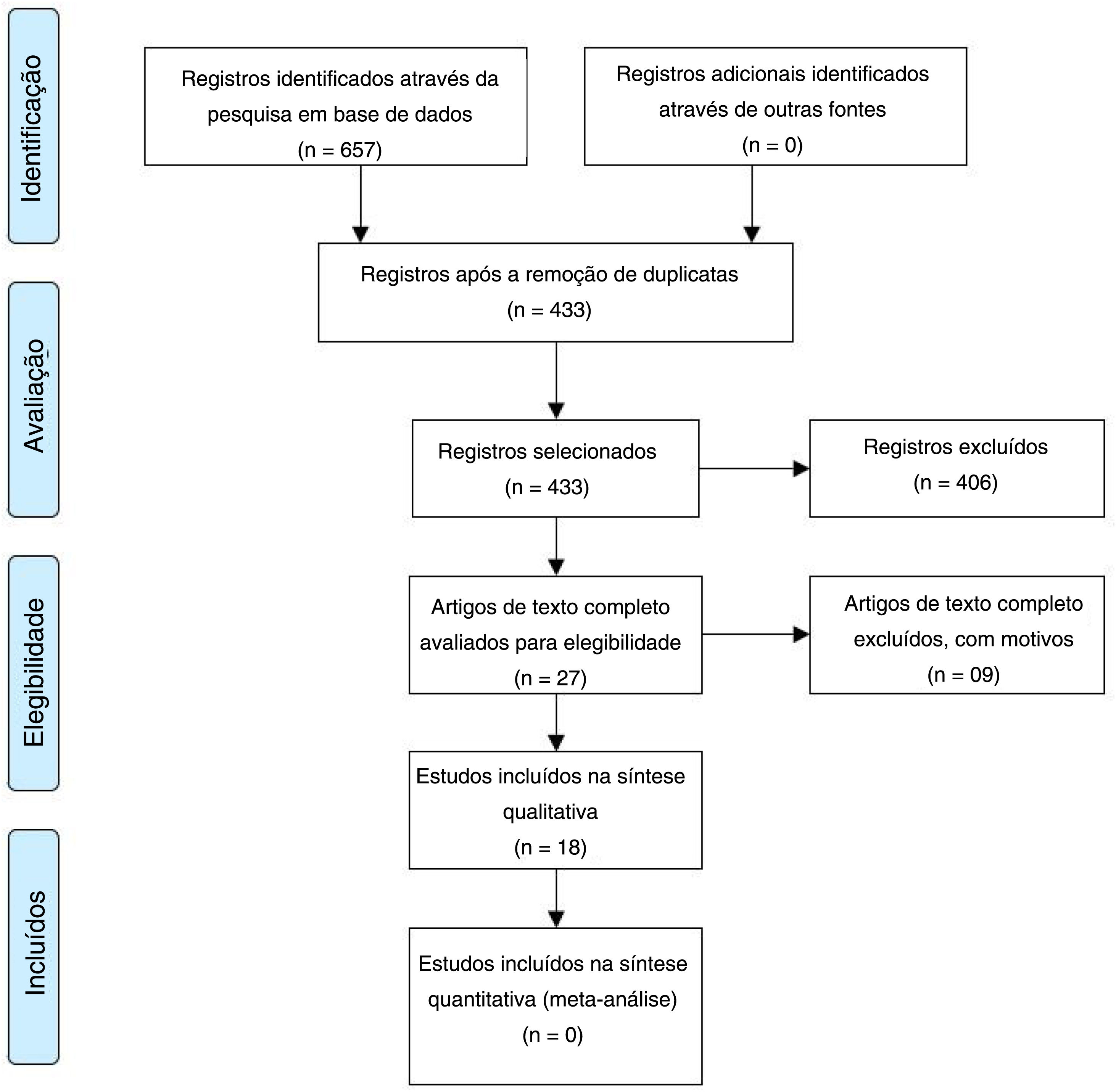
ResultadosNo total, 657 arigos foram extraídos, 148 na base de dados Scopus, 190 na Embase, 167 na PubMed e 152 na ScienceDirect. Após a remoção das duplicatas com o Zotero, 433 artigos permaneceram. Sequencialmente, após avaliação do título e resumo de acordo com os critérios de elegibilidade, 27 artigos permaneceram. Por fim, após avaliação do texto completo, restaram 18 artigos (fig. 1 e tabelas 1 e 2).
Artigos excluídos
| Título | Autor | Localização | Ano | Razão para exclusão |
|---|---|---|---|---|
| Acute‐onset smell and taste disorders in the context of Covid‐19: a pilot multicentre polymerase chain reaction‐based case‐control study | Beltrán‐Corbellini et al. | Espanha | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Autonomic Brain Centers and Pathophysiology of Covid‐19. | Chigr et al. | Marrocos | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Clinical and Radiological Evaluations of Covid‐19 Patients with Anosmia: Preliminary Report | Lechien et al. | Bélgica | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Common determinants of severe Covid‐19 infection are explicable by SARS‐CoV‐2 secreted glycoprotein interaction with the CD33‐related Siglecs, Siglec‐3 and Siglec‐5/14 | Murch et al. | Reino Unido | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Covid‐19 treatments and pathogenesis including anosmia in K18‐hACE2 mice | Zheng et al. | EUA | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Covid‐19 viral load in the severity of and recovery from olfactory and gustatory dysfunction | Cho et al. | Hong Kong | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Gaining back what is lost: recovering the sense of smell in mild to moderate patients after Covid‐19 | Ianuzzi et al. | Itália | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Inhibition of focal adhesion kinase increases adult olfactory stem cell self‐renewal and neuroregeneration through ciliary neurotrophic factor | Jia et al. | EUA | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
| Olfactory dysfunction during Covid‐19 pandemic | Izquierdo‐Domínguez et al. | Espanha | 2020 | Ausência de mecanismos fisiopatológicos relevantes |
Artigos incluídos
| Título | Autor | Localização | Ano | Desenho do estudo | Informações coletadas |
|---|---|---|---|---|---|
| A single‐cell RNA expression map of human coronavirus entry factors | Singh et al. | Alemanha | 2020 | Pesquisa Original | Expressão de TMPRSS4 como uma proteína opcional |
| Acute onset olfactory/taste disorders are associated with a high viral burden in mild or asymptomatic SARS‐CoV‐2 infections | Nakagawara et al. | Japão | 2020 | Comunicação breve | Aumento da expressão de ACE2 e TMPRSS2 no epitélio nasal |
| Anosmia in Covid‐19 associated with injury to the olfactory bulbs evident on MRI | Aragão et al | Brasil | 2020 | Pesquisa | Transmissão de SARS‐CoV‐2 através do nervo olfativo e lesão do bulbo olfatório |
| Anosmia in Covid‐19: A bumpy road to establishing a cellular mechanism | Bilinska et al. | Polônia | 2020 | Ponto de vista | Mecanismo de lesão de células não neuronais |
| Anosmia in Covid‐19: underlying mechanisms and assessment of an olfactory route to brain infection | Butowt et al. | Polônia | 2020 | Pesquisa | Relação entre a resposta imune e pioria da anosmia |
| Cerebral micro‐structural changes in Covid‐19 patients – an MRI‐based 3‐month follow‐up study | Lu et al. | China | 2020 | Pesquisa | Transmissão de SARS‐CoV‐2 através do nervo olfativo e dano ao bulbo olfatório |
| Co‐expression of peripheral olfactory receptors with SARS‐CoV‐2 infection mediators: Potential implications beyond loss of smell as a Covid‐19 symptom | Kerslake et al. | Reino Unido | 2020 | Pesquisa | Mecanismo de endocitose do SARS‐COV‐2 e expressão de ACE2 e TMPRSS2 em células não‐neuronais |
| Frequency and outcome of olfactory impairment and sinonasal involvement in hospitalized patients with Covid‐19 | Jalessi et al. | Irã | 2020 | Estudo Prospectivo | Anosmia condutiva como mecanismo improvável na infecção por SARS‐CoV‐2 |
| Loss of smell in Covid‐19 patients: MRI data reveals a transient edema of the olfactory clefts | Eliezer et al. | França | 2020 | Estudo Prospectivo | Piora da anosmia causada por dano ao bulbo olfatório |
| Massive transient damage of the olfactory epithelium associated with infection of sustentacular cells by SARS‐CoV‐2 in golden Syrian hamsters | Bryche et al. | França | 2020 | Pesquisa | Mecanismo de lesão do epitélio olfativo e tempo de regeneração |
| Neurological insights of Covid‐19 pandemic. | Das et al. | Índia | 2020 | Ponto de vista | Maior afinidade de ligação do SARS‐CoV‐2 com ACE2, em comparação com o MERS‐Cov. |
| Non‐neuronal expression of SARS‐CoV‐2 entry genes in the olfactory system suggests mechanisms underlying Covid‐19‐associated anosmia | Brann et al. | EUA e Reino Unido | 2020 | Pesquisa | Expressão de TMPRSS4 como uma proteína alternativa e mecanismo de endocitose do SARS‐COV‐2 |
| Objective evaluation of the nasal mucosal secretion in Covid‐19 patients with anosmia | Islamoglu et al. | Turquia | 2020 | Pesquisa Original | Anosmia condutiva como mecanismo improvável na infecção por SARS‐CoV‐2 |
| Olfactory bulb MRI and paranasal sinus CT findings in persistent Covid‐19 anosmia | Kandemirli et al. | Turquia | 2020 | Pesquisa Original | Pioria da anosmia causada por dano ao bulbo olfatório |
| Potential mechanisms for Covid‐19 induced anosmia and dysgeusia | Eshraghi et al. | EUA e Reino Unido | 2020 | Ponto de vista | Anosmia condutiva como mecanismo improvável na infecção por SARS‐CoV‐2 e mecanismo de lesão às células não neuronais |
| SARS‐CoV‐2: olfaction, brain infection, and the urgent need for clinical samples allowing earlier virus detection. | Butowt et al. | Polônia | 2020 | Ponto de vista | Mucosa nasal como a principal via de entrada do SARS‐CoV‐2 no corpo e a relação entre a resposta imune e a pioria da anosmia |
| Taste and smell disorders in Covid‐19 patients: Role of interleukin‐6 | Cazolla et al. | Itália | 2020 | Pesquisa | Relação entre a resposta imune e pioria da anosmia |
| The cellular basis of the loss of smell in 2019‐nCoV‐infected individuals | Gupta et al. | Índia | 2020 | Ponto de vista | Mecanismo de endocitose do SARS‐COV‐2 e expressão de ACE2 e TMPRSS2 em células não neuronais |
Dos 18 estudos selecionados, 9 foram feitos na Europa, 7 na Ásia, um nos Estados Unidos e um no Brasil. A maioria dos artigos consistia em estudos originais, desde o mecanismo de entrada do vírus SARS‐CoV‐2 no hospedeiro até os mecanismos fisiopatológicos que causam anosmia.
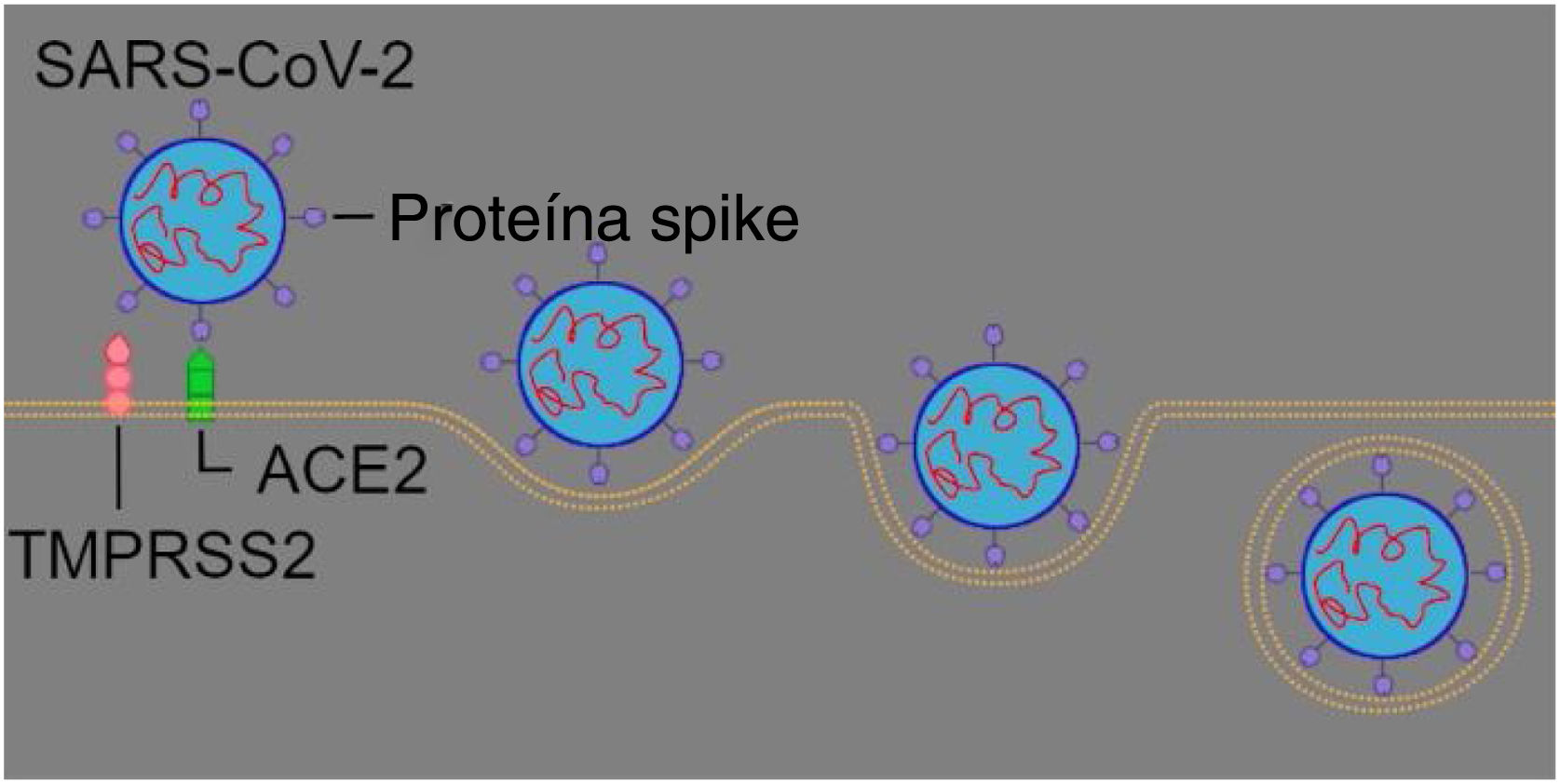
Mecanismo de entrada do SARS‐CoV‐2 no organismo hospedeiroO SARS‐CoV‐2 usa sua proteína spike (espigão) para se ligar à ACE2 e essa ligação é formada com a ajuda da serina protease 2 transmembrana (TMPRSS2). A TMPRSS2 é uma protease presente na superfície da célula‐alvo, que desempenha um papel importante na via de entrada do vírus, pois cliva um ponto específico da proteína spike, permite assim uma conexão entre o domínio terminal‐C (CTD, do inglês C‐terminal domain) da proteína spike e a ACE2. 1,5,12 Estudos recentes mostraram que outra protease transmembrana, a TMPRSS4, é capaz de desempenhar a mesma função que a TMPRSS2, é, portanto, uma protease opcional para SARS‐CoV‐2.5,13 Além das proteases transmembrana, há também a protease intracelular conhecida como catepsina‐L, que também pode ser responsável pela entrada do vírus.12
Comparado ao SARS‐CoV, além da maior estabilidade dos hotspots, o SARS‐CoV‐2 CTD tem mais ligações de van der Waals; portanto, liga‐se com maior afinidade à ACE2.2 Alguns tecidos expressam a ACE2, como pulmões, coração, mucosa oral e nasal, testículos, intestinos, órgãos linfoides e cérebro, e, como resultado, são mais suscetíveis à invasão do SARS‐CoV‐2.1,5,14
Entretanto, a principal via de entrada no organismo é pela mucosa nasal (fig. 2).2,14,15
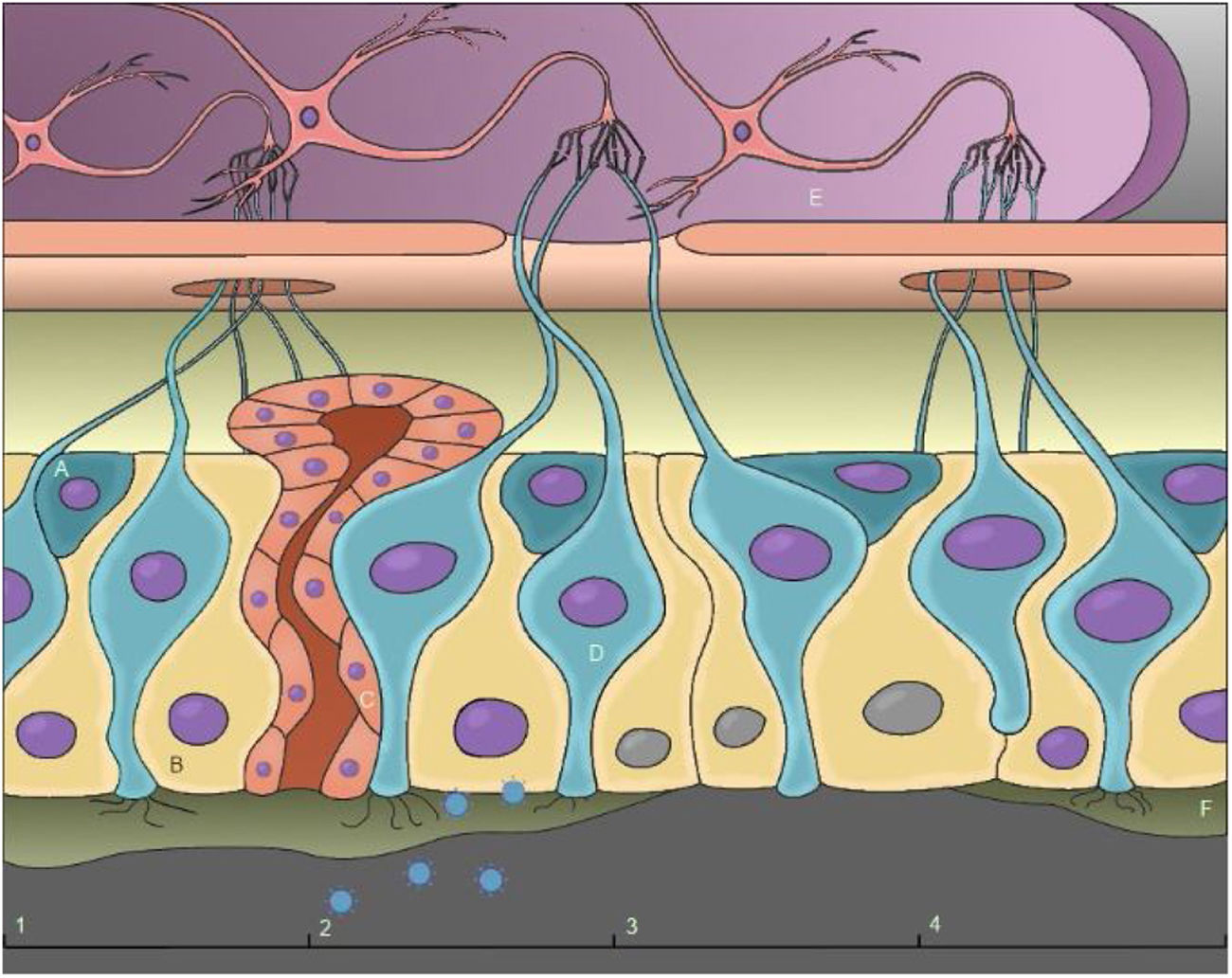
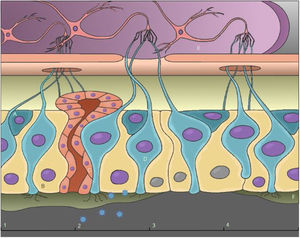
Possível mecanismo de anosmiaA anosmia condutiva ocorre devido à obstrução nasal, que é comum em muitos quadros virais, e pode ser acompanhada por rinorreia e sintomas de rinite; entretanto, estudos sugerem que a perda do olfato no Covid‐19 ocorre, na maioria dos casos, independentemente desses sintomas.16–18 Assim, essa hipótese, no caso do SARS‐CoV‐2, pode ser descartada como o principal mecanismo causador da anosmia. A lesão do epitélio olfativo é o mecanismo identificado como a causa mais provável de distúrbios olfativos causados pelo SARS‐CoV‐2, que podem ser agravados por danos ao sistema nervoso central (fig. 3).16,19,20
(A) Células‐tronco basais; (B) Células sustentaculares; (C) Célula de Bowman; (D) Neurônios receptores olfativos; (E) Bulbo olfatório; (F) Muco. (1) Epitélio olfativo intacto; (2) Chegada e invasão do SARS‐CoV‐2; (3) Danos às células sustentaculares, perda de cílios dos neurônios receptores olfativos e interrupção da produção de muco; (4) Regeneração do epitélio olfativo.
Análises baseadas no sequenciamento de RNA mostraram expressão considerável de ACE2 e TMPRSS2 em células sustentaculares (SUS), células de Bowman e uma pequena fração em células‐tronco; em contraste, a presença de ACE2 em neurônios receptores olfativos não foi confirmada.5,6,12,16,19
Sabe‐se que o vírus invade células através da ACE2 em conjunto com a TMPRSS2, ou seja, o SARS‐CoV‐2 tem como alvo principal células não neuronais. Além disso, a média de recuperação do olfato é de 2 semanas, um intervalo de tempo não compatível com a regeneração de células neuronais, o que confirma essa hipótese.16,19
Em experimentos com hamsters infectados com SARS‐CoV‐2 via instilação nasal, foram encontrados danos maciços ao epitélio olfativo apenas dois dias após a infecção. No quarto dia após a infecção, a maior parte do epitélio havia desaparecido. Após 14 dias, o epitélio dava sinais de recuperação, mas ainda não havia voltado ao normal. Verificou‐se que nas regiões onde o dano foi mais intenso os axônios dos neurônios receptores olfativos estavam praticamente em contato com o meio externo. As principais observações neste experimento foram: a infecção e descamação do epitélio olfativo, a preferência do vírus por células sustentaculares em vez de células neuronais e o intenso recrutamento de células imunes.19
Os danos às células sustentaculares e às células de Bowman afetam diretamente a percepção de odores, não pela transmissão do vírus para os neurônios receptores olfativos (ORN), mas pelo fato de comprometer algumas das funções necessárias ao metabolismo funcional desses neurônios.1,5 Danos às células de Bowman causariam uma interrupção na produção de muco nasal, necessário para a dissolução de partículas odoríferas; além disso, danos às células sustentaculares resultariam na supressão da remoção de produtos voláteis, pela via do citocromo P450, na interrupção da endocitose de complexos proteicos que se ligam a odorantes após a transdução de sinais para os ORNs e interrupção do fornecimento de glicose adicional aos cílios dos ORNs e um desequilíbrio de eletrólitos e água.5 Por essa razão, o dano às células sustentaculares certamente refletiria na percepção do odor, característica da anosmia e da hiposmia. Além disso, a infecção das células sustentaculares gera perda dos cílios dos receptores olfativos, o que se reflete na impossibilidade de transmitir o estímulo odorífero e, assim, detectar odores.6 Os estudos de ressonância magnética mostram uma correlação entre o tamanho do bulbo olfatório e sua disfunção, refletem uma menor atividade sensorial no epitélio olfativo, o que leva a menor sinaptogênese no bulbo olfatório, diminui seu volume. Essa redução na atividade epitelial olfativa é resultado de danos às células não neuronais, corrobora ainda mais essa hipótese.16,19 O restabelecimento da normosmia seria devido à rápida regeneração das células de sustentação a partir das células‐tronco.6
O dano ao epitélio olfativo pode ser agravado por uma resposta inflamatória, leva à morte celular, conhecida como piroptose. O sistema imunológico é ativado após o reconhecimento do patógeno, causa um aumento na secreção de citocinas pró‐inflamatórias e quimiocinas: interleucina‐6 (IL‐6), interferon‐gama (IFN‐γ), proteínas quimioatraentes da proteína‐1 quimioatraente de monócitos (MCP ‐1) e proteína 10 induzível por interferon (IP‐10). Essas citocinas são indicativas de uma reação mais focada no recrutamento de monócitos e linfócitos T.16,20,21 Além disso, um estudo demonstrou uma possível correlação entre anosmia e níveis de IL‐6. A IL‐6 induz a expressão de várias proteínas de fase aguda, entre elas a proteína C‐reativa, a amiloide A sérica, a alfa‐1‐antiquimotripsina, a haptoglobina, fibrinogênio e componentes do complemento. Portanto, pacientes com níveis mais elevados de IL‐6 podem estar associados a casos mais intensos de distúrbios olfativos.20 A alta produção de citocinas pode provocar a morte de neurônios olfativos. A substituição dos neurônios epiteliais olfativos por células‐tronco basais requer um tempo de recuperação mais longo, dessa forma explica os casos de anosmia persistente.16,20,22
A perda do olfato pode ser devida à inflamação do bulbo olfatório desencadeada pela infecção viral.16,19,23,24 O SARS‐CoV tem a capacidade de infectar o sistema nervoso central através das sinapses, usa as aferências do nervo olfatório para atingir o bulbo olfatório, levanta a possibilidade de o SARS‐CoV‐2 também usar essa via de infecção.21,22,25
DiscussãoFatores epidemiológicos como idade e estilo de vida interferem diretamente na prevalência de distúrbios olfativos. Estudos têm apresentado uma correlação entre a expressão do receptor da ACE2 e a idade, a ACE2 é mais prevalente em adultos do que em crianças.4,26 Em concordância com essa informação, os jovens geralmente expressam um prognóstico menos grave.27–31Em relação aos hábitos de vida, verificou‐se que fumantes têm maior chance de desenvolver distúrbios olfativos devido à Covid‐19, que é uma consequência de uma maior expressão do receptor da ACE2 estimulado pelo receptor nicotínico da acetilcolina (nAChR).2 Outro conjunto de evidências mostrou que as mulheres têm maior probabilidade de desenvolver distúrbios olfativos do que os homens.30–33 Uma possível explicação seria que a inativação incompleta do cromossomo X contribuiria para o aumento da expressão da ACE2.34
Além dos hábitos de vida e da idade, as mutações genéticas do SARS‐CoV‐2 e das populações também contribuem para uma prevalência diferente de anosmia. No início da pandemia, a cepa mais comum do SARS‐CoV‐2 era a D614, o que significa que a proteína spike do vírus tem o aminoácido D (ácido aspártico) na posição 614. Ao longo da evolução da pandemia, o aminoácido glicina passou a ocupar a posição 614, deu origem à variante G614, considerada a dominante no continente europeu. No leste asiático, a variante dominante ainda é a D614. Comparando as duas variantes, verificou‐se que a D614 estava ligeiramente correlacionada com distúrbios quimiossensoriais, como a anosmia, enquanto a G614 estava altamente correlacionada, consistente com o fato de a prevalência de anosmia encontrada na população europeia ser três vezes maior em comparação com a população do leste asiático.
Estudos têm demonstrado que a substituição de aminoácidos na posição 614, do ácido aspártico por glicina, favoreceu o estado de abertura conformacional da proteína spike, resultou em uma exposição aumentada do domínio de ligação desta proteína e, como resultado, aumentou a probabilidade de ligação com ACE2. Devido a essa maior probabilidade de ligação ao receptor do hospedeiro, a variante G614 está diretamente associada não apenas a uma maior incidência de anosmia, mas também a uma maior infectividade e transmissibilidade.34,35
Além disso, estudos têm demonstrado que há uma variação genética no receptor humano para o vírus, a ACE2, na população europeia, o que aumenta a expressão desse receptor. Como resultado, os europeus estariam mais predispostos à anosmia em comparação com os asiáticos, justamente por terem mais receptores para a entrada do SARS‐CoV‐2.36,37
ConclusãoA via de entrada do SARS‐CoV‐2 requer um receptor da ACE2, favorecido pelo uso da protease TMPRSS2. Vários órgãos expressam tanto a ACE2 quanto a TMPRSS2, inclusive o epitélio olfativo. Distúrbios olfativos como anosmia e hiposmia podem ser causados pela Covid‐19 e o principal mecanismo está associado à lesão do epitélio olfativo, tem como alvo células predominantemente não neuronais. Entretanto, células neuronais também podem ser afetadas, o que piora o quadro de perda olfativa.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Las Casas Lima MH, Cavalcante AL, Leão SC. Pathophysiological relationship between Covid‐19 and olfactory dysfunction: a systematic review. Braz J Otorhinolaryngol. 2022;88:793–801.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.