Idiopathic hypogonadotrophic hypogonadism with an olfactory deficit is defined as Kallmann syndrome and is distinct from normosmic idiopathic hypogonadotrophic hypogonadism.
ObjectiveBecause olfactory perception not only consists of orthonasally gained impressions but also involves retronasal olfactory function, in this study we decided to comprehensively evaluate both retronasal and orthonasal olfaction in patients with idiopathic hypogonadotrophic hypogonadism.
MethodsThis case‐control study included 31 controls and 45 idiopathic hypogonadotrophic hypogonadism patients. All participants whose olfactory and taste functions were evaluated with orthonasal olfaction (discrimination, identification and threshold), retronasal olfaction, taste function and olfactory bulb volume measurement. The patients were separated into three groups according to orthonasal olfaction: anosmic idiopathic hypogonadotrophic hypogonadism, hyposmic idiopathic hypogonadotrophic hypogonadism and normosmic idiopathic hypogonadotrophic hypogonadism.
ResultsDiscrimination, identification and threshold scores of patients with Kallmann syndrome were significantly lower than controls. Threshold scores of patients with nIHH were significantly lower than those of controls, but discrimination and identification scores were not significantly different. Retronasal olfaction was reduced only in the aIHH group compared to controls. Identification of bitter, sweet, sour, and salty tastes was not significantly different when compared between the anosmic, hyposmic, and normosmic idiopathic hypogonadotrophic hypogonadism groups and controls. Olfactory bulb volume was lower bilaterally in all patient groups when compared with controls. The olfactory bulb volume of both sides was found to be significantly correlated with threshold, discrimination and identification scores in idiopathic hypogonadotrophic hypogonadism patients.
Conclusion1) There were no significant differences in gustatory function between controls and idiopathic hypogonadotrophic hypogonadism patients; 2) retronasal olfaction was reduced only in anosmic patients but not in orthonasally hyposmic participants, possibly indicating presence of effective compensatory mechanisms; 3) olfactory bulb volumes were highly correlated with olfaction scores in the hypogonadotrophic hypogonadism group. The current results indicate a continuum from anosmia to normosmia in idiopathic hypogonadotrophic hypogonadism patients.
O hipogonadismo hipogonadotrófico idiopático com déficit olfatório é definido como síndrome de Kallmann e é distinto de hipogonadismo hipogonadotrófico idiopático normósmico.
ObjetivoPelo fato de a percepção olfativa não apenas consistir em impressões obtidas ortonasalmente, mas também envolver a função olfativa retronasal, neste estudo decidimos avaliar de maneira abrangente o olfato retronasal e ortonasal em pacientes com hipogonadismo hipogonadotrófico idiopático.
MétodoEste estudo caso‐controle incluiu 31 controles e 45 pacientes com hipogonadismo hipogonadotrófico idiopático. Todos os participantes tiveram as funções olfativas e de paladar avaliadas com olfação ortonasal (discriminação, identificação e limiar), olfação retronasal, função do paladar e medida do volume do bulbo olfatório. Os pacientes foram separados em três grupos de acordo com a olfação ortonasal: hipogonadismo hipogonadotrófico idiopático anósmico, hipogonadismo hipogonadotrófico idiopático hipósmico e hipogonadismo hipogonadotrófico idiopático normósmico.
ResultadosOs escores de discriminação, identificação e limiar de pacientes com síndrome de Kallmann foram significativamente menores do que os controles. Os escores dos limiares de pacientes com hipogonadismo hipogonadotrófico idiopático normósmico foram significativamente menores do que os dos controles, mas os escores de discriminação e identificação não foram significativamente diferentes. A olfação retronasal foi reduzida apenas no grupo hipogonadismo hipogonadotrófico idiopático anósmico em comparação com os controles. A identificação de gostos amargos, doces, azedos e salgados não foi significativamente diferente quando comparada entre os grupos e controles de hipogonadismo hipogonadotrófico idiopático anósmicos, hipósmicos e normósmicos. O volume do bulbo olfatório foi menor bilateralmente em todos os grupos de pacientes quando comparado com os controles. O volume do bulbo olfatório de ambos os lados foi significativamente correlacionado com os escores de limiar, discriminação, identificação em pacientes com hipogonadismo hipogonadotrófico idiopático.
Conclusão1) Não houve diferenças significativas na função gustativa entre controles e pacientes com hipogonadismo hipogonadotrófico idiopático; 2) A olfação retronasal foi reduzida apenas em pacientes anosmáticos, mas não em participantes ortonasalmente hipósmicos, possivelmente indicou presença de mecanismos compensatórios efetivos; 3) Os volumes do bulbo olfatório foram altamente correlacionados com os escores de olfação no grupo hipogonadismo hipogonadotrófico. Os resultados atuais indicam um contínuo da anosmia à normosmia em pacientes com hipogonadismo hipogonadotrófico idiopático.
A secreção pulsátil de hormônio liberador de gonadotropina (GnRH) do hipotálamo causa liberação das gonadotropinas hipofisárias, hormônio luteinizante (LH) e hormônio folículo‐estimulante (FSH). O hipogonadismo hipogonadotrófico idiopático (HHI) refere‐se a um fenótipo de hipogonadismo evidente com baixos níveis de gonadotropinas séricas sem problemas anatômicos no eixo hipotálamo‐hipófise.1 A prevalência de HHI é estimada entre 1/4.000‐1/10.000 em homens e 1/40.000 em mulheres.2
Os neurônios secretores de GnRH e os neurônios olfatórios compartilham a via de migração embriológica. Esses dois grupos de neurônios são originários do placoide olfatório embrionário. Os axônios dos neurônios receptores olfativos e os neurônios secretores de GnRH migram através da placa cribriforme, na qual os axônios dos neurônios receptores olfatórios sofrem sinapse no bulbo olfatório (BO). A migração adicional de neurônios secretores de GnRH visa ao hipotálamo médio‐basal, no qual a secreção de GnRH pulsátil ocorre.3 O desenvolvimento anormal do placoide olfatório leva ao desenvolvimento inadequado do BO e aplasia ou hipoplasia do sulco olfatório do BO e dos tratos olfativos é frequentemente associada a anosmia.
O hipogonadismo hipogonadotrófico (HH) com déficit olfativo é definido como síndrome de Kallmann (SK) e é distinto do HH normósmico. No entanto, ambas as doenças poderiam compartilhar uma etiologia genética comum.1 Estudos mais antigos mostraram que a deleção do gene KAL1 está relacionada com a SK.4,5 Essa deleção causa defeitos na migração de neurônios secretores de GnRH na embriogênese. De maneira semelhante, as deleções nos genes que funcionam na via de sinalização do fator de crescimento de fibroblastos (FGF8 e FGFR1) podem causar SK. A SK também pode resultar de deleções em genes que funcionam na via de sinalização PROK2 (PROK2 e PROKR2) e na via CHD7. Essas deleções de genes também podem ser observadas em pacientes com HH normósmicos.3 Os genes que afetam a secreção de GnRH (GNRHR, TAC3, KISS1 e KISS1R) também foram encontrados em pacientes com HH hipósmicos e normósmicos. Esses estudos indicam que HH normósmico, hipósmico e anósmico têm sua base na mesma patogenia, mas diferentes expressões de genes relacionados causam variações clínicas.
A maioria dos estudos anteriores sobre pacientes com HH usou vários métodos psicofisiológicos para avaliar a função olfatória.3,6,7 Como a percepção olfativa não consiste apenas em impressões obtidas ortonasalmente, mas também envolve a função olfativa retronasal, decidimos avaliar de maneira abrangente a olfação retronasal e ortonasal. Possíveis diferenças na função gustativa dos pacientes com HH também foram investigadas.
MétodoA presente investigação trata‐se de um estudo caso‐controle e foi aprovada pelo Comitê de Ética em Pesquisa Clínica do Haydarpasa Training Hospital. Todos os indivíduos forneceram o consentimento informado por escrito. Os pacientes com hipogonadismo hipogonadotrópico foram recrutados do departamento de endocrinologia da nossa instituição e foram selecionados consecutivamente para avaliação posterior. Foram medidas a testosterona sem soro (ng/dL), testosterona total no soro (ng/dL), globulina sérica de ligação ao hormônio sexual (nmoL/L), FSH (mIU/mL) e LH (mIU/mL). Os volumes testiculares bilaterais (mL) foram avaliados com ultrassonografia escrotal. O grupo de estudo consistiu em homens com as seguintes características: 18 anos ou mais, sinais e sintomas clínicos de hipogonadismo, níveis séricos de testosterona abaixo de 100 ng/dL, níveis baixos ou normais de gonadotropinas, níveis séricos normais de outros hormônios da hipófise anterior e ausência de anomalia anatômica nas áreas hipotalâmica e hipofisária confirmada com ressonância magnética.
Teste olfativo ortonasalO teste de olfato psicofísico foi feito com o kit de teste Sniffin’ Stick comercialmente disponível, no qual os odores são apresentados através de canetas hidrográficas.8–10 Depois de abrir a tampa, cada odorante foi cheirado pelo paciente por aproximadamente três segundos. Os testes olfativos foram divididos em três partes. A primeira parte foi o teste de limiar (L), durante o qual foram apresentadas concentrações crescentes de álcool fenil‐etílico. A segunda parte foi o teste de discriminação de odor (D), que consistiu em 16 tripletos com dois odores diferentes por tripleto. A terceira parte foi um teste de identificação de odor (I) com 16 odores comuns; os participantes foram convidados a escolher uma das quatro opções para identificar cada odor particular. A pontuação máxima de cada teste foi de 16 e o escore composto máximo foi de 48 (escore de LDI: escores totais de limiar, discriminação e identificação). Os valores normais para o escore composto de LDI são > 30,5, com um corte entre anosmia e hiposmia em 16,5.11 De acordo com seus escores de LDI, os participantes do estudo foram diagnosticados como funcionalmente anosmáticos (a partir daqui denominados “anósmicos”), hipósmicos ou normósmicos.
Teste olfativo retronasalPara o teste olfativo retronasal, usou‐se um teste padronizado e validado.12 O teste inclui 20 itens e baseia‐se na identificação de pós ou grânulos odorizados (p.ex., café instantâneo moído, canela ou cogumelos) apresentados na cavidade oral. As substâncias foram aplicadas na linha média da língua com varetas de plástico descartáveis. Os participantes eram livres para testar tanto estimulante quanto necessário para a identificação. Essa abordagem minimizou o problema da padronização da área de estimulação e diferenças nos tamanhos das línguas dos participantes e das cavidades orais. Em um ensaio típico, o experimentador colocaria aproximadamente 0,05g da substância de teste no meio da língua. Após a administração de cada pó, os participantes enxaguaram a boca com água da torneira. O procedimento foi autoprogramado. Cada substância foi identificada por meio de um procedimento de escolha forçada em que o participante selecionou um dos quatro itens verbais apresentados em conjunto com cada odor. O resultado do teste foi a soma do escore dos estímulos corretamente identificados (pontuação máxima 20).
Teste de função do paladarQuatro estimulantes do paladar básicos com quatro concentrações foram usados para a avaliação do sabor. Cada estimulante foi adsorvido em tiras de papel filtro em cada concentração (doce: 0,4; 0,2; 0,1; 0,05g/mL de sacarose, ácido: 0,3; 0,165; 0,09; 0,05g/mL de ácido cítrico, salgado: 0,25; 0,1; 0,04; 0,016g/mL de cloreto de sódio, amargo: 0,006; 0,0024; 0,0009; 0,0004g/mL de cloridrato de quinina). Essas tiras de papel filtro impregnadas foram colocadas na parte anterior da língua. Antes de cada administração, a boca foi enxaguada com água destilada. As qualidades de sabor foram aplicadas de maneira aleatória, mas em ordem crescente de intensidade. Cada participante foi testado com cada sabor em cada concentração em 16 tentativas. Os pacientes foram convidados a identificar o sabor de uma lista com “doce”, “azedo”, “salgado” e “amargo” (múltipla escolha forçada). Respostas corretas foram adicionadas para um escore de paladar (pontuação máxima 16).13
Medição do bulbo olfatórioOs exames foram feitos com um sistema de imagem de ressonância magnética (RM) de 1,5T (Avanto, Siemens, Erlangen, Alemanha) com uma bobina de cabeça de 12 canais. As seções foram anguladas perpendicularmente à base anterior do crânio ou da placa cribriforme. Usamos a perfeição tridimensional de amostragem em T2 com aplicação de contraste aprimorada com diferentes evoluções de ângulo de inversão (Space) que cobriam os segmentos anterior e médio da base do crânio. Parâmetros da sequência tridimensional em T2 Space foram os seguintes: tempo de eco, 224 milissegundos; tempo de repetição, 1.440 milissegundos; largura de banda, 349 hertz por pixel; campo de visão 190 × 190; matriz 520 × 512; espessura da fatia, 1mm; nenhum intervalo interfatias.
O software Syngo MMWP (Siemens Medical Solutions, Forchheim, Alemanha) foi usado para determinar o volume dos BO direito e esquerdo. As medidas de volume foram feitas por um radiologista experiente cego ao diagnóstico clínico. Antes das medidas volumétricas, foi escolhida uma imagem sagital média dos BO e os comprimentos de ambos os BO foram medidos. Posteriormente, as medidas dos volumes dos bulbos olfatórios direito e esquerdo (VBO) foram feitas através da segmentação manual das fatias coronais por contorno manual planimétrico (superfície em pixels), em seguida todos os pixels foram adicionados e multiplicados pelos eixos x, y e z (0,36 × 0,37 × 1 número de pixels) para obter um volume em milímetros cúbicos.14
Análise estatísticaA análise dos dados foi feita com o SPSS versão 21.0 (SPSS Inc., Chicago, IL, EUA). A distribuição normal das variáveis consideradas foi avaliada pela primeira vez com o teste de Shapiro‐Wilk. Os dados são apresentados como médias ± desvios‐padrão para variáveis contínuas e como número de casos para variáveis categóricas. Ao comparar dois grupos independentes, o teste t de Student foi usado se as variáveis contínuas fossem normalmente distribuídas e o teste U de Mann‐Whitney foi usado para variáveis contínuas não distribuídas normalmente. As variáveis categóricas (proporções) foram comparadas com o teste de qui‐quadrado. Os pacientes foram divididos em três grupos de acordo com os escores de Sniffin’ Stick (normosmia, hiposmia e anosmia). Além disso, para explorar a sensibilidade olfativa retronasal em relação a grupo, idade, gênero, tabagismo e consumo de álcool, os dados foram submetidos à análise de variância com o modelo linear geral com comparações post hoc de Bonferroni. As análises correlacionais foram calculadas de acordo com o coeficiente de correlação de Pearson. O nível de significância foi estabelecido em p < 0,05.
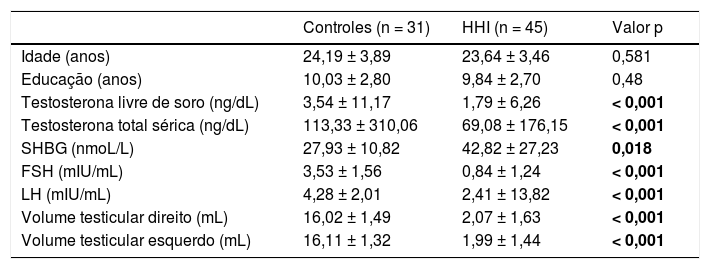
ResultadosNosso estudo incluiu 31 controles e 45 pacientes com HHI. Os grupos não diferiram significativamente em termos de idade, sexo ou nível de escolaridade. Como esperado, os pacientes com HHI apresentaram níveis mais baixos de testosterona sem soro, testosterona sérica total, FSH, LH e volumes de testículos direito e esquerdo mais baixos (tabela 1).
Características demográficas, clínicas e laboratoriais de pacientes e controlesa
| Controles (n = 31) | HHI (n = 45) | Valor p | |
|---|---|---|---|
| Idade (anos) | 24,19 ± 3,89 | 23,64 ± 3,46 | 0,581 |
| Educação (anos) | 10,03 ± 2,80 | 9,84 ± 2,70 | 0,48 |
| Testosterona livre de soro (ng/dL) | 3,54 ± 11,17 | 1,79 ± 6,26 | < 0,001 |
| Testosterona total sérica (ng/dL) | 113,33 ± 310,06 | 69,08 ± 176,15 | < 0,001 |
| SHBG (nmoL/L) | 27,93 ± 10,82 | 42,82 ± 27,23 | 0,018 |
| FSH (mIU/mL) | 3,53 ± 1,56 | 0,84 ± 1,24 | < 0,001 |
| LH (mIU/mL) | 4,28 ± 2,01 | 2,41 ± 13,82 | < 0,001 |
| Volume testicular direito (mL) | 16,02 ± 1,49 | 2,07 ± 1,63 | < 0,001 |
| Volume testicular esquerdo (mL) | 16,11 ± 1,32 | 1,99 ± 1,44 | < 0,001 |
FSH, hormônio folículo‐estimulante; HHI, hipogonadismo hipogonadotrófico idiopático; LH, hormônio luteinizante; SHBG, globulina transportadora de hormônios sexuais; valor p, controles vs. HHI.
Os valores marcados em negrito são estatisticamente significativos (p < 0,05).
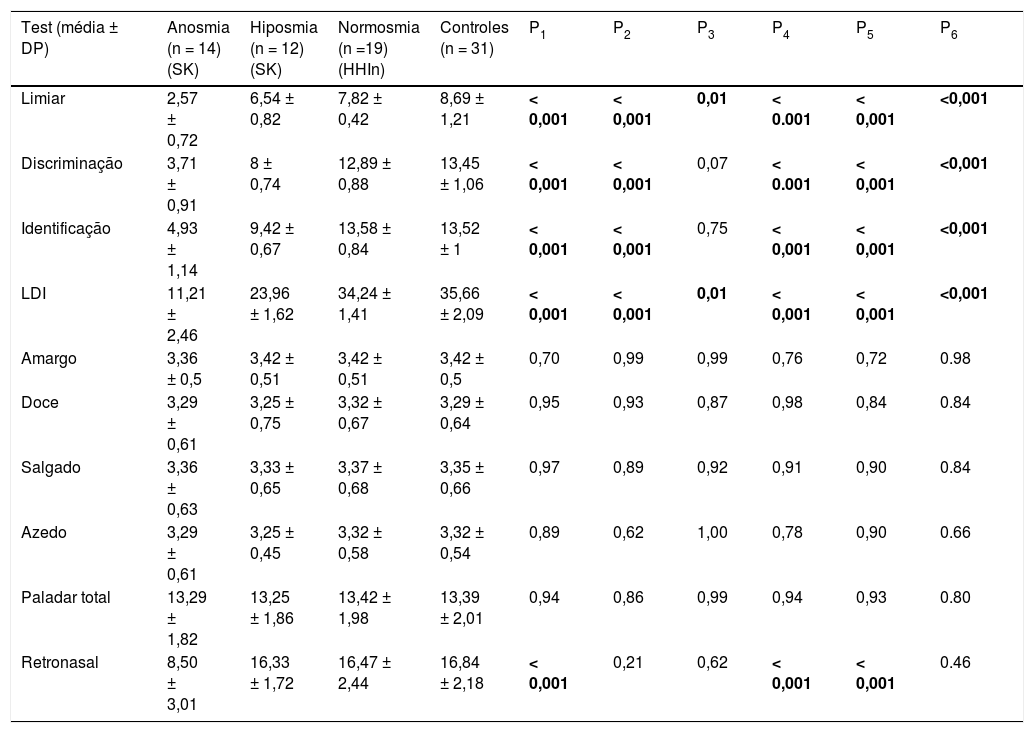
Os pacientes foram separados em três grupos de acordo com os escores de LDI: grupo de HH anósmico (n = 14), grupo de HHI hipósmico (n = 12) e grupo de HHI normósmico (HHIn, n = 19). Os resultados dos exames olfativos (ortonasais e retronasais) e de paladar para pacientes e controles são mostrados na tabela 2. Os escores de discriminação, identificação e limiar de pacientes com SK foram significativamente menores do que os dos controles. Os escores de limiar de pacientes com HHIn foram significativamente inferiores aos dos controles, mas a discriminação e os escores de identificação não foram significativamente diferentes (limiar de odor: 7,82 ± 0,42 vs. 8,69 ± 1,21, p = 0,01; escore LDI: 34,24 ± 1,41 vs. 35,66 ± 2,09, p = 0,01). A olfação retronasal foi reduzida apenas no grupo de HHI anósmico em comparação com controles (8,50 ± 3,01 vs. 16,84 ± 2,18, p = 0,001). Os grupos ortonasalmente hipósmicos e os com HHIn foram semelhantes em olfação retronasal quando comparados com os controles. A identificação de gostos amargos, doces, azedos e salgados não foi significativamente diferente quando comparada entre os grupos e controles de HHI anósmicos, hipósmicos e normósmicos.
Resultados de teste olfativo e de paladar de pacientes e controles
| Test (média ± DP) | Anosmia (n = 14) (SK) | Hiposmia (n = 12) (SK) | Normosmia (n =19) (HHIn) | Controles (n = 31) | P1 | P2 | P3 | P4 | P5 | P6 |
|---|---|---|---|---|---|---|---|---|---|---|
| Limiar | 2,57 ± 0,72 | 6,54 ± 0,82 | 7,82 ± 0,42 | 8,69 ± 1,21 | < 0,001 | < 0,001 | 0,01 | < 0.001 | < 0,001 | <0,001 |
| Discriminação | 3,71 ± 0,91 | 8 ± 0,74 | 12,89 ± 0,88 | 13,45 ± 1,06 | < 0,001 | < 0,001 | 0,07 | < 0.001 | < 0,001 | <0,001 |
| Identificação | 4,93 ± 1,14 | 9,42 ± 0,67 | 13,58 ± 0,84 | 13,52 ± 1 | < 0,001 | < 0,001 | 0,75 | < 0,001 | < 0,001 | <0,001 |
| LDI | 11,21 ± 2,46 | 23,96 ± 1,62 | 34,24 ± 1,41 | 35,66 ± 2,09 | < 0,001 | < 0,001 | 0,01 | < 0,001 | < 0,001 | <0,001 |
| Amargo | 3,36 ± 0,5 | 3,42 ± 0,51 | 3,42 ± 0,51 | 3,42 ± 0,5 | 0,70 | 0,99 | 0,99 | 0,76 | 0,72 | 0.98 |
| Doce | 3,29 ± 0,61 | 3,25 ± 0,75 | 3,32 ± 0,67 | 3,29 ± 0,64 | 0,95 | 0,93 | 0,87 | 0,98 | 0,84 | 0.84 |
| Salgado | 3,36 ± 0,63 | 3,33 ± 0,65 | 3,37 ± 0,68 | 3,35 ± 0,66 | 0,97 | 0,89 | 0,92 | 0,91 | 0,90 | 0.84 |
| Azedo | 3,29 ± 0,61 | 3,25 ± 0,45 | 3,32 ± 0,58 | 3,32 ± 0,54 | 0,89 | 0,62 | 1,00 | 0,78 | 0,90 | 0.66 |
| Paladar total | 13,29 ± 1,82 | 13,25 ± 1,86 | 13,42 ± 1,98 | 13,39 ± 2,01 | 0,94 | 0,86 | 0,99 | 0,94 | 0,93 | 0.80 |
| Retronasal | 8,50 ± 3,01 | 16,33 ± 1,72 | 16,47 ± 2,44 | 16,84 ± 2,18 | < 0,001 | 0,21 | 0,62 | < 0,001 | < 0,001 | 0.46 |
DP, desvios‐padrão; HHIn, hipogonadismo hipogonadotrófico idiopático normósmico; SK, síndrome de Kallmann; valor P1, anosmia vs. controles; valor P2, hiposmia vs. controles; valor P3, normosmia vs. controles; valor P4, anosmia vs. hiposmia; valor P5, anosmia vs. normosmia; valor P6, hiposmia vs. normosmia.
Os valores marcados em negrito são estatisticamente significativos (p < 0,05).
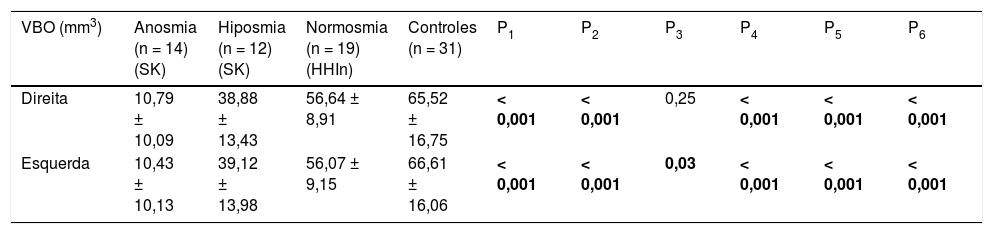
Não foram observados bulbos olfatórios em quatro pacientes no grupo anósmico. O VBO foi menor bilateralmente em todos os grupos de pacientes quando comparado com os controles. No entanto, o VBO direito não foi estatisticamente diferente entre o grupo de HHI normósmico e o grupo controle (tabela 3).
Mediçõesa de RM de pacientes e controles
| VBO (mm3) | Anosmia (n = 14) (SK) | Hiposmia (n = 12) (SK) | Normosmia (n = 19) (HHIn) | Controles (n = 31) | P1 | P2 | P3 | P4 | P5 | P6 |
|---|---|---|---|---|---|---|---|---|---|---|
| Direita | 10,79 ± 10,09 | 38,88 ± 13,43 | 56,64 ± 8,91 | 65,52 ± 16,75 | < 0,001 | < 0,001 | 0,25 | < 0,001 | < 0,001 | < 0,001 |
| Esquerda | 10,43 ± 10,13 | 39,12 ± 13,98 | 56,07 ± 9,15 | 66,61 ± 16,06 | < 0,001 | < 0,001 | 0,03 | < 0,001 | < 0,001 | < 0,001 |
DP, desvios‐padrão; HHIn, hipogonadismo hipogonadotrófico idiopático normósmico; SK, síndrome de Kallmann; RM, ressonância magnética; valor P1, anosmia vs. controles; valor P2, hiposmia vs. controles; valor P3, normosmia vs. controles; valor P4, anosmia vs. hiposmia; valor P5, anosmia vs. normosmia; valor P6, hiposmia vs. normosmia.
Os valores marcados em negrito são estatisticamente significativos (p < 0,05).
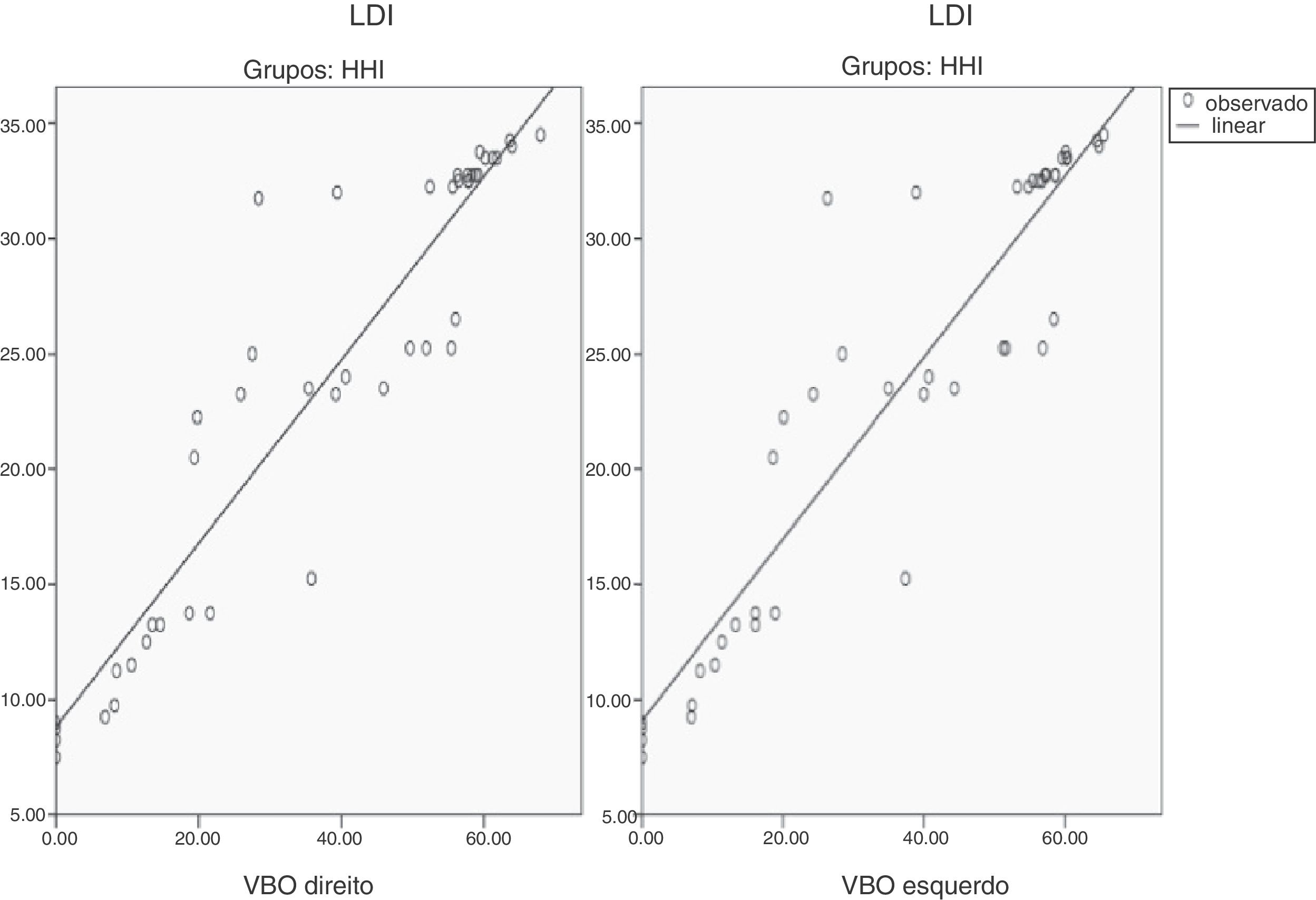
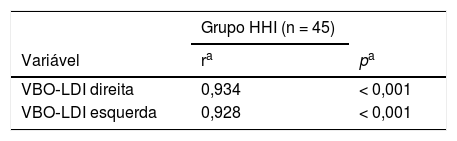
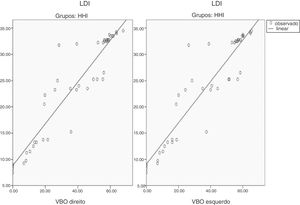
O VBO de ambos os lados mostrou‐se significativamente correlacionado com os escores de LDI em pacientes com HHI (VBO‐LDI direito, r: 0,934, p < 0,001; VBO‐LDI esquerdo, r: 0,928, p < 0,001) (tabela 4) (figs. 1 e 2). Foram investigados indicadores séricos de hipogonadismo, como FSH, LH, testosterona sem soro, testosterona total no soro e correlação de LDI; não foram encontradas correlações significativas.
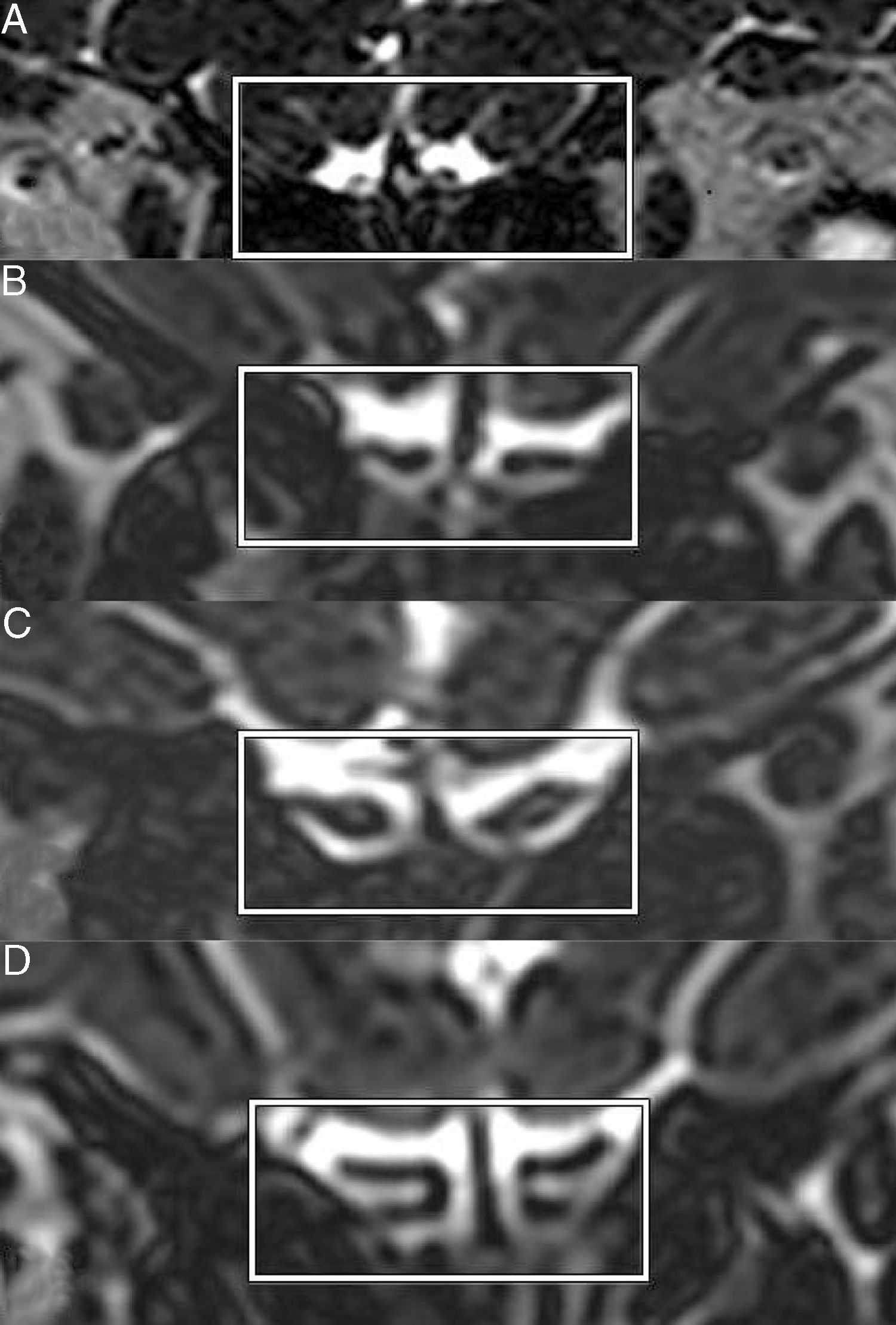
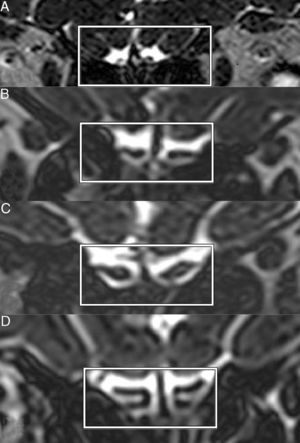
Imagens coronais de Space (aperfeiçoamento da amostragem pela aplicação aprimorada de contrastes com uma evolução diferente de ângulo invertido) de STIR (do inglês short tau inversion recovery = recuperação da inversão de tau curto) em T2 mostram bulbos olfatórios de anosmia (A), hiposmia (B), normosmia (C) e controle (D).
A olfação tem sido muito estudada em pacientes com HH. A alteração e diferenças do olfato são a principal descoberta na distinção entre HHI e SK.15 Entretanto, apenas um número limitado de estudos que investigam o paladar no HHI pode ser encontrado na literatura.6,16 Este estudo é um dos primeiros que avaliam a olfação retronasal e ortonasal e o paladar simultaneamente em pacientes com HH. A categorização de pacientes como anósmicos, hipósmicos ou normósmicos foi feita de acordo com os escores de LDI para o teste Sniffin’ Stick.11 Cada grupo foi comparado com controles com relação ao limiar de odor, discriminação de odor e identificação de odores. Os normósmicos apresentaram escores limítrofes e de LDI mais baixos. Escores olfatórios significativamente menores, mesmo em pacientes com HH normósmicos, comparados com os controles normósmicos, podem ser devidos à expressão gradual de genes HH relacionados.
A identificação dos gostos amargo, salgado, doce e azedo foi testada entre os grupos de controle e estudo. A função do paladar não foi significativamente diferente entre os controles e qualquer um dos três subgrupos de HH. Ros et al. investigaram o olfato e o paladar nos pacientes com síndrome de Turner; eles encontraram comprometimento olfativo no grupo de estudo, mas nenhuma diferença significativa para as funções do paladar.17 Os autores explicaram o comprometimento olfativo com razões genéticas e alegaram que as alterações hormonais não tiveram efeito na função gustativa. Essa é possivelmente a razão pela qual a função do paladar foi muito similar nos grupos estudados.
O sabor é uma função complexa, intimamente relacionada com a integridade do paladar e do olfato, o que, em última instância, possibilita o reconhecimento de alimentos e a apreciação deles.6,18 A olfação retronasal foi investigada em nosso estudo e revelou‐se significativamente menor no grupo anósmico em comparação com controles, mas nenhuma diferença significativa foi encontrada entre o grupo hipósmico e os controles. Landis et al. compararam olfação oronasal e retronasal e descobriram que uma proporção significativa de pacientes ortonasalmente anoscópicos tinha função normal da olfação retronasal.19 O autor explicou a diferença com diferentes níveis de vulnerabilidade do epitélio olfatório anterior e posterior a danos ou processos diferentes de evocação ortonasal e retronasal de olfação. A informação olfativa ortonasal e retronasal mostrou ser processada de forma diferente em um nível cerebral.20 Como o teste retronasal também incluiu estimulação gustativa (p.ex., açúcar de baunilha doce, sal de aipo salgado e pó de café amargo),19,20 nossos resultados podem indicar que os pacientes hipósmicos foram capazes de usar seu sistema gustativo de tal maneira que seus escores foram comparáveis com os controles. Isso pode indicar que os pacientes com HH hipósmicos desenvolvem alguns mecanismos compensatórios para compensar a diminuição da sensibilidade olfativa.
Pacientes com perda olfativa se queixam principalmente de distorção de sabor e incapacidade de identificar alimentos. No entanto, os pacientes com SK geralmente não se queixam de disfunções de sabor. Acredita‐se que os anósmicos congênitos podem aprender a concentrar‐se em outros aspectos dos alimentos para compensar a falta de olfação.6 Hasan et al. compararam quatro pacientes com SK com quatro controles com o uso de testes de olfato psicofísicos, eletrogustometria e testes para percepção de sabor.16 Eles encontraram escores de olfato mais baixos com sabor normal nos pacientes com SK, como esperado. No entanto, a percepção de sabor não é geralmente uma queixa em pacientes com SK. Valle et al. estudaram 36 pacientes com HHI e descobriram que 41,6% eram hipósmicos ou anósmicos.1 A hipoplasia ou aplasia dos bulbos olfativos foi encontrada em 75% do grupo hipósmico/anósmico, mas em apenas 7,6% do grupo normósmico. Independentemente do estado olfativo, defeitos da linha média e perda auditiva neurossensorial ocorrem em alta frequência em pacientes com HHI, apoiam a ideia de que SK e HH normósmico estão em diferentes posições no espectro de desenvolvimento da mesma doença.
Vários estudos já analisaram a possível predição da função olfativa com base no VBO.21 Medimos VBO em ambos os lados e procuramos uma relação entre VBO e função olfativa. Os volumes de bulbo olfatório foram significativamente menores nos três grupos de estudo em comparação com os controles e encontramos boa concordância entre os escores de VBO e LDI em pacientes com HHI. A razão exata para a redução do VBO no HHIn não é conhecida. Jagtap et al. encontraram alta prevalência de anormalidades na RM em pacientes com HHIn, juntamente com aumento da frequência de hipoplasia do VBO, atrofia cerebelar bilateral, fenda labial e fenda palatina.22 Eles postularam que esses pacientes podem ter anormalidades olfativas neuroanatômicas sutis que podem não comprometer a função do aparelho olfativo (pelo menos não em uma idade mais jovem). Estudos genéticos desses pacientes forneceriam informações valiosas e podem fornecer algumas pistas sobre os motivos do menor VBO em HHIn. Anik et al. estudaram volumes de bulbos olfativos em seis pacientes com SK e observaram que a imagem de RM dos bulbos olfatórios estava fortemente correlacionada com os resultados da olfatometria.23 Hudson et al. mostraram que os escores da função olfativa de indivíduos aparentemente normósmicos estavam dentro da extremidade inferior dos intervalos normais para indivíduos controle, argumentaram uma sutil anormalidade olfativa dentro desse subgrupo.24 Da mesma maneira, Vogl et al. demonstraram que uma pequena porcentagem de indivíduos aparentemente com HHIn apresentava bulbos olfatórios anormais e seus testes de olfato estavam na faixa mais baixa da distribuição normal.25
ConclusãoOs principais resultados do presente estudo são os seguintes: 1) Não houve diferenças significativas na função gustativa entre controles e pacientes com HHI; 2) A olfação retronasal foi reduzida apenas em pacientes anósmicos, mas não em participantes ortonasalmente hipósmicos, possivelmente indicou presença de mecanismos compensatórios efetivos; e 3) os volumes do bulbo olfatório foram altamente correlacionados com os escores de olfação no grupo HH. Os resultados atuais indicam um contínuo da anosmia à normosmia em pacientes com HHI.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Salihoglu M, Kurt O, Ay SA, Baskoy K, Altundag A, Saglam M, et al. Retro‐ and orthonasal olfactory function in relation to olfactory bulb volume in patients with hypogonadotrophic hypogonadis. Braz J Otorhinolaryngol. 2018;84:630–37.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.