Introdução: A saliva exerce influência primordial na homeostase do sistema digestório, pelos seus componentes inorgânicos e pelos fatores de crescimento. Indivíduos com síndrome de Sjögren (SS) apresentam maior incidência da doenc¸a do refluxo gastroesofágico (DRGE) e do refluxo laringofaríngeo (RLF). Concentrações salivares diminuídas do fator transformador de crescimento alfa (TGF-α) foram observadas em doentes dispépticos, porém não há estudos em populações com SS e RLF.
Objetivo: Comparar concentrações salivares do TGF-α; de indivíduos com SS e RLF a de controles saudáveis.
Método: Trata-se de um estudo prospectivo controlado. Doze pacientes com SS e RLF e 11 indivíduos controles saudáveis tiveram amostras salivares espontâneas e estimuladas coletadas para estabelecer concentração de TGF-α.
Resultados: A concentração salivar de TGF-α; foi estatisticamente maior no grupo estudo para ambas amostras. Este aumento foi confirmado nos sete indivíduos do grupo estudo que não apresentavam esofagite erosiva quando comparados ao grupo controle, porém não houve diferença estatística da concentração de TGF-α; entre pacientes do grupo estudo que apresentava mesofagite erosiva em comparação ao grupo controle.
Conclusão: A concentração salivar de TGF-α; foi estatisticamente maior no grupo de indivíduos com SS e RLF, sem esofagite erosiva.
Introduction: Saliva plays a key role in the homeostasis of the digestive tract, through its inorganic components and its protein growth factors. Sjögren’s syndrome patients have a higher prevalence of gastroesophageal reflux disease and laryngopharyngeal reflux. Decreased salivary transforming growth factor alpha levels were observed in dyspeptic patients, but there have been no studies in patients with Sjögren’s syndrome and laryngopharyngeal reflux.
Objective: To compare the salivary transforming growth factor alpha levels of patients with Sjögren’s syndrome and laryngopharyngeal reflux to those of healthy controls.
Methods: This is a prospective controlled study. Twelve patients with Sjögren’s syndrome and laryngopharyngeal reflux and 11 controls were prospectively evaluated. Spontaneous and stimulated saliva samples were obtained to establish salivary transforming growth factor alpha concentrations.
Results: The salivary transforming growth factor alpha levels of patients were significantly higher than those of healthy controls. Five patients with laryngopharyngeal reflux also had erosive esophagitis; their salivary transforming growth factor alpha levels were comparable to controls.
Conclusion: Salivary transforming growth factor alpha level was significantly higher in patients with Sjögren’s syndrome and laryngopharyngeal reflux when compared to the control group.
Pagina nueva Introdução
A saliva desempenha múltiplas funções na homeostase do sistema digestório.1-6 São exemplos de suas atribuições a digestão enzimática de alimentos, a formação do bolus alimentar, a facilitação da mastigação, deglutição e fala, a lubrificação das mucosas e a manutenção da integridade dentária, da mucosa oral e do sistema digestório. Mudanças que interfiram no conteúdo salivar podem comprometer, portanto, a integridade deste delicado equilíbrio e gerar consequências na cavidade oral, na faringe e no esôfago.1,2,4,6,7
A saliva é quase toda composta por água (mais de 99%), e menos de 1% é representado por elementos sólidos, na maior parte proteínas e sais.6 Os componentes inorgânicos da saliva são representados, principalmente, pelos íons bicarbonato, cálcio e fosfato.4,5,8-12 Por sua vez, a composição orgânica é representada por uma série de proteínas denominadas de fatores de crescimento, cuja ação biológica baseia-se na replicação e reparação dos epitélios do sistema digestório.13 Pela influência que exercem nos mecanismos protetores do sistema digestório durante a homeostase contra fatores agressores cotidianos, os fatores de crescimento de maior importância na saliva são a família dos fatores de crescimento epidérmicos, que é constituída pelo próprio “Fator de Crescimento Epidérmico (EGF)”, e também pelo “Fator Transformador de Crescimento – fração alfa (TGF- α)”.14
O TGF-α salivar é um potente polipeptídeo mitogênico de 50 aminoácidos cujas propriedades cicatrizantes se baseiam em sua capacidade de estimular a síntese de DNA das células epiteliais, com neoangiogênese e indução de regeneração tissular após agressões locais.15 A literatura afirma que o TGF-α salivar exerce sua influência no sistema digestório no auxílio da manutenção de uma barreira de defesa pré-epitelial apropriada, interagindo com outros componentes salivares, como o EGF, as mucinas e as prostaglandinas salivares.2,5,6,16
Embora as características protetoras do TGF- α sobre a mucosa gástrica já tenham sido comprovadas,5 não há dados disponíveis na literatura com relação à participação do TGF-α na fisiopatologia das manifestações supraesofágicas da doença do refluxo gastroesofágico (DRGE), denominadas de refluxo laringofaríngeo (RLF). Por ligar-se ao mesmo receptor celular que o EGF, pode ser aventada a hipótese de que o TGF-α salivar exerceria influência semelhante ao EGF salivar na proteção laríngea frente às agressões do RLF.17 Está provado que os efeitos biológicos do EGF abrangem a cicatrização de úlceras, a inibição de secreção gástrica e o estímulo de síntese de DNA, além de promover proteção à mucosa local frente a fatores agressores intraluminais, como ácido gástrico, ácidos biliares, pepsina e tripsina.1,2,6 Estudos em indivíduos com RLF observaram deficiências de EGF nas amostras salivares coletadas em comparação às amostras de indivíduos saudáveis, propondo ação protetora da molécula de EGF para o epitélio laringofaríngeo.9,10,17,18
Outro estudo sugeriu que haveria uma deficiência salivar primária de EGF em sujeitos com RLF que os tornariam mais susceptíveis a desenvolver a doença, uma vez que após a remissão dos sintomas pelo tratamento do RLF, estes sujeitos apresentaram concentração salivar de EGF estatisticamente semelhante às concentrações encontradas na fase ativa da doença e significativamente menores que indivíduos normais.19
Cientes da importância da saliva, Rourk16 e Korsten20 observaram que estados de hipossalivação podem aumentar o risco da doença do refluxo gastroesofágico (DRGE) pela concomitante redução no clareamento oroesofágico e na proteção mucosa. Outros autores observaram uma maior incidência de cáries e periodontite em pacientes com hipossalivação.21-23
Como o conteúdo protetor proteico é adicionado à saliva ao nível dos ácinos glandulares, a busca por um modelo experimental clínico de hipossalivação de origem acinar pode contribuir para a compreensão do papel seletivo dos componentes proteicos salivares na gênese da DRGE. Com este intuito, adotou-se a síndrome de Sjögren (SS) como modelo clínico para estudo salivar, tanto por ser uma das formas clássicas de hipossalivação conhecida, quanto por ter etiologia relacionada à disfunção acinar das glândulas exócrinas (é observada uma infiltração linfoplasmocitária progressiva e substituição do parênquima excretor, particularmente das glândulas salivares, ocasionando sua falência e induzindo a hipossalivação).6,24
Estudos prévios já registraram maior prevalência da DRGE e suas manifestações supraesofágicas (o RLF) em populações com SS, sugerindo que a associação seja frequente.5,6,20,25-28 Para Belafsky e Postma,25 apesar de não existir comprovação de deficiências primárias na resistência epitelial, a inflamação das glândulas seromucosas nos pacientes com SS tornaria as mucosas laríngea, faríngea e esofágica mais vulneráveis aos efeitos lesivos do material refluído.
Pelo exposto acima, a pesquisa da concentração do TGF-α salivar em pacientes com síndrome de Sjögren pode vir a auxiliar no esclarecimento do mecanismo de instalação do RLF nesta população, contribuindo para uma melhor compreensão da fisiopatologia desta doença e permitindo a prevenção de possíveis complicações que esta associação de comorbidades possa causar.
O objetivo deste estudo foi analisar a concentração do fator de transformação de crescimento – subfração alfa em amostras salivares de indivíduos com síndrome de Sjögren e refluxo laringofaríngeo – e compará-las à de indivíduos saudáveis.
Casuística e método
Após aprovação do Comitê de Ética em pesquisas em seres humanos da instituição (projeto número 354/10), um total de 12 sujeitos com diagnóstico confirmado de síndrome de Sjögren e 11 controles normais foram estudados no período de agosto de 2010 a fevereiro de 2013, em hospital universitário terciário.
O diagnóstico de SS foi feito de acordo com as definições do consenso europeu-americano de 2002.29 O diagnóstico de RLF foi feito por sintomas laringofaríngeos sugestivos e uma videolaringoscopia compatível, corroborado por endoscopia digestiva alta (EDA) e/ou pH-metria esofágica de 24 horas de duplo canal (pHmetria).14,28-31
Foram admitidos todos os pacientes que se enquadraram nos critérios de inclusão e exclusão, após seu consentimento e esclarecimento sobre os objetivos, metodologia e riscos.
Os critérios de inclusão foram: idade maior de 18 anos e diagnóstico clínico, laboratorial e anatomopatológico confirmado de síndrome de Sjögren; e que tolerassem a realização a videolaringoscopia rígida ou flexível.
Os fatores de exclusão foram: tabagismo; etilismo; rinossinusite alérgica ou infecciosa em atividade; exposição a químicos inalatórios abrasivos; e doenças pulmonares crônicas. Todos estes fatores citados causam processo inflamatório na mucosa respiratória, podendo mimetizar as alterações macroscópicas laríngeas e faríngeas encontradas no RLF.30,31
Além disso, também foram excluídos pacientes incapazes de produzir volume salivar suficiente para coleta e análise. Os indivíduos em uso de drogas que sabidamente poderiam alterar o fluxo salivar e secreções gástricas, como diuréticos, anti-histamínicos, inibidores da bomba de prótons, prócinéticos, antiácidos, drogas inalatórias para asma, neurolépticos, psicotrópicos e salivas artificiais, foram excluídos.32
Optou-se também por excluir indivíduos submetidos a cirurgias de glândulas salivares ou do sistema digestório; sujeitos com lesões pré-neoplásicas ou neoplásicas da laringe, faringe, esôfago, estômago e duodeno (presentes ou previamente tratadas); e indivíduos submetidos à radioterapia prévia, para evitar outros possíveis vieses metodológicos.17,33 Todos os indivíduos foram avaliados pelo mesmo médico experiente na realização e interpretação de exames de laringoscopia.
O grupo controle das 11 mulheres saudáveis voluntárias sem síndrome de Sjögren e sem DRGE ou RLF foi igualmente estudado, respeitando os mesmos critérios de exclusão expostos anteriormente.
Todos os indivíduos estudados foram submetidos à anamnese dirigida e a exame físico otorrinolaringológico, com mensuração do peso e altura para cálculo do índice de massa corpórea (IMC, expresso em Kg/m2). Além disso, os pacientes do grupo estudo foram ainda subdivididos em dois grupos quanto ao uso crônico de medicamentos potencialmente agressivos à mucosa do esôfago e estômago e que podem ser frequentemente utilizados por indivíduos com SS, tais como anti-inflamatórios não-hormonais, metotrexate, cloroquina e alendronato. Essa informação foi utilizada para verificar a influência do abuso destas substâncias com a ocorrência de DRGE e RLF na casuística estudada.
A seguir, os pacientes foram submetidos a um questionário sobre sintomas sugestivos de refluxo laringofaríngeo, denominado Reflux Symptom Index34 (RSI) ou Índice de Sintomas de Refluxo (ISR). Instrumento já validado para a língua inglesa, e em processo de validação em nosso país, o RSI é um escore de pontos em que valores superiores a 13 indicam a presença do RLF com 95% de acurácia.34
Os pacientes foram submetidos à videolaringoscopia com laringoscópio de 10 mm e 70º (marca Storz, modelo Precision SN – 29052 – Alemanha) acoplado a sistema de vídeo (marca Toshiba, modelo IK – CU44A – Japão, gravador de DVD marca LG, modelo tri-system – Brasil e monitor marca LG, modelo tri-system Cinemaster – Brasil). Foi utilizado o nasofibrolaringoscópio flexível de 3,4 mm de diâmetro (marca Fujinon, modelo EPX 2200 processor – monitor color LCD – Japão) somente nos casos de reflexo nauseoso exacerbado ou incapacidade de visualização do segmento laringofaríngeo pelo método de telescopia. Todos os exames foram registrados e armazenados em mídia de DVD (marca LG). Não foi utilizado qualquer tipo de anestésico tópico durante avaliação endoscópica da laringe.
A presença e gravidade dos sinais sugestivos de refluxo laringofaríngeo foi estabelecida através da aplicação de um sistema de pontuação de sinais inflamatórios endoscópicos endolaríngeos denominado Reflux Finding Score (RFS)35 ou Escala de Achados Videolaringoscópicos de Refluxo (EVAR).36 Da mesma forma que o RSI,34 o RFS35 já foi validado para a língua inglesa e encontra-se em processo de validação em nosso meio.36 Segundo este instrumento, valores de RFS superiores a sete sugerem a presença de RLF com 95% de acurácia.35,36
Para manter o rigor científico do projeto, além da utilização dos dois instrumentos clínicos para diagnóstico de refluxo laringofaríngeo descritos acima (RSI e RFS), os pacientes foram submetidos a exame complementar para a comprovação da DRGE e do RLF (Endoscopia Digestiva Alta – Fujinon® série 2200, 9,8 mm diâmetro, Japão – e/ou manometria/pH-metria esofágica de 24 horas de duplo canal – Alacer Biomedical São Paulo, Brasil).17,30,34,35,37,38 A presença de esofagite erosiva em indivíduos com RSI e RFS sugestivos de refluxo confirmou o diagnóstico da DRGE/RLF.17,30 Os
pacientes sem a confirmação endoscópica da DRGE foram então submetidos à pHmetria esofágica de 24 horas de duplo canal precedida de manometria esofágica para localização dos esfíncter esofagiano inferior.17,39,40 Considerou-se refluxo patológico proximal qualquer episódio de queda do pH no sensor proximal a valores inferiores a quatro, precedidos de evento de mesma magnitude no sensor distal, independentemente de sua duração.37,41 Para determinação do refluxo patológico distal, foram considerados igualmente eventos de queda do pH no sensor distal a valores inferiores a quatro, seguindo os critérios descritos por Demeester et al.42 e de acordo com os parâmetros de tempo total de exposição ácida definido por Jamieson et al.43
Foram considerados positivos para RLF casos com pHmetria que apresentassem refluxo patológico proximal, isolado ou associado a refluxo patológico distal.17,30,40,44
Processamento e análise salivar
A coleta de saliva foi realizada sempre no período da manhã após jejum de 8 horas, para respeitar o ritmo circadiano de produção salivar. O paciente foi orientado a não escovar os dentes ou fazer uso de colutórios na manhã da coleta da saliva. No momento da coleta, o paciente foi instruído a realizar bochecho com água corrente à vontade, sem deglutir, para reduzir o excesso de descamação celular presente na cavidade oral.
Duas amostras consecutivas de saliva total foram obtidas de cada participante: a primeira, de saliva não estimulada (denominada como saliva basal), e a segunda, de saliva estimulada pela mastigação de fragmento de 25cm2 de parafilm M®(Pechiney Plastic Packing Chicago, IL, EUA), denominada saliva estimulada.5,16,45
As amostras de saliva basal e estimulada foram coletadas solicitando ao paciente cuspir à vontade, em um frasco coletor universal, todo volume salivar produzido durante o período de 10 minutos. O paciente foi orientado a não escarrar ou puxar secreção da nasofaringe durante o período da coleta, a fim de não contaminar o material com secreções que não fossem salivares.17,18 Foi solicitado ao paciente permanecer igualmente em silêncio durante o período da coleta, para não haver interferência na demanda salivar.
O processamento da saliva foi feito no mesmo período da coleta por meio de centrifugação, durante 10 minutos (3500 rpm – centrífuga Excelsa II – Fanen – Brasil), condições necessárias para sedimentação dos debris e restos celulares. O sobrenadante foi separado com uso de pipetas para a mensuração do volume e da concentração de TGF-α, seguindo protocolo estabelecido por Eckley para mensuração da concentração de fatores salivares.5,30
As amostras foram posteriormente armazenadas e mantidas em temperatura de –20º C até o momento da análise final da concentração salivar do TGF-α, que foi realizado pelo método de ELISA sanduíche com utilização de kit comercial disponível (Quantikine®, R&D Systems Inc., EUA). As etapas do método foram realizadas a partir das orientações do produtor, descritas no respectivo manual de instruções.46
Um anticorpo monoclonal específico para o TGF-α havia sido previamente aderido a poços de uma microplaca fornecida pelo produtor. Soluções-padrão fornecidas e soluções diluídas das amostras foram pipetadas nos poços e incubadas, para que as moléculas de TGF-α aderissem ao anticorpo imobilizado nas microplacas. Após lavagens recorrentes, moléculas com ligações fracas aos anticorpos específicos foram eliminadas, e foi adicionado à solução anticorpo policlonal específico para TGF-α respectivamente ligado a uma enzima. Após novas lavagens, foi adicionado substrato para a ação desta enzima e para que ocorresse desenvolvimento de coloração na solução, em proporção à quantidade de TGF-α respectivamente aderida aos poços no início do processamento. A reação foi então interrompida pela adição de substrato específico, e a concentração de TGF-α de cada amostra foi determinada com base na densidade óptica das soluções, registrada através de espectofotometria. Esta concentração foi estabelecida em função da concentração geral de proteínas salivares presentes na amostra, independentemente do volume salivar total, através da comparação com densidades ópticas de soluções-padrão com concentrações previamente conhecidas, e expressa em picogramas por mililitros (pg/mL).
Os pacientes com SS foram posteriormente subdivididos em dois grupos, de acordo com a gravidade da hipossalivação apresentada, e comparados entre si com relação à concentração salivar de TGF-α. No total, quatro pacientes apresentaram hipossalivação leve (volume salivar basal entre 1 e 3 mL e/ou volume salivar estimulado entre 7 e 15 mL), e oito pacientes apresentaram hipossalivação grave (volume salivar basal inferior a 1mL e/ou volume salivar estimulado inferior a 7 mL).25,45,47
Estes pacientes com SS foram ainda subdivididos em outros dois grupos, de acordo com a presença de esofagite erosiva na EDA (presente em cinco casos e ausente em sete). Os dois subgrupos foram posteriormente comparados entre si, a partir da concentração salivar de TGF-α.
A análise estatística foi realizada com o programa EPI-Info 7 (CDC – Atlanta – EUA) e Statistical Package for the Social Sciences – SPSS – versão 13 para Windows®. Foram calculadas medidas resumo para as variáveis quantitativas. Para as variáveis qualitativas foram calculadas frequências absolutas e relativas. Foram adotados métodos estatísticos paramétricos e não paramétricos para análise das variáveis (teste t Student e teste de Mann-Whitney). O nível de significância estatística adotado para todas as análises foi de 5%.
Resultados
O grupo estudo foi formado por 12 indivíduos com diagnóstico de SS, com média de idade de 56,25 anos ± 8,6, sendo todos do sexo feminino. Dentre eles, cinco indivíduos apresentaram diagnóstico de SS primário, e sete de SS secundário, sendo quatro casos associados a lúpus eritematoso sistêmico (LES), dois à artrite reumatoide (AR), e um caso com a associação AR + LES. Para caracterizar o grupo estudo, foi obtido também o tempo médio do diagnóstico da síndrome de Sjögren quando da inclusão do sujeito na presente pesquisa. Esta média foi de 5,3 ± 2,2 anos. Ainda para o grupo estudo, a pontuação média do RSI foi de 22,8 ± 6,56 pontos, e do RFS foi de 13,3 ± 1,7 pontos.
O grupo controle foi composto por 11 mulheres voluntárias saudáveis, com idade média de 56,1 ± 12,7 anos e sem sintomas de DRGE/RLF ou sinais videolaringoscópicos de RLF. O RSI médio foi de 4,2 ± 3,8 pontos, e o RFS médio foi de 3,4 ± 1,9.
O diagnóstico do refluxo laringofaríngeo foi inicialmente firmado nos 12 indivíduos com síndrome de Sjögren através da aplicação dos escores RSI e RFS (todos positivos para RLF). Em cinco pacientes, o diagnóstico foi posteriormente corroborado por EDA com esofagite erosiva, sendo que em sete indivíduos foi confirmado pela presença de refluxo patológico no sensor proximal durante realização de pHmetria esofágica de 24 horas com duplo sensor. Além disso, oito destes 12 pacientes analisados também apresentaram a forma clássica da doença do refluxo gastroesofágico (os cinco casos com esofagite erosiva à EDA assinalados acima associados com três outros casos em que a pH-metria esofágica apresentou concomitância de refluxo patológico distal).
Com relação ao IMC, o grupo estudo apresentou média de 26,2±4,2 kg/m2, estatisticamente semelhante à do grupo controle (27,2 ± 4,1 kg/m2) (Mann-Whitney; p = 0,806).
Dentre os 12 pacientes com SS analisados, oito apresentaram uso crônico de drogas potencialmente agressivas à mucosa digestória. Apesar disso, cinco desses oito casos não apresentaram alterações durante a EDA (teste exato de Fisher; p = 1).
Não houve diferença estatisticamente significante entre os dois grupos analisados quanto à idade dos indivíduos analisados (Mann-Whitney; p = 0,82), ou quanto ao sexo (todas eram mulheres), o que tornou os grupos comparáveis entre si. Por sua vez, os grupos estudo e controle foram estatisticamente distintos quando analisados os escores RSI e RFS (Anova com p < 0,001 para ambas variáveis).
O volume salivar basal do grupo estudo (1,6 mL ± 1,62) foi significativamente menor do que o do grupo controle (2,6 mL ± 1,44). (Mann-Whitney, p = 0,03). Além disso, o volume salivar estimulado do grupo estudo (6,7 mL ± 5,54) também foi significativamente menor que do grupo controle (9,9 mL ± 7,29) (Mann-Whitney, p = 0,09).
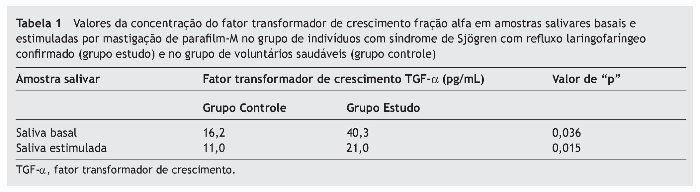
A concentração de TGF-α na saliva basal foi significativamente maior no grupo estudo (40,3 pg/mL ± 40,87) em relação ao grupo controle (16,2 pg/mL ± 6,59) (Mann-Whitney, p = 0,036). O mesmo foi observado na concentração de TGF-α na saliva estimulada no grupo estudo (21,0 pg/mL ± 20,83) em relação ao grupo controle (11,0 pg/m ± 1,92) (Mann-Whitney, p = 0,015) (tabela 1).
Ao comparar o grupo controle separadamente com os cinco casos com esofagite erosiva, foi observado que as médias de TGF-α da saliva basal e estimulada deste grupo estudo com esofagite erosiva (31,2 e 11,8 pg/mL, respectivamente) foram estatisticamente semelhantes às do grupo controle (16,2 e 11,0 pg/mL, respectivamente) (Mann-Whitney, p = 0,395 para saliva basal e p = 0,335 para saliva estimulada).
No entanto, ao comparar o grupo controle separadamente com os sete casos sem esofagite erosiva, observou-se que as médias de TGF-α da saliva basal e estimulada deste grupo estudo sem esofagite erosiva (46,7 e 23,5 pg/mL) foram estatisticamente maiores do que as do grupo controle (16,2 e 11,0 pg/mL) (Mann-Whitney, p = 0,016 para saliva basal e p = 0,005 para saliva estimulada).
No grupo com hipossalivação leve, a concentração média de TGF-α na saliva basal foi 13,5 ± 3,34 pg/mL, enquanto que na saliva estimulada foi de 11,4 ± 1,84 pg/mL. Quando analisado o grupo com hipossalivação grave, os valores de TGF-α encontrados na amostra basal e estimulada foram, respectivamente, 53,7 ± 44,8 e 25,7 ± 24,5 pg/mL.
A concentração salivar de TGF- α do grupo com hipossalivação grave foi estatisticamente maior nas amostras basal (Mann-Whitney; p = 0,007) e estimulada (Mann-Whitney; p = 0,089), quando comparada ao grupo com hipossalivação leve.
Discussão
A elevada prevalência de DRGE e RLF em sujeitos com SS já havia sido descrita anteriormente pelo atual grupo de pesquisa em artigo publicado em 2012.30 Naquela ocasião, a presença do RLF foi observada em 100% dos indivíduos de um grupo com 19 adultos com SS.30 A casuística utilizada no presente estudo foi inédita e contou com 12 novos sujeitos com SS, todos apresentando RLF (oito deles também apresentaram DRGE), confirmando elevada frequência da associação em subpopulações com SS.
No presente estudo, a presença de DRGE não se mostrou influenciada pelo IMC, tampouco pelo uso crônico de medicações potencialmente agressivas à mucosa do esôfago e do estômago, sugerindo que a DRGE em indivíduos com SS aparentemente não está influenciada pelos mesmos fatores de risco classicamente relacionados à DRGE da população geral sem xerostomia.
A pesquisa da concentração do TGF- α na saliva foi motivada pela reconhecida importância que este fator de crescimento possui na homeostase do sistema digestório, tanto por meio de seus efeitos cicatrizante e indutor de neoangiogênese quanto por sua ação inibitória frente à secreção gástrica.5,14,48 Além disso, não há dados na literatura que analisem as concentrações de TGF-α salivar de indivíduos com RLF, muito menos que cruzem estas informações em população exclusiva de pacientes com SS.
Sabe-se que o conteúdo proteico é adicionado à saliva ao nível dos ácinos das glândulas salivares.6,49 No entanto, não se sabe se haveria uma diferença da taxa de excreção salivar do TGF-α de acordo com o tipo glandular salivar examinado. A análise exclusiva da saliva basal avaliaria principalmente a contribuição das glândulas submandibulares ao conteúdo total examinado, enquanto que amostras estimuladas refletiriam contribuição maior das parótidas.6 Dessa forma, optou-se pela coleta de amostras salivares basal e estimulada para obter representação mais fidedigna da produção salivar global dos sujeitos estudados.
Com relação aos resultados obtidos, de fato, a concentração salivar de TGF-α nos sujeitos com SS foi significativamente maior que no grupo controle, tanto para amostra salivar basal quanto para amostra estimulada.
Sabendo da função essencial do TGF-α em estimular cicatrização tecidual, os achados de aumento de sua concentração salivar nos sujeitos com SS e RLF sugerem que este fator de crescimento pode participar na primeira linha de defesa na resposta do organismo frente à agressão da DRGE/ RLF, sugerindo ainda que sua produção local representa papel significante na restituição da mucosa laríngea e faríngea no reparo pós-lesão.
Não foram encontradas publicações que abordassem as concentrações salivares de TGFα e sua possível participação na gênese da manifestação supraesofágica da DRGE. Quando analisados, porém, os poucos estudos dedicados à participação deste fator de crescimento na homeostase do sistema digestório, os resultados observados na presente análise concordam com os publicados por Polk e colaboradores, que relataram haver um aumento da produção de TGF-α em resposta à agressão gástrica aguda com HCl.50 Achado semelhante foi observado por Fujiwara et al., quando analisaram ratos com esofagite de refluxo crônica.15
Segundo estes autores, a ativação do TGF-α em resposta ao refluxo esofágico patológico pode facilitar a cura da mucosa por estimular a proliferação epitelial.15
No estudo atual, ao subdividir o grupo de indivíduos com SS segundo o grau de hipossalivação, o objetivo foi analisar a influência dos estágios mais avançados de disfunção acinar na capacidade de produção salivar do TGF-α e, consequentemente, na capacidade de defesa da mucosa laringofaríngea e digestória.
Os sujeitos com hipossalivação grave apresentaram concentrações maiores de TGF-α, reforçando que este fator de crescimento faz parte de um mecanismo de defesa compensatório. Dessa forma, estágios mais avançados de disfunção salivar tentam suprir qualitativamente a deficiência quantitativa do volume salivar produzido.
Considerados apenas os pacientes do grupo estudo com RLF que apresentaram esofagite erosiva, foi observado que não existe diferença nas concentrações salivares basal e estimulada de TGF-α quando comparado ao grupo controle. Por outro lado, o subgrupo sem esofagite respondeu à agressão com concentração significativamente maior de TGF-α nas amostras basal e estimulada em relação ao grupo controle.
Admitindo que a presença de esofagite erosiva à EDA configura uma complicação decorrente de maior gravidade da DRGE/RLF, o exposto acima sugere que o subgrupo com esofagite apresenta uma dificuldade intrínseca em incrementar a produção e/ou secreção do TGF-α salivar necessária para evitar o surgimento da referida complicação. Supõe-se, então, que, no presente estudo, a capacidade dos sujeitos com SS estudados em responder à agressão da DRGE/RLF com maior concentração salivar de TGF-α evitou a instalação da esofagite erosiva.
Dessa forma, é possível pensar na hipótese de que a resposta de um indivíduo com xerostomia à presença da DRGE/ RLF seria o aumento de TGF-α salivar, para, compensatoriamente, evitar a progressão da doença. Os casos em que este aumento fosse insuficiente apresentariam complicações, como a esofagite erosiva.
Na casuística analisada durante um período de três anos não foram encontrados pacientes com SS sem DRGE/ RLF. Postula-se que a determinação da concentração de TGF-α salivar em um subgrupo de SS sem DRGE/RLF, e sua comparação com grupo de SS com DRGE/RLF, possa ser esclarecedora para desvendar a participação deste fator salivar no equilíbrio bioquímico do sistema digestório. Dada a raridade da SS, estudos multicêntricos mostramse necessários para aumentar a representatividade dos achados e para comprovar as hipóteses científicas apresentadas.
Se confirmados em estudos futuros, os resultados obtidos podem potencialmente desempenhar relevância clínica significante no manejo dos indivíduos com SS. Poderia a mensuração das concentrações salivares de TGF-α predizer grupos de sujeitos com SS que apresentariam modalidades mais graves da DRGE/RLF, e, dessa forma, que inspirariam cuidados mais intensivos.
Os achados encontrados alertam para o fato de que a etiologia das manifestações supraesofágicas da DRGE ainda não é totalmente conhecida, principalmente quando levase em consideração um grupo tão exclusivo de indivíduos com SS.
Conclusão
No presente estudo, a concentração do fator transformador de crescimento alfa (TGF-α) foi estatisticamente maior nas amostras salivares basal e estimulada de indivíduos com síndrome de Sjögren e refluxo laringofaríngeo, quando comparadas às respectivas amostras de controles saudáveis.
Financiamento
Este estudo foi financiado pelo CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico) (grant # 147627/2-10-9).
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 8 de abril de 2013;
aceito em 24 de maio de 2014
☆Como citar este artigo: Corvo MA, Eckley CA, Rizzo LV, Sardinha LR, Rodriguez TN, Bussoloti Filho I. Salivary transforming growth factor alpha in patients with Sjögren’s syndrome and reflux laryngitis. Braz J Otorhinolaryngol. 2014;80:462-9.
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2014.08.006
* Autor para correspondência.
E-mail:marcoantoniocorvo@hotmail.com (M.A.A. Corvo).