Temporal bone paragangliomas (TBPs) are benign tumors arising from neural crest cells located along the jugular bulbus and the tympanic plexus. In general surgical excision, radiotherapy and wait‐and‐scan protocols are the main management modalities for TBPs.
ObjectiveIn this paper we aim to present our clinical experience with TBPs and to review literature data.
MethodsThe patients who were operated for tympanomastoid paraganglioma (TMP) or tympanojugular paraganglioma (TJP) in our clinic in the last 15 years were enrolled in the study. A detailed patient's charts review was performed retrospectively.
ResultsThere were 18 (52.9%) cases with TMPs and 16 (47.1%) cases with TJPs, a total of 34 patients operated for TBPs in this time period. The mean age was 50.3± 11.7 (range 25–71 years). The most common presenting symptoms were tinnitus and hearing loss for both TMPs and TJPs. Gross total tumor resection was achieved in 17 (94.4%) and 10 (62.5%) cases for TMPs and TJPs, respectively. Five patients (31.2%) with TJP experienced facial palsy following the operation. For all the patients the mean follow‐up period was 25.8 months (range 4–108 months).
ConclusionIn conclusion, based on our findings and literature review, total surgical excision alone or with preoperative embolization is the main treatment modality for TBPs. However radiotherapy, observation protocol and subtotal resection must be considered in cases of preoperative functioning cranial nerves, large tumors and advanced age.
Paragangliomas do osso temporal (POT) são tumores benignos derivados de células da crista neural localizados ao longo do bulbo jugular e do plexo timpânico. Em geral, a excisão cirúrgica, a radioterapia e os protocolos de acompanhamento com estudos por imagem são as principais modalidades de conduta para o POT.
ObjetivoApresentar nossa experiência clínica com POT e revisar os dados da literatura.
MétodoOs pacientes que foram submetidos a cirurgia para paraganglioma timpanomastoideo (PTM) ou paraganglioma timpanojugular (PTJ) em nossa clínica nos últimos 15 anos foram incluídos no estudo. Realizou-se retrospectivamente uma revisão detalhada dos prontuários dos pacientes.
ResultadosHouve 18 (52,9%) casos com PTM e 16 (47,1%) com PTJ, portanto, um total de 34 pacientes operados para POT nesse período. A idade média foi de 50,3±11,7 (intervalo de 25‐71 anos). Os sinais e sintomas de apresentação mais comuns foram o zumbido e perda auditiva, tanto para PTM quanto para PTJ. A ressecção tumoral completa foi obtida em 17 (94,4%) e 10 (62,5%) casos para PTM e PTJ, respectivamente. Cinco pacientes (31,2%) com PTJ apresentaram paralisia facial decorrente da cirurgia. Para todos os pacientes o tempo médio de seguimento foi de 25,8 meses (intervalo 4‐108).
ConclusãoCom base nos nossos dados e na revisão da literatura, a excisão cirúrgica total isolada ou com embolização pré‐operatória é a principal modalidade de tratamento para POT. No entanto, a radioterapia, o protocolo de observação e a ressecção subtotal devem ser considerados no caso de nervos cranianos funcionais no pré‐operatório, grandes tumores e idade avançada.
Paragangliomas (PG) são tumores benignos que surgem das células da crista neural localizadas em grandes estruturas neurovasculares.1,2 Paragangliomas de cabeça e pescoço também são chamados de tumores glômicos. Em ordem de incidência, paraganglioma de corpo carotídeo (60%), jugular (23%), vagal (13%) e timpânico (6%) são os mais comuns na região da cabeça e do pescoço.3,4 Outros locais de origem menos comuns na cabeça e no pescoço incluem as regiões laríngea, nasal, orbitária e paranasal.3–5 A maioria dos PG na região da cabeça e do pescoço não são funcionais, uma vez que não secretam catecolamina.6 “Glomus” é na verdade um termo impreciso frequentemente usado para definir paragangliomas. Portanto, paraganglioma timpanomastoideo (PTM) e paraganglioma timpanojugular (PTJ) correspondem à terminologia mais precisa, em vez de glomus timpânico e glomus jugular, respectivamente.7 PTM e PTJ são classificados em conjunto com os paragangliomas ósseos temporais (POT). Em geral, a incidência de POT é de 1/1.000.000 por ano e são comumente unilaterais, apresentam padrão esporádico.8,9 No entanto, vários PG, inclusive POT, tendem a ser variedades herodofamiliares e representam cerca de 10% dos casos.10 POT podem se apresentar clinicamente com sintomas como zumbido, perda auditiva, otorreia, paralisia facial, disfagia e disfonia.11 Em geral, a excisão cirúrgica total/subtotal, a radioterapia de feixe externo convencional em doses fracionadas ou a radioterapia estereotáxica (RTE) e os protocolos de acompanhamento com exames tomográficos são as principais modalidades de conduta para os POT.11 O objetivo deste estudo foi apresentar nossa experiência clínica com POT em pacientes operados em nossa clínica e comparar esses achados com dados da literatura.
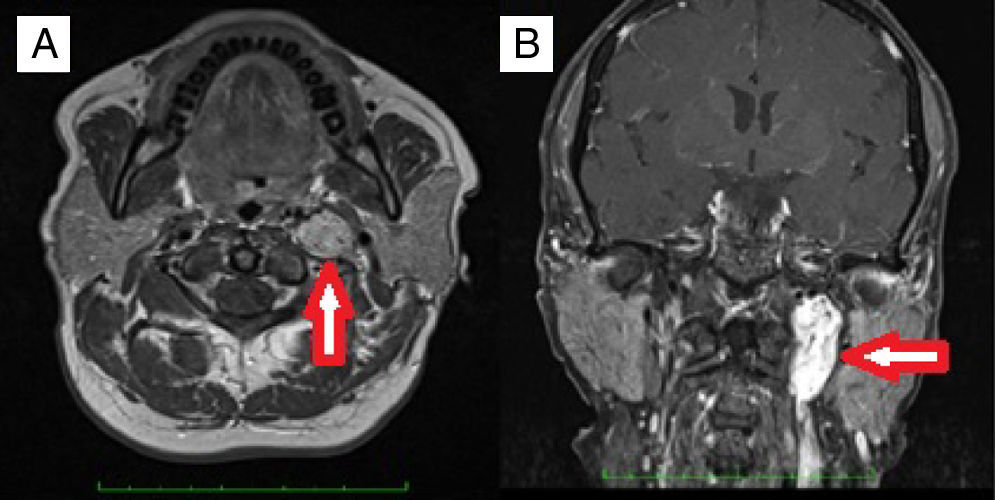
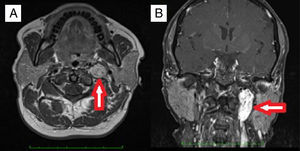
MétodoDesenho do estudoEste estudo foi feito no Departamento de Otorrinolaringologia da Faculdade de Medicina da Universidade Gazi. O estudo foi aprovado pelo Comitê de Ética da universidade (12.01.2016 edital número 16). Foram analisados retrospectivamente os prontuários de pacientes submetidos à cirurgia com diagnóstico de paragangliomas ósseos temporais (PTM e PTJ) entre 2000 e 2015. Os pacientes tratados apenas com RTE ou protocolos de acompanhamento com exames de imagem não foram incluídos. O outro critério de exclusão foi a falta de um diagnóstico histopatológico definitivo. O exame otorrinolaringológico foi feito em todos os pacientes. O sistema de classificação House‐Brackmann (HB) foi usado para determinar a função do nervo facial.12 A ressonância magnética (RM) foi rotineiramente feita antes da cirurgia (fig. 1). A classificação de Fisch13,14 foi usada para o estadiamento dos tumores. A angiografia de subtração digital (ASD) foi feita para diagnóstico diferencial ou embolização pré‐operatória. Para a embolização foram usadas partículas de APV (álcool polivinílico). Os níveis de catecolamina no sangue e na urina não foram rotineiramente analisados. O exame audiométrico foi feito por audiometria tonal. Todas as cirurgias foram feitas sob anestesia geral. Suspensão de eritrócitos (SE) foi preparada antes da cirurgia. Para os PTM foram feitas timpanomastoidectomia simples ou radical modificada (MRM) por incisão retroauricular, enquanto o procedimento pela via da fossa infratemporal tipo A (ITFA‐A) foi usado para PTJ (fig. 2). Todos os pacientes foram submetidos à ressonância magnética durante o seguimento para excluir qualquer recorrência de tumor ou para verificar o tamanho do tumor residual, se existente. As características demográficas, os sintomas e sinais, os achados radiológicos, as técnicas operatórias, as complicações e os dados de acompanhamento foram todos revisados em detalhes.
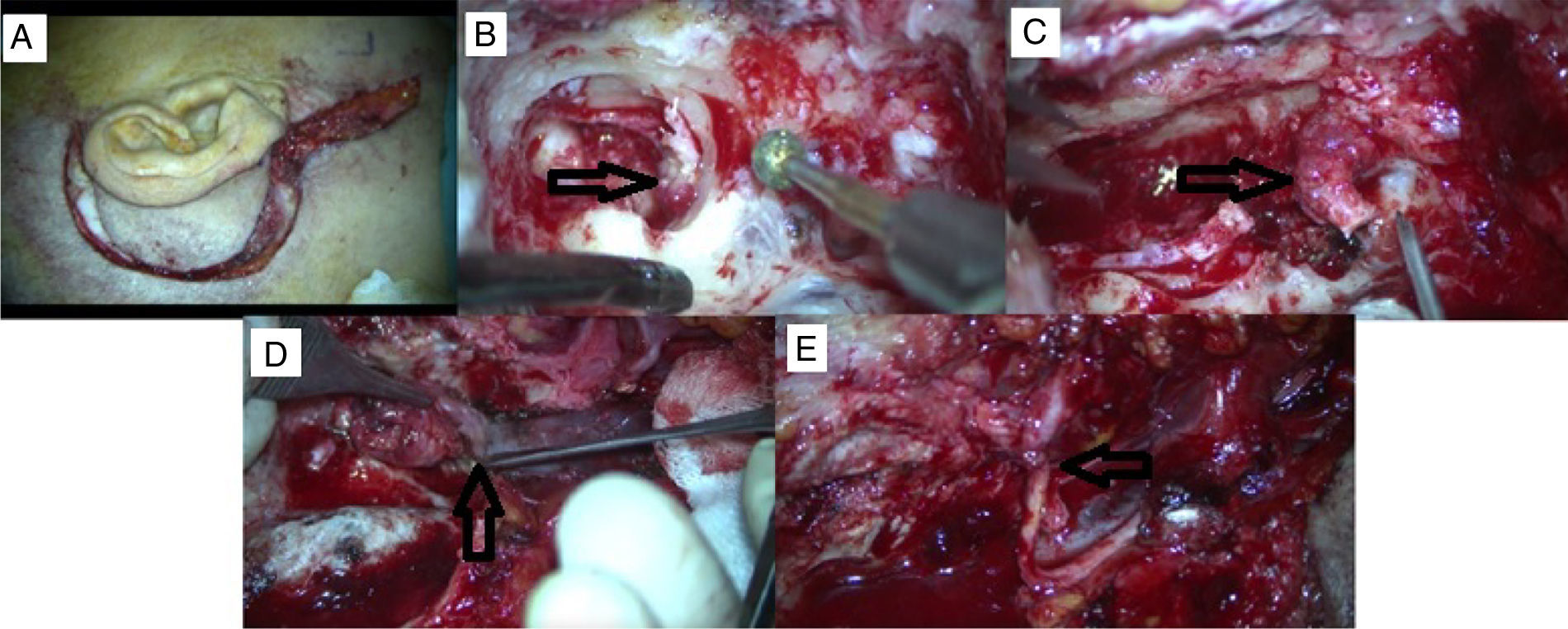
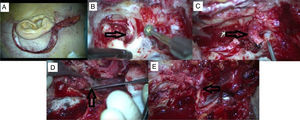
Um caso de PTJ apresentou paralisia do nervo facial HB grau 5 e foi submetido à excisão tumoral total bruta via abordagem IFTA‐A após embolização pré‐operatória. A, incisão pós‐auricular com extensão cervical. B, a extensão do tumor é observada no hipotímpano durante a mastoidectomia. C, o nervo facial é sacrificado, o qual se encontra invadido pelo tumor na região do forâmen estilomastoideo. D, tumor originário do bulbo jugular. E, anastomose de NC 7‐12.
Todos os espécimes histopatológicos foram analisados por microscopia óptica e os arranjos característicos dos agrupamentos de células principais (Zellballen) foram examinados. Anticorpos contra cromogranina, sinaptofisina e proteína S‐100 foram rotineiramente usados na análise imuno‐histoquímica.
Análise estatísticaFoi feita com o software estatístico SPSS, versão 20.0 (Chicago, Illinois). As estatísticas descritivas foram apresentadas como média±desvio padrão (DP). As variáveis contínuas foram testadas pelo teste de Kolmogorov‐Smirnov, histogramas e teste P‐P para normalidade. O teste qui‐quadrado de Pearson foi usado para comparar as variáveis nominais. Os parâmetros numéricos foram comparados pelo teste de postos com sinais de Wilcoxon. Em todos os testes, p<0,05 foi considerado estatisticamente significativo.
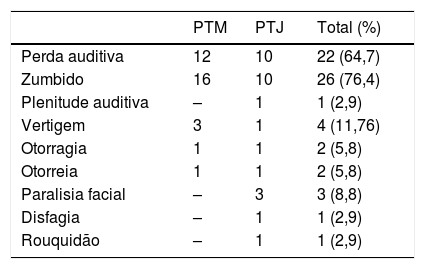
ResultadosForam operados 34 pacientes com PTB em nossa clínica nos últimos 15 anos. Desses, 18 (52,9%) apresentavam PTM e os restantes 16 (47,1%) PTJ. A idade média foi de 50,26±11,65 anos (intervalo de 25‐71). A proporção do sexo feminino/masculino foi de 1,8:1 (22 do sexo feminino e 12 do masculino). Particularmente em relação aos casos de PTM e PTJ, a relação sexo feminino/masculino foi de 2,6:1 e 1,2:1 respectivamente. O tumor estava localizado no lado direito em 16 (47,1%) casos e no esquerdo nos restantes 18 (52,9%). Múltiplos paragangliomas foram observados em dois casos com PTM (5,8%). Um dos pacientes apresentava PTM e paragangliomas de corpo carotídeo bilateralmente. Nesse caso, a investigação em relação à presença de mutação genética mostrou uma mutação de sucinato desidrogenase (SDH). Os parentes de primeiro grau também foram examinados quanto à presença de tumores glômicos com exame clínico e de imagem. Não foi observada penetrância familiar. O segundo caso apresentava um PTM no lado direito e um paraganglioma de corpo carotídeo no lado esquerdo. Os sintomas apresentados são mostrados na tabela 1. O sintoma e o sinal de apresentação mais comum foram zumbido e perda auditiva tanto para PTM quanto para PTJ. Paralisia facial, disfagia e sintomas de rouquidão só foram observados em pacientes com PTJ. Os níveis de catecolaminas foram analisados em três pacientes com PTJ e em um caso de PTM com paraganglioma múltiplo. Não encontramos níveis elevados de catecolaminas em amostras de plasma ou urina.
Sintomas de apresentação para os paragangliomas do osso temporal
| PTM | PTJ | Total (%) | |
|---|---|---|---|
| Perda auditiva | 12 | 10 | 22 (64,7) |
| Zumbido | 16 | 10 | 26 (76,4) |
| Plenitude auditiva | – | 1 | 1 (2,9) |
| Vertigem | 3 | 1 | 4 (11,76) |
| Otorragia | 1 | 1 | 2 (5,8) |
| Otorreia | 1 | 1 | 2 (5,8) |
| Paralisia facial | – | 3 | 3 (8,8) |
| Disfagia | – | 1 | 1 (2,9) |
| Rouquidão | – | 1 | 1 (2,9) |
Os limiares auditivos médios para condução óssea e aérea feitos com audiometria tonal foram de 19,28±11,84 e 39,52,39±21,34dB, respectivamente. Portanto, o gap aéreo‐ósseo médio no lado afetado foi de 19,44±14,52dB (variação 0‐43). Em particular, os gaps aéreos‐ósseos médios para PTM e PTJ foram de 16,59±14,77 (intervalo 0‐40) e 25,50±12,73 (intervalo 0‐43), respectivamente (p=0,219).
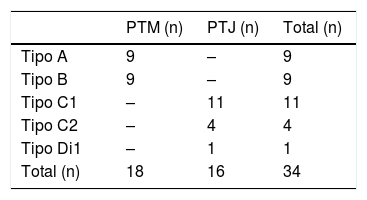
Características do tumorO envolvimento tumoral foi classificado como Fisch tipo A em nove (50%) casos e Fisch tipo B (50%) nos outros nove casos de PTM. Os tumores PTJ foram classificados como C1, C2 e Di1 para 11, quatro e um caso, respectivamente, como mostrado na tabela 2. O tamanho médio máximo do tumor no plano axial para PTM e PTJ foi de 11,23±5,23mm (intervalo 5‐23) e 30,20±10mm (intervalo 15‐70), respectivamente (p=0,001). A angiografia de subtração digital foi feita de maneira total em 15 casos (46,87%). Em particular, foi feita para nove (50,0%) casos com PTM e sete (50,0%) com PTJ. Os vasos aferentes identificados com a angiografia estão listados na tabela 3. Em alguns casos havia mais de um vaso aferente. No entanto, em quatro casos com PTM não houve identificação de qualquer vaso aferente. Em um caso com PTM o tumor localizado na cavidade timpânica não foi observado na arteriografia. As artérias aferentes mais comuns nos PTM e PTJ foram a artéria auricular posterior e a artéria occipital, respectivamente. A embolização completa foi feita em oito (23,5%) casos.
Vasos aferentes identificados com ASD
| PTM (n) | PTJ (n) | Total (n) | |
|---|---|---|---|
| Artéria faríngea ascendente | 2 | 3 | 5 |
| Artéria occipital | 2 | 6 | 8 |
| Artéria auricular posterior | 4 | 4 | 8 |
| Artéria meníngea média | – | 1 | 1 |
| Total (n) | 8 | 14 | 22 |
ASD, angiografia por subtração digital.
Em qualquer um dos casos, o tumor pode ter mais de um vaso aferente.
A excisão total do tumor foi alcançada em quase todos os casos (17/18; 94,4%) de PTM. Quatro casos foram operados por timpanomastoidectomia aberta. Nos oito casos restantes, dois foram operados via transcanal e seis foram operados por timpanomastoidectomia+timpanotomia posterior. No entanto, a excisão completa foi obtida em apenas oito casos (8/16 50,0%) para PTJ (p=0,003). Excisão completa foi obtida em cinco (80%) casos de seis de PTJ que haviam sido submetidos a embolização pré‐operatória. No entanto, excisão completa foi obtida em três (30%) casos entre 10 pacientes que não haviam sido submetidos a embolização pré‐operatória (p=0,039) (tabela 4). Dos oito casos com ressecção tumoral subtotal, cinco (62,5) receberam radioterapia estereotáxica devido ao crescimento do tumor durante o seguimento. Todos os casos restantes estão sob controle, sem evidências de aumento no tamanho do tumor na RM de controle. Para todos os pacientes, o seguimento médio foi de 25,8 (intervalo 4‐108) meses. Em particular, o seguimento médio foi de 40,1 (intervalo: 10‐108) e 10,2 (intervalo: 1‐26) meses para PTJ e PTM, respectivamente.
Informações detalhadas de pacientes com PTJ
| N | Gênero | Idade | EP | Apresentação/complicações/manejo | Cirurgia | Recorrência/crescimento tumor | RTE | Seguimento/meses |
|---|---|---|---|---|---|---|---|---|
| 1 | M | 60 | Sim | Apresentou paralisia facial HB grau 5 | Total | Não | – | 10 |
| Nervo facial sacrificado/NC 7‐12 anastomose‐implante de peso de ouro na pálpebra superior | ||||||||
| 2 | F | 48 | Sim | Nenhum | Subtotal | Não | Não | 13 |
| 3 | F | 51 | Sim | Caso de revisão | Total | Não | – | 15 |
| Apresentou paralisia facial HB grau 4 | ||||||||
| Perda auditiva, otalgia, vazamento de LCR/acetazolamida | ||||||||
| 4 | F | 55 | Sim | Recuperação com HB grau 2 em 1 ano de pós‐operatório | Total | Não | – | 18 |
| 5 | M | 49 | Sim | Nenhum | Total | Não | – | 24 |
| 6 | F | 58 | Não | Nenhum | Subtotal | Não | Não | 48 |
| 7 | F | 46 | Não | Nenhum | Subtotal | Não | Não | 52 |
| 8 | M | 34 | Não | NC 10,12 sacrificados/tireoplastia | Total | 18 | ||
| 9 | M | 49 | Não | Paralisia facial HB grau 4/implante de peso de ouro na pálpebra superior um ano depois: HB grau 2 | Subtotal | Sim | Sim | 53 |
| Vazamento de LCR/drenagem lombar | ||||||||
| Total SNİK | ||||||||
| 10 | F | 29 | Não | Nenhum | Subtotal | Sim | Sim | 35 |
| 11 | M | 53 | Não | Caso de revisão | Subtotal | Sim | Sim | 60 |
| Paralisia facial (HB grau 3) | ||||||||
| Total SNIK | ||||||||
| 12 | M | 38 | Não | Paralisia facial (total)/NC 7‐12 anastomose‐implante de peso de ouro na pálpebra superior. | Total | Não | – | 108 |
| Colesteatoma | ||||||||
| 13 | F | 61 | Não | Paralisia facial (HB grau 4) 1 ano depois: HB grau 2 | Total | Não | – | 66 |
| 14 | F | 71 | Sim | Apresentou paralisia facial (grau desconhecido) | Total | Não | – | 12 |
| Nenhum | ||||||||
| 15 | M | 25 | Não | Caso de revisão | Subtotal | Sim | Sim | 15 |
| Operado anteriormente para otite média crônica, resultado de biópsia anterior: hemangioma. | ||||||||
| Artéria carótida externa sacrificada | ||||||||
| 16 | F | 40 | Não | Nenhum | Subtotal | Sim | Sim | 96 |
EP, embolização pré‐operatória; RTE, radioterapia estereotática.
A complicação operatória mais comum foi a paralisia do nervo facial. Cinco pacientes com PTJ (31,2%) a tiveram. Três pacientes com HB grau 4 após a operação foram tratados com implante de peso de ouro na pálpebra superior. No primeiro ano tiveram uma recuperação aceitável com paralisia facial HB grau 2. O nervo facial foi sacrificado em dois casos (um deles já apresentava paralisia facial HB grau 5). Foi feita anastomose término‐terminal dos nervos hipoglosso‐facial. A artéria carótida externa foi sacrificada em um caso de PTJ. Otorreia e perfuração da membrana timpânica foram observadas em três pacientes. Um deles (caso PTJ) desenvolveu colesteatoma iatrogênico. Perda auditiva neurossensorial total foi documentada em três casos. Um deles apresentou concomitância de schwannoma vestibular (SV) e PTM. Inicialmente foi feita uma cirurgia de revisão para a excisão total de PTM e a seguir o SV no lado esquerdo foi excisado totalmente por abordagem retrosigmoidea. No seguimento a paciente apresentou perda auditiva neurossensorial total bilateral e a restauração da audição foi feita com implante coclear do lado direito. Em um caso de PTJ a cirurgia teve de ser interrompida devido a sangramento grave e a remoção tumoral foi subtotal. Fístula liquórica (FL) ocorreu em dois pacientes com PTJ. Um deles foi tratado com drenagem lombar e o outro recebeu acetazolamida oral por quatro dias. Em um caso com PTM, a FL ocorreu após a remoção do tumor do meato acústico interno. A pequena abertura foi fechada com enxerto muscular durante a cirurgia. Apenas um paciente, com PTJ, apresentou paralisia de nervos cranianos inferiores no pós‐operatório (NC 10, NC 12). Foi tratado com tireoplastia. Detalhes das cirurgias e complicações para casos de PTJ são apresentados na tabela 4. Além disso, não observamos qualquer mortalidade devido a falha do tratamento ou complicações operatórias de PTB.
DiscussãoPG de cabeça e pescoço são comumente aceitos como tumores benignos, localmente invasivos e de crescimento lento que surgem de fibras parassimpáticas localizadas ao longo de estruturas neurovasculares.4 Apenas a metástase para os gânglios linfáticos cervicais ou órgãos distantes como pulmão e ossos é considerada como critério de malignidade, o que representa menos de 5% dos casos.4 A bifurcação carotídea é o local mais comum para PG na região da cabeça e do pescoço.3,4 PG do osso temporal são comumente originários de fibras parassimpáticas localizadas ao longo da adventícia do bulbo jugular e do plexo timpânico, denominados PTJ e PTM.15 A ocorrência na meia‐idade e o predomínio do sexo feminino para PTB são relatados na literatura.16,17 Do mesmo modo, em nosso estudo, a razão entre mulheres e homens e a média de idade foram de 1,8: 1 e 50,26, respectivamente. Além disso, a predominância do sexo feminino foi mais aparente para PTM (2,6:1) em comparação com PTJ (1,2:1) de acordo com os achados da literatura.16,17 Os sintomas de apresentação mais comuns para PTB são zumbido e perda auditiva.6,18,19 Entretanto, o PTJ também pode apresentar sintomas que indicam envolvimento de nervos cranianos.4,19 Em nossa série de PTB os sintomas mais comuns também foram o zumbido (76,4%) e a perda auditiva (64,7%). Quatro casos de PTJ apresentaram sintomas de paralisia facial, disfagia e rouquidão, indicaram comprometimento do nervo craniano. A otorreia sangrenta crônica pode ser o sintoma de apresentação em alguns casos.6 Da mesma forma, a otorreia crônica foi o principal sintoma em dois casos (5,8%) neste estudo. O aumento da atividade endócrina é muito raro e a incidência relatada é de 1% a 8% para PTB.20 Portanto, a análise dos níveis de urina e catecolamina só é aconselhada na presença de sintomas clínicos como hipertensão paroxística e rubor. Também não observamos níveis elevados de catecolaminas na análise de sangue e urina de quatro pacientes examinados por suspeita clínica. Mutações em subunidades do SDH estão bem estabelecidas para ocorrência familiar e paragangliomas múltiplos.10 Em nossa série, a mutação de subunidade do SDH foi estudada e demonstrada em apenas um caso com paraganglioma múltiplo esporádico (tumor carotídeo bilateral, PTM unilateral).
Existem muitos sistemas de classificação sugeridos para o estadiamento de paragangliomas de cabeça e pescoço. As classificações de Fisch, Glasscock‐Jackson e Shamblin são as mais comumente usadas.13,14,21,22 Na classificação de Fisch, PTM e PTJ são classificados juntos como POT.13,14 Portanto, também usamos o sistema de classificação de Fisch. No presente estudo, o envolvimento tumoral foi classificado como Fisch tipo A em nove (50%) casos e Fisch tipo B (50%) nos nove casos remanescentes de PTM. Os PTJ foram classificados como C1, C2 e Di1 em 11, quatro e um caso, respectivamente. Como esperado, o caso classificado como estádio Di1 resultou em FL. A média do tamanho máximo do tumor no plano axial foi significativamente maior para PTJ em comparação com os casos de PTM. O tamanho foi calculado como 11,23±5,23mm (variação 5‐23) e 30,20±10mm (variação 15‐70) nos PTM e PTJ, respectivamente (p=0,001). Carlson et al. relataram, em sua série de 16 pacientes com PTJ uma mediana de dimensão linear máxima para PTJ no plano axial de 2,0cm (variação, 1,4‐3,9cm).18
Carlson et al. também apresentaram sua experiência com PTM em 115 pacientes por quatro décadas.6 A remoção cirúrgica completa foi obtida em 108 (93,9%) pacientes. Nos sete (6,1%) com ressecção subtotal, o tumor estava aderido à artéria carótida petrosa, ao nervo facial, à plataforma do estribo ou à janela redonda. Não houve recorrência durante o seguimento médio de 30,4 meses. A condução aérea pré‐operatória e o gap aéreo‐ósseo na audiometria tonal foram de 40,6 e 17,1 respectivamente.6 No presente relato houve um paciente (5,5%) com excisão subtotal dentre 18 pacientes com PTM. Nesse caso, o tumor estava aderido ao nervo facial. Os gaps aéreos‐ósseos pré‐operatórios para PTM e PTJ foram 16,59±14,77 meses (intervalo 0‐40) e 31,33±6,18 (intervalo 25‐43), respectivamente (p=0,219). As principais modalidades de tratamento para PTB são cirurgia e radioterapia. Ressecção tumoral total sem grandes complicações como déficits de nervos cranianos é o principal objetivo da cirurgia. Timpanomastoidectomias abertas ou fechadas, com ou sem abordagem pelo recesso facial, são geralmente adequadas para a remoção de PTM.6 Entretanto, a abordagem IFTA‐A é comumente necessária para a remoção completa de PTJ, especialmente em casos de extensão intracraniana. Conforme definido por Fisch em 1982, ele inclui a extensão cervical de uma incisão pós‐auricular para manter um melhor controle neurovascular, expor o bulbo jugular, a veia jugular e a artéria carótida após a mastoidectomia, redirecionamento facial, incisão cervical e fechamento em fundo cego do meato auditivo.13,14 A aparência em “sal e pimenta”, que significa a existência de áreas de alta e baixa intensidade na ressonância magnética, é típica em PG.23 No entanto, a ASD pode ser feita para confirmar o diagnóstico em caso de suspeita.23 Em candidatos cirúrgicos, a ASD pode ser feita imediatamente antes da cirurgia, para embolização seletiva. A artéria faríngea ascendente e seus ramos são conhecidos por ser o principal vaso de alimentação para POT.23 Entretanto, no presente estudo, a artéria occipital, a artéria auricular posterior e a artéria faríngea ascendente foram os vasos aferentes mais comuns em ordem de incidência. Em quatro casos com PTM não houve vaso aferente identificado com a ASD. A embolização pré‐operatória não é aconselhada para os tumores classe A de Fisch, enquanto é fortemente recomendada para tumores classe C e D de Fisch. O objetivo principal da embolização pré‐operatória é reduzir a vascularização e, assim, o sangramento durante o procedimento. No estudo retrospectivo de Murphy et al., o sangramento intraoperatório, o tempo de cirurgia e a internação hospitalar para PTJ mostraram‐se significativamente reduzidos após a embolização pré‐operatória.24 No entanto, a embolização pré‐operatória para POT também pode causar paralisia permanente de nervos cranianos.25
Em nossa série de 18 casos com PTM e 16 casos com PTJ, a ressecção completa foi obtida em 17 (94,4%) e oito (50,0%) casos, respectivamente. Verificou‐se que a nossa taxa de excisão subtotal (50%) em casos de PTJ era muito elevada em comparação com a experiência do Gruppo Otologico. Sanna et al. (Gruppo Otologico) alcançaram 90,7% de excisão completa em 55 pacientes durante 15 anos. Sua taxa de controle cirúrgico geral foi de 83% quando tumores residuais e recorrências foram levados em consideração.26 Modificamos nosso protocolo de tratamento para PTJ nos últimos anos. Todos os casos de PTJ (cinco) com tumores de classe C operados nos últimos cinco anos foram submetidos a embolização seletiva pré‐operatória. A excisão completa foi obtida em cinco (80%) casos de seis com PTJ submetidos à embolização pré‐operatória. No entanto, a excisão completa foi obtida em três (30%) casos de 10 pacientes que não fizeram embolização pré‐operatória (p<0,05). De oito casos com PTJ residuais, cinco deles foram submetidos à RTE devido ao crescimento tumoral residual e os três casos remanescentes foram seguidos com RM seriada, sem evidência de crescimento tumoral.
No entanto, apesar da boa exposição cirúrgica com a abordagem IFTA‐A e embolização pré‐operatória, a remoção total do tumor não pode ser obtida sem complicações maiores, ocorre déficit de nervos cranianos inferiores em alguns casos. Wanna et al. avaliaram o crescimento tumoral após ressecção subtotal de grandes PTJ em 12 casos com nervos cranianos inferiores funcionais. No seguimento médio de 44,6 meses, não houve crescimento tumoral no tumor residual em oito casos (66,6%). De quatro casos com evidência de crescimento tumoral no tecido residual, dois deles receberam RTE.27 Karaman et al. obtiveram ressecção completa com abordagem IFTA‐A após embolização pré‐operatória em nove de 11 casos com PTJ. A RTE foi indicada para tumores residuais.19 Portanto, a ressecção subtotal também é uma opção cirúrgica recomendável em PTJ.
Entre as complicações operatórias de POT|, a paralisia do nervo facial é uma das mais comumente encontradas.11,19 Em nossa série, cinco pacientes (31,2%) com PTJ tiveram paralisia facial após a cirurgia. Todos, exceto dois, melhoraram, com HB grau 2 e 3 no seguimento. A anastomose do nervo hipoglosso‐facial foi necessária em dois casos devido ao sacrifício do nervo facial (um deles já apresentava paralisia facial de grau 5 HB antes da cirurgia). Um dos casos de PTJ que inicialmente apresentou paralisia facial HB grau 4 recuperou‐se com HB grau 2 após a cirurgia. A otorreia crônica pode ser um sintoma primário de apresentação ou ser causada por uma complicação do procedimento cirúrgico em POT.19 No presente estudo, três pacientes experimentaram otorreia e perfuração da membrana timpânica após o procedimento. Um dos nossos casos, no qual foi feita cirurgia de revisão para desenvolvimento de otorreia crônica após cirurgia primária para PTJ, o exame histopatológico final revelou um colesteatoma iatrogênico, provavelmente devido à técnica incorreta de fundo cego. Que seja de nosso conhecimento, é o terceiro caso de colesteatoma adquirido após cirurgia de PTJ relatado na literatura em língua inglêsa.28,29 Houve também uma coexistência de SV e PTM em nossa série. Após o tratamento de PTM e SV, a paciente apresentou perda auditiva neurossensorial total bilateral e a restauração auditiva foi alcançada após implante coclear no lado direito. Que seja de nosso conhecimento, este é o terceiro caso de coexistência de SV e PTM e é o primeiro caso relatado na literatura internacional no qual foi feito implante coclear para a ocorrência simultânea de SV e PTM em lados opostos.30
Como mencionado acima, o único tratamento curativo para POT é a excisão total. No entanto, no caso de grandes tumores e idade avançada, a radioterapia ou observação sem intervenção adicional devem ser consideradas. Lee CC et al. apresentaram sua experiência com radiocirurgia com bisturi gama para PTJ e PTM. Verificou‐se que a redução média do volume tumoral foi de 34,0% durante um tempo médio de seguimento de 40,3 meses. Houve apenas um paciente com paralisia do nervo facial e deficiência auditiva após o tratamento. A taxa de controle tumoral relatada foi de 100%.31 Carlson et al. relataram sua experiência com observação e acompanhamento do PTJ em 16 pacientes. A principal indicação para observação foi a preferência do paciente e idade avançada. No exame radiológico seriado em 12 pacientes, cinco (42%) demonstraram crescimento radiológico, enquanto sete (58%) permaneceram estáveis.18 Van der Mey et al. compararam os resultados de cirurgia, radioterapia e protocolos de observação. Em sua série de 105 pacientes com seguimento de 36 anos, nenhuma diferença foi demonstrada em relação às taxas de sobrevivência entre esses grupos.32
ConclusãoCom base em nossos achados e na revisão da literatura, a excisão cirúrgica total isoladamente ou com embolização pré‐operatória e excisão cirúrgica total com embolização pré‐operatória são as principais modalidades de tratamento para PTM e PTJ, respectivamente.
No entanto, a radioterapia e as modalidades de observação também podem ser consideradas em casos de grandes tumores, casos recorrentes, idade avançada e preferência do paciente. Além disso, nos casos de grandes tumores com nervos cranianos funcionais pré‐operatórios, a ressecção subtotal deve ser considerada em vez de sacrificar as principais estruturas neurovasculares. Nos POT, além do zumbido e da perda auditiva, a otorreia também pode ser um sintoma de apresentação ou um achado pós‐operatório que indica recidiva tumoral ou uma complicação como colesteatoma. Além disso, que seja do nosso conhecimento, relatamos o primeiro caso no qual foi feito implante coclear, por ocorrência simultânea de SV e PTM em locais opostos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Düzlü M, Tutar H, Karamert R, Karaloğlu F, Şahin MM, Göcek M, et al. Temporal bone paragangliomas: 15 years experience. Braz J Otorhinolaryngol. 2018;84:58–65.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.