In daily life biological systems are usually exposed to magnetic field forces at different intensities and frequencies, either directly or indirectly. Despite negative results, the therapeutic use of the low dose magnetic field has been found in recent studies. The effect of magnetic field forces on cochlear cells is not clear in the literature.
ObjectiveIn our study, we first applied in vivo pulsed magnetic fields to laboratory rats to investigate the effects on cochlea with distortion product otoacoustic emission test followed by histopathological examinations.
MethodsTwelve rats were included in this study, separated into two groups as study group and control group. The rats in the study group were exposed to 40Hz pulsed magnetic field for 1h/day for 30 days; the hearing of the rats was controlled by otoacoustic emission test. Also, their cochleas were removed and histochemical examination was performed by Caspase‐3, Caspase‐9, and TUNEL methods.
ResultsA statistically significant difference was determined (p<0.05) when the hearing thresholds of the groups obtained by using 5714Hz and 8000Hz stimuli were compared by Kruskal–Wallis test. A significant reaction was observed in the study group, especially in the outer ciliated cells during immunohistochemical examinations by using Caspase‐3 and Caspase‐9 methods. A significantly positive difference was determined in the study group, especially at the outer ciliated cells and the support cells of the corti organ, when compared to the control group (p<0.05) by the TUNEL method.
ConclusionAccording to the results of our study, the very low dose magnetic field, which is considered to be used for therapeutic purposes recently, can cause both auditory function defects and histopathologic damage in cochlear cells.
Os sistemas biológicos são geralmente expostos a forças de campo magnético em diferentes intensidades e frequências, direta ou indiretamente, na vida diária. Apesar dos resultados negativos, o uso terapêutico do campo magnético de baixa dose tem sido encontrado em estudos recentes. O efeito das forças do campo magnético sobre as células cocleares não está claro na literatura.
ObjetivoEm nosso estudo, aplicamos pela primeira vez campos magnéticos pulsados in vivo em ratos de laboratório para investigar os efeitos na cóclea através do teste de emissão otoacústica por produto de distorção e análises histopatológicas.
MétodoDoze ratos foram incluídos neste estudo, os quais foram separados em dois grupos, grupo de estudo e grupo controle. Os ratos do grupo de estudo foram expostos a campo magnético pulsado de 40 Hz por 1 hora/dia por 30 dias, e a audição dos ratos foi controlada por testes de emissão otoacústica. Além disso, suas cócleas foram colhidas e o exame histoquímico foi feito pelos métodos caspase‐3, caspase‐9 e TUNEL.
ResultadosFoi determinada uma diferença estatisticamente significante (p<0,05) quando os limiares auditivos dos grupos obtidos por meio dos estímulos de 5714Hz e 8000Hz foram comparados pelo teste de Kruskal‐Wallis. Uma reação significante foi observada no grupo de estudo, especialmente nas células ciliadas externas nas análises imuno‐histoquímicas, com os métodos caspase‐3 e caspase‐9. Uma diferença significantemente positiva foi determinada no grupo de estudo, especialmente nas células ciliadas externas e nas células de suporte do órgão de Corti, quando comparadas com o grupo controle (p<0,05) pelo método TUNEL.
ConclusãoDe acordo com os resultados do nosso estudo, o campo magnético de dose baixa, que tem sido considerado para uso terapêutico recentemente, pode causar defeitos na função auditiva e danos histopatológicos nas células cocleares.
Ondas eletromagnéticas (OEM) são a disseminação de energia, com características de ondas e partículas. Assim, o espectro formado considerando‐se as características da onda e as energias das OEM é chamado de espectro eletromagnético.1
As OEM são classificadas em dois grupos, ionizadas e não ionizadas. As não ionizadas são classificadas como UV, luz visível, radiação infravermelha, micro‐ondas e de radiofrequência de acordo com a diminuição de energia. As ondas de rádio estão na parte inferior desse espectro.1 Como as ondas de rádio cobrem uma área muito ampla do espectro, elas são separadas em 11 subunidades com relação ao aumento em certos valores de frequência. Os campos eletromagnéticos (EM) de frequência extremamente baixa (FEB) que usamos em nosso estudo são gerados pelas fontes de energia que operam nas principais frequências. O campo magnético pulsado de frequência extremamente baixa e de baixa frequência tem sido usado recentemente e frequentemente em muitos tratamentos, como terapia neuropática, edema de medula óssea, promotor da formação óssea após fraturas e cicatrização de feridas em diferentes locais.2–5 Ondas eletromagnéticas de alta frequência são as ondas de rádio que são usadas em comunicações móveis.6,7
A cóclea é a unidade auditiva onde as vias auditivas elétricas, que consistem em células ciliadas vibratórias internas e externas, se iniciam. As células cocleares podem ser facilmente afetadas por vários fatores, como drogas, voz, doenças sistêmicas e trauma. As células mais suscetíveis à degeneração são as células ciliadas externas vibratórias. As funções auditivas podem ser avaliadas diretamente pelas emissões otoacústicas (EOA). Respostas que refletem na cóclea e são obtidas no canal auditivo externo mostram função normal.8
Estamos frequentemente expostos a forças de campos magnéticos em muitas áreas da vida diária e esses também são usados para fins de diagnóstico e tratamento. O formato das ondas e o tempo de exposição a elas são os mesmos usados para fins terapêuticos. As ondas para fins de diagnóstico são as de 50 ± 200MHz, com frequência muito alta. Se elas são eficazes ou não nas células cocleares, é uma questão a ser pesquisada.
Em nosso estudo, examinamos o efeito do campo magnético de dose muito baixa (40Hz) na cóclea, o qual é usado como dose terapêutica na literatura. Aplicamos um campo magnético pulsado de baixa dose in vivo a ratos de laboratório e, em seguida, examinamos a função coclear através do teste de emissão otoacústica por produto de distorção (EOAPD) e por análises imuno‐histoquímicas.
Material e métodoCuidados com os animais e procedimento experimentalDoze ratos albinos Wistar machos com 250‐300g foram usados em nosso estudo. Antes das experiências, a aprovação ética foi recebida do comitê de ética local para experimentação animal (2017/611). Inicialmente, os ratos foram deixados no laboratório com temperatura ambiente de 24-25°C, umidade de 40% a 50% e ciclo dia/noite de 12 horas, de acordo com o ritmo circadiano, por uma semana para o período de adaptação. Após uma semana de adaptação, os ratos foram separados em dois grupos, o grupo de estudo (Grupo I, n = 6), que é exposto ao campo magnético, e o grupo controle (Grupo II, n = 6). Os ratos do grupo de estudo foram expostos ao campo magnético pulsado (PMF, do inglês pulsed magnetic field) de mesma intensidade e frequência (1,5 mT, 40Hz) por uma hora, na mesma hora do dia por 30 dias e durante esse período de um mês os ratos foram alimentados com comida e água ad libitum.
O PMF foi aplicado aos ratos com um sistema com bobinas de Helmholtz de 60cm de diâmetro, colocadas a uma distância de 30cm. Essas bobinas foram colocadas em uma gaiola de Faraday e conectadas a um gerador de sinal (ILFA Electronic, Adana, Turquia) e produziram uma amplitude de pico de campo magnético de 1,5 miliTesla (1,49‐1,51 mT). O valor de pico do campo magnético foi medido por um medidor de Gauss (gaussímetro) com uma sonda de efeito Hall (FW Bell modelo 6010, Sypris, Orlando, FL, EUA). O campo magnético com variação de tempo consistiu em um formato de onda quase triangular, com um tempo de subida de 0,5ms e um tempo de descida de 9,5ms. O campo elétrico induzido foi um formato de onda retangular unipolar com campos elétricos de pico de 0,6V/m (0,59 a 0,61V/m) entre as bobinas. O período de aplicação do PMF foi determinado após o exame e aprimoramento dos estudos na literatura nos quais o efeito do PMF foi experimentado.9,10
Medidas do teste de EOAPDOs animais foram expostos a EOAPD duas vezes antes do início do estudo e no fim do experimento de quatro semanas. A medição do PD‐grama foi feita entre 500Hz e 8.000Hz (instrumento usado: Neuro‐Audio OAE (versão 2010): sonda OAE (Neurosoft), sonda ER‐10D). A avaliação funcional nessas frequências de 5-8 kHz, corresponde aos giros basais. Nas EOAPD, a razão entre as frequências f2 e f1 (f2 / f1) foi fixada em 1,22 e as intensidades do estímulo foram definidas em L1 = 55 e L2 = 55. Os PD‐gramas foram registrados medindo‐se para cada oitava. Seis pontos de frequência foram amostrados. Os valores da Relação Sinal‐Ruído (SNR, do inglês signal‐to‐noise ratio) das EOAPD foram registrados nas frequências de 988Hz, 1481Hz, 2222Hz, 2963Hz, 5714Hz e 8000Hz. As médias de SNR das respostas das EOAPD do Grupo II, que não foi exposto ao campo magnético, e do Grupo I, que foi exposto ao campo magnético, foram analisadas pelo teste de Kruskal‐Wallis e, portanto, os grupos foram comparados entre si.
Exame histopatológicoDepois de examinar a audição dos ratos através de EOAPD (Emissão Otoacústica do Produto de Distorção) no fim do período de quatro semanas, todos os ratos foram sacrificados instantaneamente ao mesmo tempo pelo método de decapitação após anestesia com a combinação de 40mg / kg de cloridrato de cetamina intraperitoneal (Ketalar‐PFIZER) e cloridrato de xilazina 5mg / kg (XilazinaBio‐BIOVETA). Após a decapitação, os pavilhões auriculares foram cortados e a fórmula foi injetada na orelha interna. Em seguida, a preparação histológica preliminar foi iniciada com a remoção da cóclea após a sua fixação com paraformaldeído a 4%. Os tecidos foram mantidos em formalina durante 24 horas. Em seguida, foram colocados em solução de 0,1 moL/L de ácido etilenodiamino tetra‐acético (EDTA) (Sigma‐Aldrich, EUA) por três semanas para a descalcificação dos tecidos ósseos. Isso foi seguido, depois de uma noite, por uma lavagem sob um fluxo de água. Depois de serem desidratadas através de uma série graduada de etanol, as amostras foram limpas em xileno e processadas para inclusão em cera de parafina, de acordo com protocolos de rotina. O giro basal da cóclea foi avaliado. As figuras apresentadas correspondem ao giro basal.
Método imuno‐histoquímicoOs blocos de parafina do tecido foram cortados em amostras de 5μm. Para a análise imuno‐histoquímica, as amostras foram tratadas com tripsina a 2% em tampão Tris (Sigma‐Aldrich, St Louis, Missouri, EUA) a 37°C por 15min. Após o tratamento com peróxido de hidrogênio a 0,3% em metanol por 15min, as amostras foram incubadas em uma solução bloqueadora (Invitrogen, Carlsbad, Califórnia, EUA) por 10min. Elas foram então incubadas em câmara úmida por 1h a 4°C com agonistas de anticorpos primários caspase‐3 (anticorpo policlonal de coelho; Lab Vision, EUA), caspase‐9 (anticorpo policlonal de coelho, Lab Vision, EUA), todos diluídos em 1:100 As amostras foram então incubadas com anticorpo secundário biotinilado e depois com estreptavidina conjugada com peroxidase de rábano durante 30min cada (Invitrogen) de acordo com as instruções do kit. Finalmente, elas foram incubadas com 3‐amino‐9‐etil carbazole (AEC) (Spring, Califórnia, EUA), preparado de acordo com as instruções do fabricante, por 3 a 5 minutos, após o que os núcleos foram contracorados com hematoxilina de Mayer. As lâminas foram visualizadas e as imagens foram obtidas com um microscópio fotolight (CX31 Olympus, Alemanha) acoplado a uma câmera digital (C‐5060 Olympus, Alemanha). As figuras foram obtidas a partir do giro basal da cóclea. A análise imuno‐histoquímica foi feita em cortes transversais renais para todos os animais, com um software de análise de imagens (Leica Q Win V3 Plus Image). Dois observadores independentes, cegos quanto ao regime de tratamento, fizeram avaliações separadas do escore de imunomarcação. A intensidade da marcação foi classificada semiquantitativamente e o HSCORE foi calculado com a equação HSCORE = ΣPi (i + 1), onde i é a intensidade da marcação com um valor de 1, 2 ou 3 (fraca, moderada ou forte, respectivamente) e Pi é a porcentagem de células marcadas para cada intensidade, variando de 0% a 100%.
Método TUNELAs amostras desparafinizadas e reidratadas, preparadas como descrito acima, foram coradas com um kit comercial (Apoptag, S7101, Chemicon, CA, EUA) de acordo com as instruções do fabricante. As lâminas coradas com a técnica de TUNEL foram avaliadas com um microscópio de campo claro CX41 (Olympus, Tóquio, Japão). Dois observadores cegos para informação experimental avaliaram os escores TUNEL de forma independente. O número de todas as células imunorreativas positivas para todos os indivíduos foi contado do giro apical até o giro basal e analisado. O número médio de células apópticas foi determinado contando células positivas para TUNEL, as quais foram contadas em campos escolhidos aleatoriamente por caso. Em cada caso, foram calculadas 100 células, tanto positivas quanto negativas, e foi dada a porcentagem de células positivas para TUNEL. As células nas áreas de necrose e morfologia insuficiente ou nas bordas das amostras não foram incluídas.
Análise estatísticaO teste de Kruskal‐Wallis foi usado para comparar as respostas das EOAPD e as médias da SNR dos grupos. O teste U de Mann‐Whitney foi usado com os métodos caspase‐3, caspase‐9 e TUNEL para comparar o estado de apoptose dos grupos. O valor de p < 0,05 foi considerado significante.
ResultadosOs valores da relação sinal‐ruído em seis pontos de frequência foram registrados e analisados entre si na avaliação das EOAPD pelo teste de Kruskal‐Wallis. Uma diferença estatisticamente significante foi determinada (p < 0,05) nos limiares auditivos dos estímulos de 5714Hz e 8000Hz e os valores de SNR estavam reduzidos no Grupo I (tabela 1).
Comparação das médias e desvio‐padrão (DP) das médias da SNR das respostas das EOAPD dos grupos com o teste de Kruskal‐Wallis
| Grupos | 988 Hz | 1481 Hz | 2222 Hz | 2963 Hz | 5714 Hz | 8000 Hz |
|---|---|---|---|---|---|---|
| Grupo I PMF (+) | 3,72 ± 9,58 | 11,31 ± 11,48 | 7,28 ± 10,41 | 12,05 ± 5,66 | 21,58 ± 8,87 | 23,70 ± 6,29 |
| Grupo IIPMF (−) | 3,96 ± 10,96 | 11,68 ± 10,32 | 7,35 ± 9,77 | 12,95 ± 5,86 | 27,38 ± 6,83 | 27,80 ± 10,71 |
| p | 0,190 | 0,213 | 0,132 | 0,97 | < 0,05 | < 0,05 |
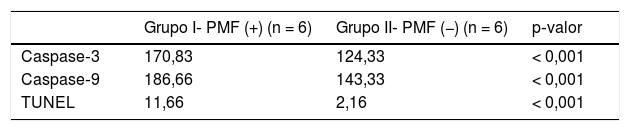
As células apoptóticas foram marcadas e contadas com as colorações TUNEL, caspase 3 e caspase‐9 (tabela 2).
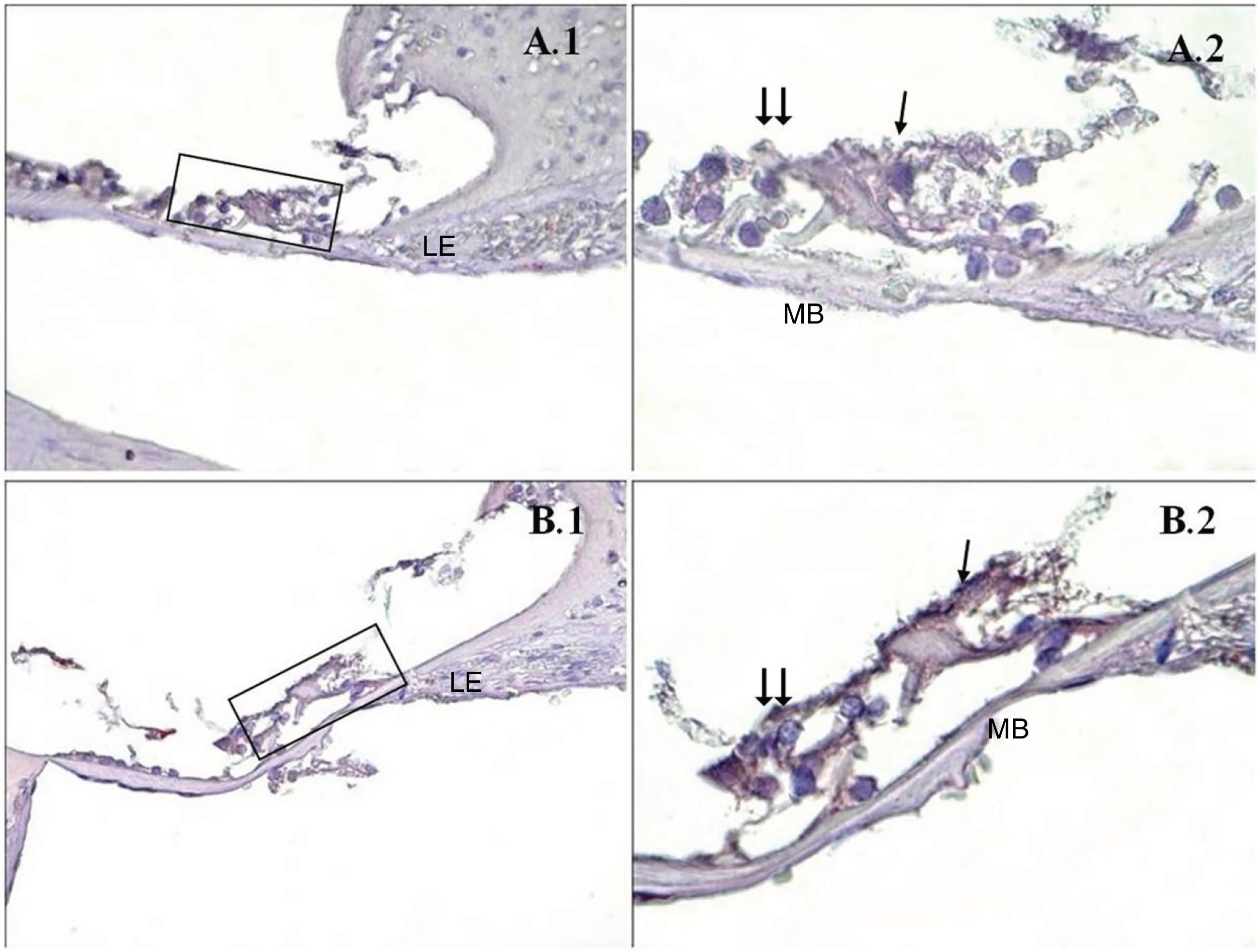
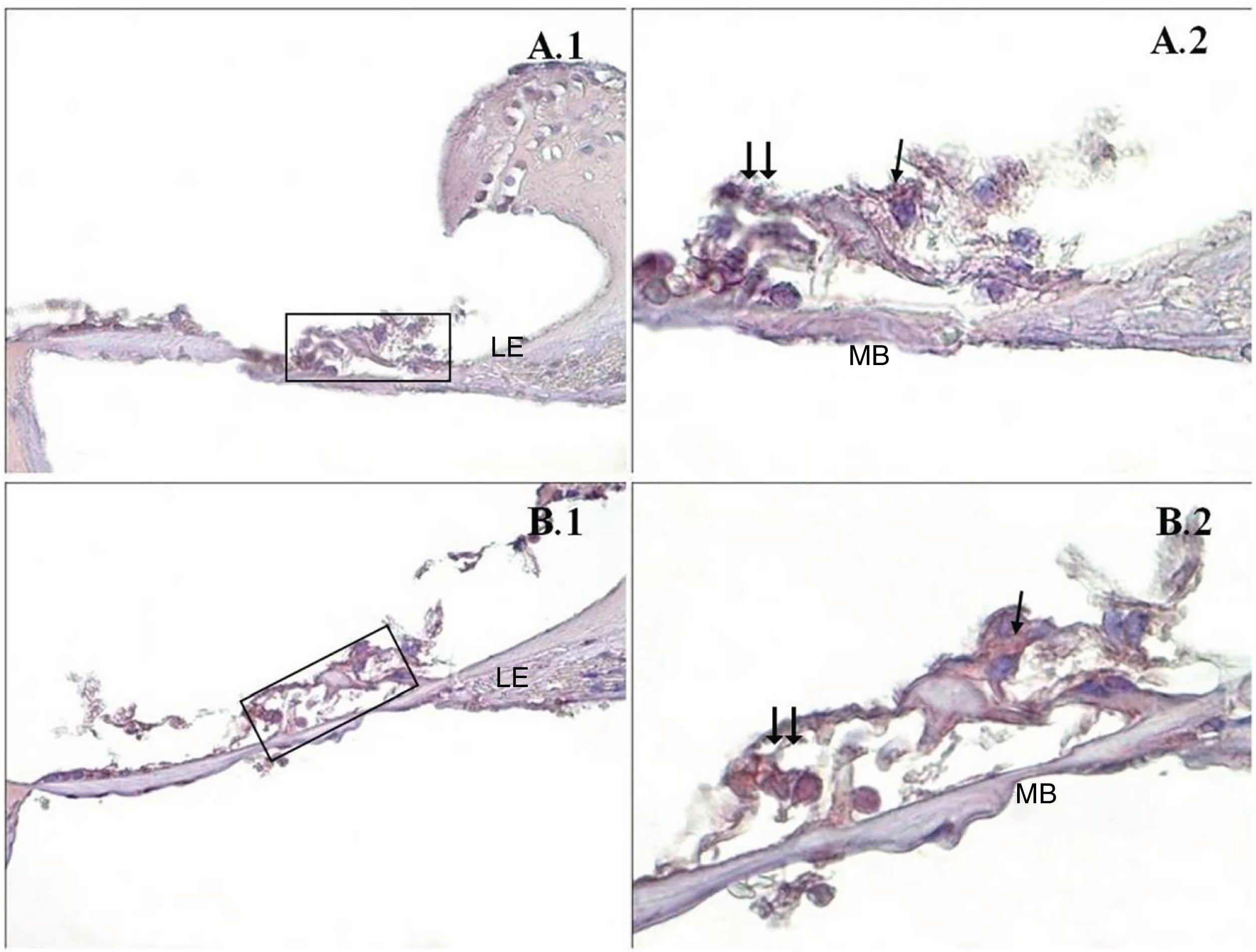
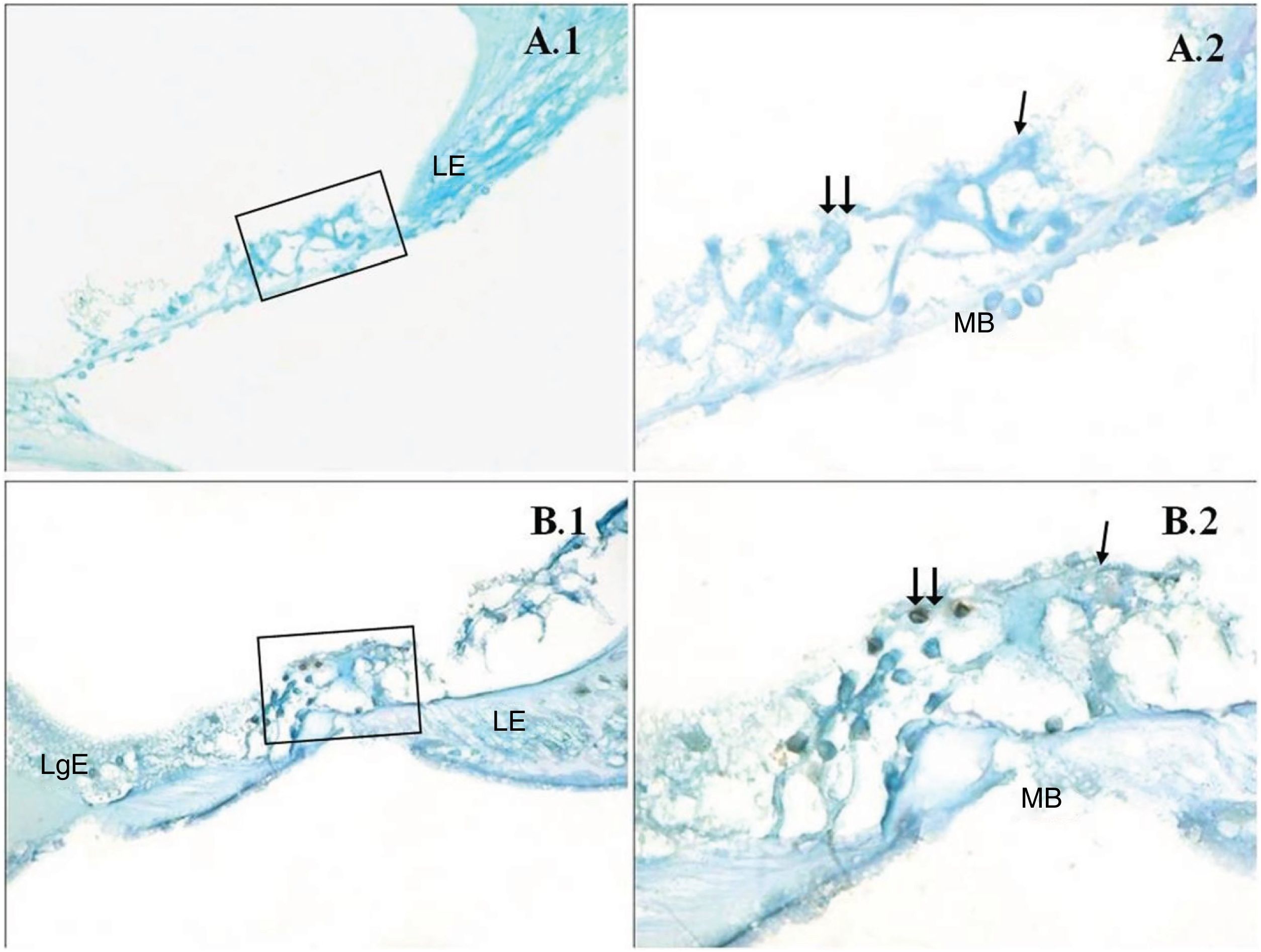
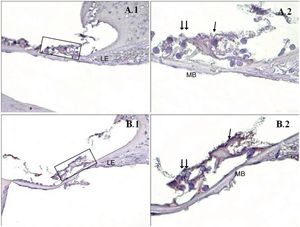
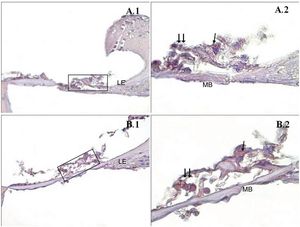
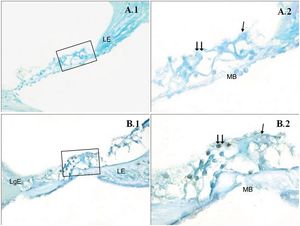
Uma diferença significativa foi encontrada entre os grupos (p < 0,001) quando os resultados da apoptose foram comparados com os métodos caspase‐3, caspase‐9 e TUNEL (tabela 3). Embora uma expressão fraca tenha sido observada nas células ciliadas externas do órgão de Corti do grupo PMF (−) durante a imunomarcação com caspase‐3 (fig. 1A), foi observada reação moderada no grupo PMF (+) (fig. 1B) (p < 0,001). Enquanto reações que variaram de fracas a moderadas foram observadas nas células ciliadas externas do órgão de Corti do grupo PMF (−) durante a imunomarcação com caspase‐9 (fig. 2A), o aumento da imunomarcação que variou de moderado a forte, especialmente nas células ciliadas externas do órgão de Corti, foi observado no grupo PMF (+) (fig. 2B) (p < 0,001). Não havia quase nenhuma célula TUNEL‐positiva no órgão de Corti do grupo PMF (−) que foi corado pelo método TUNEL (fig. 3A), enquanto as células ciliadas externas e as células de suporte do órgão de Corti no grupo PMF (+) mostraram positividade para TUNEL (fig. 3B) (p < 0,001).
Imunomarcação de caspase‐3 do Órgão de Corti da cóclea. →: células ciliadas internas, → →: Células ciliadas externas, LE: Limbo espiral, LgE: Ligamento espiral, MB: Membrana basal, PMA (−) (A), PMA (+) (B), órgão de Corti X40 (1), Órgão de Corti X100 (2). Coloração de fundo: hematoxilina de Mayer.
Imunomarcação de caspase‐9 do Órgão de Corti da cóclea. →: células ciliadas internas, → →: Células ciliadas externas, LE: Limbo espiral, LgE: Ligamento espiral, MB: Membrana basal, PMA (−) (A), PMA (+) (B), órgão de Corti X40 (1), Órgão de Corti X100 (2). Coloração de fundo: hematoxilina de Mayer.
Neste estudo, objetivamos examinar as alterações na emissões otoacústicas, juntamente com degenerações histopatológicas e imuno‐histoquímicas na cóclea de ratos expostos a campos magnéticos pulsados de dosagem extremamente baixa. Observamos degeneração estatisticamente significante nas células cocleares tanto nos valores de alta frequência das EOAPD quanto histopatologicamente, como resultado da exposição ao campo magnético.
Os sistemas biológicos são geralmente expostos a forças de campo magnético em diferentes intensidades e frequências, direta ou indiretamente, na vida diária. Muitos estudos mostram que essas forças têm efeito sobre a proliferação celular, síntese e secreção de fatores de crescimento, morte celular programada etc. Esses estudos também mencionam seu efeito carcinogênico.11,12 Da mesma forma, a relação entre o campo magnético e tumores neurogênicos, como neurinomas acústicos e gliomas, também foi demonstrada.13 Não há muitos estudos sobre seus efeitos na cóclea e nas células cocleares. Se a exposição ao campo magnético tem um efeito negativo na audição ou não, ainda é algo controverso na literatura. Embora alguns estudos mostrem que eles não causam diferença na audição, outros estudos mostram que eles têm efeitos negativos.14–18
Ondas de campo magnético contínuas ou intermitentes foram usadas em estudos anteriores conduzidos para analisar os efeitos negativos do campo magnético. Os estudos que investigaram as diferenças entre o EMF contínuo e pulsado são insuficientes. O aumento dos danos ao DNA e da peroxidação lipídica foi determinado nos estudos aplicados com o campo magnético com baixa frequência contínua (50Hz).19,20 Em outro estudo feito em ratos com campo magnético pulsado de 40Hz, o aumento na IL‐6, que é um marcador inflamatório, foi determinado em células cardíacas e cerebrais.21
Apesar desses resultados negativos, o uso terapêutico do campo magnético de baixa dose foi encontrado em estudos recentes. Na literatura, o campo magnético de 40Hz foi usado para a cicatrização de feridas, edema de medula óssea e neuropatia diabética para fins de tratamento e resultados positivos foram relatados.2–4 Em outro estudo, os ratos foram expostos a um campo magnético pulsado de 50Hz três vezes ao dia por quatro horas e verificou‐se que ele reduzia a necrose das células uretrais.22 Por quase 50 anos, várias formas de EMF foram usadas para promover a formação óssea após fraturas, bem como para o tratamento da osteoporose.5 Em um estudo in vitro, o aumento das atividades osteoblásticas foi observado na terapia com EMF pulsado de dosagem extremamente baixa em células osteoblásticas humanas.23 A dor neuropática permanece difícil de tratar. Devido à falta de agentes terapêuticos eficazes, é necessário buscar potenciais terapias opcionais para esse tipo de doença. Estudos recentes têm demonstrado que a aplicação magnética pode ter um impacto positivo na regeneração de nervos periféricos lesionados.24
O efeito do EMF pulsado de baixa dose em células cocleares não está claro. Estudos prévios que examinaram o dano coclear foram feitos na frequência do campo magnético que corresponde à frequência GSM (300MHz–300GHz) e apoptose em células cocleares e degeneração do núcleo coclear foram detectados.15–25 Quando o uso do campo magnético de baixa frequência para fins terapêuticos foi discutido nos últimos anos, a questão sobre a possibilidade do campo magnético de baixa dose poder causar danos às células cocleares tornou‐se objeto de pesquisa. Em nosso estudo, examinamos o efeito do campo magnético de dose muito baixa (40Hz) na cóclea, que é usado como dose terapêutica no literatura.
O mecanismo de degeneração da célula coclear em resposta a diferentes estímulos ototóxicos, como o campo magnético, compartilha uma via final comum, a apoptose. Essa morte celular programada também pode ser vista em células normais e termina com fagocitose, não ocorre inflamação. Pode haver menor marcação devido à continuação da apoptose normalmente no grupo controle. No entanto, neste estudo, foi encontrada uma diferença significante entre os grupos (p < 0,001) quando os resultados da apoptose foram comparados com caspase‐3 e caspase‐9.
Usamos as EOAPD para medir a função auditiva em múltiplas frequências nos ratos. Essa medida é uma mensuração não invasiva, indolor, prática e objetiva que não requer participação ativa.26,27 As células ciliadas externas vibratórias são importantes indicadores de dano coclear. Danos às células ciliadas externas vibratórias podem ser determinados com as EOAPD. A rápida mudança do potencial elétrico causada pelo campo magnético pode prejudicar os equilíbrios homeostáticos nas células com mecanismos de sinalização elétrica, afetar os mecanismos de transmissão de sinal. Além disso, estudos mostram que a aplicação do campo magnético afeta a ativação dos canais de Ca2+ dependentes de voltagem na membrana plasmática e o Ca2+ que aumenta incontrolavelmente nas células causa ativação da caspase através do citocromo‐c secretado pelas mitocôndrias, o que causa apoptose.28
Usamos os métodos caspase 3‐9 e TUNEL para analisar a apoptose coclear em nosso estudo. De acordo com os nossos resultados, os valores que detectamos com as EOAPD no grupo exposto ao campo magnético estão correlacionados com os resultados do exame histopatológico. Em resumo, o aumento de Ca2+ na célula, o aumento no dano ao DNA e a peroxidação lipídica e o aumento de IL‐6 causam apoptose e afetam uns aos outros. Mecanismos de lesões do EMF em células pilosas cocleares que levam à apoptose podem estar em todas essas situações e estudos posteriores deveriam pesquisar tais reações bioquímicas.
A principal limitação deste estudo é que os resultados auditivos e histoquímicos gerados pelo EMF foram examinados apenas em nível coclear. A cóclea é uma parte importante da via auditiva e é muito sensível a fatores de risco externos. A resposta auditiva do tronco encefálico teria sido uma medida muito melhor da função auditiva com o auxílio da histopatologia retrococlear para avaliar toda a via auditiva. Em estudos futuros, além da cóclea, os efeitos retrococleares devem ser examinados.
ConclusãoDe acordo com os resultados do nosso estudo, o campo magnético de dosagem extremamente baixa, que é considerado para fins terapêuticos atualmente, pode causar defeitos na função auditiva e danos histopatológicos nas células cocleares. Por essa razão, é difícil fazer estudos histológicos na cóclea humana. Nossos resultados foram obtidos em ratos; estudos em humanos, com EOA ou PEATE, ainda são escassos. Acreditamos que mais estudos de campos magnéticos com dosagem variada de frequência contribuirão para a literatura.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Tuhanioğlu B, Erkan SO, Gürgen SG, Özdaş T, Görgülü O, Çiçek F, et al. The effect of very low dose pulsed magnetic waves on cochlea. Braz J Otorhinolaryngol. 2019;85:282–9.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.