Although the red cell distribution width has been reported as a reliable predictor of prognosis in several types of cancer, to our knowledge few reports have focused on the prognostic value of red cell distribution width in laryngeal carcinoma.
ObjectiveWe aimed to explore whether the pretreatment red cell distribution width predicted recurrence in laryngeal cancer patients is a simple, reproducible, and inexpensive prognostic biomarker.
MethodsAll laryngeal cancer patients who underwent curative surgery (n=132) over a 7 year study period were evaluated. Data on demographics, primary tumor site, T‐stage, N‐stage, histological features (differentiation; the presence of perineural/perivascular invasion), treatment group (total laryngectomy or partial laryngectomy) or adjuvant therapy (chemotherapy/radiotherapy); laboratory parameters (complete blood count, including the pre‐operative red cell distribution width), and disease‐free survival rates were retrospectively reviewed. All cases were divided into three groups by the red cell distribution width tertile [<13% (25th percentile) (n=31), 13–14.4% (50th percentile) (n=72), and >14.4% (75th percentile) (n=29)].
ResultsHigh‐red cell distribution width group included more patients of advanced age, and more of those with recurrent and metastatic tumors (p=0.005, 0.048, and 0.043, respectively). Individuals with red cell distribution width >14.4% (75th percentile) had lower disease free survival rates than did those with red cell distribution width <13% (25th percentile) (p=0.014). Patients with red cell distribution width >14.4% at diagnosis were at a higher risk of locoregional recurrence (hazard ratio=5.818, 95% confidence interval (95% CI) 1.25–26.97; p=0.024) than patients with a normal red cell distribution width (<13%).
ConclusionWe found that the pretreatment red cell distribution width was independently prognostic of disease free survival rate in patients with laryngeal cancer and may serve as a new, accurate, and reproducible means of identifying early‐stage laryngeal cancer patients with poorer prognoses.
Embora a amplitude de distribuição de eritrócitos tenha sido relatada como um preditor confiável de prognóstico em vários tipos de câncer, que seja de nosso conhecimento, poucos estudos se concentraram no valor prognóstico dessa medida no carcinoma laríngeo.
ObjetivoAvaliar se a amplitude de distribuição de eritrócitos pré‐tratamento prevê a recorrência em pacientes com câncer de laringe como um biomarcador prognóstico simples, reprodutível e não dispendioso.
MétodoForam avaliados todos os pacientes com câncer de laringe submetidos à cirurgia curativa (n=132) durante sete anos. Dados demográficos, local do tumor primário, estágio T, estágio N, características histológicas (diferenciação; presença de invasão perineural/perivascular), grupo de tratamento (laringectomia total ou laringectomia parcial) ou terapia adjuvante (quimioterapia/radioterapia); parâmetros laboratoriais (hemograma, inclusive a amplitude de distribuição de eritrócitos pré‐operatório) e a sobrevida livre de doença foram revisados retrospectivamente. Todos os casos foram divididos em três grupos pelo tercil da amplitude de distribuição de eritrócitos [< 13% (percentil 25) (n=31), 13%–14,4% (percentil 50) (n=72) e > 14,4% (percentil 75) (n=29)].
ResultadosO grupo com amplitude de distribuição de eritrócitos elevado incluiu um número maior de pacientes com idade avançada e mais pacientes com tumores recorrentes e metastáticos (p=0,005, 0,048 e 0,043, respectivamente). Os indivíduos com a amplitude de distribuição de eritrócitos > 14,4% (percentil 75) apresentaram taxas de sobrevida livre de doença menores do que aqueles com a amplitude de distribuição de eritrócitos < 13% (percentil 25) (p=0,014). Pacientes com a amplitude de distribuição de eritrócitos > 14,4% no diagnóstico apresentaram maior risco de recorrência locorregional [Hazard Ratio=5,818, intervalo de confiança de 95% (IC 95%) 1,25–26,97; p=0,024] do que pacientes com a amplitude de distribuição de eritrócitos normal (< 13%).
ConclusãoVerificamos que a amplitude de distribuição de eritrócitos pré‐tratamento foi um fator prognóstico independente de sobrevida livre de doença em pacientes com câncer de laringe e pode servir como um novo parâmetro, preciso e reprodutível, para identificar pacientes com câncer de laringe em estágio inicial com piores prognósticos.
Nos últimos anos, os marcadores hematológicos sistêmicos têm se tornado cada vez mais reconhecidos como prognósticos dos desfechos de lesões malignas. A amplitude de distribuição de eritrócitos (RDW, do inglês Red cell Distribution Width), rotineiramente medida no hemograma completo, reflete a extensão da heterogeneidade do tamanho dos eritrócitos (ou seja, o nível de anisocitose). O índice RDW é um marcador da resposta inflamatória sistêmica e muitos estudos exploraram a relação entre o RDW e doença cardiovascular e condições inflamatórias.1–6 Recentemente, o RDW mostrou ser de utilidade prognóstica em pacientes com diferentes lesões malignas.7–9 Um estudo anterior indicou que o RDW poderia prever a sobrevida de pacientes com câncer de laringe.10
O carcinoma de células escamosas de laringe (CCEL) é uma das lesões malignas mais comuns em todo o mundo e a identificação de fatores prognósticos pode melhorar os desfechos dos pacientes. Os fatores prognósticos conhecidos incluem estágio T, extensão extracapsular, envolvimento cervical e resultados do tratamento cirúrgico.11,12 Esses fatores são associados ao estágio da doença; pouco se sabe sobre fatores prognósticos não relacionados à doença. Embora certas assinaturas moleculares tenham sido usadas para estratificar a sobrevida em diferentes coortes de pacientes com CCEL,13–15 um biomarcador prognóstico simples, reproduzível e não dispendioso para uso no ambiente clínico ainda não se encontra disponível. O hemograma é um teste simples, reprodutível e barato. Assim, nosso objetivo foi avaliar se o RDW pré‐tratamento poderia prever a recorrência em pacientes com câncer de laringe.
Material e métodoDepois de obter a aprovação do Comitê de Ética local (n° 812‐13/06/2017), revisamos retrospectivamente os dados de 132 pacientes consecutivos, submetidos à cirurgia para tratamento de CCEL entre 2002 e 2009 em nossa unidade. Obtivemos dados demográficos e informações sobre estadiamento, exames laboratoriais pré‐operatórios, tratamentos e desfechos (conforme registrados em anotações sobre o caso, diários cirúrgicos e em nossos bancos de dados eletrônicos de pacientes e histopatológicos). Infelizmente, alguns relatórios da patologia não estavam claros ou faltavam. Dados pouco claros foram omitidos da análise.
Foram incluídos pacientes com câncer de laringe confirmado histopatologicamente e aqueles submetidos à ressecção curativa (laringectomia parcial ou total com esvaziamento cervical). Os critérios de exclusão foram: (1) tratamento não cirúrgico (quimioterapia/radioterapia); (2) câncer de laringe recorrente ou outro tipo histológico de câncer de laringe diferente do carcinoma de células escamosas (por exemplo, tumores estromais e tumores neuroendócrinos); (3) prescrição de terapia neoadjuvante; (4) downstaging histopatológico de tumores para o estágio I ou II a partir do estágio III ou IV; (5) frente coesiva ou margem de excisão positiva; (6) qualquer lesão maligna in situ; e (7) um relatório histopatológico pouco claro. Todos os pacientes foram estadiados com o sistema AJCC/UICC‐TNM para o câncer de laringe (7ª edição).16 As variáveis usadas para estratificar a sobrevida incluíram idade, local do tumor primário, estágio T, estágio N, características histológicas (diferenciação, presença de invasão perineural/perivascular), terapêutica do grupo de tratamento (laringectomia total – LT ou laringectomia parcial – LP) ou terapia adjuvante (quimioterapia – QT/radioterapia – RT); parâmetros laboratoriais (hemograma completo, inclusive o RDW pré‐operatório) e a sobrevida livre de doença (SLD). Todos os pacientes foram divididos em dois grupos em relação ao estágio: inicial (T‐estágios I e II) (n=73) e avançado (T‐estágios III e IV) (n=59). O acompanhamento incluiu exames clínicos a cada 3‐6 meses durante os dois primeiros anos e exames anuais subsequentes. Isso garantiu uma duração do seguimento ≥ 5 anos. A SLD foi considerada como o período a partir da data do diagnóstico até a data da recorrência locorregional ou até o último seguimento. Somente 10 pacientes foram a óbito durante o seguimento (quatro devido ao câncer); assim, a sobrevida global não pôde ser calculada. A recorrência a distância (RD) foi diagnosticada clinicamente (inclusive através de punção aspirativa com agulha fina guiada por ultrassom) ou por exame de imagem (tomografia computadorizada – TC ou tomografia por emissão de pósitrons – PET). Todas as recorrências foram comprovadas por biópsia, exceto nos pacientes nos quais a comorbidade ou a progressão da doença tornaram as biópsias invasivas contraindicadas.
EstatísticaTodas as análises estatísticas foram feitas com o auxílio do programa de software SPSS versão 15.0 para Windows. As estatísticas descritivas são expressas como médias±desvios‐padrão (DP) e medianas (variáveis contínuas), ou como frequências com porcentagens (variáveis categóricas). Todos os casos foram divididos em três grupos pelo tercil do RDW [< 13% (percentil 25), 13%–14,4% (percentil 50) e>14,4% (percentil 75)]. Diferenças clinicamente relevantes foram definidas com o teste qui‐quadrado ou via simulação de Monte Carlo, conforme apropriado. Os parâmetros contínuos e categóricos foram comparados com o teste t para amostras independentes ou o teste U de Mann‐Whitney e o teste qui‐quadrado, respectivamente. A sobrevida foi avaliada com o auxílio do teste log‐rank de Kaplan‐Meier. As mortes por causas diferentes do câncer foram censuradas nas datas de óbito antes da análise DSS (do inglês Decision Support System). As variáveis potencialmente prognósticas nas análises univariadas foram submetidas a análises multivariadas com o modelo de regressão de riscos proporcionais de Cox. Um valor de p bilateral <0,05 foi considerado estatisticamente significante.
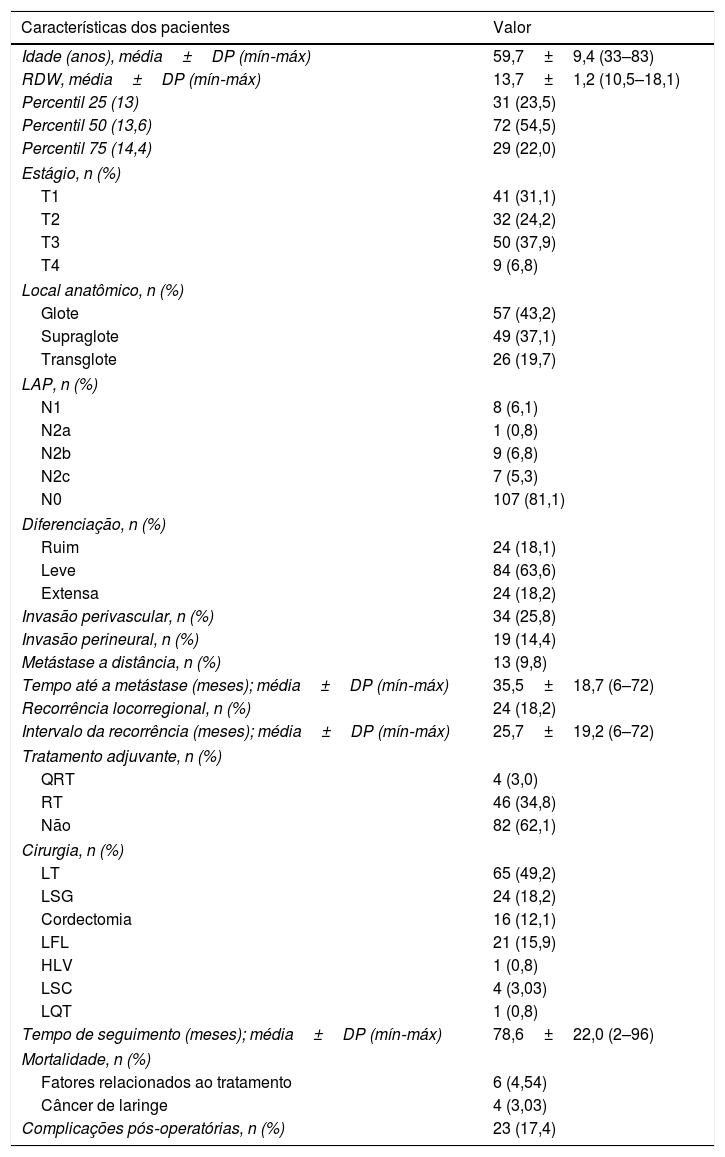
ResultadosAvaliamos 132 homens com média de 59,7±9,4 anos (variação de 33‐83). O RDW médio (%) de toda a coorte foi de 13,7±1,2 (percentil 25‐75: 13–14,4). No total, 31 pacientes apresentaram RDW <13% (percentil 25), 72 tinham RDW de 13%–14,4% (percentil 50) e 29 tinham RDW>14,4% (percentil 75); 24 pacientes (18,2%) desenvolveram recorrências locorregionais durante o seguimento. Durante a mediana do período de seguimento de 78,6±22,0 meses (intervalo 2‐96), a mortalidade geral foi de 7,5% (n=10). A maioria das mortes foi atribuída a outros fatores que não as lesões malignas índice (portanto, a complicações relacionadas ao tratamento ou causas não relacionadas/desconhecidas). Quatro pacientes foram a óbito em decorrência da própria doença; 13 pacientes (9,8%) desenvolveram metástases a distância (tabela 1).
Dados demográficos e características clínicas dos pacientes
| Características dos pacientes | Valor |
|---|---|
| Idade (anos), média±DP (mín‐máx) | 59,7±9,4 (33–83) |
| RDW, média±DP (mín‐máx) | 13,7±1,2 (10,5–18,1) |
| Percentil 25 (13) | 31 (23,5) |
| Percentil 50 (13,6) | 72 (54,5) |
| Percentil 75 (14,4) | 29 (22,0) |
| Estágio, n (%) | |
| T1 | 41 (31,1) |
| T2 | 32 (24,2) |
| T3 | 50 (37,9) |
| T4 | 9 (6,8) |
| Local anatômico, n (%) | |
| Glote | 57 (43,2) |
| Supraglote | 49 (37,1) |
| Transglote | 26 (19,7) |
| LAP, n (%) | |
| N1 | 8 (6,1) |
| N2a | 1 (0,8) |
| N2b | 9 (6,8) |
| N2c | 7 (5,3) |
| N0 | 107 (81,1) |
| Diferenciação, n (%) | |
| Ruim | 24 (18,1) |
| Leve | 84 (63,6) |
| Extensa | 24 (18,2) |
| Invasão perivascular, n (%) | 34 (25,8) |
| Invasão perineural, n (%) | 19 (14,4) |
| Metástase a distância, n (%) | 13 (9,8) |
| Tempo até a metástase (meses); média±DP (mín‐máx) | 35,5±18,7 (6–72) |
| Recorrência locorregional, n (%) | 24 (18,2) |
| Intervalo da recorrência (meses); média±DP (mín‐máx) | 25,7±19,2 (6–72) |
| Tratamento adjuvante, n (%) | |
| QRT | 4 (3,0) |
| RT | 46 (34,8) |
| Não | 82 (62,1) |
| Cirurgia, n (%) | |
| LT | 65 (49,2) |
| LSG | 24 (18,2) |
| Cordectomia | 16 (12,1) |
| LFL | 21 (15,9) |
| HLV | 1 (0,8) |
| LSC | 4 (3,03) |
| LQT | 1 (0,8) |
| Tempo de seguimento (meses); média±DP (mín‐máx) | 78,6±22,0 (2–96) |
| Mortalidade, n (%) | |
| Fatores relacionados ao tratamento | 6 (4,54) |
| Câncer de laringe | 4 (3,03) |
| Complicações pós‐operatórias, n (%) | 23 (17,4) |
HLV, hemilaringectomia vertical; LAP, linfadenopatia; LFL, laringectomia frontolateral; LQT, laringectomia quase‐total; LSC, laringectomia supracricoide; LSG, laringectomia supraglótica; LT, laringectomia total; QRT, quimiorradioterapia; RDW, amplitude de distribuição de eritrócitos; RT, radioterapia; SDP, desvio‐padrão.
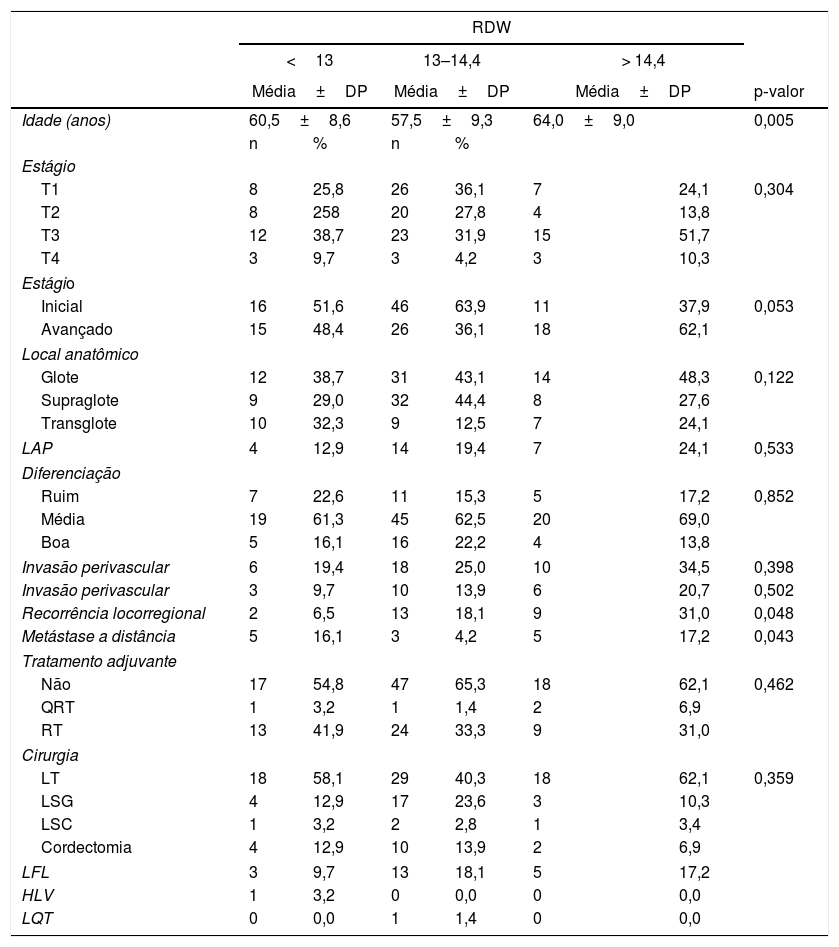
As características dos pacientes estratificados pelo RDW pré‐tratamento são mostradas na tabela 2. Não encontramos correlação significativa entre RDW e o estágio T, local do tumor, envolvimento linfonodal, extensão da diferenciação histológica, nível de invasão perivascular ou peritumoral, escolha cirúrgica ou quimiorradioterapia adjuvante (sim ou não). No entanto, o grupo com RDW elevado incluiu um número maior de pacientes com idade avançada e mais pacientes com tumores recorrentes e metastáticos (p=0,005, 0,048 e 0,043, respectivamente). Na análise de subgrupos, os pacientes com RDW>14,4% (percentil 75) apresentaram maior probabilidade de desenvolver recorrências locorregionais do que aqueles com RDW <13% (percentil 25) (p=0,014). Entretanto, a diferença entre pacientes com RDW>14,4% (percentil 75) e RDW 13%–14,4% (percentil 50) não foi significativa (p=0,153). Por outro lado, o grupo com RDW elevado (percentil 75) incluiu mais pacientes idosos do que o grupo do percentil 50 (p=0,004). Metástases a distância foram mais frequentes no grupo RDW no percentil 75 do que o grupo RDW no percentil 50 (17,2 vs. 4,2%; p=0,042) (tabela 2).
Características clínico‐patológicas de pacientes com câncer de laringe por tercil de RDW
| RDW | |||||||
|---|---|---|---|---|---|---|---|
| <13 | 13–14,4 | > 14,4 | |||||
| Média±DP | Média±DP | Média±DP | p‐valor | ||||
| Idade (anos) | 60,5±8,6 | 57,5±9,3 | 64,0±9,0 | 0,005 | |||
| n | % | n | % | ||||
| Estágio | |||||||
| T1 | 8 | 25,8 | 26 | 36,1 | 7 | 24,1 | 0,304 |
| T2 | 8 | 258 | 20 | 27,8 | 4 | 13,8 | |
| T3 | 12 | 38,7 | 23 | 31,9 | 15 | 51,7 | |
| T4 | 3 | 9,7 | 3 | 4,2 | 3 | 10,3 | |
| Estágio | |||||||
| Inicial | 16 | 51,6 | 46 | 63,9 | 11 | 37,9 | 0,053 |
| Avançado | 15 | 48,4 | 26 | 36,1 | 18 | 62,1 | |
| Local anatômico | |||||||
| Glote | 12 | 38,7 | 31 | 43,1 | 14 | 48,3 | 0,122 |
| Supraglote | 9 | 29,0 | 32 | 44,4 | 8 | 27,6 | |
| Transglote | 10 | 32,3 | 9 | 12,5 | 7 | 24,1 | |
| LAP | 4 | 12,9 | 14 | 19,4 | 7 | 24,1 | 0,533 |
| Diferenciação | |||||||
| Ruim | 7 | 22,6 | 11 | 15,3 | 5 | 17,2 | 0,852 |
| Média | 19 | 61,3 | 45 | 62,5 | 20 | 69,0 | |
| Boa | 5 | 16,1 | 16 | 22,2 | 4 | 13,8 | |
| Invasão perivascular | 6 | 19,4 | 18 | 25,0 | 10 | 34,5 | 0,398 |
| Invasão perivascular | 3 | 9,7 | 10 | 13,9 | 6 | 20,7 | 0,502 |
| Recorrência locorregional | 2 | 6,5 | 13 | 18,1 | 9 | 31,0 | 0,048 |
| Metástase a distância | 5 | 16,1 | 3 | 4,2 | 5 | 17,2 | 0,043 |
| Tratamento adjuvante | |||||||
| Não | 17 | 54,8 | 47 | 65,3 | 18 | 62,1 | 0,462 |
| QRT | 1 | 3,2 | 1 | 1,4 | 2 | 6,9 | |
| RT | 13 | 41,9 | 24 | 33,3 | 9 | 31,0 | |
| Cirurgia | |||||||
| LT | 18 | 58,1 | 29 | 40,3 | 18 | 62,1 | 0,359 |
| LSG | 4 | 12,9 | 17 | 23,6 | 3 | 10,3 | |
| LSC | 1 | 3,2 | 2 | 2,8 | 1 | 3,4 | |
| Cordectomia | 4 | 12,9 | 10 | 13,9 | 2 | 6,9 | |
| LFL | 3 | 9,7 | 13 | 18,1 | 5 | 17,2 | |
| HLV | 1 | 3,2 | 0 | 0,0 | 0 | 0,0 | |
| LQT | 0 | 0,0 | 1 | 1,4 | 0 | 0,0 | |
| Análise de subgrupos | Idade | Recorrência locorregional | Metástase a distância | |
|---|---|---|---|---|
| RDW | p‐valor | p‐valor | p‐valor | |
| <13 | 13–14,4 | 0,284 | 0,221 | 0,051 |
| > 14,4 | 0,285 | 0,014 | 1,000 | |
| 13–14,4 | > 14,4 | 0,004 | 0,153 | 0,042 |
DP, desvio‐padrão; HLV, hemilaringectomia vertical; LAP, linfadenopatia; LFL, laringectomia frontolateral; LQT, laringectomia quase‐total; LSC, laringectomia supracricoide; LSG, laringectomia supraglótica; LT, laringectomia total; QRT, quimiorradioterapia; RDW, amplitude de distribuição de eritrócitos; RT, radioterapia.
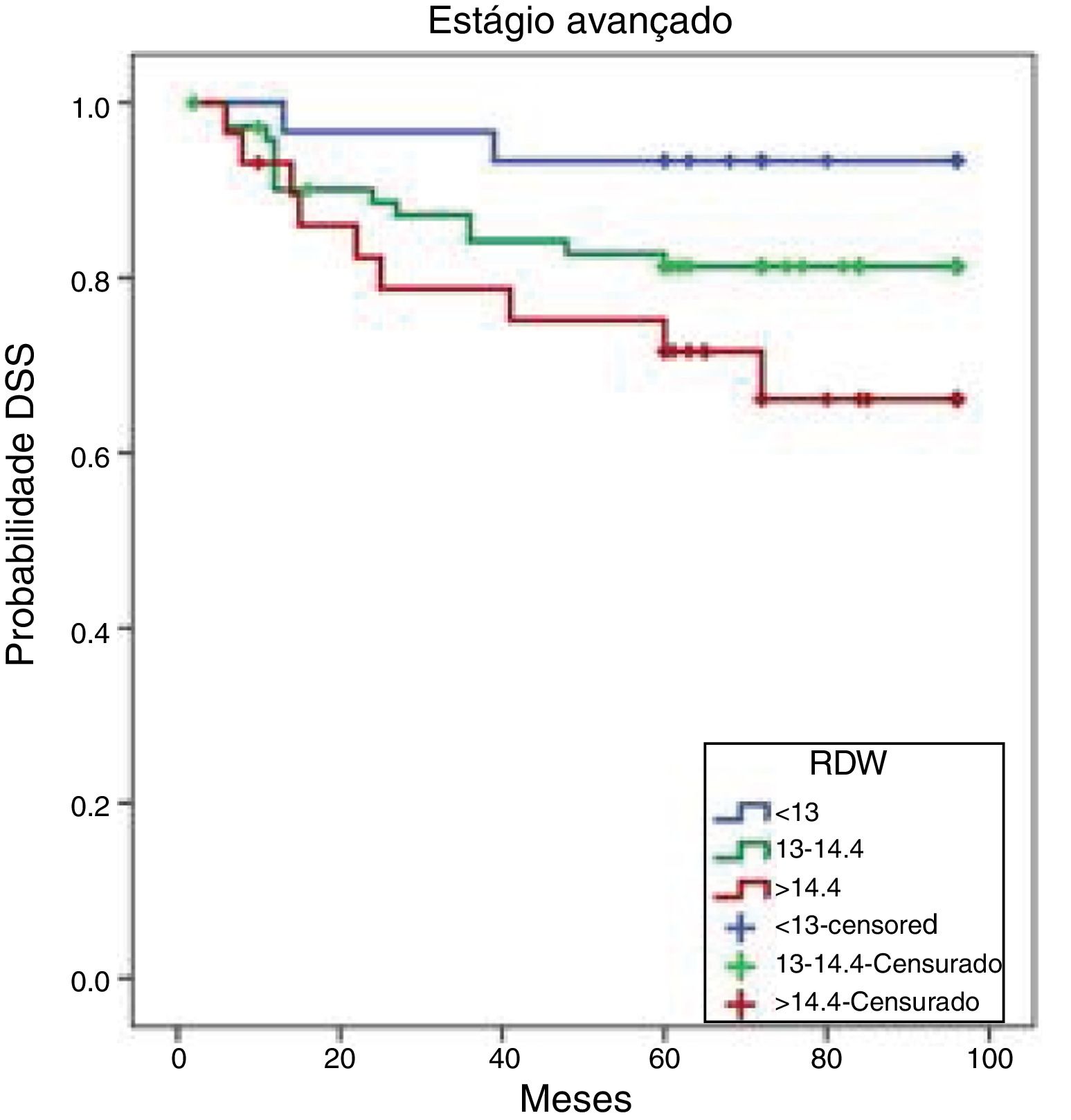
As taxas de SLD de oito anos foram de 93,3%, 81,3% e 66,1% entre os pacientes nos percentis 25, 50 e 75, respectivamente. As diferenças da SLD entre os três grupos foram estatisticamente significativas (p=0,049). Os indivíduos com RDW>14,4% (percentil 75) apresentaram taxas de SLD menores do que aqueles que apresentaram RDW <13% (percentil 25) (p=0,014) (fig. 1)
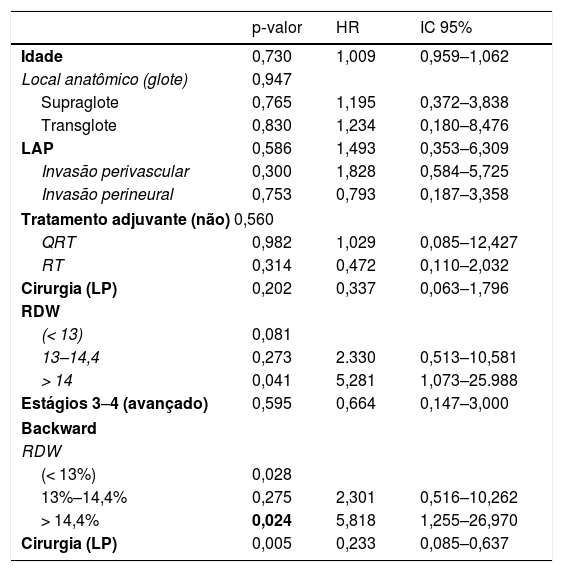
O RDW apresentou significância prognóstica independente. O RDW ao diagnóstico em pacientes com câncer de laringe foi um preditor independente de recorrência locorregional, como revelado por uma análise multivariada (tabela 3). Pacientes com RDW>14,4% ao diagnóstico apresentaram maior risco de recorrência locorregional (Hazard Ratio – HR=5,818; intervalo de confiança de 95%: IC 95%: 1,25–26,97; p=0,024) do que pacientes com RDW <13%. A laringectomia parcial (LP) também foi um preditor independente de SLD (HR=0,233; IC 95%: 0,085‐0,637; p=0,005).
Análise multivariada de fatores prognósticos de progressão do câncer de laringe, conforme demonstrado pela modelagem de regressão
| p‐valor | HR | IC 95% | |
|---|---|---|---|
| Idade | 0,730 | 1,009 | 0,959–1,062 |
| Local anatômico (glote) | 0,947 | ||
| Supraglote | 0,765 | 1,195 | 0,372–3,838 |
| Transglote | 0,830 | 1,234 | 0,180–8,476 |
| LAP | 0,586 | 1,493 | 0,353–6,309 |
| Invasão perivascular | 0,300 | 1,828 | 0,584–5,725 |
| Invasão perineural | 0,753 | 0,793 | 0,187–3,358 |
| Tratamento adjuvante (não) 0,560 | |||
| QRT | 0,982 | 1,029 | 0,085–12,427 |
| RT | 0,314 | 0,472 | 0,110–2,032 |
| Cirurgia (LP) | 0,202 | 0,337 | 0,063–1,796 |
| RDW | |||
| (< 13) | 0,081 | ||
| 13–14,4 | 0,273 | 2.330 | 0,513–10,581 |
| > 14 | 0,041 | 5,281 | 1,073–25.988 |
| Estágios 3–4 (avançado) | 0,595 | 0,664 | 0,147–3,000 |
| Backward | |||
| RDW | |||
| (< 13%) | 0,028 | ||
| 13%–14,4% | 0,275 | 2,301 | 0,516–10,262 |
| > 14,4% | 0,024 | 5,818 | 1,255–26,970 |
| Cirurgia (LP) | 0,005 | 0,233 | 0,085–0,637 |
HR, Hazard Ratio; IC, intervalo de confiança; LAP, linfadenopatia; LP, laringectomia parcial; QRT, quimiorradioterapia; RDW, amplitude de distribuição dos eritrócitos; RT, radioterapia.
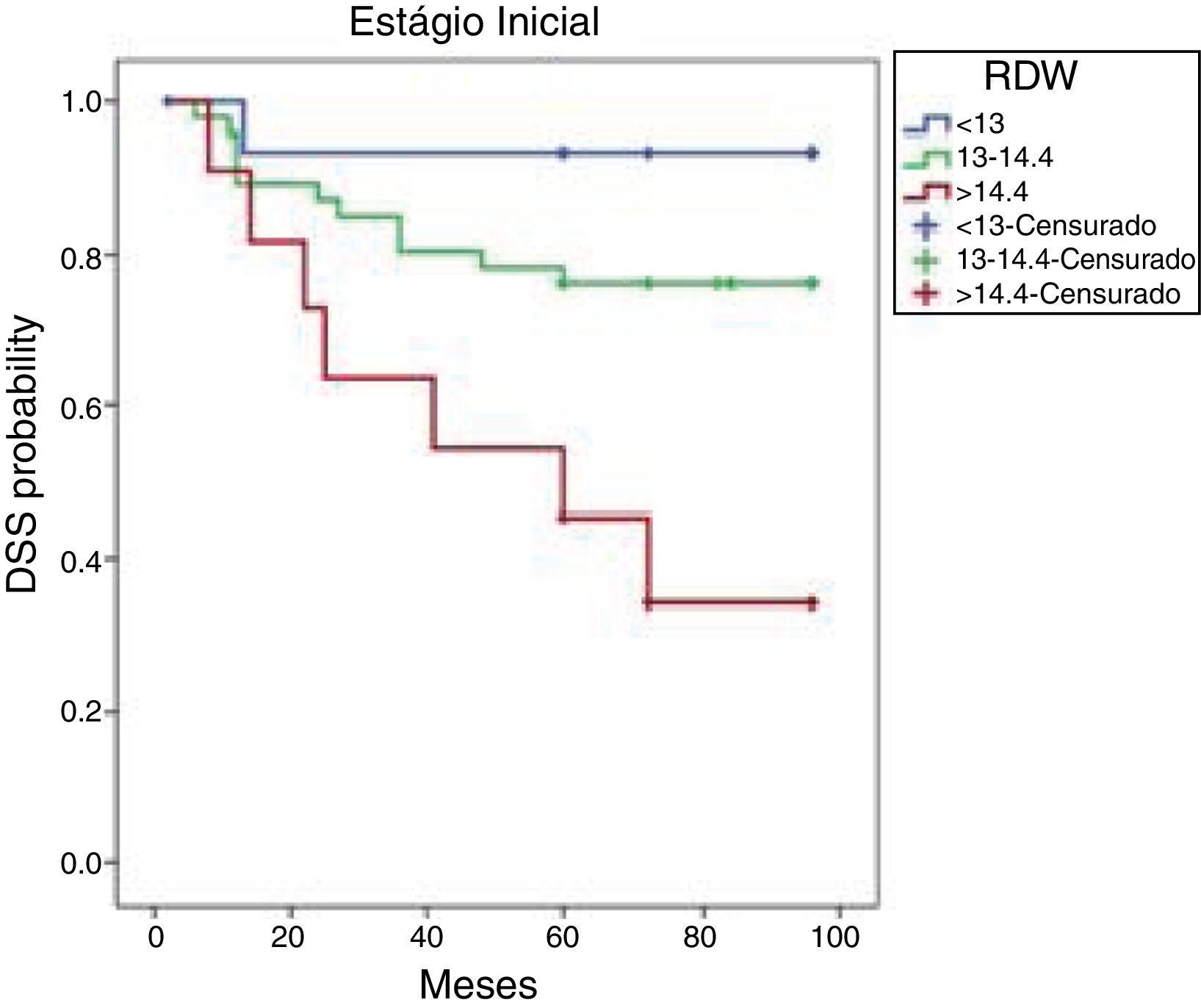
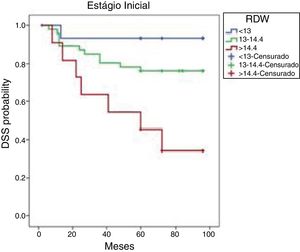
Para maior clareza, as características do paciente e os desfechos do tratamento para aqueles tratados com intenção curativa são apresentados separadamente daqueles com tumores nos estágios T1–2 e T3–4. As curvas cumulativas de Kaplan‐Meier de SLD baseadas no RDW de pacientes em estágio inicial são mostradas na figura 2. As taxas de SLD de oito anos foram 93,3, 76,1 e 34,1 nos tercis de 25%, 50% e 75%, respectivamente. As taxas de SLD dos três grupos diferiram significantemente (p=0,004). Em uma mediana de seguimento de 78,6 (2‐96) meses, os pacientes com RDW <13% (percentil 25) apresentaram uma SLD melhor do que aqueles com RDW>14,4% (percentil 75) (p=0,003).
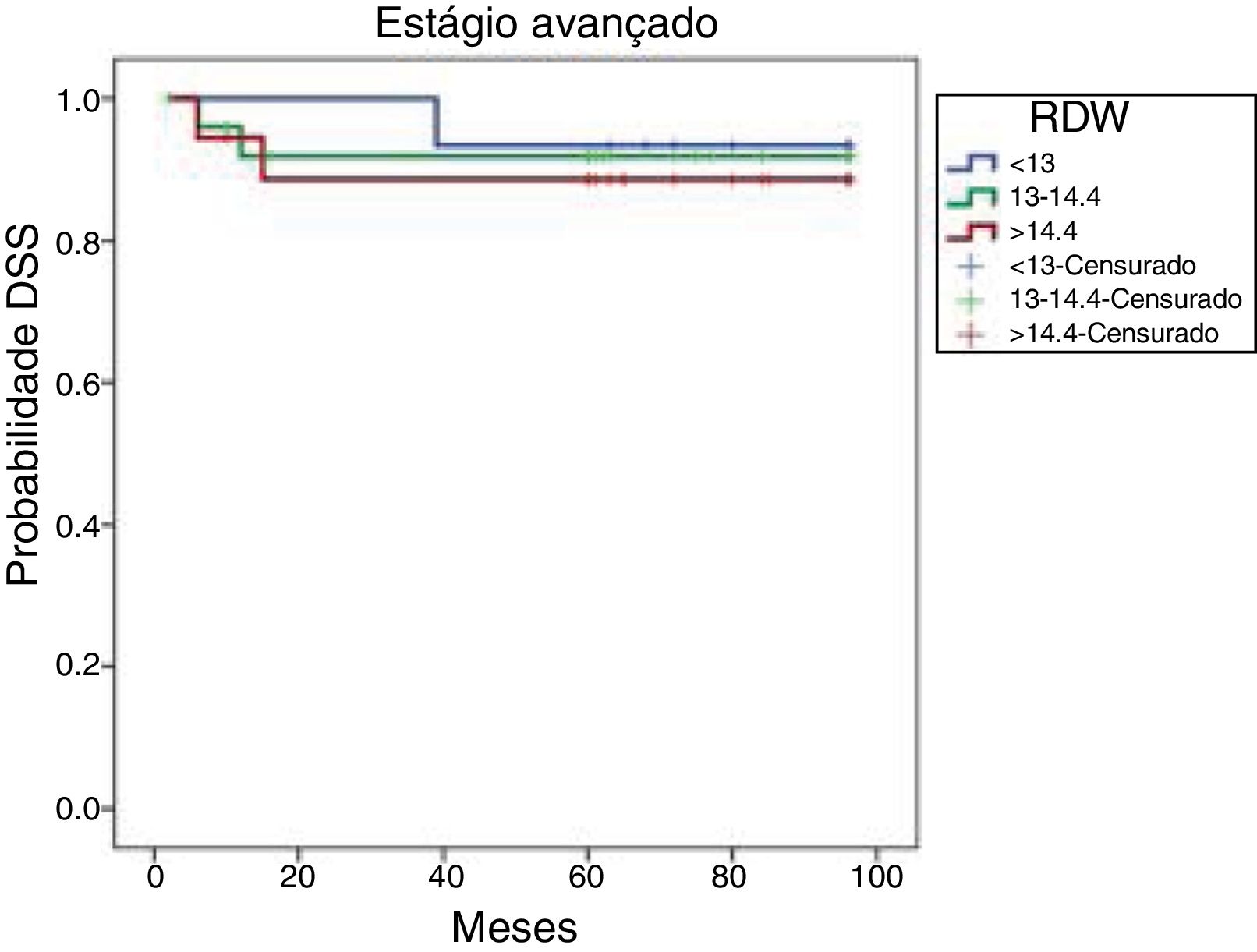
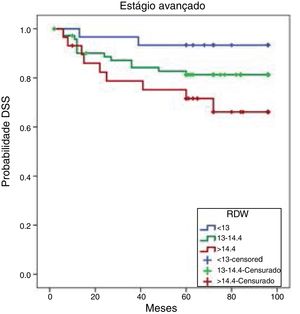
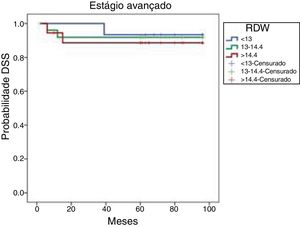
As taxas de SLD cumulativas de Kaplan‐Meier baseadas no RDW de pacientes em estágio avançado são mostradas na figura 3. As SLDs de oito anos foram 93,3%, 91,8% e 88,5% nos tercis de 25%, 50% e 75%, respectivamente. Essas taxas de SLD não diferiram significantemente (p=0,875).
DiscussãoAcredita‐se amplamente que a inflamação peritumoral desempenha papéis cruciais no início e na progressão do câncer. Estudos recentes verificaram que marcadores inflamatórios pré‐tratamento facilmente mensuráveis podem ser usados para prever a sobrevida e a recorrência do carcinoma de células escamosas de cabeça e pescoço (CCECP), independentemente do estágio TNM.17–19 Além disso, marcadores inflamatórios elevados, inclusive a relação neutrófilo/linfócitos (N/L) e a razão plaquetas‐linfócitos, foram associados a uma sobrevida menor de pacientes com câncer de laringe.10,20,21 A inflamação inibe a maturação dos eritrócitos ao alterar a membrana celular, eleva assim o RDW.22 Muitos autores procuram uma melhor compreensão dessa relação, dadas as possibilidades prognósticas e terapêuticas. O RDW é um marcador simples da resposta inflamatória sistêmica e recentemente foi descrito como tendo influência negativa nos resultados clínicos de vários tipos de câncer.23,24 No entanto, poucos trabalhos se concentraram no CCECP.
Neste relato, apresentamos nossos principais achados: 1) Os pacientes com RDW mais elevados (> 14,4%) apresentaram maior chance de metástases a distância durante o tratamento (p=0,043); e 2) A SLD foi correlacionada negativamente com o RDW pré‐operatório. Além disso, os pacientes com RDW <13% (percentil 25) apresentaram melhor SLD do que os pacientes com RDW>14,4%, que pode ser um limiar adequado para a predição de recorrência; esses pacientes exigem atenção especial. No entanto, Kara et al.10 não encontraram diferença nos RDW de pacientes com recorrência local ou regional e relataram que um RDW maior aumentou a mortalidade 4,6 vezes e foi um prognóstico independente da mortalidade em pacientes com câncer de laringe. No presente estudo, apenas quatro de nossos pacientes foram a óbito pelo câncer de laringe; dessa forma, não conseguimos comparar as taxas de mortalidade. As complicações crônicas associadas ao tratamento prévio podem causar mortalidade; muitas mortes “censuradas” podem, de fato, ser atribuídas a eventos relacionados ao tratamento. Em 1990, Howell‐Burke et al.25 fizeram uma observação semelhante ao estudar 114 pacientes com câncer glótico T2, dos quais apenas sete morreram da doença. Ward et al.26 observaram que o tratamento das comorbidades clínicas era uma característica fundamental da sobrevida. Nossos achados sugerem que os desfechos dos pacientes provavelmente são explicados por uma combinação de fatores complexos e inter‐relacionados específicos para esse paciente, e não pelos efeitos dos tumores primários em si. Embora não tenhamos encontrado diferenças significativas na sobrevida global (SG), não podemos excluir a possibilidade de uma série maior produzir dados mais representativos associados a uma diferença estatisticamente significante nas taxas de SG.
Artigos previamente publicados na literatura estão de acordo com nossos achados sobre o fato de que o grupo com RDW elevado incluiu mais pacientes com idade avançada. 27,28 O aumento da concentração de biomarcadores inflamatórios, juntamente com deficiências de folato e vitamina B, é parte do processo normal de envelhecimento.29 Portanto, um RDW mais elevado deve ser esperado em idosos. O RDW também reflete a anisocitose em pacientes com várias doenças, inclusive doenças cardiovasculares, tromboembolismo venoso, câncer, diabetes, pneumonia adquirida na comunidade, doença pulmonar obstrutiva crônica e insuficiência hepática e renal.30 Um RDW aumentado pode ser uma característica de vários tipos de câncer em humanos. Yazici et al.31 verificaram que o RDW era um potencial biomarcador prognóstico em pacientes com câncer gástrico. Riedl et al.32 relataram que um RDW elevado previu uma SG ruim de forma independente em pacientes com vários tipos de câncer, inclusive câncer de cérebro, mama, cólon, rim ou câncer de pulmão; linfoma e mieloma múltiplo; e câncer de pâncreas, próstata ou estômago. O RDW de pacientes com câncer de cólon foi significativamente maior do que aquele de pacientes com pólipos colônicos.33 Verificamos que um RDW>14,4% resultou em aumento de 5,8 vezes da taxa de recorrência locorregional e foi prognóstico independente de SLD em pacientes com câncer de laringe.
O motivo da associação entre um RDW mais elevado e um desfecho ruim ainda não está claro. No entanto, tanto a inflamação quanto o mau estado nutricional podem exercer um papel.24,26 O RDW foi positivamente associado ao estágio do câncer em um estudo de Koma et al.24 Encontramos uma interação limítrofe significativa (p=0,053); pacientes com câncer de laringe avançado tinham um RDW pré‐operatório significantemente maior. No entanto, não encontramos relação significante entre quaisquer outras características tumorais associadas a um prognóstico ruim (extensão de diferenciação, envolvimento linfonodal ou invasão perivascular e perineural) em pacientes com RDW elevado.
Tem sido difícil identificar preditores confiáveis de recorrência locorregional após a cirurgia de câncer de laringe. Brandstorp‐Boesen et al.34 estudaram 1.615 pacientes com câncer de laringe. Os pacientes com câncer supraglótico, indivíduos mais jovens, aqueles com tumores no estágio T2‐T3 e pacientes tratados anteriormente ao período do estudo apresentaram maior risco de recorrência. Haapaniemi et al.35 estudaram pacientes com câncer de laringe na Finlândia. Aqueles com câncer glótico T2 ou supraglótico T2 inesperadamente apresentaram sobrevida ruim específica para a doença. Nenhuma explicação clara foi dada, mas as classificações erradas para os tumores T2‐T3 e a falta de intervenção cirúrgica durante o manejo foram sugeridas como explicações. Estudamos apenas os pacientes submetidos a cirurgia; Haapanemi et al.35 incluíram pacientes submetidos a quimiorradioterapia primária ou cirurgia. A alta frequência de recorrência em pacientes com carcinomas glóticos T2‐T3 está de acordo com nossos resultados. Digno de nota, a laringectomia total proporcionou a maior taxa de controle local da maioria dos tumores avançados.
O nosso estudo tem certas limitações. Todo o trabalho foi feito em um único centro e o número de pacientes foi pequeno. O trabalho foi de natureza retrospectiva e alguns dados (particularmente os relatórios histopatológicos) faltavam. Além disso, não avaliamos se o RDW estava associado à anemia e não medimos os níveis de ferro ou vitamina B12. No entanto, o RDW parece ser um preditor significativo de prognóstico do câncer da laringe. Assim, estudos prospectivos multicêntricos adicionais com um número maior de pacientes são justificados.
ConclusãoObservamos que o RDW pré‐tratamento foi prognóstico independente de SLD em pacientes com câncer de laringe. Considerando que o RDW é prontamente disponível, são necessários estudos adicionais de validação e viabilidade para determinar se o RDW normalmente é prognóstico para o câncer da laringe. Como o RDW é um parâmetro de rotina (não dispendioso), ele pode servir como um novo método, preciso e reprodutível, para identificar pacientes com câncer de laringe em estágio inicial com prognósticos piores. Ao planejar a laringectomia parcial na presença de valores de RDW superiores a 14,4%, deve‐se ter em mente que esses pacientes são mais propensos a desenvolver recorrências locorregionais após a cirurgia. No entanto, estudos prospectivos adicionais são necessários.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Bozkurt G, Korkut AY, Soytaş P, Dizdar SK, Erol ZN. The role of red cell distribution width in the locoregional recurrence of laryngeal cancer. Braz J Otorhinolaryngol. 2019;85:357–64.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.