Stomal recurrence is a troublesome complication after total laryngectomy. Despite a large number of studies having been performed, there is still controversy about which risk factors are most significant for the development of stomal recurrence.
ObjectiveThe objective of the present meta‐analysis was to analyze the potential factors leading to stomal recurrence after total laryngectomy.
MethodsPubMed, Web of Science, Cochrane Library, and Ovid databases were systematically searched using multiple search terms. Eighteen studies with 6462 patients were identified. The quality of evidence was assessed by The National Institute for Health and Clinical Excellence.
ResultsThe results showed that, tumor subsite (supraglottic vs. subglottic, RR=0.292, 95% CI 0.142‐0.600, p=0.001; glottic vs. subglottic, RR=0.344, 95% CI 0.175‐0.676, p=0.002), T stage (RR=0.461, 95% CI 0.286‐0.742, p=0.001), preoperative tracheotomy (RR=1.959, 95% CI 1.500‐2.558, p<0.001) were the high‐risk factors associated with the development of stomal recurrence.
ConclusionFrom the results of our study, tumor subsite, T stage and preoperative tracheotomy were the significant risk factors for stomal recurrence. Methodologically high‐quality comparative investigations are needed for further evaluation.
A recorrência estomal pós‐laringectomia total e é uma complicação de difícil manejo. Apesar de um grande número de estudos ter sido feito, ainda há controvérsias sobre quais fatores de risco são mais significativos para o seu desenvolvimento.
ObjetivoO objetivo da presente meta‐análise foi analisar os fatores potenciais para recorrência estomal após a laringectomia total.
MétodoAs bases de dados PubMed, Web of Science, Cochrane Library e Ovid foram sistematicamente pesquisadas com vários termos de busca. Dezoito estudos com 6.462 pacientes foram identificados. A qualidade da evidência foi avaliada pelo National Institute for Health and Clinical Excellence.
ResultadosOs resultados mostraram que o subsítio tumoral (supraglótico vs. subglótico, RR=0,292, IC 95% 0,142±0,600, p=0,001; glótico vs. subglótico, RR=0,344, IC 95% 0,175±0,676, p=0,002), estágio T (RR=0,461, IC 95% 0,286±0,742, p=0,001), traqueotomia pré‐operatória (RR=1,959, IC 95% 1.500±2.558, p<0,001) foram os fatores de alto risco associados ao desenvolvimento de recorrência estomal.
ConclusãoCom base nos resultados de nosso estudo, o subsítio do tumor, o estágio T e a traqueotomia pré‐operatória foram fatores de risco significativos para recorrência estomal. São necessárias investigações comparativas metodologicamente de alta qualidade para maior avaliação.
O carcinoma de laringe é uma das neoplasias de cabeça e pescoço mais comuns, representa aproximadamente 20% de todos os pacientes. A cada ano, aproximadamente 10.000 pessoas nos Estados Unidos da América são diagnosticadas e representam 2,4% das novas lesões malignas em todo o mundo a cada ano.1 A maioria dos casos de câncer é de carcinoma espinocelular e até 40% dos casos apresentam doença avançada.2 Dado o importante papel que a laringe desempenha na fala e comunicação humanas, é fundamental determinar o tratamento ideal para o câncer de laringe. A laringectomia é um dos pilares do tratamento do câncer de laringe há mais de 50 anos. Embora a laringectomia total (LT) ofereça benefício terapêutico significativo, ela está repleta de complicações em longo prazo. As principais complicações pós‐operatórias após a laringectomia incluem estenose laríngea e fístula faringoperiestomal.3,4 A recorrência estomal (RE) do câncer de laringe é considerada uma das complicações mais graves após a LT. É definida como “um infiltrado difuso de tecido neoplásico na junção de uma traqueia amputada e da pele”.5 De acordo com estudos anteriores, a taxa de incidência varia muito (2% a 25%)6 e embora sua incidência seja relativamente baixa, é quase universalmente fatal. Assim, ela constitui uma questão terapêutica muito complexa e frequentemente requer manejo individualizado.
Muitas investigações foram feitas para descobrir os fatores que contribuem para o desenvolvimento da RE. Atualmente, vários parâmetros têm sido considerados na literatura como predisponentes à RE, como localização primária,7–11 classificação histológica,11–13 momento da traqueotomia,11,14–16 radioterapia (RT) pré‐operatória,8,10,15 RT pós‐operatória,8,9,17 quimiorradioterapia pré‐operatória,18 grau de classificação T, 10,12,17 grau de classificação N, 9,12,19 fístula faringoperiestomal,20,21 margens cirúrgicas,11,13 e estado p53.22
Para os cirurgiões de cabeça e pescoço, uma melhor compreensão desses fatores de risco é fundamental na seleção dos pacientes e no planejamento operatório. Embora vários fatores tenham sido propostos como associados à RE em mais de um estudo, ainda existem resultados conflitantes quanto à sua importância. De fato, quais fatores de alto risco são mais significativos ainda estão sendo debatidos. Embora duas metanálises tenham sido publicadas sobre esse tópico,23,24 consideramos que uma delas incluiu número insuficiente de estudos23 e a outra se concentrou nos fatores de risco naqueles pacientes submetidos a LT e/ou laringectomia parcial.24 Assim, fizemos uma revisão sistemática e metanálise, a fim de investigar os potenciais fatores de risco para RE após LT.
MétodoEstratégia de buscaUma pesquisa sistemática foi feita em toda a literatura publicada em inglês, de janeiro de 1990 a junho de 2019. A pesquisa abrangente foi feita nos bancos de dados eletrônicos PubMed, Web of Science, Ovid e Cochrane Library. Foram usadas as seguintes palavras‐chave: câncer de laringe, laringectomia total, recorrência estomal, recorrência periestomal e recorrência na área do traqueostoma. A estratégia de busca foi ligeiramente ajustada de acordo com as exigências de diferentes bancos de dados. Estudos de revisão e bibliografias de outras investigações relevantes identificadas foram pesquisados a mão para identificar artigos adicionais.
Critérios de inclusão e exclusãoTodos os estudos clínicos precisavam atender aos seguintes critérios para este estudo: (1) diagnóstico comprovado de RE; (2) tinham de relatar pelo menos um dos fatores de risco para RE; (3) estudos clínicos comparativos de pacientes com câncer de laringe submetidos a LT, isoladamente ou associados ao esvaziamento cervical; (4) inclusão de um estudo de alta qualidade ou o mais recente quando dois estudos fossem publicados pela mesma instituição ou pelos mesmos autores. Os seguintes artigos foram excluídos: (1) a laringectomia parcial foi feita como tratamento cirúrgico; (2) cartas, comentários, opiniões de especialistas, revisões ou relatos de casos; (3) os resultados medidos não foram apresentados claramente nas publicações ou foi impossível extrair os dados apropriados dos artigos.
Extração de dados e avaliação de qualidadeDois revisores revisaram cada artigo independentemente e obtiveram os dados dos artigos através de um formulário padronizado. Os desacordos foram resolvidos através de discussão e, quando isso não resolveu as diferenças, uma terceira pessoa tomou a decisão final. Os seguintes dados foram extraídos: autores, ano de publicação, desenho do estudo, tamanho da amostra, taxa de RE, fatores de risco (localização do tumor, diferenciação tumoral, estágio T, LNM, LNM paratraqueal, RT pré‐operatória, RT pós‐operatória, traqueotomia pré‐operatória (TPO) e fístula faringoperiestomal. Não existe um padrão métrico de avaliação de qualidade amplamente aceito disponível para séries de casos. Assim, a qualidade foi avaliada com um dos formulários emitidos pelo National Institute for Health and Clinical Excellence. Esse mesmo padrão métrico de qualidade foi usado em outras metanálises semelhantes de estudos observacionais.25 Quanto à qualidade, os escores variaram de 0 (mais baixo) a 8 (mais alto) (tabela 1). O resultado da avaliação da qualidade para os estudos incluídos foi o seguinte: sete com escore 6, oito com escore 5 e três com escore 4.
Avaliação de qualidade para séries de casos
| 1 | Séries de casos coletadas em mais de um centro (por exemplo, estudo multicêntrico)? |
| 2 | A hipótese / propósito / objetivo do estudo está claramente descrito (a)? |
| 3 | Os critérios de inclusão e exclusão (definição de caso) são claramente relatados? |
| 4 | Há uma definição clara dos desfechos relatados? |
| 5 | Os dados foram coletados prospectivamente? |
| 6 | Existe uma afirmação explícita de que os pacientes foram recrutados consecutivamente? |
| 7 | Os principais achados do estudo estão claramente descritos? |
| 8 | Os resultados são estratificados (por exemplo, por estágio da doença, resultados de testes anormais e características do paciente)? |
Estimamos a razão de risco (RR) e o intervalo de confiança (IC) de 95% e reunimos dados de todos os artigos para avaliar as associações entre os fatores de risco potenciais e a RE. Os testes Q e estatística I2 foram usados para medir a heterogeneidade estatística entre os estudos. Quando o p‐valor do teste Q era >0,1 e I2<50%, um modelo de efeitos fixos foi usado; caso contrário, um modelo de efeitos aleatórios foi aplicado. A análise de sensibilidade foi feita por omissão sequencial de estudo individual para verificar a estabilidade do resultado. O viés de publicação foi estimado com avaliação visual da assimetria do gráfico em forma de funil de Begg.26 Finalmente, o teste de Egger foi usado para fornecer evidências quantitativas do viés de publicação.27 A análise estatística foi feita com o software STATA 12.0 (Stata Corporation, College Station, Texas, EUA) e Microsoft Excel 2010. Um valor de p<0,05 indicou diferença estatisticamente significante.
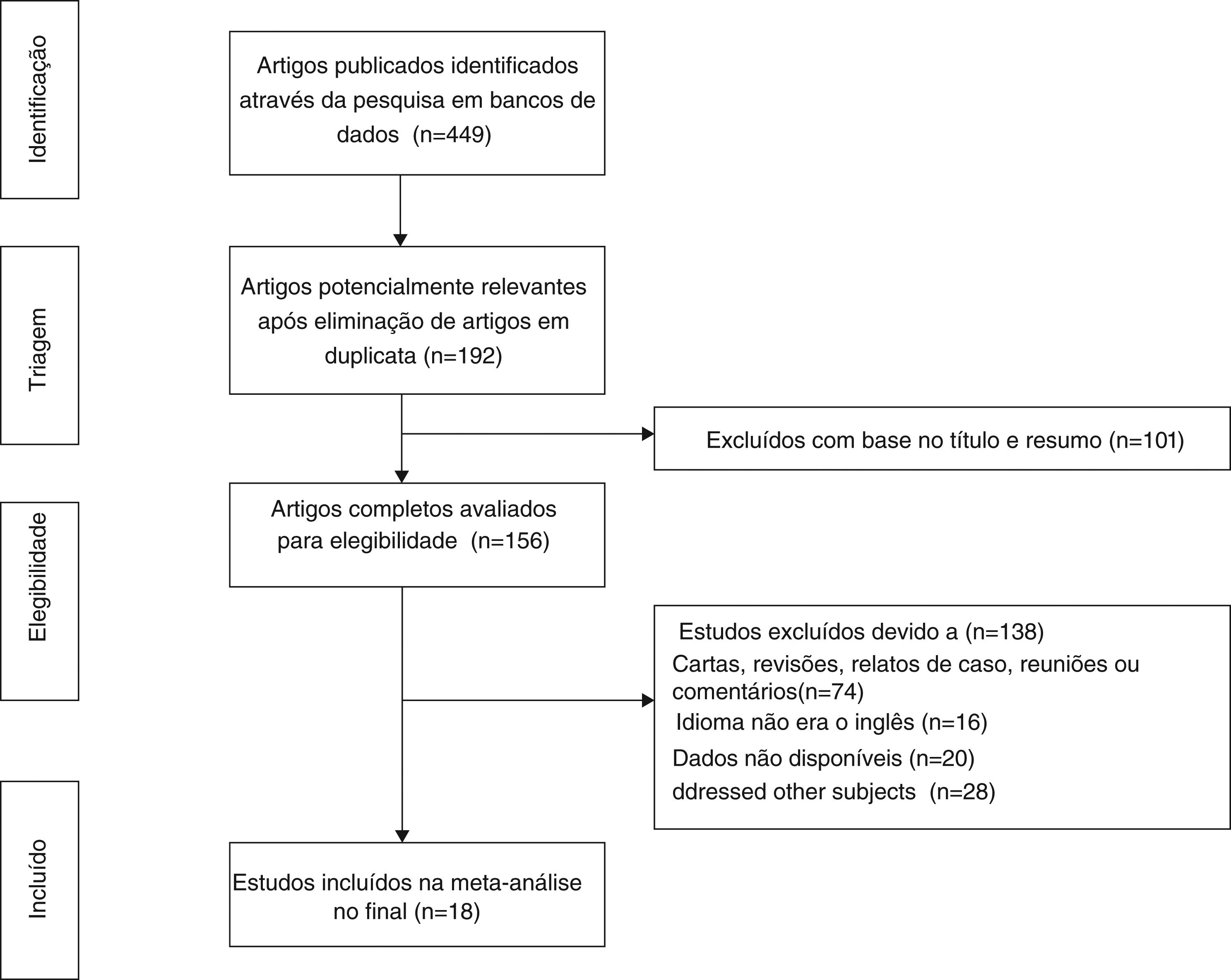
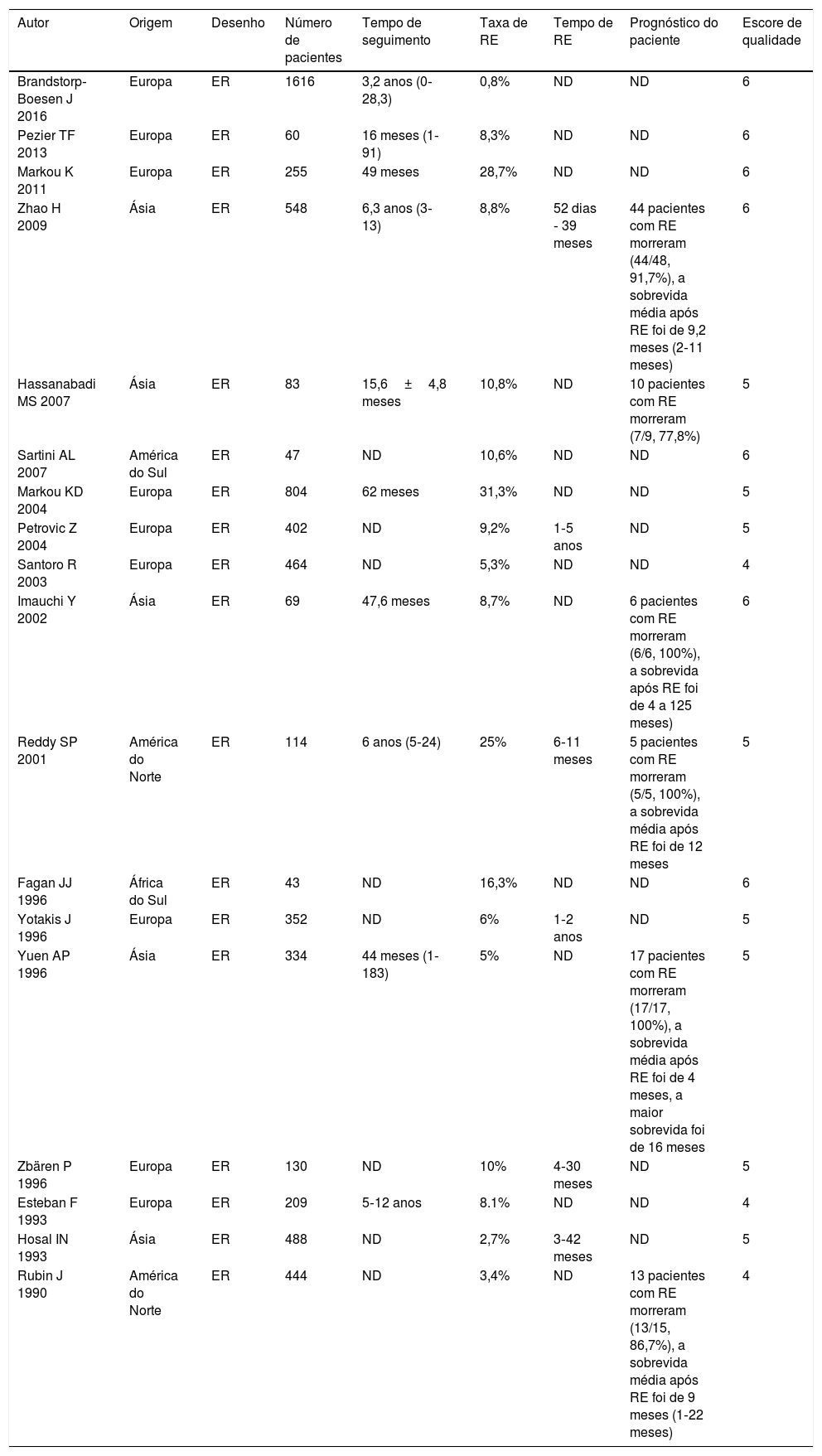
ResultadosSeleção de estudos e característicasForam recuperados inicialmente 449 artigos, de acordo com palavras‐chave específicas, 192 dos quais foram excluídos após a revisão inicial de estudos em duplicata e idioma. Aproximadamente 101 estudos foram excluídos após a triagem de títulos e resumos, restaram 156 artigos de texto completo para avaliação. Desses, devido a relatos de casos, revisões, atas de reuniões, resumos de conferências e estudos irrelevantes, 18 preencheram os critérios de inclusão e finalmente foram incluídos em nossa revisão.5,7–12,15,17,19–22,28–32 O diagrama de fluxo que ilustra o processo de busca e seleção de artigos é mostrado na figura 1. As características e a avaliação metodológica da qualidade são mostradas na tabela 2. Todos os artigos incluídos eram retrospectivos. O número total de pacientes incluídos foi de 6.462, variou de 43 a 1.616 pacientes por estudo. A taxa de RE variou de 0,8% a 31,3% e a RE foi diagnosticada de 52 dias a 5 anos após a LT.9,11,21,22,30,32 Quatrocentos e sessenta e sete pacientes apresentaram RE no pré‐operatório8,10,15,21 e 162 pacientes tiveram RE pós‐operatória.8,9,15,17,21 Três estudos relataram que os pacientes receberam quimioterapia pós‐operatória11,19,22 e apenas um estudo relatou que os pacientes receberam quimioterapia pré‐operatória.8 Entre os 18 estudos, 3 foram feitos na Grécia,12,20,30 2 na China,11,19 2 nos EUA,15,22 um no Reino Unido,5 um na África do Sul,29 um no Brasil,17 um no Irã,10 um na Sérvia e Montenegro,9 um na Noruega,28 um na Suíça,21 um no Japão,8 um na Itália,7 um na Turquia32 e um na Espanha.31
Principais características dos estudos incluídos
| Autor | Origem | Desenho | Número de pacientes | Tempo de seguimento | Taxa de RE | Tempo de RE | Prognóstico do paciente | Escore de qualidade |
|---|---|---|---|---|---|---|---|---|
| Brandstorp‐Boesen J 2016 | Europa | ER | 1616 | 3,2 anos (0‐28,3) | 0,8% | ND | ND | 6 |
| Pezier TF 2013 | Europa | ER | 60 | 16 meses (1‐91) | 8,3% | ND | ND | 6 |
| Markou K 2011 | Europa | ER | 255 | 49 meses | 28,7% | ND | ND | 6 |
| Zhao H 2009 | Ásia | ER | 548 | 6,3 anos (3‐13) | 8,8% | 52 dias ‐ 39 meses | 44 pacientes com RE morreram (44/48, 91,7%), a sobrevida média após RE foi de 9,2 meses (2‐11 meses) | 6 |
| Hassanabadi MS 2007 | Ásia | ER | 83 | 15,6±4,8 meses | 10,8% | ND | 10 pacientes com RE morreram (7/9, 77,8%) | 5 |
| Sartini AL 2007 | América do Sul | ER | 47 | ND | 10,6% | ND | ND | 6 |
| Markou KD 2004 | Europa | ER | 804 | 62 meses | 31,3% | ND | ND | 5 |
| Petrovic Z 2004 | Europa | ER | 402 | ND | 9,2% | 1‐5 anos | ND | 5 |
| Santoro R 2003 | Europa | ER | 464 | ND | 5,3% | ND | ND | 4 |
| Imauchi Y 2002 | Ásia | ER | 69 | 47,6 meses | 8,7% | ND | 6 pacientes com RE morreram (6/6, 100%), a sobrevida após RE foi de 4 a 125 meses) | 6 |
| Reddy SP 2001 | América do Norte | ER | 114 | 6 anos (5‐24) | 25% | 6‐11 meses | 5 pacientes com RE morreram (5/5, 100%), a sobrevida média após RE foi de 12 meses | 5 |
| Fagan JJ 1996 | África do Sul | ER | 43 | ND | 16,3% | ND | ND | 6 |
| Yotakis J 1996 | Europa | ER | 352 | ND | 6% | 1‐2 anos | ND | 5 |
| Yuen AP 1996 | Ásia | ER | 334 | 44 meses (1‐183) | 5% | ND | 17 pacientes com RE morreram (17/17, 100%), a sobrevida média após RE foi de 4 meses, a maior sobrevida foi de 16 meses | 5 |
| Zbären P 1996 | Europa | ER | 130 | ND | 10% | 4‐30 meses | ND | 5 |
| Esteban F 1993 | Europa | ER | 209 | 5‐12 anos | 8.1% | ND | ND | 4 |
| Hosal IN 1993 | Ásia | ER | 488 | ND | 2,7% | 3‐42 meses | ND | 5 |
| Rubin J 1990 | América do Norte | ER | 444 | ND | 3,4% | ND | 13 pacientes com RE morreram (13/15, 86,7%), a sobrevida média após RE foi de 9 meses (1‐22 meses) | 4 |
ER, ensaio retrospectivo; ND, não disponível; RE, recorrência estomal.
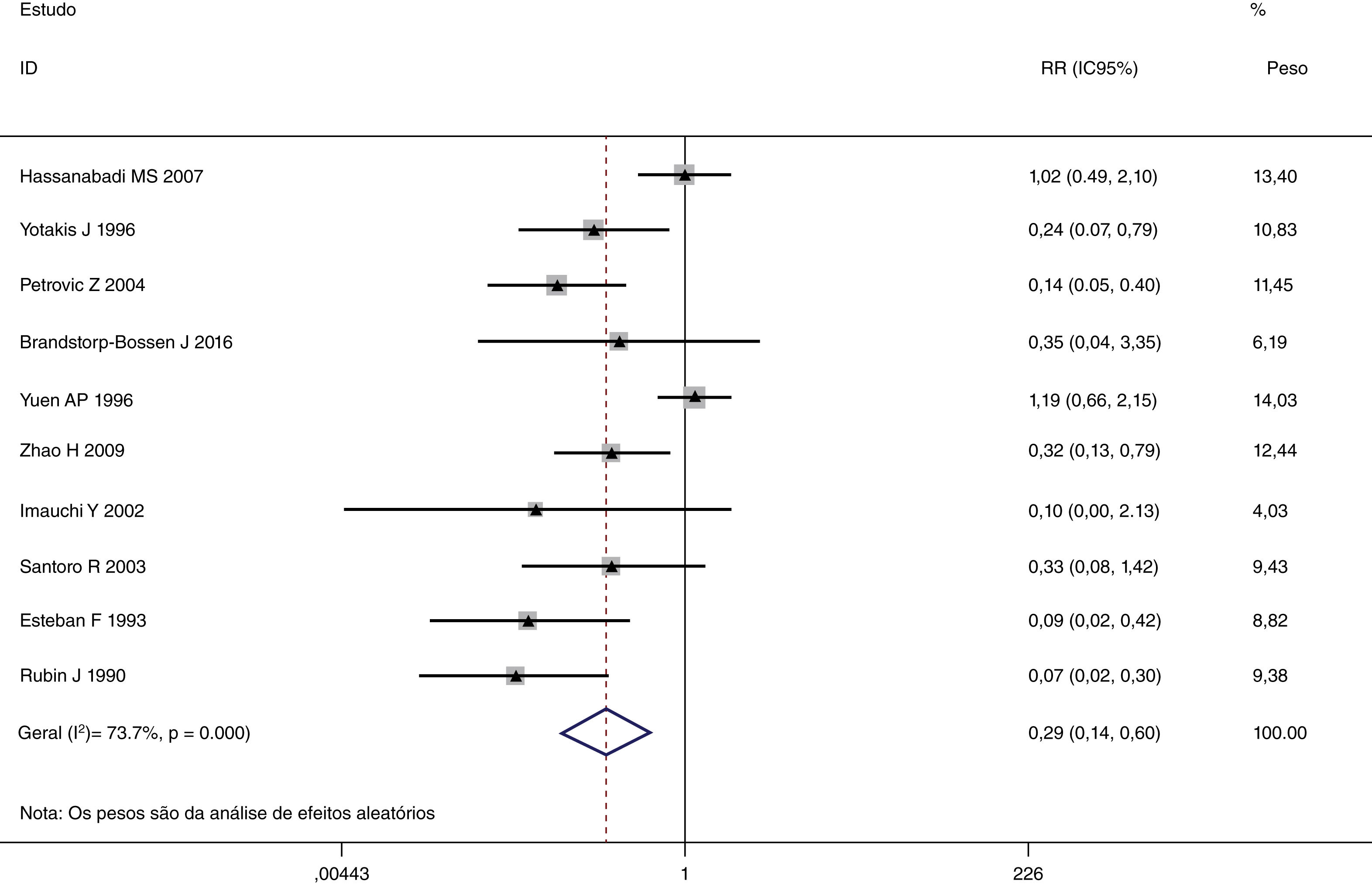
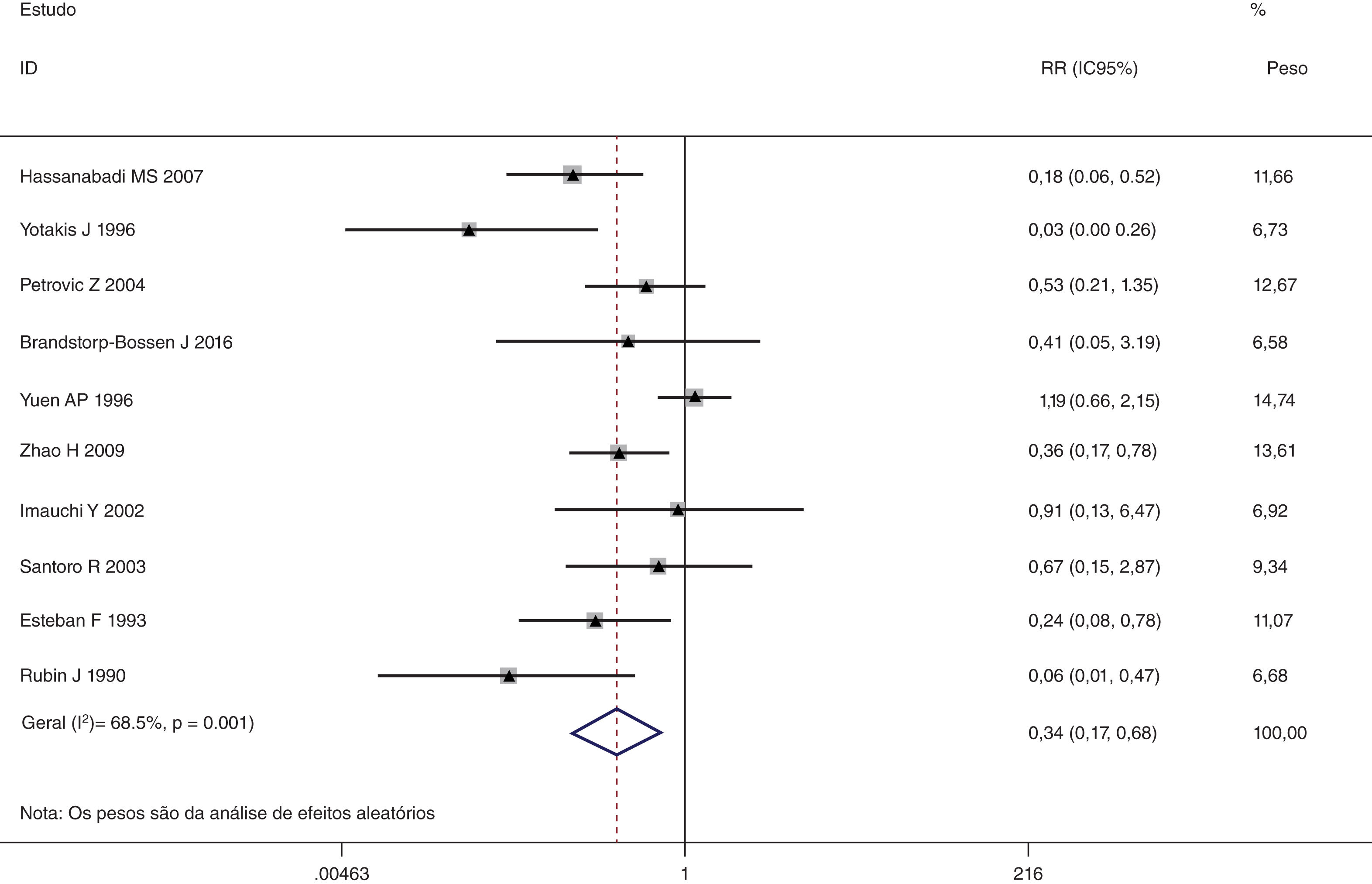
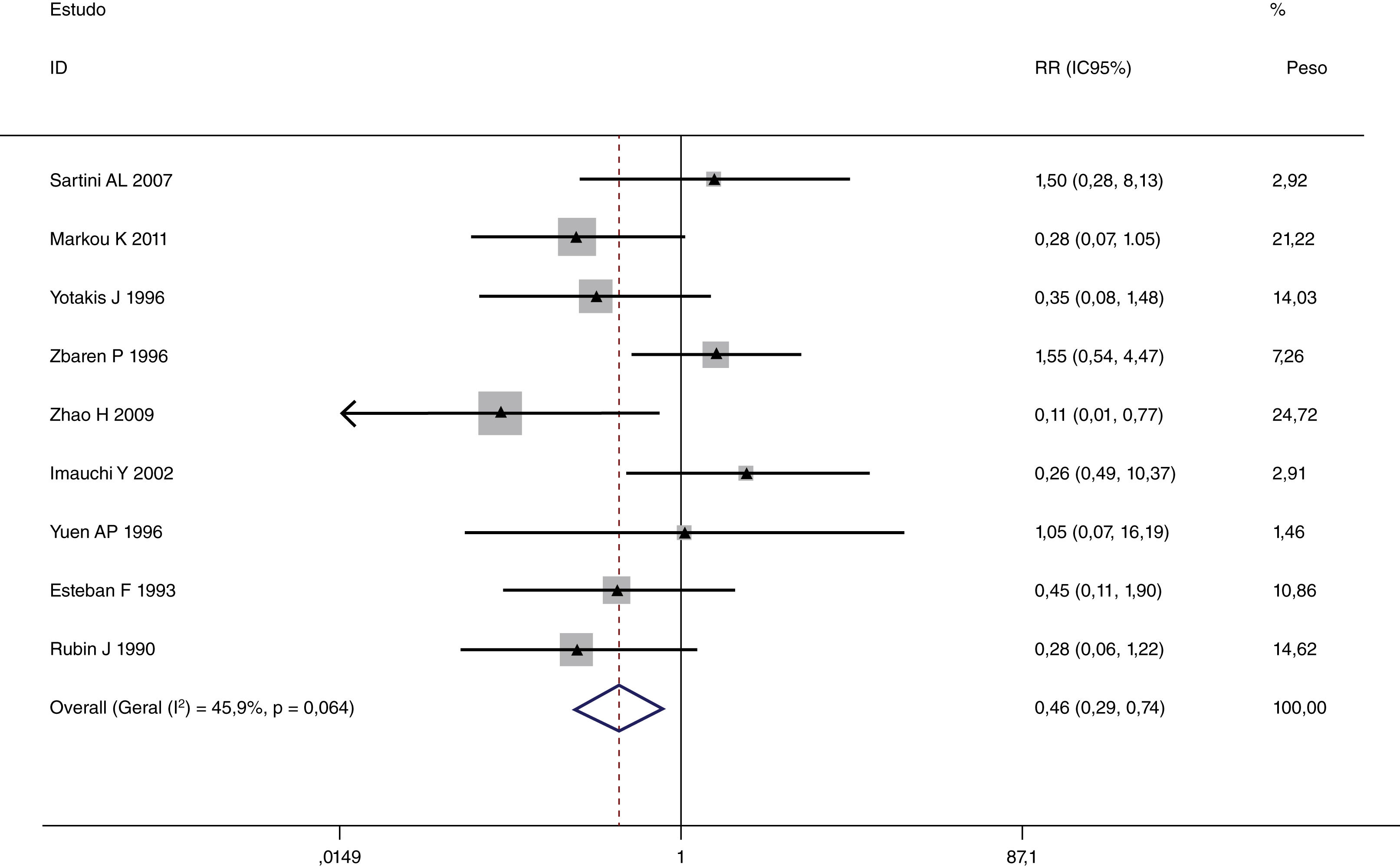
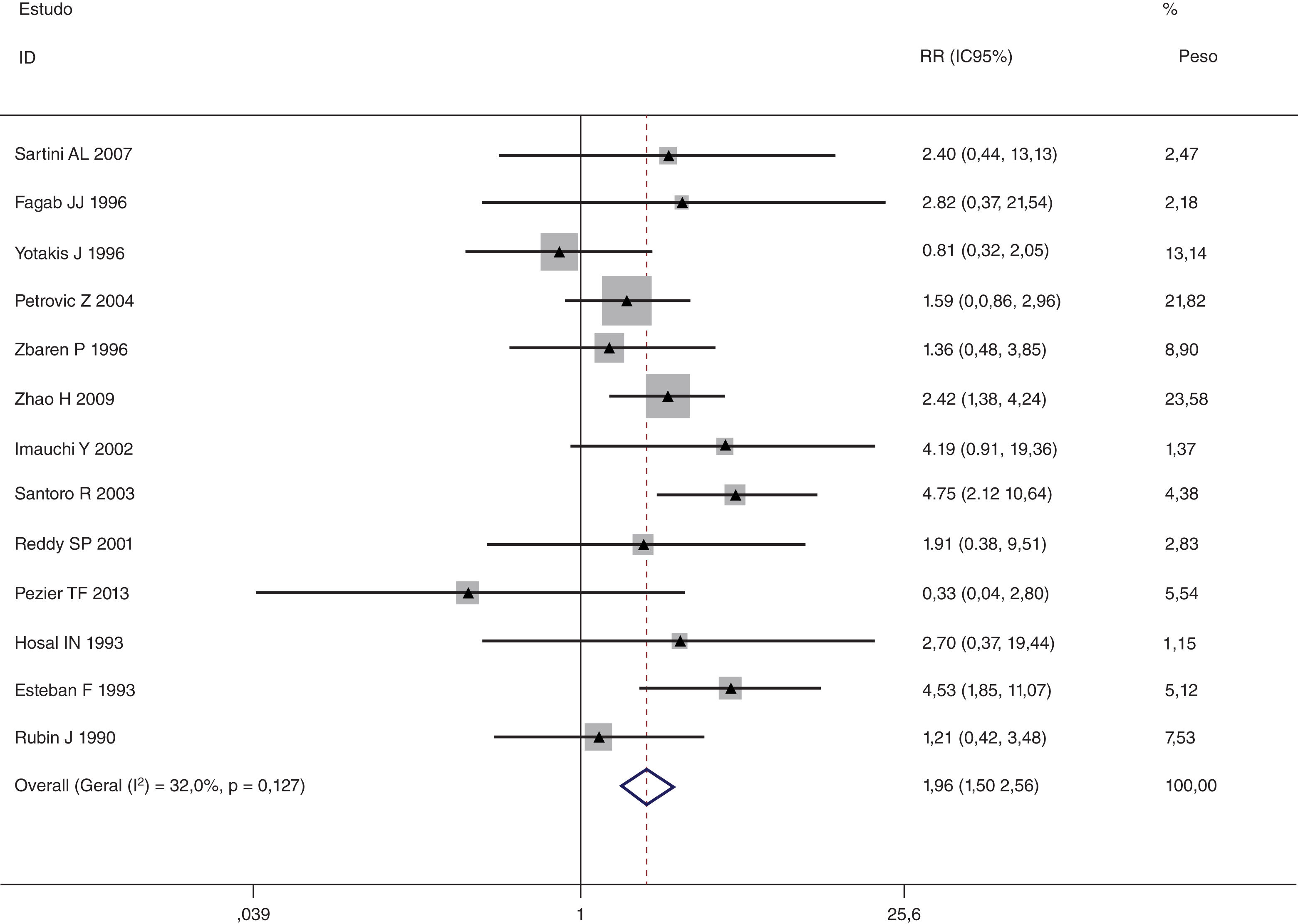
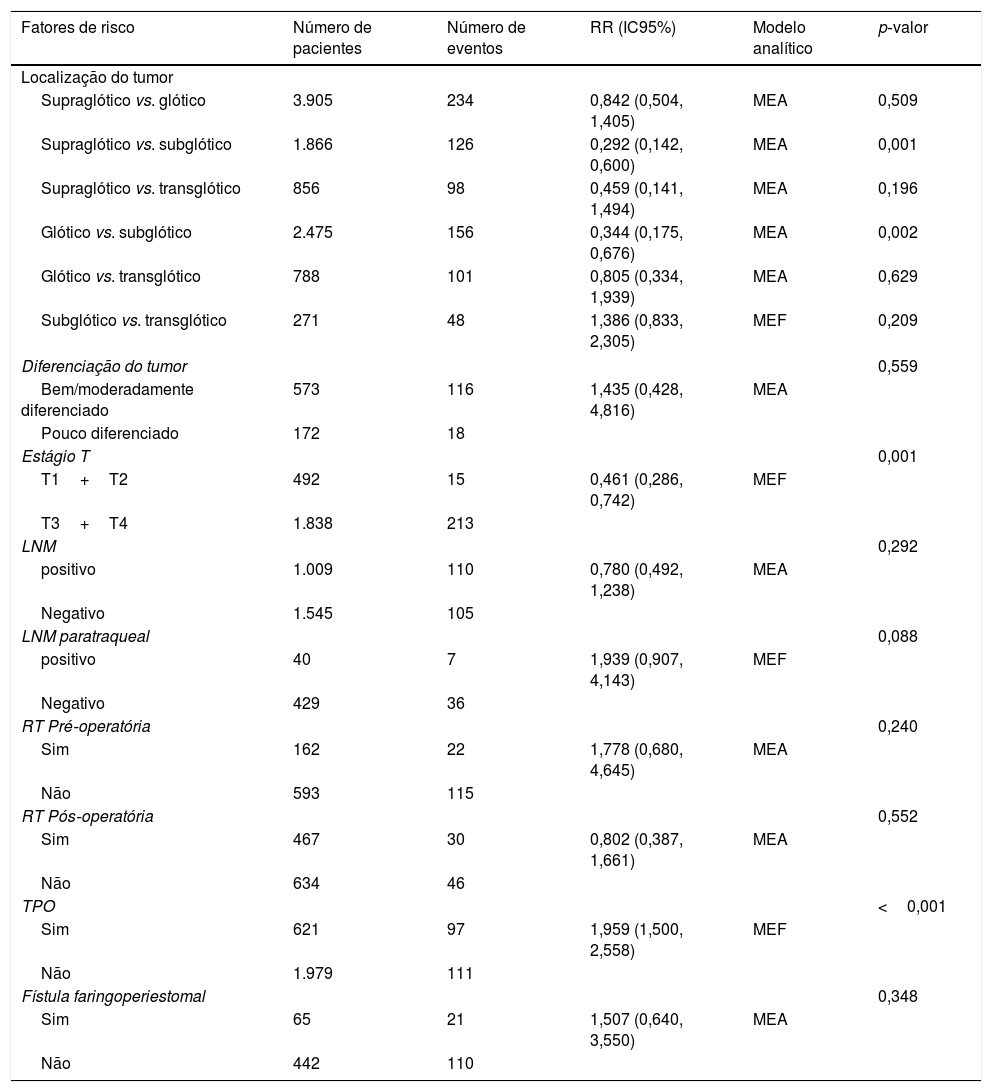
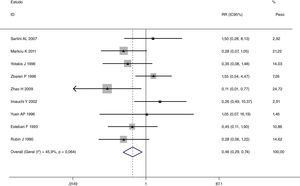
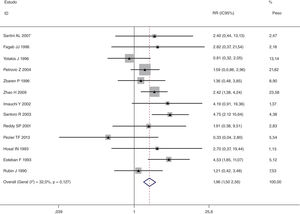
Esta metanálise de dados combináveis foi feita para analisar os fatores de risco para RE e os principais achados são mostrados na tabela 3. Treze estudos relataram dados sobre o subsítio do tumor,7–12,15,17,19,22,28,30,31 dois relataram dados sobre diferenciação tumoral,11,12 nove relataram dados sobre o estágio T,8,11,12,15,17,19,21,30,31 onze relataram dados sobre LNM,8,9,11,12,15,17,19,21,22,30,31 dois relataram dados sobre LNM paratraqueal,8,9 quatro relataram dados sobre RT pré‐operatória,8-10,15 cinco relataram dados sobre RT pós‐operatória,8,9,15,17,21 13 relataram dados sobre TPO5,7–9,11,15,17,21,22,29–32 e dois relataram dados sobre a fístula faringoperiestomal.20,21 Quando os dados foram agrupados, respectivamente, o subsítio do tumor (p=0,001, p=0,002) (figs. 2 e 3), estágio T (p=0,001) (fig. 4) e TPO (p <0,001) (fig. 5) foram identificados como fatores de risco para RE. Especificamente, os RRs combinados (IC 95%) foram os seguintes: 0,292 (0,142,600) para o subsítio tumoral (supraglótico vs. subglótico), 0,344 (0,175,6,676) para subsítio tumoral (glótico vs. subglótico), 0,461 (0,286, 0,742) para o estágio T e 1,959 (1,500, 2,558) para TPO.
Resultados estatísticos dos fatores de risco para RE após LT
| Fatores de risco | Número de pacientes | Número de eventos | RR (IC95%) | Modelo analítico | p‐valor |
|---|---|---|---|---|---|
| Localização do tumor | |||||
| Supraglótico vs. glótico | 3.905 | 234 | 0,842 (0,504, 1,405) | MEA | 0,509 |
| Supraglótico vs. subglótico | 1.866 | 126 | 0,292 (0,142, 0,600) | MEA | 0,001 |
| Supraglótico vs. transglótico | 856 | 98 | 0,459 (0,141, 1,494) | MEA | 0,196 |
| Glótico vs. subglótico | 2.475 | 156 | 0,344 (0,175, 0,676) | MEA | 0,002 |
| Glótico vs. transglótico | 788 | 101 | 0,805 (0,334, 1,939) | MEA | 0,629 |
| Subglótico vs. transglótico | 271 | 48 | 1,386 (0,833, 2,305) | MEF | 0,209 |
| Diferenciação do tumor | 0,559 | ||||
| Bem/moderadamente diferenciado | 573 | 116 | 1,435 (0,428, 4,816) | MEA | |
| Pouco diferenciado | 172 | 18 | |||
| Estágio T | 0,001 | ||||
| T1+T2 | 492 | 15 | 0,461 (0,286, 0,742) | MEF | |
| T3+T4 | 1.838 | 213 | |||
| LNM | 0,292 | ||||
| positivo | 1.009 | 110 | 0,780 (0,492, 1,238) | MEA | |
| Negativo | 1.545 | 105 | |||
| LNM paratraqueal | 0,088 | ||||
| positivo | 40 | 7 | 1,939 (0,907, 4,143) | MEF | |
| Negativo | 429 | 36 | |||
| RT Pré‐operatória | 0,240 | ||||
| Sim | 162 | 22 | 1,778 (0,680, 4,645) | MEA | |
| Não | 593 | 115 | |||
| RT Pós‐operatória | 0,552 | ||||
| Sim | 467 | 30 | 0,802 (0,387, 1,661) | MEA | |
| Não | 634 | 46 | |||
| TPO | <0,001 | ||||
| Sim | 621 | 97 | 1,959 (1,500, 2,558) | MEF | |
| Não | 1.979 | 111 | |||
| Fístula faringoperiestomal | 0,348 | ||||
| Sim | 65 | 21 | 1,507 (0,640, 3,550) | MEA | |
| Não | 442 | 110 | |||
MEA, modelo de efeitos aleatórios; MEF, modelo de efeitos fixos.
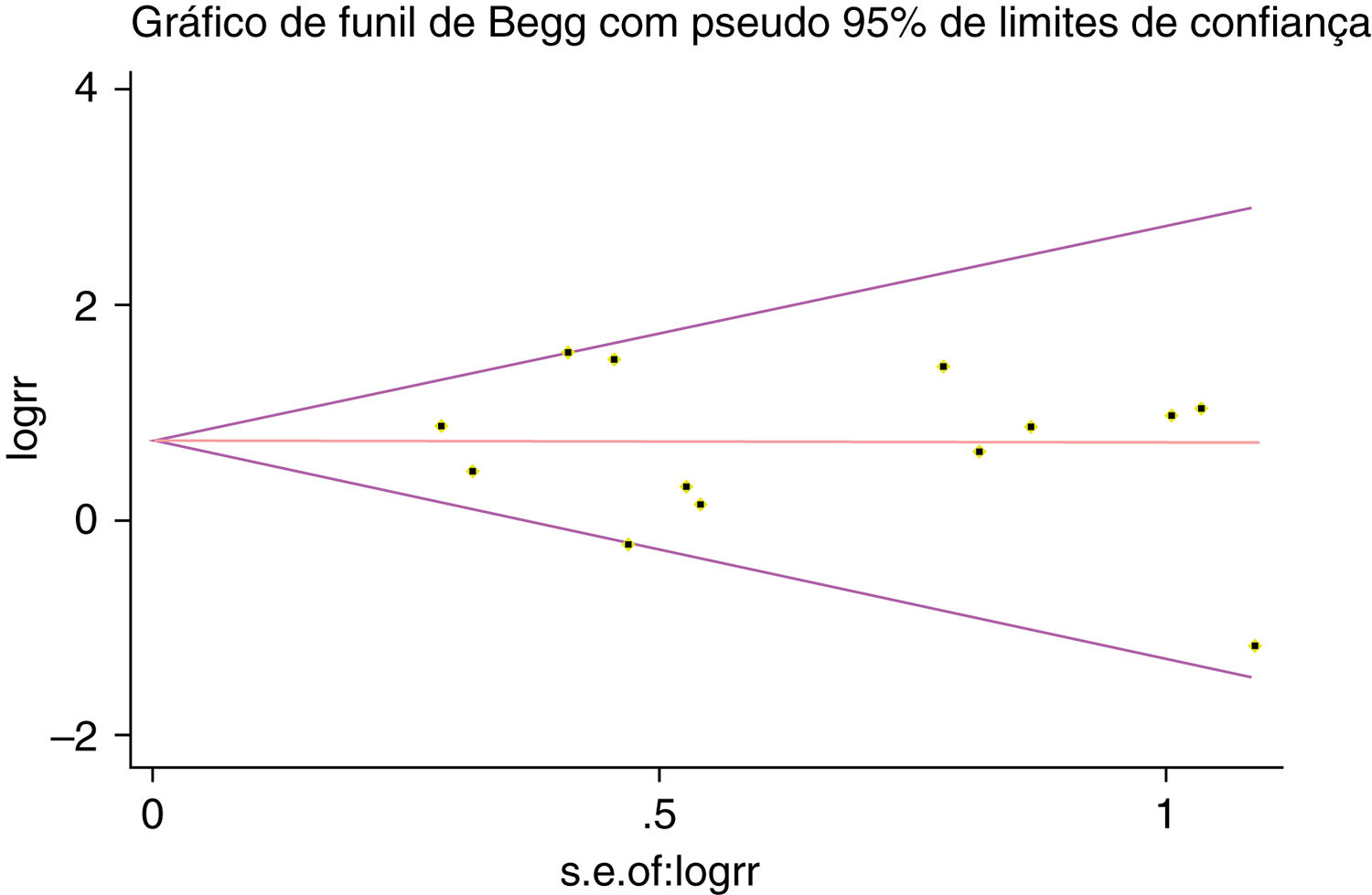
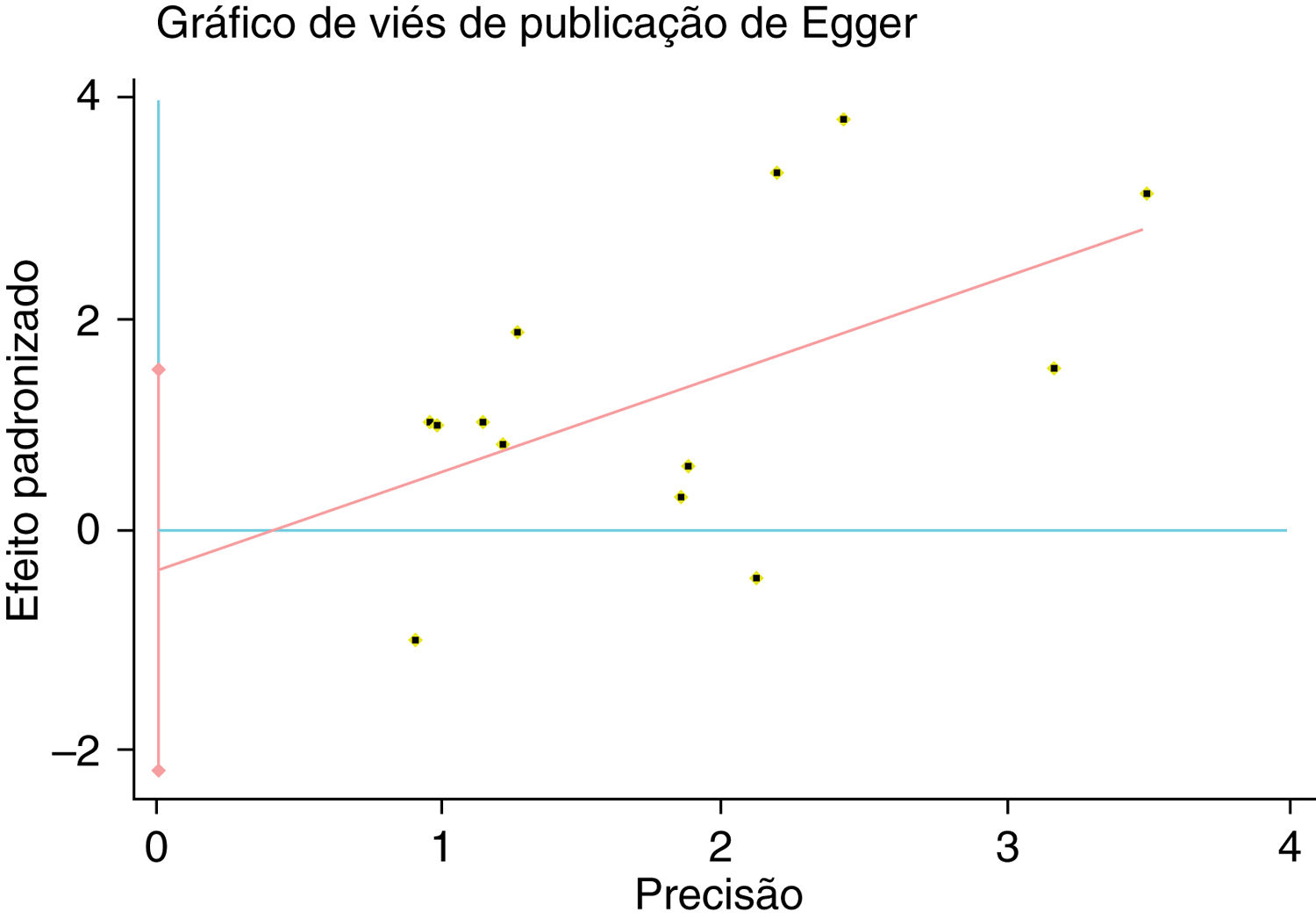
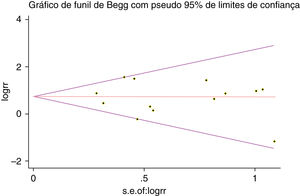
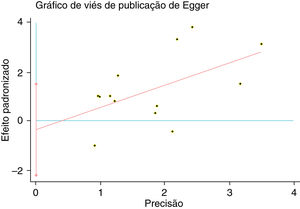
Um único artigo incluído em nossa metanálise foi excluído de cada vez para refletir a influência do conjunto de dados individual no RR combinado e o RR combinado correspondente não foi materialmente alterado. O gráfico em funil de Begg e o teste de Egger foram feitos para avaliar o viés de publicação dos artigos. O formato do gráfico em funil não mostrou evidência de assimetria óbvia (fig. 6). Além disso, o teste de Egger foi feito para fornecer evidência estatística da simetria do gráfico em funil. Da mesma forma, os resultados não revelaram evidência de viés de publicação (fig. 7).
DiscussãoA recorrência tumoral no estoma traqueal após LT para tratamento do câncer de laringe é um fenômeno bem reconhecido. Eles são diagnosticados no primeiro ano após a LT, mas há descrição de casos em até 3,5 anos.33 Em estudos anteriores, a ocorrência de RE é altamente variável. Kowalski et al. propuseram que a RE pode ser explicada pelas diferenças nos critérios diagnósticos usados por cada autor.33 Nossos resultados mostraram que a taxa de RE variou de 0,8% a 31,3%. Concluímos que o motivo poderia ser a heterogeneidade da técnica cirúrgica em diferentes períodos. Apesar do aprimoramento do tratamento multimodal nos últimos 20 anos, a taxa de sobrevida em 5 anos de 40% permaneceu estática desde meados da década de 1980.34 Alguns estudos relataram que a RE estava associada a 90% de mortalidade e mais de 80% dos pacientes morreram nos dois primeiros anos.10 Em nosso estudo, apenas seis artigos avaliaram o prognóstico dos pacientes8,10,11,15,19,22 e a taxa de mortalidade foi de 77,8% a 100%. A maioria dos pacientes morreu devido à progressão da doença. O prognóstico para esses pacientes é ruim, apesar dos progressos na cirurgia, quimioterapia e radioterapia para o tratamento da RE. Na tentativa de estabelecer um prognóstico mais adequado para esses pacientes, Sisson et al. propuseram um sistema de classificação para recorrência.35 Essa classificação é baseada na anatomia e leva em consideração o sítio da recorrência, mas não necessariamente a origem ou etiologia do tumor. Pacientes com os tipos I e II têm mediana de sobrevida de 10 meses, com 37,5% de sobrevida em um ano e 25% em 2 anos. Pacientes com os tipos I e II têm mediana de sobrevida de 6 meses, com 40% de sobrevida em um ano e 0% em 2 anos. Como o tratamento atual da RE não é ideal, maior atenção deve ser direcionada à identificação dos fatores de risco para minimizar a chance de RE. Apesar de um grande número de artigos ter sido investigado, o assunto ainda está em debate.
No câncer de laringe, há um consenso geral sobre o papel do envolvimento subglótico no desenvolvimento da RE. A ocorrência na faixa de 38% a 44% foi relatada em estudos anteriores.36 Devido à expansão submucosa dos tumores, os cânceres subglóticos tendem a acelerar o envolvimento do tecido paratraqueal. A área da cartilagem cricoide na extensão subglótica apresenta grande suprimento sanguíneo, faz com que as células tumorais tenham uma chance maior de se espalhar diretamente na área paratraqueal para se infiltrar na glândula tireoide e no tecido mole perilaríngeo.11,15,21 Constatamos que o envolvimento da região subglótica apresentou uma tendência estatística significante quando comparado aos tumores supraglóticos e glóticos. Nosso resultado foi consistente com os relatos anteriores. Além disso, pacientes com comprometimento subglótico e transglótico apresentaram incidência semelhante de RE (20,1% vs. 15,3%) e não encontramos diferença significante entre eles.
Alguns autores consideraram o tamanho do tumor um fator significativo e associado à sobrevida sem doença desfavorável.12,37 Eles propuseram a possibilidade de o desenvolvimento da RE aumentar com o tamanho do tumor.38 Pacientes com estágio T4 tiveram significantemente mais chances de apresentar RE do que aqueles com lesões menos graves (T1‐3).15 Markou et al. também verificaram que tumores T3 grandes (> 4cm) ou T4 pequenos (< 2cm) podem ter maior taxa de RE.12 Embora vários autores tenham relatado que o tamanho do tumor contribuiu para a RE, outros não relataram qualquer efeito.9,31,39 Keim et al. relataram que não há correlação significativa em pacientes com tumores pequenos, intermediários e grandes.30,39 Petrovic et al. verificaram que não houve diferença significante entre os pacientes com tumores T3 e T4.9 Nossos resultados mostraram que a taxa de RE nos estágios T1‐2 e T3‐4 foi de 3,0% e 11,6%, respectivamente. Os pacientes com estágio tumoral mais alto (T3‐4) apresentaram taxa significantemente maior de RE.
Atualmente, o estado nodal está bem estabelecido como um importante fator prognóstico quando o tumor está localizado na laringe.5,9 A drenagem linfática da laringe é estudada há muitos anos. É amplamente reconhecido que os linfonodos de alto risco são frequentemente das cadeias pré‐traqueais e paratraqueais. Eles raramente são palpáveis e, inicialmente, não causam rouquidão e dor; muitos pacientes não recebem tratamento até que a doença atinja estágio avançado, com sintomas de obstrução das vias aéreas.40 Muitos autores propuseram que esses linfonodos metastáticos (LNM) fossem considerados um fator que influencia a RE.8,9,41 Isso, por sua vez, parece influenciar a incidência de traqueotomia de emergência. Ou seja, aqueles pacientes que precisam de TPO apresentam maiores taxas de LNM paratraqueais ocultos. Considerando o padrão de metástase linfática, a remoção dos linfonodos pré‐traqueais e paratraqueais deve ser feita para evitar a RE. Em nosso estudo, 1.545 pacientes com doença N0 tiveram 105 recidivas (6,8%), enquanto 1.009 pacientes com doença N+tiveram 110 recidivas (10,9%). No entanto, esse resultado não foi estatisticamente significante. Simultaneamente, verificamos que a taxa de LNM paratraqueal foi maior nos pacientes com RE (17,5% vs. 8,4%), mas não foi observada correlação significante entre eles.
A traqueotomia de emergência antes da laringectomia tem sido associada a um aumento da incidência de RE.8,31 A taxa de RE em pacientes submetidos a TPO variou de 8% a 41% em estudos anteriores.42 De acordo com a hipótese de implantação de células tumorais, as células cancerígenas desalojadas têm chance de se implantar no tecido da ferida traqueal.16,43 Por outro lado, alguns autores não observaram qualquer correlação.13,44 Eles consideraram que o implante mecânico de células tumorais era menos provável, porque margens suficientes poderiam ser obtidas em um LT de campo amplo, adequadamente feita, como feito na maioria dos hospitais.8 Assim, alguma atenção se concentrou em outros mecanismos, como o LNM paratraqueal, a presença de linfonodo de Delphian e a disseminação de células tumorais por todo o tecido paratraqueal e pela glândula tireoide. Por exemplo, Rockley et al. verificaram que pacientes submetidos a TPO tinham doença mais avançada e podem ter uma taxa mais alta de LNM paratraqueal oculto, o que aumentou o risco de RE.14 Devido à inflamação e fibrose dos tecidos ao redor das anastomoses causadas pela TPO, é difícil fazer a dissecção dos linfonodos paratraqueais na prática clínica. Portanto, isso também pode explicar o motivo pelo qual os pacientes submetidos à TPO apresentam uma taxa mais elevada de RE. Nossos resultados apoiam uma forte correlação entre TPO e RE.
A RT é frequentemente usada para o tratamento da RE. Algumas investigações demonstraram a utilidade da RT pré‐operatória, inclusive o estoma traqueal e o mediastino superior no campo da irradiação.45 Além disso, vários autores verificaram que a incidência de RE foi significantemente menor nos pacientes submetidos a RT no pós‐operatório e propuseram que a RT pós‐operatória pode ser uma vantagem na prevenção da recorrência.9,46,47 Sartini et al. sugeriram que a RT pós‐operatória deve ser feita quando as margens cirúrgicas estiverem comprometidas e muito finas e a presença de LNM for demonstrada.17 Entretanto, os resultados de nosso estudo parecem controversos: não há uma associação entre RE e RT pré e pós‐operatória. Esperamos obter mais informações de grandes amostras de estudos para uma melhor compreensão e precisão da autenticação em um futuro próximo.
Os resultados deste estudo devem ser interpretados com cautela devido a algumas limitações. Primeiro, a natureza retrospectiva dos estudos incluídos é claramente uma limitação. Esses estudos também não são a evidência da mais alta qualidade e podem levar a achados menos importantes. Segundo, a maioria desses estudos foi feita em países europeus e asiáticos, o que pode não refletir a situação real. Além disso, a publicação é uma das principais preocupações de todas as formas de metanálise e os resultados positivos tendem a ser aceitos pelos periódicos, enquanto os resultados negativos são frequentemente rejeitados ou nem mesmo submetidos. Embora este estudo não apoie o viés de publicação, deve‐se notar que não foi possível excluir completamente os vieses. Por exemplo, este estudo foi restrito a artigos escritos apenas em inglês, o que provavelmente levou a viés de idioma ou cultural. Entretanto, alguns autores sugerem que excluir estudos publicados em outros idiomas além do inglês geralmente tem pouco efeito nas estimativas de efeito.48 Embora duas metanálises tenham sido publicadas sobre esse tópico,47,48 este estudo é diferente delas. Consideramos que uma pesquisa incluiu um número insuficiente de estudos47 e a outra se concentrou nos fatores de risco naqueles pacientes submetidos à LT ou laringectomia parcial.48 Mais pesquisas são necessárias para determinar o impacto da restrição de idioma.
ConclusãoA RE após LT continua a ser um problema difícil para cirurgiões de cabeça e pescoço. Quando a RE está presente, o prognóstico é ruim. A etiologia da RE após a LT é multifatorial e a identificação de fatores de alto risco é imprescindível. Nossos resultados mostraram que o subsítio do tumor, estágio T e TPO foram os fatores de risco associados à maior incidência de RE. Este estudo será ainda mais atual quando novas e fortes evidências estiverem disponíveis.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
FinanciamentoEste trabalho foi financiado pelo Baiqianwan Talent Project (Tipo C, n°. 6) e pelo Natural Science Foundation of Liaoning Province (n°. 20180530038).
Como citar este artigo: Liang J, Zhu X, Zeng W, Yu T, Fang F, Zhao Y. Which risk factors are associated with stomal recurrence after total laryngectomy for laryngeal cancer? A meta‐analysis of the last 30 years. Braz J Otorhinolaryngol. 2020;86:502–12.