Introdução: A realização de modelos experimentais nasossinusais em animais vem sendo realizada há décadas, com substancial aumento nos últimos anos. Tem como objetivos identificar as alterações fisiopatológicas ocasionadas pelo processo infeccioso sinusal e avaliar a eficácia de medicamentos no tratamento da rinossinusite.
Objetivo: Avaliar a eficácia do modelo experimental proposto para a indução de um processo infeccioso nasossinusal agudo bacteriano, utilizando parâmetros histopatológicos e cultura da secreção sinusal.
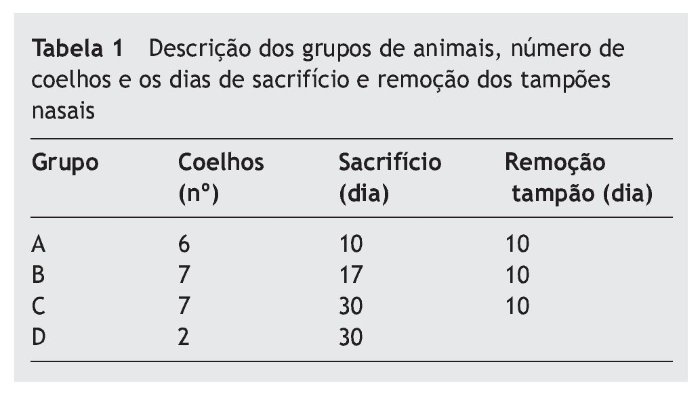
Método: Estudo experimental com 22 coelhos da raça Nova Zelândia, divididos em: grupo A (6 coelhos), grupo B (7 coelhos), grupo C (7 coelhos) e grupo D (controle com 2 coelhos).Induzido quadro de rinossinusite através da inserção de esponja sintética nas fossas nasais direita dos 20 coelhos (grupos de estudo), seguido por instilação de toxoide bacteriano (50% estreptocócico, 50% estafilocócico). Os grupos foram sacrificados com 10 dias (grupo A), 17 dias (grupo B) e 30 dias (grupos C e D).
Resultados: Todos os coelhos do grupo de estudo apresentaram quadro de rinossinusite aguda bacteriana, através da identificação macroscópica, análise histológica e cultura das secreções.
Conclusão: O modelo proposto apresenta simplicidade técnica para sua execução, similaridade ao quadro rinogênico que acomete os humanos e é altamente eficaz na produção de um quadro infeccioso bacteriano agudo sinusal.
Introduction: For decades, animals have been used in sinonasal experimental models, and the practice has increased substantially in the last few years. This study aimed to assess the pathogenesis of infectious process and medication efficiency to treat rhinosinusitis.
Objective: To evaluate the efficiency of the proposed experimental model to induce an acute bacterial sinonasal infectious process through histological analysis and sinus secretion cultures.
Methods: This was an experimental study with 22 New Zealand rabbits, divided into: group A (six rabbits), group B (seven rabbits), group C (seven rabbits), and group D (control group withtwo rabbits). Rhinosinusitis was induced by the insertion of a synthetic sponge into the rightnasal cavity of 20 animals (study groups), followed by the instillation of bacterial strains (50% Staphylococcus sp. and 50% Streptococcus sp.). The groups were euthanized within 10 days (group A), 17 days (group B), and 30 days (groups C and D).
Results: All the rabbits of the study group developed acute bacterial rhinosinusitis, which was diagnosed through macroscopic evaluation, histological analysis, and sinus secretion culture.
Conclusion: the proposed model is technically simple to perform, it is similar to the rhinogenic model in human beings, and it is highly efficient to reproduce an acute bacterial sinus infection.
Pagina nueva Introdução
A rinossinusite é uma das doenças mais prevalentes atualmente. É a quinta doença mais comum que requer uso de antibióticos.1 Aproximadamente 25 milhões de pessoas são diagnosticadas com rinossinusite por ano nos EUA, tornando esta uma das principais doenças que requer atendimento médico com otorrinolaringologistas ou generalistas. Os custos diretos e indiretos associados às rinossinusites são altos, incluindo métodos diagnósticos, terapêuticos, procedimentos, medicações e diminuição da produtividade.2
A prevalência das RSA (rinossinusite aguda) e RSC (rinossinusite crônica) na população geral é bastante elevada, porém existe uma dificuldade em se estimar exatamente este valor, principalmente porque boa parte dos episódios são autolimitados e pouco sintomáticos, não levando o paciente a buscar assistência médica. As rinossinusites são responsáveis por 9% do total de antibióticos prescritos para a população pediátrica e 21% do total prescrito para a população adulta nos EUA, gerando gastos de cerca de 5,8 bilhões de dólares anuais, sendo 150 milhões de dólares em antibióticos.3,4
A literatura mundial tem apresentado diversas tentativas de modelação em animais, sendo os estudos com coelhos os mais frequentes. Estes animais apresentam anatomia e fisiologia muito semelhantes aos humanos. São os mais adequados para estudos que exijam manipulação cirúrgica, porém apresentam alto grau de mortalidade quando mantidos em estresse. Outros animais utilizados para estudos são os ratos Wistar e Sprague-Dawley, cobaias e ovelhas.5-7
Os modelos experimentais de rinossinusite citados na literatura têm como objetivo causar uma inflamação dos seios paranasais semelhante aos processos de rinossinusite habituais. Os modelos experimentais têm sido utilizados para estudo da fisiopatogenia da inflamação e avaliação dos resultados de tratamento.8-10 Estudos sugerem manobras de obliteração das fossas nasais, obliteração dos óstios de drenagem sinusal, instilação de mediadores do processo inflamatório e até materiais que atuam como meio de cultura nas fossas nasais.11-14
Não encontramos na literatura algum modelo experimental de rinossinusite aguda bacteriana que tivesse sido realizado e descrito detalhadamente, através das análises histológicas de ambos os seios maxilares (lado induzido e lado contralateral) e das análises microbiológicas de ambos os lados dos seios maxilares, em um quadro infeccioso bacteriano.
Também não encontramos na literatura algum estudo que tenha realizado a análise do tampão nasal, quando este foi utilizado como método para indução do quadro de rinossinusite bacteriana. Esta análise poderia ser realizada na tentativa de correlacionar os achados microbiológicos da cavidade nasal com o seio maxilar. Poucos estudos analisaram esta correlação e não encontraram resultados significativos.15
Observamos, ainda, que muitos estudos realizados tinham como objetivos a produção de um quadro infeccioso ou a avaliação da eficácia terapêutica de medicamentos. Portanto, poucos avaliaram as alterações histológicas e microbiológicas no período subsequente ao diagnóstico do processo infeccioso agudo sinusal sem a utilização de algum medicamento, após a retirada do tampão nasal; ou seja, não analisaram o período de recuperação.
Dessa forma, podemos identificar que a literatura carece de um modelo experimental de rinossinusite aguda com metodologia detalhada, através da avaliação de parâmetros microbiológicos e histopatológicos em ambos os lados dos seios maxilares, análise do tampão nasal para pesquisa da relação entre as bactérias encontradas nos seios e nas fossas nasais, e que seja de simples execução, facilmente reprodutível e altamente eficaz na geração de um quadro infeccioso agudo bacteriano.
Existem ainda algumas dúvidas na literatura com relação à fisiopatologia e ao tratamento das rinossinusites agudas, como o período esperado após o diagnóstico da afecção para o início da terapêutica com antibióticos, a avaliação de pacientes com recidiva do quadro logo após o término de tratamento e porque alguns pacientes desenvolvem quadros recorrentes e/ou crônicos após um episódio agudo de rinossinusite.
Método
O estudo foi aprovado pelo Comitê de Ética em Experimentação Animal (CEEA) e realizado em Instituto Privado, sob o número de aprovação 008-12. Os animais foram confinados em gaiolas individuais, adequadas para raça e peso. Os mesmos tiveram oferta livre de ração e água durante todo o período em que estiveram confinados. Todos os animais foram mantidos em condições uniformes, por um período de oito dias antes do início do estudo. Todos os procedimentos cirúrgicos e experimentais foram realizados no mesmo instituto, de acordo com os princípios éticos na experimentação animal, postulados pelo código brasileiro de experimentação em animais (COBEA). As preparações e análises histológicas foram realizadas em laboratório privado. Os estudos microbiológicos foram feitos no laboratório de microbiologia de um hospital terciário.
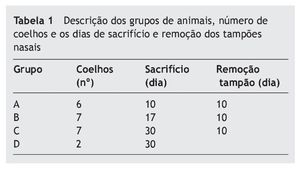
Foram utilizados 22 coelhos da raça Nova Zelândia, adultos, brancos, de ambos os gêneros, com peso entre 2500-3000 g no início do experimento. Os coelhos foram divididos em quatro grupos: grupo A (seis coelhos), grupo B (sete coelhos), grupo C (sete coelhos) e grupo D como controle (dois coelhos). Os coelhos do grupo A foram sacrificados no dia da remoção do tampão, 10 dias após a indução do experimento. Os coelhos do grupo B foram sacrificados 17 dias após a indução, e os coelhos do grupo C foram sacrificados 30 dias após a indução. Os dois coelhos do grupo D foram mantidos em ambiente separado, em uma sala diferente dos animais dos grupos de estudo, durante 30 dias, e sacrificados juntamente com os coelhos do grupo C (tabela 1).
Foi realizado experimento para obtenção de um processo inflamatório nasossinusal, através da cavidade nasal dos animais, simulando uma rinossinusite infecciosa aguda. Os coelhos foram submetidos à anestesia geral e colocação de Merocel® estéril medindo 0,3 ´ 0,5 ´ 2,5 cm em fossa nasal direita com o uso de uma pinça baioneta estéril, seguido pela instilação de 1 mL de toxoide estreptocócico e estafilocócico (Toxoidepot®) em fossa nasal ipsilateral com o uso de uma seringa e agulha de insulina estéreis. Realizamos a instilação do toxoide no interior da fossa nasal após a colocação do tampão nasal para que pudéssemos padronizar a quantidade de toxoide em todos os animais. O tampão foi retirado no 10º dia após o início do experimento em todos os animais dos três grupos de estudo.
Foi realizada a abertura e a exposição da parede anterior dos seios maxilares bilateralmente em cada animal, inicialmente do lado esquerdo para evitar contaminação do lado contralateral ao da indução do experimento, com coleta de secreção do interior dos mesmos através de swab (Cuturet®). Os materiais foram mantidos em local com temperatura ambiente, sem exposição solar e encaminhados ao laboratório após 24-36 horas da coleta.
Todas as amostras de secreção foram preparadas em lâminas e coradas pela técnica de Gram, para realização de exame bacterioscópico. Desta forma, as lâminas foram coradas com violeta de metila, fixadas com lugol, descoradas com álcool etílico e coradas novamente com safranina. Realizou-se leitura das lâminas por meio de microscopia ótica, com objetiva de imersão (1000´).
Após o exame bacterioscópico, os materiais foram semeados em cultura ágar sangue, ágar chocolate e ágar Sabouraud. As placas de ágar sangue e ágar chocolate foram incubadas à temperatura de 35 ± 2ºC. Foram realizadas leituras diárias das placas até completar 48 horas para os meios ágar sangue e ágar chocolate, e 15 dias para ágar Sabouraud.
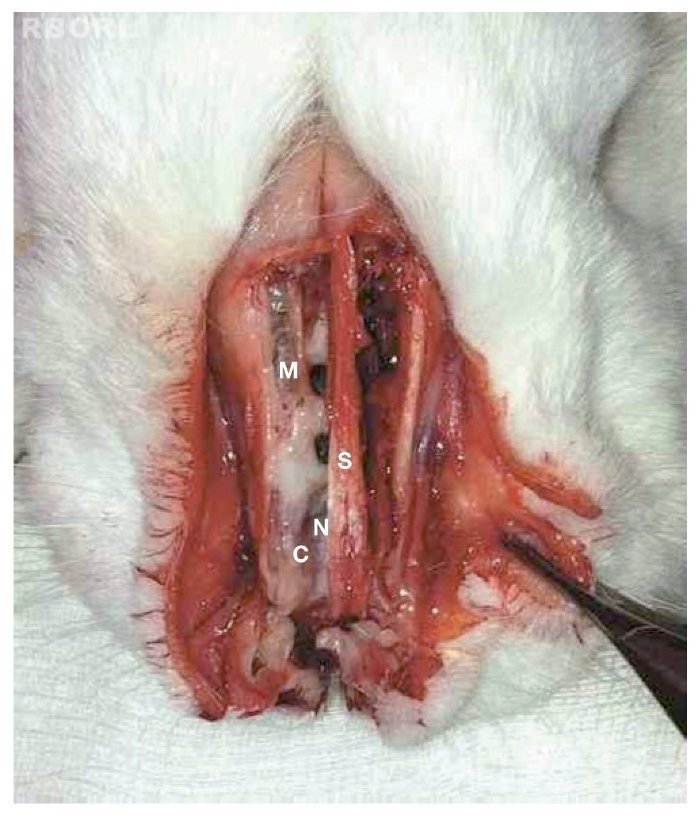
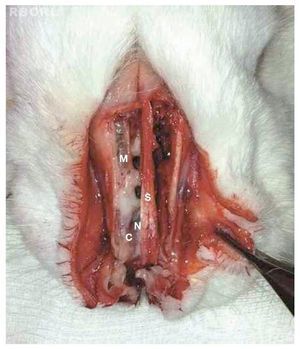
Logo após o sacrifício, as estruturas que revestem a face do coelho foram dissecadas, e foi realizada a abertura da parede anterior dos seios maxilares e da parede externa das cavidades nasais. Foi removida, então, mucosa do interior dos seios maxilares (fig. 1).
Figura 1 Parede externa das cavidades nasossinusais aberta, com exposição dos seios maxilares e cavidade nasal. Processo infeccioso evidente à direita, caracterizado por edema mucoso e presença de secreção purulenta. Locais anatômicos representados por seio maxilar (M), septo nasal (S), concha inferior (C) e fossa nasal (N).
As amostras de mucosa foram obtidas dos coelhos, com remoção de mucosa do interior dos seios maxilares, sendo imediatamente fixadas em formol a 10% tamponado, permanecendo nesta solução pelo período mínimo de 24 horas, para adequada fixação. Permaneceram 24-48 h sob nossa responsabilidade e a seguir foram encaminhadas ao laboratório de patologia. A seguir, foi realizada a clivagem das amostras, passando-se então ao processamento histológico propriamente dito (desidratação em banhos sucessivos com concentrações crescentes de álcool etílico, diafanização em xilol e inclusão em parafina a 60 graus centígrados). A seguir, foi realizada a microtomia, tendo cada corte histológico a espessura máxima de 4 micrômetros. Finalizando, as lâminas foram coradas pela técnica da hematoxilina-eosina (HE) e montadas em lamínulas para análise microscópica pelo patologista.
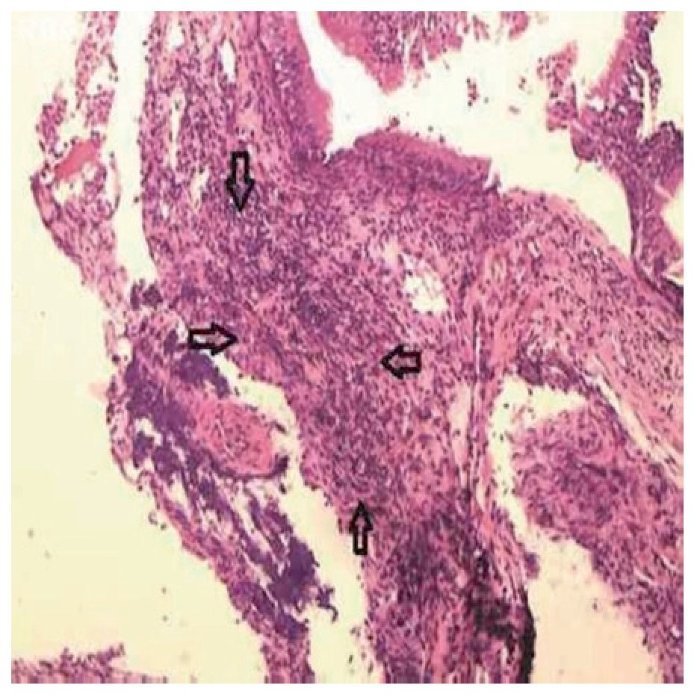
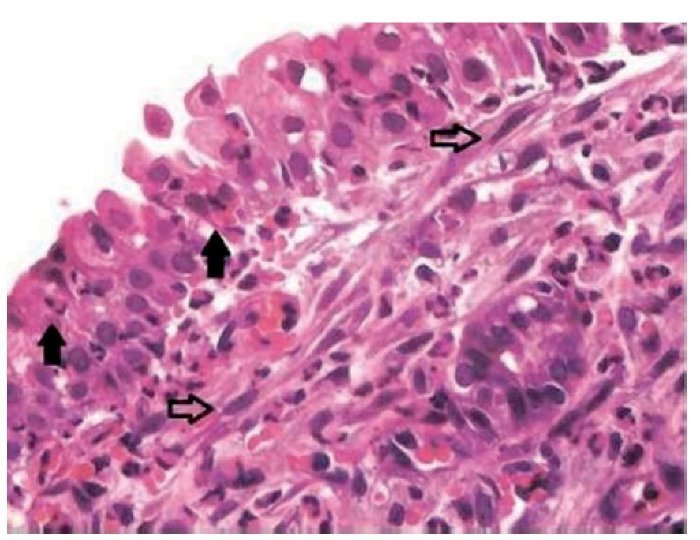
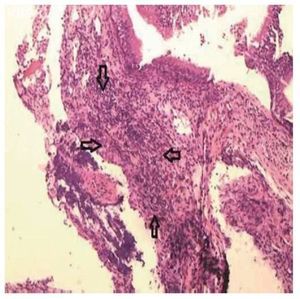
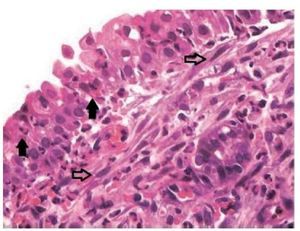
Todas as lâminas foram analisadas por um único patologista, que desconhecia o grupo ao qual a amostra pertencia. Foi feita uma avaliação semiquantitativa das alterações presentes. Posteriormente, as amostras foram classificadas pelos critérios de inflamação adotados, segundo Marks16,17: 0 = ausência de inflamação; 1 = inflamação leve (esparsas células inflamatórias, sem lesão epitelial); 2 = inflamação moderada (infiltrado inflamatório difuso em lâmina própria, sem formação de agregados inflamatórios, com lesão focal de células epiteliais caracterizada por desorganização e ruptura de células epiteliais); 3 = inflamação intensa (denso infiltrado inflamatório difuso com formação de agregados de células inflamatórias, com lesão difusa de células epiteliais caracte rizada por desorganização e ruptura de células epiteliais); 4 = inflamação severa com ulceração. Foi avaliada, também, a proliferação conjuntivo-fibrosa existente, de acordo com a sua intensidade, tendo sido classificada em ausente, presente e intensa (figs. 2 e 3).
Figura 2 Mucosa sinusal do lado direito do grupo de estudo sacrificado após dez dias, com inflamação moderada caracterizada por infiltrado inflamatório difuso em lâmina própria, sem formação de agregados inflamatórios (grau 2), delimitada pelas setas. Microscopia óptica, coloração HE, aumento de 100 vezes.
Figura 3 Mucosa sinusal do lado direito do grupo de estudo sacrificado após 17 dias, com inflamação intensa (grau 3), demonstrando permeação do epitélio por neutrófilos (setas cheias) e fibroblastos (setas vazadas) no córion superficial. Microscopia óptica, coloração HE, aumento de 200 vezes.
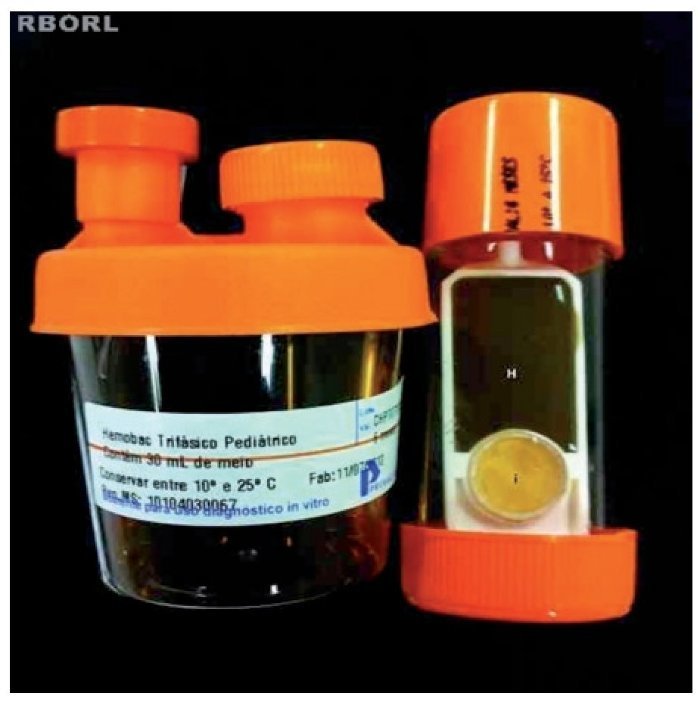
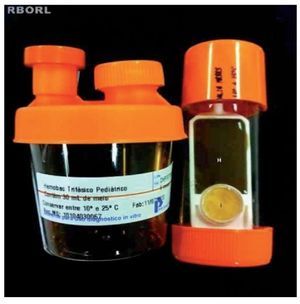
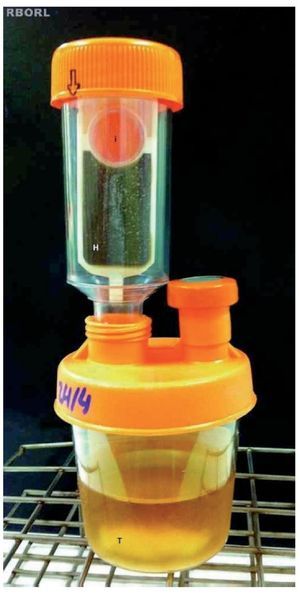
O tampão nasal removido das fossas nasais dos coelhos foi analisado para cultura de micro-organismos através do Hemobac®, no mesmo laboratório de microbiologia. O Sistema Hemobac Trifásico® é um produto utilizado na realização de culturas de sangue e seus componentes, stem cell (células tronco), líquidos corpóreos e nutrição parenteral. Utilizamos o Hemobac Trifásico Pediátrico®. O sistema é composto por dois elementos: recipiente plástico contendo 30 ml de um caldo suplementado com extrato de levedura e polianetol sulfonato de sódio (SPS) e um laminocultivo (fig. 4). Este último apresenta duas faces, sendo uma face larga, composta por ágar Chocolate e indicador de CO2 para detectar crescimento bacteriano e/ou fúngico, e outra face dividida, formada por ágar Sabouraud e ágar MacConkey.
Figura 4 Recipiente com caldo suplementado à esquerda e laminocultivo à direita. Face do laminocultivo constituída por meio ágar Chocolate (H) e indicador de CO2 (i).
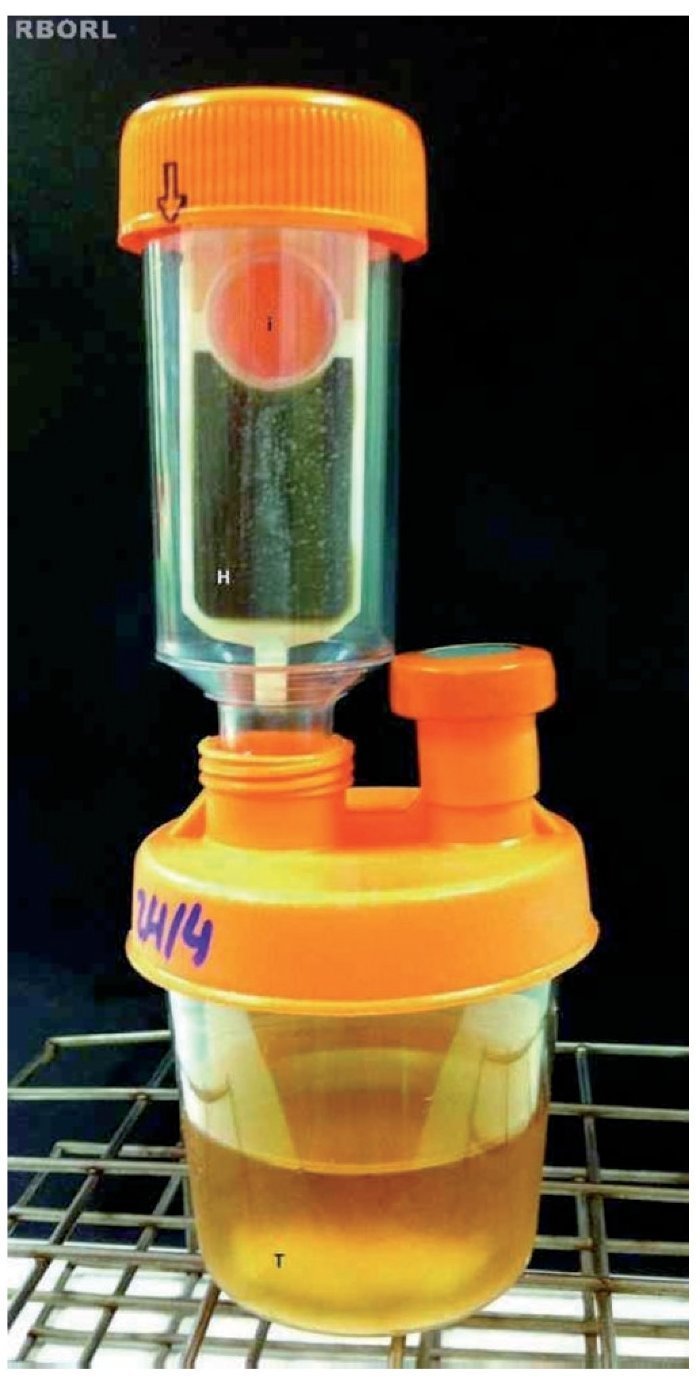
Iniciamos com a colocação do tampão nasal no interior do recipiente contendo o caldo, logo após sua retirada da cavidade nasal do coelho, com oclusão do frasco. Para cada tampão nasal removido, utilizamos um Hemobac Trifásico Pediátrico®. Este foi agitado levemente para que ocorresse a homogeneização da amostra com o caldo. Mantivemos o material durante 72 horas em temperatura ambiente, sem exposição solar e manipulação do material. O sistema foi reposicionado na posição original para que todo o meio líquido voltasse para a porção inferior do frasco. Todos os materiais foram novamente incubados a 35º C ± 2º C e observados duas vezes ao dia para a identificação de colônias e/ou mudança do indicador de CO2 (fig. 5).
Figura 5 Sistema após o término do período de incubação. Tampão nasal (T) no interior do frasco com caldo suplementado, indicador de CO2 (i) com coloração rosa forte pela presença de micro-organismos e meio ágar chocolate (H) com presença de colônias bacterianas.
O período de incubação foi de sete dias, procedendo-se, a seguir, com a separação dos dois recipientes e a identificação das colônias presentes em meio sólido. Os meios ágar chocolate e ágar MacConkey foram utilizados para a identificação bacteriana. Os materiais foram mantidos incubados à temperatura ambiente por mais oito dias, totalizando 15 dias, para a pesquisa de fungos no meio ágar Sabouraud.
Foi realizada a análise estatística para avaliar o grau de inflamação na mucosa, a proliferação conjuntivo-fibrosa e a presença ou não de bactérias, de acordo com o dia de sacrifício dos animais. Foram descritos todos os grupos de bactérias encontrados na amostra em ambos os lados com uso de frequências absolutas e relativas. O grau de inflamação da mucosa e a proliferação conjuntivo-fibrosa foram comparados entre os dias de sacrifício com o uso de testes Kruskal-Wallis,18 seguidos de comparações múltiplas não paramétricas de Dumm19 para confronto dos dias dois a dois, quando necessário. Para a presença ou não de bactérias, foi verificada a existência de associação com uso de teste da razão de verossimilhanças.18
A concordância entre o swab e a cultura realizada no tampão foi descrita conforme os dias de sacrifício, e foi verificada a existência de associação da concordância com esses dias através do teste da razão de verossimilhanças.
Os testes foram realizados com nível de significância de 5% (p < 0,05).
Resultados
Utilizamos no estudo 22 coelhos, sendo 20 no grupo de estudo e dois no grupo controle. Nenhum animal evoluiu a óbito durante o período do experimento. No momento da retirada do tampão, no décimo dia da indução do experimento, todos os coelhos apresentavam rinorreia purulenta unilateral no lado direito. Assim sendo, todos os coelhos sacrificados do grupo A apresentavam rinorreia purulenta neste momento. Três coelhos do grupo B apresentavam rinorreia evidente antes do sacrifício. Nenhum coelho do grupo C apresentava rinorreia evidente pela cavidade nasal no momento do sacrifício. Porém, quatro coelhos do grupo B e dois coelhos do grupo C apresentavam secreção purulenta no seio maxilar após o sacrifício dos animais e exposição destas estruturas anatômicas.
Cultura de secreção e exame bacterioscópico
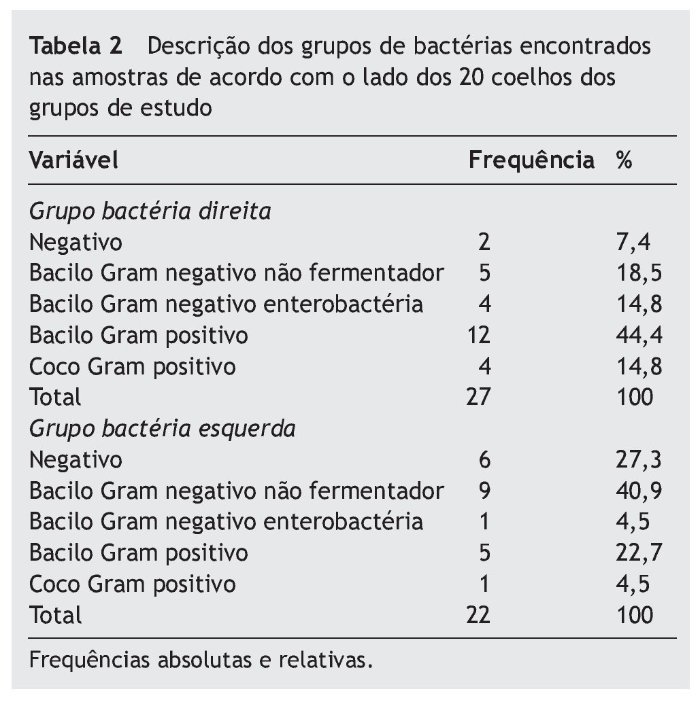
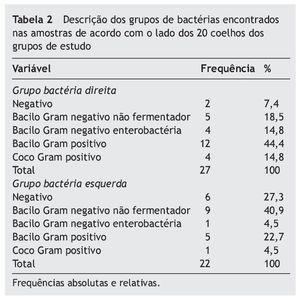
Realizamos coleta e análise das secreções dos seios maxilares direito e esquerdo de todos os coelhos. Optamos pela classificação das bactérias encontradas nos seguintes grupos: bacilo Gram negativo não fermentador (Acinetobacter baumanii, Acinetobacter Iwoffii, Achromobacter sp e Pseudomonas aeruginosa), bacilo Gram negativo enterobactéria (Escherichia coli), bacilo Gram positivo (Bacillus sp) e cocos Gram positivos (Micrococcus sp, Staphylococcus coagulase negativo e Staphylococcus aureus). Os resultados encontram-se descritos na tabela 1.
A tabela 2 mostra que, no lado submetido à indução de rinossinusite (lado direito), o grupo de bactéria mais frequente encontrado foi o de bacilo Gram positivo (44,4%); já no lado contralateral foi o grupo de bacilo Gram negativo não fermentador (40,9%). Identificamos maior incidência de bactérias Gram negativas no total dos coelhos avaliados. Estas foram identificadas em 15 animais (75%), sendo que as bactérias Gram positivas, em apenas nove deles (45%). O micro-organismo mais encontrado nos exames de cultura do seio maxilar direito dos coelhos foi o Bacillus sp, identificado em 11 coelhos. Também observamos que sete coelhos apresentaram dois micro-organismos nos exames de cultura do lado direito.
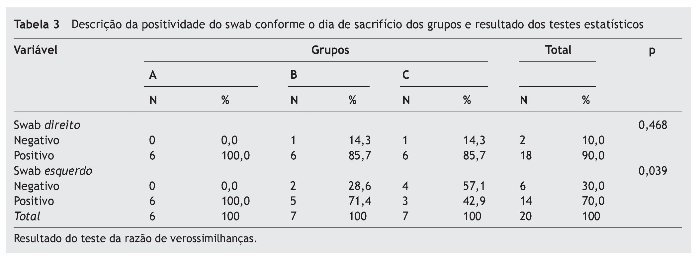
Avaliamos a positividade do swab bilateralmente nas amostras coletadas. Os resultados encontram-se na tabela 3.
A tabela 3 demonstra que não há associação estatisticamente significativa na positividade do swab no lado direito (p = 0,468). Observamos apenas que a positividade no swab do lado esquerdo está estatisticamente associada aos dias de sacrifício, sendo que a positividade vai diminuindo com o passar dos dias (p = 0,039).
As culturas dos seios maxilares dos dois coelhos utilizados como controle não apresentaram crescimento de nenhuma bactéria.
Avaliação histológica da mucosa sinusal
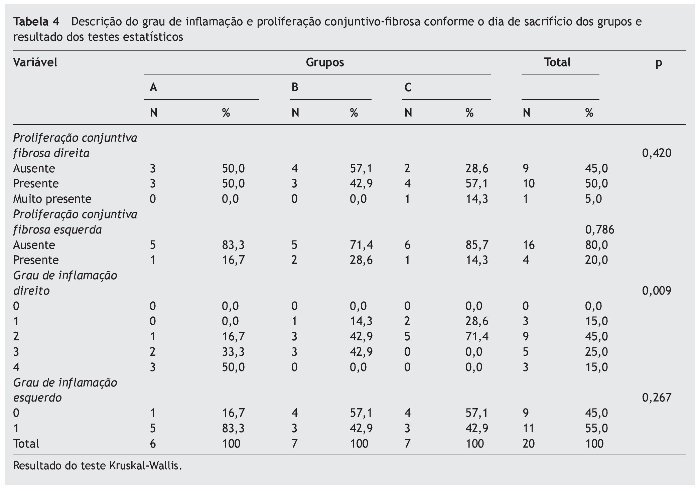
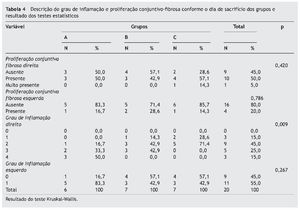
A análise histológica das mucosas dos seios maxilares direito e esquerdo apresentaram grau de inflamação na maioria das amostras. Os resultados da avaliação histológica semi-quantitativa das amostras de mucosa encontram-se na tabela 4.
A tabela 4 mostra que há diferença estatisticamente significativa entre os grupos para o grau de inflamação no lado induzido (p = 0,009), não havendo diferença estatisticamente significativa na proliferação conjuntivo-fibrosa entre os grupos (p = 0,420). No lado esquerdo não houve diferença estatisticamente significativa em ambos os parâmetros. Com relação ao grau de inflamação da mucosa do seio maxilar esquerdo, observamos apenas os graus 0 e 1.
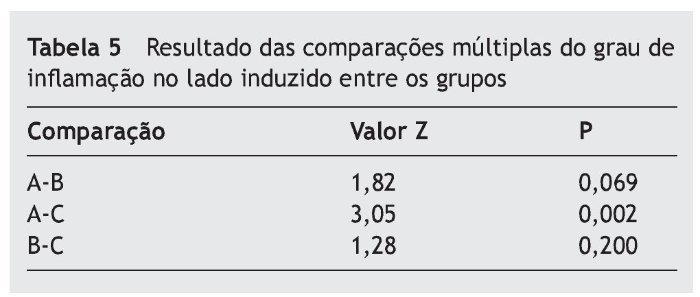
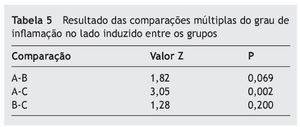
A tabela 5 aponta a comparação do grau de inflamação do lado direito em relação aos três grupos do estudo.
A tabela 5 mostra que o grau de inflamação no grupo A (dia 10) é estatisticamente maior que no grupo C (dia 30), com p = 0,002.
A análise histológica dos seios direito e esquerdo dos dois coelhos do grupo controle apresentou grau 0 de inflamação e proliferação conjuntivo-fibrosa ausente.
Análise do tampão nasal
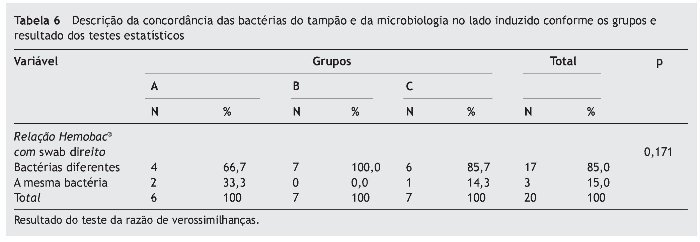
Analisamos a relação entre as bactérias encontradas no swab do lado direito e as bactérias identificadas nos tampões de Merocel®.
Na tabela 6 não há associação estatisticamente significativa entre a concordância das bactérias encontradas no swab e no tampão nasal conforme os grupos (p = 0,171).
Foi realizada análise de um tampão de Merocel® utilizado como controle através do sistema Hemobac® e não houve crescimento bacteriano.
Discussão
Diversos modelos experimentais para indução de rinossinusite foram realizados e estão descritos na literatura.20 Os coelhos são os animais mais utilizados neste tipo de trabalho, seguidos por ratos e ovelhas. Optamos pela utilização dos primeiros, por apresentarem maior semelhança anatômica e fisiológica com as cavidades nasossinusais dos humanos, conforme relatado por Casteleyn et al.21
Estes modelos experimentais vêm sendo descritos para avaliarem diversos aspectos do processo infeccioso sinusal. Foram avaliadas alterações anatômicas, fisiológicas e histopatológicas dos seios paranasais13,16,22,23; e realizadas comparações da eficácia de diferentes tratamentos para rinossinusite.8,9,11,24-26 A pesquisa e identificação da presença de biofilmes bacterianos também foram realizadas.27
Diferentes métodos foram utilizados para a indução de processo infeccioso bacteriano sinusal nos coelhos. Os primeiros trabalhos realizavam a obstrução definitiva dos óstios maxilares através de procedimentos cirúrgicos ou uso de cola.6,22-24 Embora este modelo de rinossinusite tenha provado ser extremamente eficaz na formação de rinossinusite purulenta, a inflamação era geralmente limitada ao seio maxilar, como um abscesso sinusal. Além disso, a manipulação para promover a obstrução do óstio era realizada através da cavidade sinusal para dentro da cavidade nasal.
Em nosso trabalho, optamos pela indução de rinossinusite através da inserção de esponja sintética na fossa nasal direita dos animais, com retirada das mesmas após 10 dias em todos os grupos. Este método apresenta simplicidade técnica para sua confecção, causa pouca lesão em mucosa nasal e grande facilidade na remoção do tampão dos coelhos que prosseguiram no estudo. Além disso, este método não promove alterações permanentes na mucosa nasossinusal dos animais, sendo reversível, o que nos permitiu avaliar a recuperação histológica após a indução de quadro de rinossinusite aguda.
Alguns autores realizaram a inoculação do agente infeccioso dentro do seio maxilar,7,22,25,26,28,29 e outros dentro da cavidade nasal.15,20,30 Optamos por não utilizar a primeira técnica, por ser mais invasiva e causar alterações iatrogênicas na mucosa sinusal. Alguns trabalhos provaram que a simples obliteração das fossas nasais já seria suficiente para desenvolver um quadro infeccioso bacteriano.7,13,31
Utilizamos a inoculação de toxoide estafilocócico e estreptocócico em conjunto com a inserção de esponja sintética nas mesmas fossas nasais. Decidimos pela inoculação do toxoide, com o objetivo de padronizar os agentes patogênicos presentes nas amostras com os agentes que causam o quadro infeccioso sinusal em humanos, e também para acelerar o tempo de indução da rinossinusite. Este achado foi demonstrado por Kara et al.,15 que evidenciaram, através da realização de tomografia computadorizada, a presença de infecção no seio maxilar de coelhos a partir do sexto dia após a indução de rinossinusite com a inoculação de toxoide, e no oitavo dia sem a inoculação do mesmo.
Após a retirada da esponja no décimo dia, todos os animais apresentavam rinorreia purulenta unilateral na cavidade nasal em que as mesmas foram inseridas. Este resultado é compatível com outros autores15,26,32 que utilizaram método semelhante através da via rinogênica, modelo inicialmente proposto por Marks,20 utilizando apenas a inserção de tampão nasal associado ou não à inoculação de agentes bacterianos ou toxoides bacterianos através da cavidade nasal. Marks20 apresentou 83% de sucesso com seu método, e Liang et al.31 obtiveram 91,7% na indução de quadro infeccioso agudo.
Utilizamos como critério principal para o diagnóstico de rinossinusite aguda a presença de rinorreia purulenta na cavidade nasal dos animais. As avaliações microbiológicas e histológicas dos animais pertencentes ao grupo A nos permitiu a avaliação do processo infeccioso no momento do seu diagnóstico, ou seja, 10 dias após o início do experimento. A partir de então, pudemos observar o período de recuperação da rinossinusite aguda, sem nenhum tipo de tratamento. Desta forma, alguns coelhos do grupo B ainda apresentavam secreção nas cavidades nasais e nos seios maxilares após serem sacrificados, e alguns coelhos do grupo C ainda apresentavam secreção nos seios maxilares no momento do sacrifício.
Nas análises microbiológicas e histológicas dos coelhos do grupo A, todos os animais apresentavam swab positivo do seio maxilar para micro-organismos e sinais de inflamação na mucosa bilateralmente. Já os coelhos dos grupos B e C apresentavam alguns resultados de swab negativo do seio maxilar, enquanto que na avaliação histológica todos estes animais ainda mantinham algum grau de inflamação no seio maxilar direito. Com estes resultamos, podemos sugerir que, na evolução de um quadro de rinossinusite aguda bacteriana, a persistência dos achados inflamatórios na mucosa sinusal é mais prolongada do que a presença de micro-organismos, causando um processo infeccioso.
A maioria dos trabalhos que utilizou cepas de Streptococcus pneumoniae para auxiliar na indução da rinossinusite apresentou a substituição deste patógeno por outros agentes oportunistas. Westrin et al.33 utilizaram esta bactéria na indução e observaram sua substituição após cinco dias, em média. Cheng et al.26 não isolaram este agente em nenhum coelho após dez dias do início da indução. Em nosso estudo, não identificamos a presença do pneumococo em qualquer dos coelhos estudados.
A grande maioria dos modelos descritos na literatura não avaliou o seio contralateral ao seio da indução do experimento. Poucos trabalhos relataram a cultura do material do seio contralateral, e, quando realizada, foi em pequeno número do total de animais do estudo. Liang et al.31 relataram pouco crescimento bacteriano em cavidades nasais sem a presença de rinossinusite. Em nosso trabalho, obtivemos a presença de bactérias no seio contralateral em 14 coelhos (70% do total). Acreditamos que a progressão do quadro inflamatório na mucosa nasossinusal também favoreça o aparecimento de bactérias oportunistas no seio contralateral, ao lado de indução do experimento.
A análise histológica da mucosa sinusal em coelhos submetidos a experimentos para indução de rinossinusite foi realizada na grande maioria dos trabalhos, com diversos objetivos. Foi utilizada sua avaliação como critério diagnóstico para presença de infecção sinusal15,20,29,31 na avaliação da intensidade da infecção,16,34 na comparação da eficácia de diferentes tratamentos para rinossinusite12,14,25 e nas alterações fisiopatológicas sinusais após indução de quadro infeccioso agudo nasossinusal.13,24,30
Optamos, em nosso trabalho, pela análise semiquantitativa, para que pudéssemos graduar a intensidade da inflamação e comparar os três grupos do estudo (sacrifício com 10, 17 e 30 dias). Obtivemos diferença estatisticamente significativa no grau de inflamação entre os coelhos do grupo sacrificado com 10 dias e o grupo sacrificado com 30 dias. Demonstramos, dessa forma, que o processo inflamatório regride após a retirada do tampão. Porém, mesmo após 30 dias do início do experimento (20 dias após a retirada do tampão), muitos coelhos ainda apresentavam inflamação na mucosa sinusal. Este achado denota que o quadro de rinossinusite aguda causa alterações histológicas mais prolongadas do que os achados macroscópicos, e que persistem por algumas semanas até sua regressão completa.
Poucos estudos realizados fizeram a análise histológica da mucosa do seio maxilar contralateral ao seio acometido. Jyonouchi et al.23 observaram aumento de células glandulares e caliciformes nos seios contralaterais, além de leve espessamento do estroma. Porém, utilizaram como método de indução, a obliteração permanente do óstio sinusal com cianoacrilato. Genc et al.30 não observaram alterações na cavidade nasal contralateral à estudada. Liang et al.31 avaliaram apenas alguns lados controle e não observaram alterações histológicas.
Acreditamos ser este um achado muito significativo, e que possa ser justificada a progressão da inflamação como uma resposta de todo epitélio respiratório a um foco local, que desencadearia uma maior resposta mesmo em áreas sem agressão direta. Fato este que também é evidenciado em pacientes asmáticos e portadores de rinite alérgica e/ou rinossinusite, que apresentam agravamento do quadro pulmonar em consequência da piora do quadro nasal, na relação conhecida como “via aérea unificada”. Esta apresenta algumas outras hipóteses para sua ocorrência, como reflexo neural nasobronquial, contaminação das vias aéreas inferiores com células inflamatórias e mediadores através de secreção nasal posterior, ou absorção de células inflamatórias do epitélio nasal para a circulação sistêmica e, consequentemente, para a mucosa bronquial.35,36 Futuros estudos serão necessários para avaliar a relação desta resposta em quadros de rinossinusite.
A avaliação da proliferação conjuntivo-fibrosa não apresentou diferença estatisticamente significativa entre os grupos. Não pudemos, portanto, utilizar este parâmetro como marcador de cronificação do processo infeccioso. O número de coelhos pode não ter sido suficiente para reproduzir alteração estatística neste parâmetro avaliado.
Nas últimas décadas, a grande maioria dos estudos experimentais em coelhos utilizou como método de indução de rinossinusite a inserção de tampão nasal. O material utilizado foi esponja sintética de Merocel®,15,20,26,31 esponja gelatinosa32 ou esponja de polivinil.7,29 O objetivo foi promover um processo inflamatório e infeccioso através da obstrução do óstio sinusal. Outra hipótese aventada para o início deste processo seria a reação inflamatória da mucosa nasal a um corpo estranho, causando uma desorganização da fisiologia ostiomeatal.7
Porém, não encontramos na literatura algum estudo que houvesse realizado a análise do tampão nasal para cultura de micro-organismos, ou com algum outro objetivo.
Kara et al.15 realizaram em seu estudo a cultura do seio maxilar direito (lado de indução da infecção) e da cavidade nasal direita de todos os coelhos, com a coleta de swab. Este foi realizado em apenas uma região da parede lateral da cavidade nasal. Eles afirmaram que a propagação de bactérias da cavidade nasal para o interior do seio era esperada, porém não foi observada esta relação.
A avaliação do tampão nasal foi realizada para que pudéssemos analisar de maneira precisa os micro-organismos presentes nas cavidades nasais, nas quais realizamos a indução do quadro infeccioso. Utilizamos este método para correlacionar as bactérias presentes no interior da cavidade nasal com aquelas presentes no interior do seio maxilar. Não encontramos associação significativa entre as bactérias presentes nestes dois locais anatômicos distintos. Esta associação não foi demonstrada, inclusive, no primeiro grupo de coelhos sacrificados, nos quais a retirada do tampão foi realizada neste mesmo dia, dez dias após o início do estudo.
Conclusão
O modelo experimental realizado e avaliado por meio de parâmetros histopatológicos da mucosa sinusal, por cultura da secreção sinusal e do tampão nasal e por avaliação da presença de secreção nasal, mostrou-se capaz de induzir quadro de rinossinusite aguda bacteriana em 100% dos animais utilizados no estudo.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 14 de março de 2013;
aceito em 22 de julho de 2014
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2014.09.001
☆Como citar este artigo: Dolci EL, de Campos CA, da Silva L, Dolci RL, Dolci JE. Evaluation of the ability of an experimental model to induce bacterial rhinosinusitis in rabbits. Braz J Otorhinolaryngol. 2014;80:480-9.
☆☆nstituição: Irmandade da Santa Casa de São Paulo, São Paulo, SP, Brasil.
* Autor para correspondência.
E-mail:eduardodolci@hotmail.com (E.L.L. Dolci).