A eletrococleografia surgiu recentemente como uma ferramenta diagnóstica na cirurgia de implante coclear, objetiva a preservação da audição e o posicionamento ideal dos eletrodos.
ObjetivoDeterminar as alterações eletrofisiológicas indicativas de trauma coclear após a cocleostomia e após o implante do eletrodo em diferentes profundidades de inserção.
MétodoNeste estudo experimental, potenciais extracocleares foram obtidos durante a cirurgia de implante coclear em cobaias. Cobaias com audição normal (n=14) foram implantadas uni‐ ou bilateralmente com eletrodo multicanal. Os potenciais de ação do nervo coclear extracoclear foram obtidos em resposta a estímulos acústicos em frequências específicas antes e após a cocleostomia e após a introdução do feixe de eletrodos. Após os experimentos eletrofisiológicos, as cobaias foram submetidas à eutanásia e a microtomografia foi feita para determinar a posição do eletrodo e calcular a profundidade de inserção. Com base nas mudanças de amplitude e limiares em relação à frequência do estímulo, os dados eletrofisiológicos e a posição obtida na reconstrução microtomográfica foram comparados.
ResultadosA cocleostomia promoveu um pequeno impacto eletrofisiológico, enquanto a inserção do eletrodo causou alterações na amplitude dos potenciais eletrofisiológicos extracocleares em uma ampla faixa de frequências, especialmente nas inserções mais profundas. Houve, entretanto, preservação da resposta elétrica aos estímulos de baixa frequência na maioria dos casos, indicou um impacto auditivo limitado na avaliação intraoperatória. A profundidade média de inserção dos eletrodos apicais foi 5339,56μm (± 306,45 ‐ 6 contatos inseridos) e 4447,75μm (± 290,23 ‐ 5 contatos inseridos).
ConclusãoAs principais alterações eletrofisiológicas observadas durante os procedimentos cirúrgicos ocorreram durante o implante do eletrodo, especialmente nas inserções mais profundas, enquanto a cocleostomia alterou os potenciais em menor grau. Embora a perda auditiva seja frequentemente observada em posição apical ao implante coclear, foi possível preservar as baixas frequências após a inserção.
Os critérios para cirurgia de implante coclear (IC) mudaram acentuadamente nos últimos anos, inclusive para pacientes com perda severa ou mesmo seletiva em frequências leves a altas.1 Melhores escores no desempenho de percepção de fala, especialmente em condições de dificuldade de audição, em pacientes tratados por estimulação eletroacústica (EAS [electroacoustic stimulation], implantes híbridos) em comparação com pacientes tratados por qualquer um dos métodos isoladamente, juntamente com a perspectiva de terapia futura do ouvido interno, tornaram a preservação da audição residual uma meta crítica no campo auditivo.2,3 Assim, minimizar o trauma das delicadas estruturas intracocleares é geralmente um objetivo na cirurgia moderna de IC. Aprimoramentos recentes no projeto dos eletrodos, bem como nas técnicas cirúrgicas, contribuíram substancialmente para melhorar a audição pós‐operatória.4,5 Entretanto, há dados limitados e alta variabilidade entre os estudos disponíveis sobre os resultados da preservação da audição. A porcentagem de audição residual total ou parcialmente comprometida ainda é alta em pacientes com IC, apesar de todos os esforços.6–8
A determinação da posição precisa do eletrodo, bem como a detecção imediata de possíveis danos da inserção, é um ponto‐chave nas pesquisas atuais sobre implantes cocleares. A eletrococleografia (ECOG) surgiu recentemente como uma ferramenta para avaliação do estado fisiológico coclear e profundidade de inserção do eletrodo durante a cirurgia.9,10 A ECOG consiste em 4 componentes principais: 1) potenciais de ação compostos (PACs), um componente transitório no início da resposta comumente associado à atividade do nervo auditivo;11,12 2) neurofonia do nervo auditivo (NNA), que também tem origem neural; 3) potenciais microfônicos cocleares (MCs), um componente AC em toda a resposta ao estímulo que se origina das células ciliadas externas (CCEs); 13 4) potenciais somadores (PSs), um componente DC que depende em grande parte da atividade das células ciliadas internas (CCIs) e CCEs.14–16 Mudanças de amplitude de PACs e MCs em registros monopolares têm se mostrado um marcador precoce de contato entre o eletrodo e as estruturas cocleares ou mesmo danos menores e reversíveis, durante a inserção de IC em gerbils.17–19 Uma correlação entre os potenciais de ECOG intraoperatórios e a preservação da audição pós‐operatória foi descrita, mas ainda é avaliada.20,21
O objetivo do presente estudo foi determinar o local e a extensão da cocleostomia e do trauma do implante, documentar o PAC extracoclear em cobaias normo‐ouvintes submetidas à cirurgia de IC. Os achados eletrofisiológicos foram correlacionados com a profundidade de inserção medida pelo número de canais de eletrodos inseridos na cóclea. Comparamos as amplitudes e os limiares do PAC em duas profundidades de inserção diferentes na escala timpânica por meio de cocleostomia. Com esse objetivo, analisamos as frequências envolvidas nas mudanças de limiar em diferentes etapas da cirurgia e hipotetizamos as possíveis causas, como um efeito de pistão e contato ou dano da membrana basilar. A posição do eletrodo intracoclear reconstruído a partir de imagens de microtomografia computadorizada post mortem (μTC, microtomografia) foi verificada.
MétodoO comitê consultivo institucional de pesquisa e cuidado animal aprovou todos os experimentos. O estudo foi conduzido de acordo com a “lei de proteção aos animais” (TierSchG) da Alemanha e com a European Communities Council Directive 86/609/EEC para a proteção de animais usados para fins experimentais.
Neste estudo, foram avaliadas 24 cócleas em 14 cobaias Dunkin Hartley machos saudáveis e com audição normal (Charles River Laboratories International Inc., Sulzfeld, Alemanha) que pesavam entre 300‐600g e constituíram a amostra do estudo.
Procedimentos experimentaisDetalhes técnicos do eletrodoOs eletrodos usados neste estudo foram IC de pesquisa feitos sob medida (Med‐El Inc., Innsbruck, Áustria), compreenderam 6 contatos de platina‐irídio, espaçados por 700μm, 0,5mm de diâmetro máximo do suporte de silicone, afunilaram a 0,3mm na extremidade e com um comprimento inserível de 4,5mm coberto por contatos (da extremidade ao último contato). De acordo com a numeração‐padrão para os ICs MedEl, o contato mais apical será chamado de canal ou contato 1 (Ch1), o contato mais basal como canal ou contato 6 (Ch6) e os contatos intermediários serão numerados adequadamente.
Anestesia e monitoramentoQuatorze animais foram implantados uni‐ ou bilateralmente (24 orelhas). Todas as medidas e todos os procedimentos cirúrgicos foram feitos sob anestesia geral. Os animais foram anestesiados inicialmente por injeção intramuscular de 50mg/kg de solução de cetamina a 10% (CP Pharma, Burgdorf, Alemanha), 10mg/kg de solução de xilazina a 2% (WDT, Garbsen, Alemanha) e 0,1mg/kg de sulfato de atropina (B. Braun, Melsungen, Alemanha). A anestesia de seguimento em intervalos de 45 minutos foi aplicada com 25% a 30% da dose inicial, substituiu o sulfato de atropina por solução de acetato de Ringer. O nível de anestesia foi avaliado por monitoramento contínuo da frequência cardíaca (através de eletrocardiograma) e capnometria (%CO2/vol.). A ausência dos reflexos de retirada de pata e corneal foi testada em intervalos regulares para verificar a profundidade da anestesia. Foi feita uma ampla raspagem dos pelos na pele atrás da orelha, ao redor do pescoço e no vértice do crânio. Os animais foram mantidos em manta térmica (TC‐1000 Temperature Controller, CWE Inc., Ardmore, EUA). A temperatura central foi monitorada continuamente por uma sonda retal e mantida acima de 38°C. Um tubo endotraqueal feito sob medida foi inserido através de traqueotomia e conectado ao capnômetro (Normocap CO2 & O2 Monitor, Datex, Helsinki, Finlândia). A ventilação por tubo endotraqueal foi feita em ventilador para roedores (Ugo Basile, Gemonio, Itália) e o volume corrente foi ajustado ao peso corporal do animal. A taxa respiratória foi definida entre 50 e 60 por segundo, dependeu da concentração expirada de CO2, mantida entre 3% e 4%. As cabeças dos animais foram fixadas em um suporte de cabeça de roedor personalizado que permitiu o ajuste ao longo de três eixos. Todas as medidas foram feitas em uma câmara com atenuação de som.
Medidas de potenciais evocados auditivos de tronco encefálico (Peate)Eletrodos subcutâneos de A/AgCl foram colocados retroauricularmente em ambos os lados (referências) da cabeça e no vértice (eletrodo de registro) para os registros. Um eletrodo de Ag/AgCl grosso foi inserido por via subcutânea na nuca (eletrodo de aterramento). Os limiares auditivos iniciais para ambas as orelhas antes da cirurgia foram determinados pelo registro dos potenciais evocados auditivos de tronco encefálico (Peate). Uma série de cliques de níveis de som crescentes (0‐80dB NPS com aumentos de 5dB, duração de clique de 50μs, 100 estímulos de cada condensação e rarefação em média por nível de estímulo) foram apresentados através de um fone de ouvido com alto‐falante dinâmico (DT48, Beyerdynamic, Heilbronn, Alemanha). O alto‐falante foi posicionado a 1cm de distância do pavilhão auditivo em condições próximas de campo livre. Os sinais foram gerados e as respostas adquiridas com o software AudiologyLab (Otoconsult, Frankfurt, Alemanha) através de um conversor DA/AD (NI‐6259, National Instruments, Austin, TX, EUA). Os estímulos foram enviados através de um atenuador (ATT7, Otoconsult, Frankfurt, Alemanha) e os sinais gravados foram filtrados (filtro Butterworth de 6ª ordem, frequência do filtro passa‐alta de 200Hz, frequência do filtro passa‐baixa de 5kHz) e amplificados em 80dB com uma combinação de filtro e amplificador (dispositivo F1, Otoconsult Comp., Frankfurt / M., Alemanha). A função do ouvido médio e a função coclear foram consideradas normais para níveis de limiar de Peate de 30dB NPS‐pico equivalente ou melhor. Todas as orelhas incluídas neste estudo atenderam a esse critério.
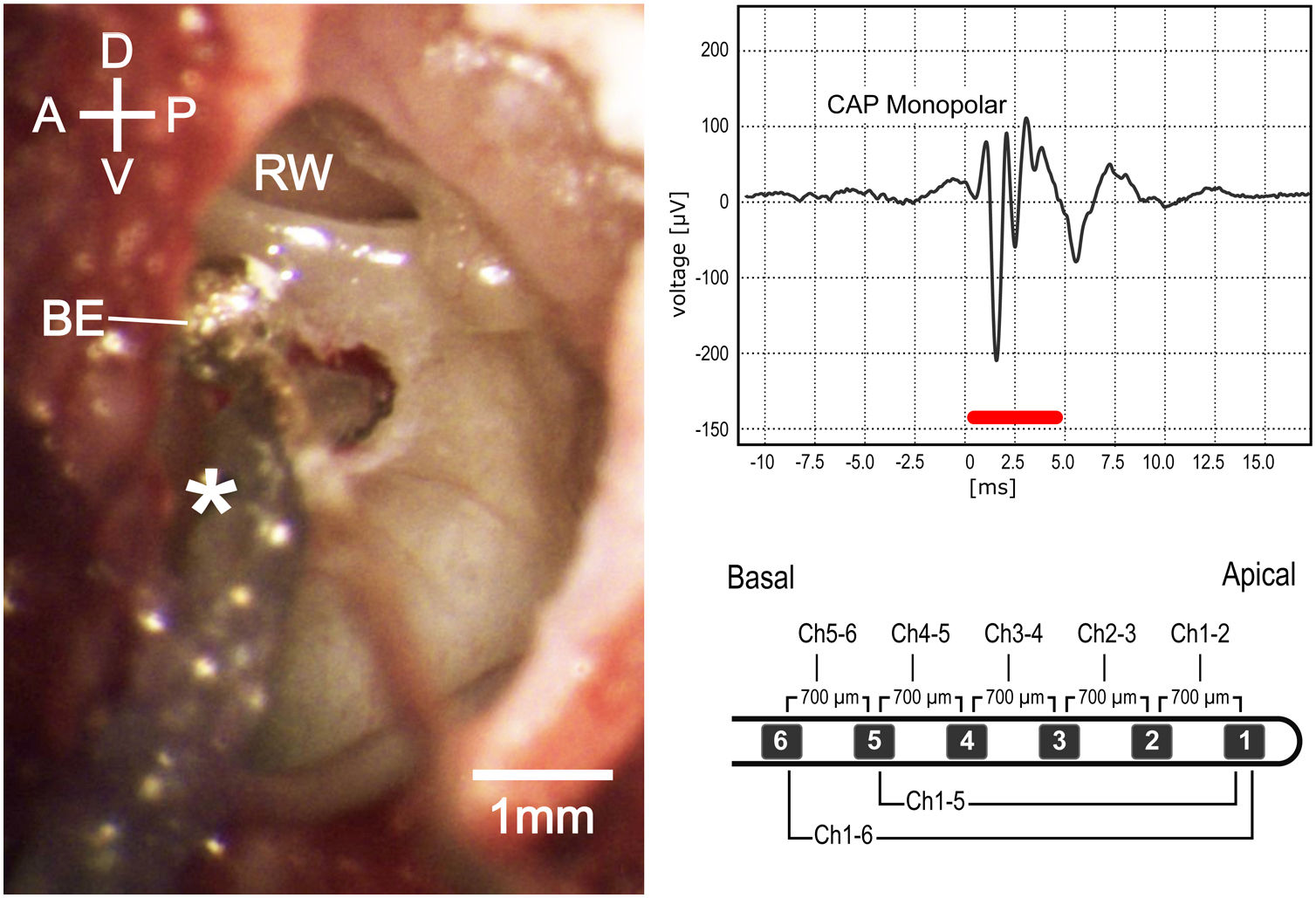
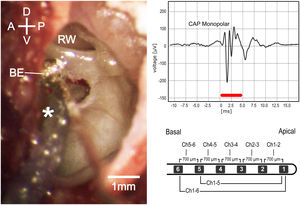
Cirurgia e inserção de implante coclearOs seguintes procedimentos e medidas nas orelhas direita ou esquerda foram feitos sequencialmente (fig. 1). A anestesia local (lidocaína a 2%, 2mL) foi aplicada na pele ao redor do pavilhão antes de uma ressecção completa do mesmo. O músculo e o tecido mole foram dissecados e a parte posterolateral da bula timpânica foi exposta e aberta com uma agulha oca sob visualização estereomicroscópica (Carl Zeiss OPMI® pico, Carl Zeiss, Goettingen, Alemanha). A parede lateral da bula foi adicionalmente exposta e cuidadosamente removida com uma microbroca para acessar a orelha média e o giro basal da cóclea, inclusive a janela redonda (JR), sem causar lesões à membrana timpânica. Um eletrodo tipo bola de prata foi posicionado e fixado por suporte mecânico na aba inferior da JR e mantido no local durante todo o procedimento. O alto‐falante foi posicionado próximo à entrada da cartilagem do meato acústico externo por meio de um adaptador cônico, sem deslocamento ou obstrução do conduto auditivo. A cocleostomia foi feita a 0,5mm ventral à JR, com broca de diamante de 0,6mm a 4000rpm e cuidado foi tomado para evitar que pó de osso ou sangue entrasse na cóclea. O eletrodo do IC foi inserido até que todos os 6 contatos dele fossem colocados na escala timpânica (de agora em diante chamados de 6Ch in) ou até que 5 contatos do IC fossem inseridos (de agora em diante chamados de 5Ch in).
Visão microscópica intraoperatória (esquerda). D, Dorsal; V, Ventral; A, anterior; P, posterior; be, eletrodo do tipo esfera de prata; JR, janela redonda. Potencial de ação do composto monopolar (canto superior direito); a barra vermelha representa a duração do estímulo. Imagem esquemática do eletrodo usado nos experimentos (canto inferior direito).
Após o término dos procedimentos experimentais, os animais foram sacrificados com infusão transcardíaca de 2mL de pentobarbital sódico (Release 300, WDT, Garbsen, Alemanha). O carreador silástico do IC foi então fixado em posição na borda da bula timpânica (Histoacryl; B. Braun Melsungen AG, Melsungen, Alemanha). Os cadáveres dos espécimes foram decapitados e as cabeças preservadas em solução tamponada de formaldeído a 3,5% ‐3,7% antes do procedimento subsequente de imagem de μTC.
Registros coclearesPotenciais de ação compostos (PACs) extracocleares foram registrados com mo eletrodo tipo bola de prata na aba da JR. Tone bursts com 5ms de duração (períodos de elevação/queda de 2,5ms) foram apresentados em ordem aleatória em frequências entre 2 e 32kHz (com incrementos logarítmicos de 4/oitava), com níveis de pressão sonora entre 0 e 90dB NPS em incrementos de 10dB. Os estímulos foram gerados através do software AudiologyLab 25 (Otoconsult, Frankfurt, Alemanha). A saída de som foi calibrada com um microfone de ¼ polegada (tipo 4939, Brüel & Kjaer, Nærum, Dinamarca) em combinação com um pré‐amplificador (tipo 2670, Brüel & Kjaer, Nærum, Dinamarca) e um amplificador de condicionamento (tipo 2690, Nexus, Brüel & Kjaer, Dinamarca) conectado à placa da National Instruments. Os sinais de gravação foram filtrados entre 5Hz e 5kHz e foi calculada a média com mais de 20 apresentações de estímulos. As medidas do PAC foram feitas após a abertura da bula timpânica, imediatamente após a cocleostomia e após a inserção do IC.
Análise de dadosOs dados registrados foram analisados na faixa de 4 oitavas (2 a 32kHz) a 9 níveis de som (0 a 80dB NPS) com rotinas MATLAB personalizadas (MathWorks, Natick, MA, EUA), os softwares Prism (Graph Pad Software Inc., La Jolla, CA, EUA) e Microsoft Excel (Professional Edition, 2007, Microsoft Corp, Redmond, WA, EUA). Extraímos os potenciais de ação compostos (PACs) a partir do potencial eletrococleográfico por filtros off line ajustados diferencialmente (fig. 1). Durante a análise off line dos PACs, a média do sinal de gravação foi calculada nas apresentações dos estímulos de condensação e rarefação para excluir amplamente os MCs. O sinal de gravação foi filtrado entre 200Hz e 5kHz. Os PACs foram identificados pela morfologia dos componentes típicos N1 e P1 no início do estímulo (janela de análise entre 0 e 10ms) e a amplitude pico a pico foi calculada. O valor limite foi definido como a menor intensidade capaz de evocar uma resposta duas vezes maior do que a amplitude da linha basal.
As comparações estatísticas foram feitas com os testes de Wilcoxon pareado e de Mann‐Whitney, para grupos independentes. Uma probabilidade de p <0,05 foi considerada significativa. Os resultados foram expressos como média±erro‐padrão da média (EPM), a menos que indicado de outra forma.
Imagem de microtomografia computadorizada e reconstrução tridimensionalAs cabeças das cobaias com os implantes fixados no lugar e preservadas em solução tamponada de formaldeído a 3,5%‐3,7% foram escaneadas em um sistema de microtomografia computadorizada (μTC, XtremeCT II, SCANCO Medical AG, Brüttisellen, Suíça) com um protocolo definido para um resolução de tamanho de voxel de 17,0μm (68 kVp, 1470μA, 100W).
Um conjunto de dados μTC de alta resolução de uma cóclea esquerda não implantada foi usado para reconstruir o comprimento da membrana basilar ao longo do ponto médio entre a lâmina espiral óssea e o ponto de fixação do ligamento espiral no software de análise 3D Amira (Versão 6.0.1, FEI Corp., Hillsboro, OR, EUA). A reconstrução incluiu a região basal curva, adjacente à janela redonda. Todos os espécimes implantados foram registrados neste modelo no software Amira.
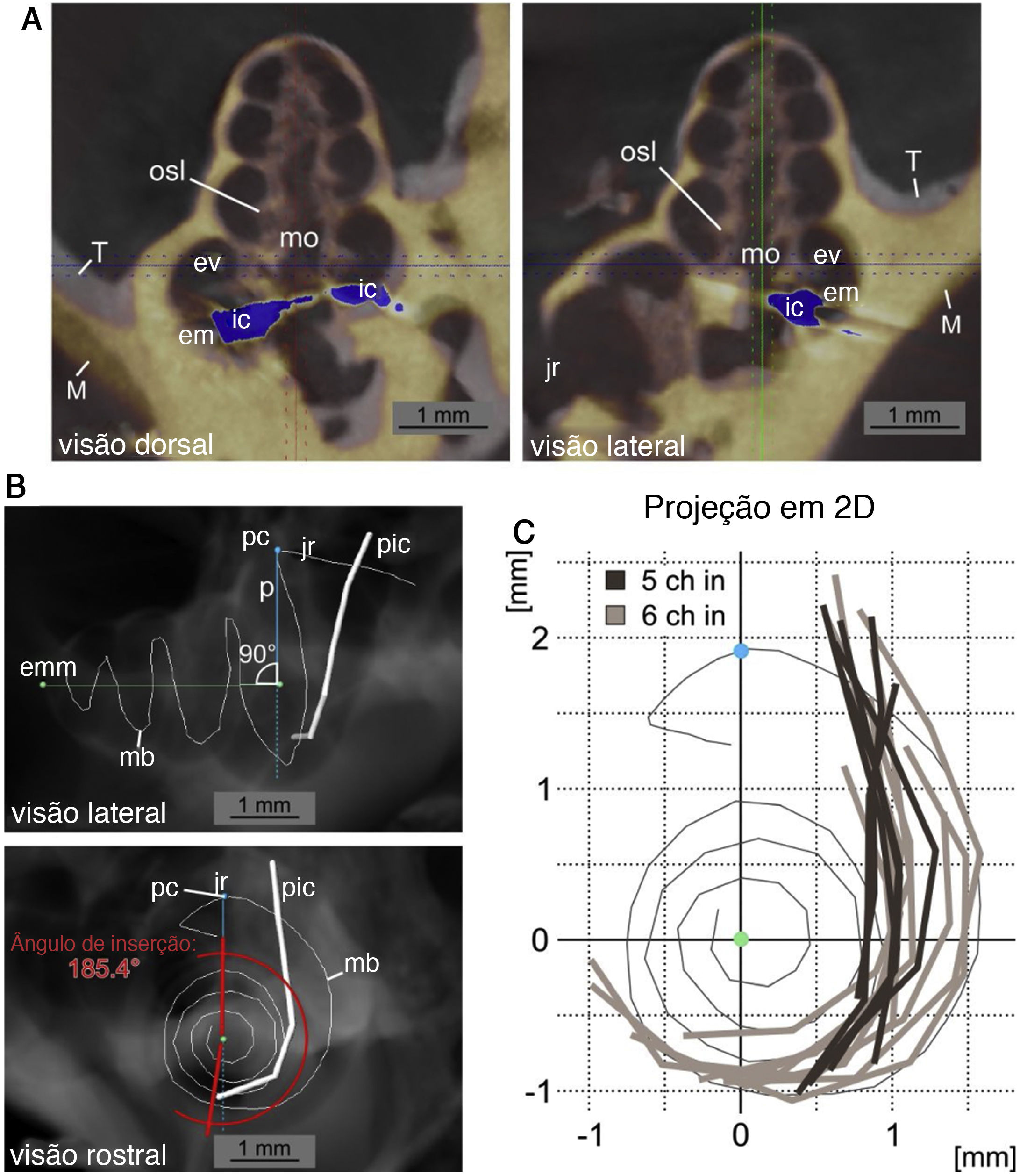
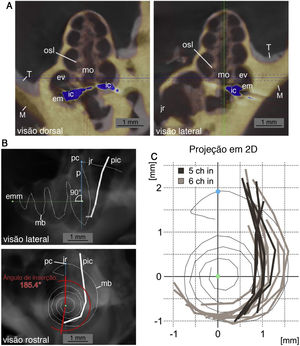
As cócleas direitas foram espelhadas para permitir o registro. Em seguida, as coordenadas dos contatos foram medidas. Então, para girar esses dados tridimensionais (forma de espiral), em um plano bidimensional, os valores foram girados e projetados em uma representação rostrocaudal bidimensional da cóclea. A projeção foi girada para representar um corte ao longo do eixo médio‐modiolar rostrocaudal que se cruza com a perpendicular vertical até o cimo da membrana basilar antes de virar para a região do gancho (ponto do cimo). Dessa forma, o comprimento da membrana basilar em porcentagem, conforme descrito por Viberg et al.,22 a profundidade de inserção (último contato como endpoint de inserção em relação ao comprimento da membrana basilar) e o ângulo de inserção (em relação à perpendicular do cimo até o eixo médio‐modiolar) (fig. 2).
Reconstrução do caminho de inserção. A, vista dorsal e lateral de dados da μTC de uma cóclea implantada (amarelo, M) para o modelo não implantado (cinza, T) é representada. O registro foi feito para obter o máximo de concordância entre as cócleas ósseas. A posição do IC com os artefatos florescentes na μTC é mostrada em azul (ic: implante coclear; mo: modíolo; jr: janela redonda; em: escala média; ev: escala vestibular). B, Vista lateral e rostral de uma radiografia digital (a partir de dados da μTC no software Amira) do modelo não implantado com a posição da membrana basilar (mb) reconstruída e a reconstrução exemplar sobreposta da posição do implante coclear (pic). As imagens mostram o eixo modiolar médio (emm), o ponto do cimo (pc) da reconstrução da membrana basilar e o eixo perpendicular ao eixo modiolar (p). A medida do ângulo de inserção (aqui, 185,4°) é exemplificada na vista rostral. C, Projeções bidimensionais na direção basal a apical de 15 posições de implante coclear a partir de dados da μTC relativos à reconstrução da membrana basilar. Uma diferença pronunciada é visível na profundidade de inserção entre inserções de 5 contatos (5Ch pol., cinza escuro) e 6 contatos (6Ch pol., cinza claro) (janela redonda e região de gancho no topo, projeção centrada no eixo médio‐modiolar, comparado a B).
A posição‐frequência dos canais dos eletrodos também foi calculada, de acordo com a equação de Greenwood espécie‐específica, na qual 2,59mm (∼14% do comprimento coclear) de distância dentro da cóclea corresponde a uma oitava (2,59mm/oitava).
Os dados eletrofisiológicos foram analisados em 24 orelhas de 14 cobaias e, dessas, as imagens de μTC foram obtidas em 20 orelhas de 10 animais. No entanto, cinco conjuntos de dados tiveram que ser excluídos por causa do deslocamento post mortem do IC ou problemas de imagem; 15 orelhas de 9 animais foram então incluídas na análise de μTC.
ResultadosAs respostas extracocleares obtidas com o eletrodo tipo bola de prata foram avaliadas como limiares mínimos nos quais um PAC era visível na faixa de frequência de 2 a 32kHz. Os implantes puderam ser reconstruídos anatomicamente em 15 cócleas (fig. 2) e mostraram diferentes profundidades de implante em diferentes animais (ver abaixo). Os implantes mais profundos em condições ideais podem se aproximar do ângulo de inserção de 270° na cobaia. Nos presentes experimentos, nenhum trauma anatômico de implante foi detectado nas imagens de μTC.
Nos presentes experimentos, foram usados animais com audição normal; esses são considerados um caso extremo que não seriam implantados em condições clínicas. Entretanto, essa condição fornece o caso ideal para comparar o trauma de implante ao longo de toda a partição coclear em alta sensibilidade.
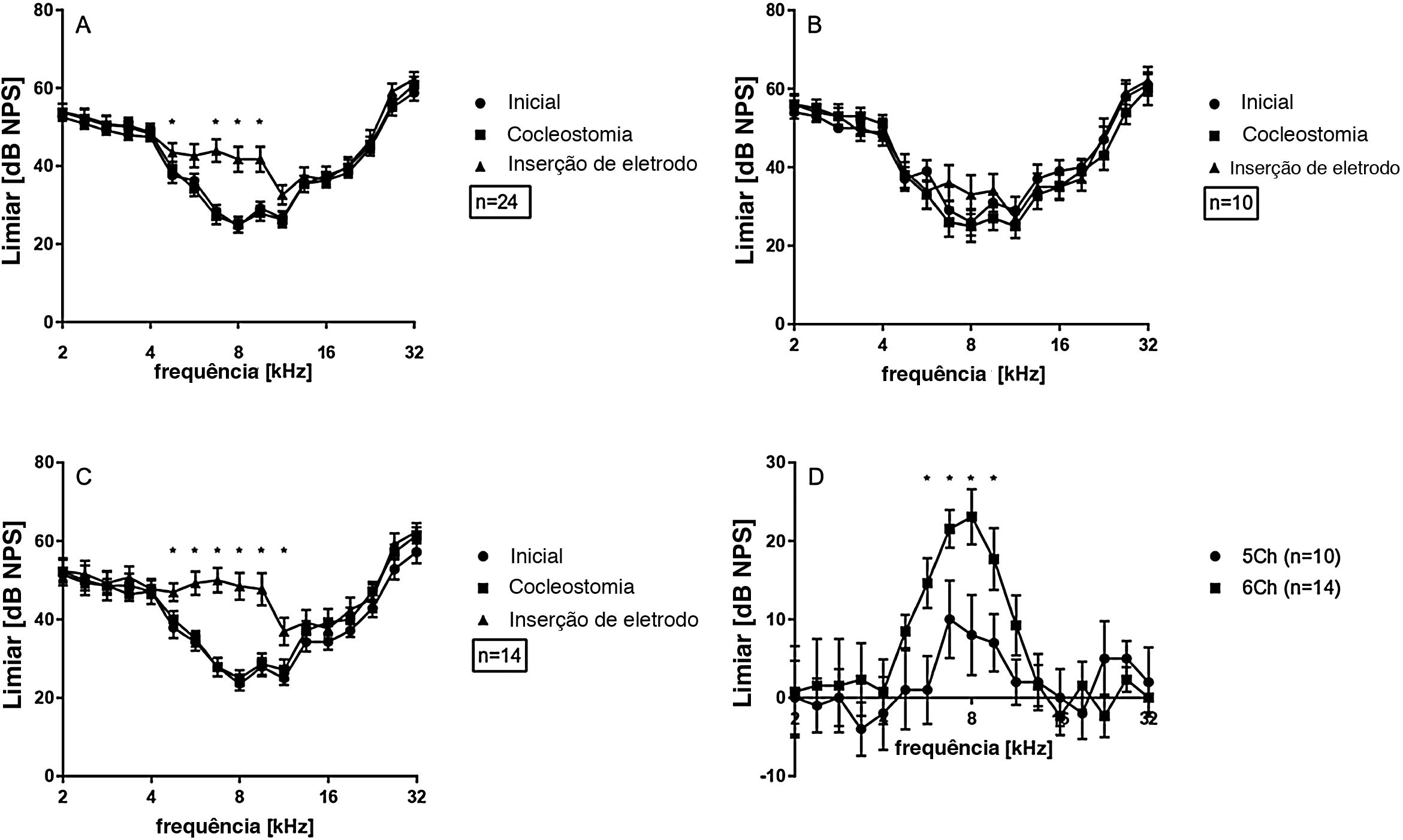
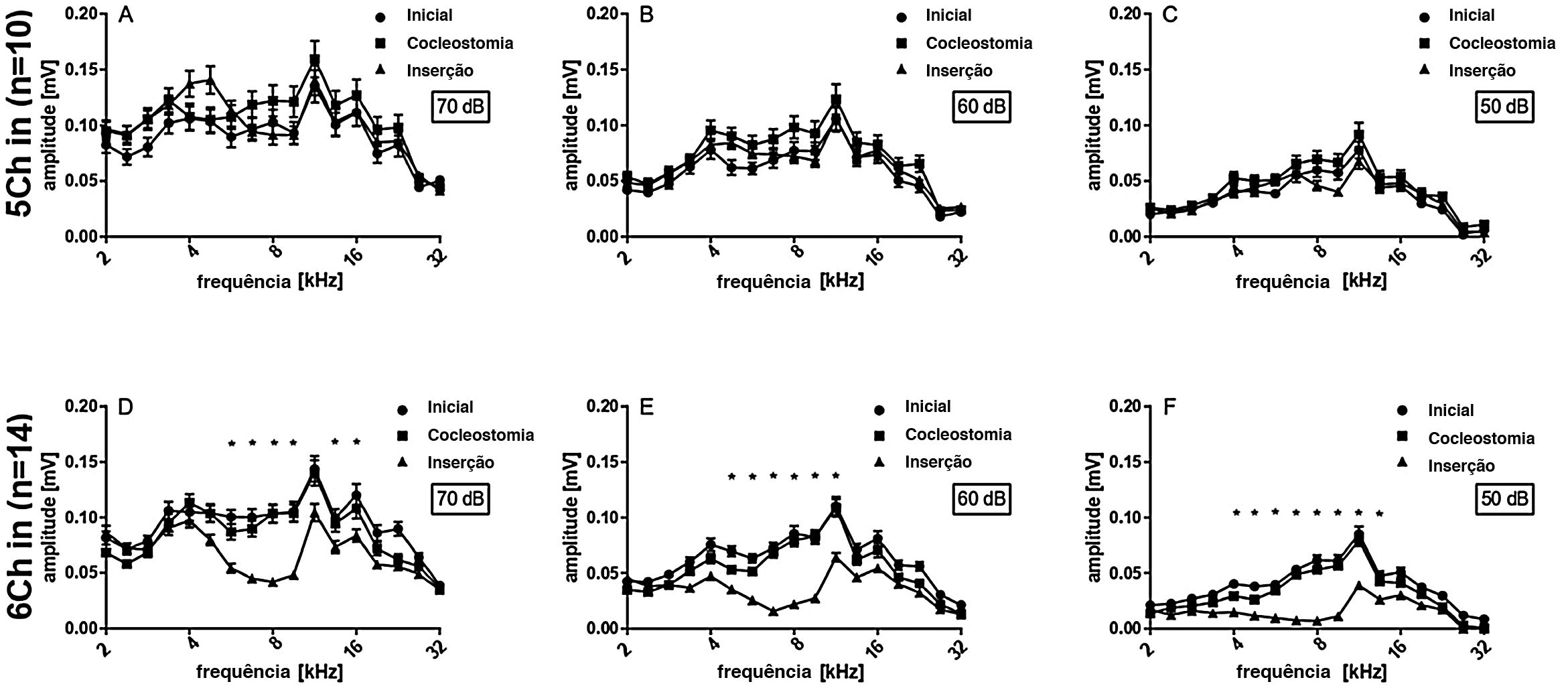
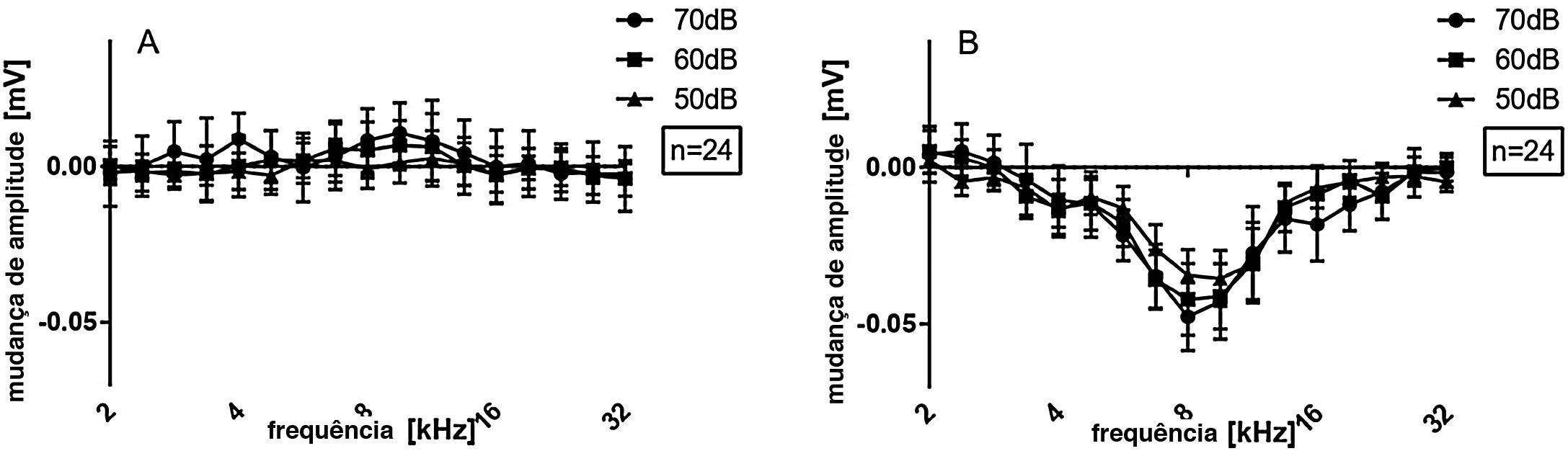
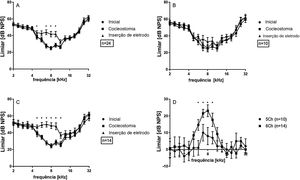
Os dados das 24 cócleas investigadas são mostrados na figura 3A, exibidos como média e erro‐padrão da média (EPM). Imediatamente após a cocleostomia, as mudanças de limiar (ML) foram mínimas ou ausentes e não significativas em todas as frequências avaliadas. No entanto, em todos os casos, a inserção do eletrodo causou alguma mudança de limiar. ML significativa ocorreu principalmente nas frequências de 4,7 a 9,5kHz. As respostas às frequências de 2,0−4,0kHz foram as menos afetadas pelo implante. Considerando o comprimento do eletrodo (3,5mm do contato apical ao basal) e a função de Greenwood,22 a inserção induziu mudanças ao redor do ápice do implante, em frequências que se estendem aproximadamente por 0,5 a uma oitava (ou 1,3 a 2,6mm) na direção apical além da cobertura do eletrodo. Isso foi confirmado pelas profundidades de implante anatomicamente reconstruído nas 15 cócleas com imagens de μTC disponíveis (fig. 2).
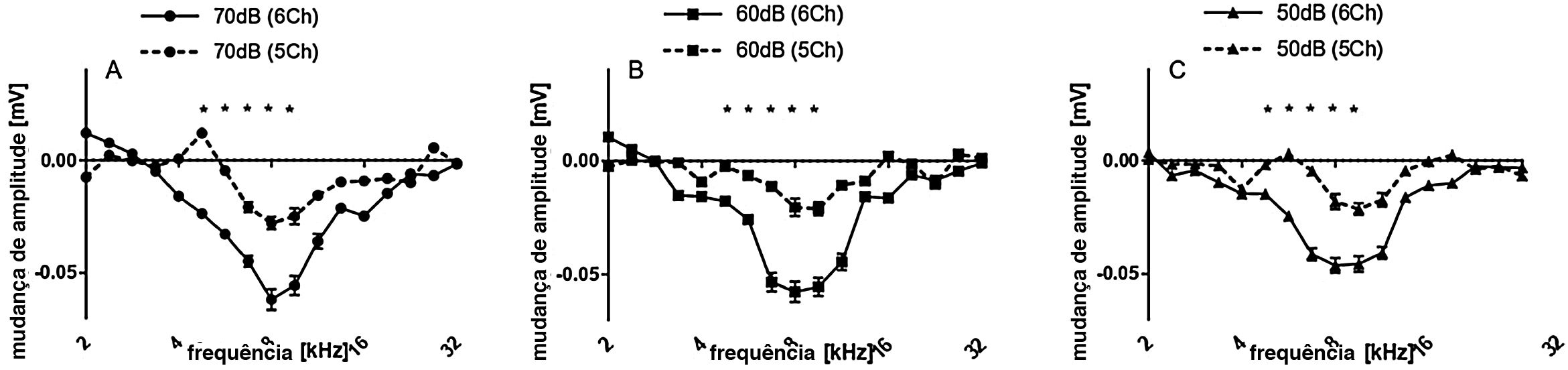
Em média, a ML atingiu no máximo 16,5±2,7dB, considerando as 24 orelhas. Essa foi uma perda auditiva muito leve. Os implantes, conforme relatado durante a cirurgia, foram subsequentemente divididos em implantes de 5 contatos (ou seja, implantes mais superficiais) e implantes de 6 contatos (ou seja, implantes mais profundos). As inserções de 6 contatos (chamadas de 6Ch) apresentaram alterações maiores (23,0±3,5dB, onda TS máxima) quando comparadas às inserções de 5 contatos (chamadas de 5Ch; 10,0±4,5dB TS máxima) (fig. 3 B e C). TS foi observada nas frequências de 4,7 e 5,6kHz exclusivamente no grupo 6Ch (não observado no grupo 5Ch). A comparação direta dos grupos de 6Ch e 5Ch revelou diferenças estatisticamente significativas na faixa de frequência de 5,7‐9,5kHz (fig. 3D).
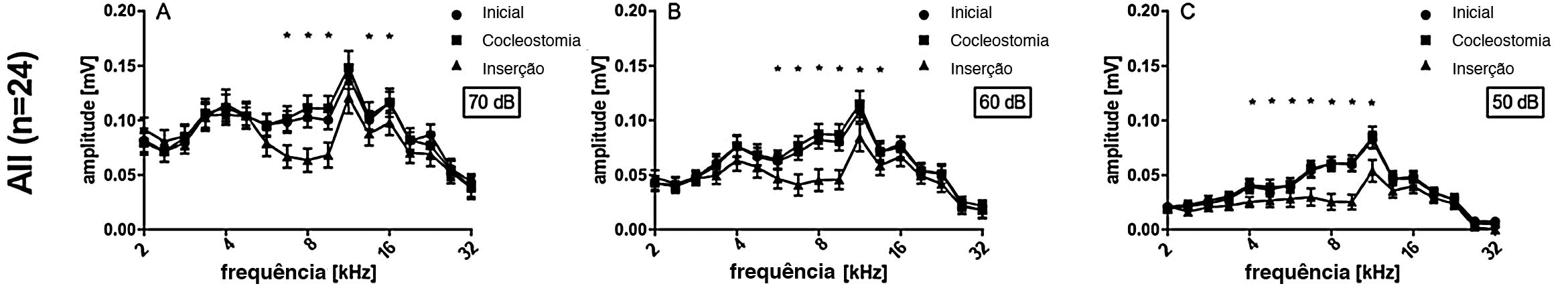
As amplitudes pico a pico dos PACs supralimiares foram analisadas posteriormente (fig. 4), para diferentes frequências (2‐32kHz) e 50, 60 e 70dB NPS. Não houve diferenças entre as condições iniciais e de cocleostomia para qualquer dos níveis de estímulo. A inserção do eletrodo, entretanto, induziu uma diminuição estatisticamente significativa nas amplitudes do PAC nas frequências 6,7, 8,0 e 9,5 para o nível de estímulo de 70, 60 e 50dB quando todos os casos foram considerados juntos (fig. 4 A, B e C), espelharam a TS mostrada na figura 3. Posteriormente, comparamos os implantes profundos e superficiais. Com o 5Ch implantado, não encontramos efeitos de implante estatisticamente significativos nas amplitudes para todos os níveis testados (fig. 5 A, B e C). Por outro lado, o grupo 6Ch mostrou mudanças de amplitude que cobriram uma ampla faixa de frequência, de 4 a 16kHz (fig. 5A − F).
5 inserções vs. 6 inserções de canal. Os gráficos superiores (A−C) representam as amplitudes obtidas para inserções de 5 canais com diferentes intensidades de estímulo, enquanto os gráficos inferiores (D − F) representam as amplitudes obtidas para inserções de 6 canais com diferentes intensidades de estímulo, como adequado. As inserções de 6 canais apresentam diminuições significativas nas amplitudes do PAC para diferentes intensidades de estímulo, o que não é observado nas inserções de 5 canais. Teste estatístico: teste de postos sinalizados de Wilcoxon; * p ≤ 0,05, barras de erro±erro‐padrão.
As mudanças de amplitude para todos os casos juntos são avaliadas na figura 6 para os dois grupos em conjunto. Não houve mudanças significativas de amplitude detectadas após a cocleostomia (fig. 6A). Após o implante, mudanças de limiar foram encontradas principalmente de 5,6 a 11,3kHz. Ao dividir os casos entre os grupos 5Ch e 6Ch, foram identificadas alterações de amplitude maiores e um espectro de frequência mais amplo no grupo de inserção mais profunda (grupo 6Ch) (fig. 7 A − C). As mudanças de amplitude foram particularmente maiores para o grupo 6Ch em 4,7 e 9,5kHz.
De todas as inserções reconstruídas na μTC, a frequência característica média mais baixa alcançada pelo eletrodo implantado foi de 8,04kHz. A inserção mais profunda em nosso subgrupo atingiu 5,51kHz, enquanto a inserção mais superficial atingiu 9,96kHz.
Os implantes no grupo 5Ch cobriram menos de 33% (média: 31,3%;±1,1%) do comprimento total da membrana basilar. Por outro lado, o grupo 6Ch apresentou implantes mais profundos: mais de 34% do comprimento total da membrana basilar em todos os casos (média: 37,1%;±2,5%). A profundidade média de inserção do eletrodo mais apical (Ch1) foi de 5.340±307μm no grupo 6Ch vs. 4.448±290μm no grupo 5Ch.
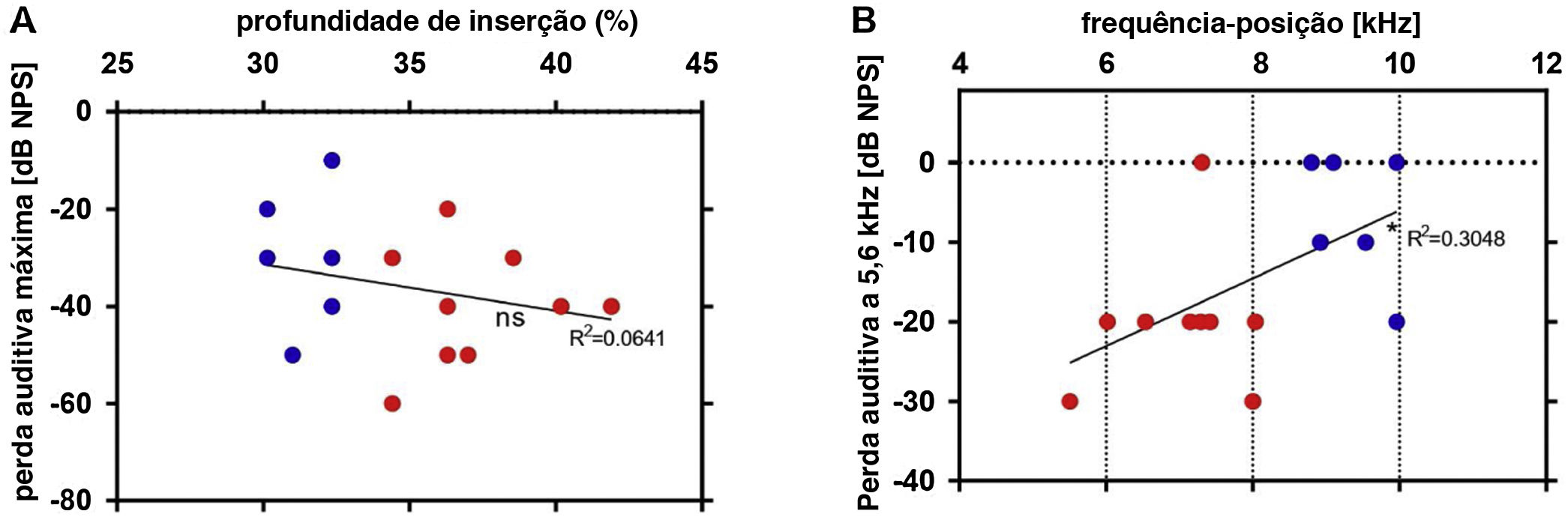
Finalmente, a profundidade do eletrodo e suas posições de frequência calculadas estavam relacionadas ao deslocamento do limiar causado pelo implante (pós‐limiar – pré‐limiar). Não houve correlação significativa entre a profundidade de inserção e a perda auditiva máxima (fig. 8A). Foi observada uma relação positiva significativa entre a posição da frequência do eletrodo de contato um e a perda auditiva em 5,6kHz (fig. 8B). A frequência de 5,6kHz é a mais baixa na qual uma significância é detectada e, portanto, foi escolhida. Esse resultado documenta que existem outros fatores além da profundidade do implante que são responsáveis pela maior perda auditiva observada, mas os dados anteriores mostram claramente que o perigo de perda auditiva em si é maior se houver uma tentativa de implante mais profundo.
Regressão linear entre a profundidade do eletrodo estimada por μTC e as alterações nos limiares após a inserção: em comparação com inserções mais rasas (pontos azuis), as inserções mais profundas (pontos vermelhos) se correlacionam com maior perda auditiva máxima (A). A posição da frequência calculada pela função de Greenwood do contato do eletrodo 1 foi correlacionada com a perda auditiva em 5,6kHz (B). * p ≤ 0,05; ns: não significativo.
O presente estudo avalia o trauma de implante no contexto da cirurgia de IC em cobaias com audição normal. Essa condição excepcional, não acessível em humanos, permitiu comparar o trauma do implante especificamente em diferentes partições cocleares. Além disso, os experimentos permitiram relacionar a posição do eletrodo com reconstrução anatômica por meio de μTC.
Este estudo demonstrou que é possível fazer um implante em uma orelha sem perda auditiva,23 desde que os implantes evitem a inserção até que uma resistência seja sentida (grupo 5Ch; comparável a achados anteriores).24 De maneira similar, em ossos temporais humanos, pode‐se demonstrar que o dano coclear nem sempre pode ser detectado pelo cirurgião, porque as forças relacionadas estão abaixo da sensibilidade da mão humana.25 Evitar a resistência deve, portanto, ser um objetivo do implante coclear.
As inserções mais profundas dos eletrodos tiveram um impacto maior na função da orelha interna. O PAC de tom específico obtido reflete indiretamente a posição do eletrodo por sua especificidade de frequência. As mudanças na onda TS e na amplitude aumentaram também nas frequências mais baixas, quando o eletrodo atingiu as regiões cocleares na 2ª metade do giro basal (além de 180°). Apesar disso, os resultados também mostraram que a inserção do eletrodo pode ser feita sem causar praticamente qualquer efeito nas regiões de frequência mais apicais (<4kHz). Normalmente, a interferência eletrofisiológica se espalha além da extremidade do eletrodo, em direção às frequências representadas no segundo giro coclear. Isso pode ser consequência do dano que afeta a membrana basilar ou ser devido a um efeito do tipo pistão quando a escala timpânica é preenchida pelo implante coclear (como também visto anteriormente).24
A inserção do eletrodo pode ser feita em alguns casos com perda auditiva restrita, mantém inalteradas várias faixas de frequência. Nesta série de dados, não verificamos a reversibilidade das mudanças de limiar ao retirar o eletrodo, como fizeram outros autores,9,10,26 o que poderia ajudar a revelar a etiologia das mudanças de amplitude, como interferência mecânica na membrana basilar.
É interessante notar que o trauma do implante nos casos presentes envolveu principalmente a extremidade do eletrodo.27–29 Trauma em ossos temporais humanos foi observado na base da cóclea devido ao encurvamento do implante após encontrar resistência.25 Não observamos tais danos aqui, seja devido à anatomia diferente da cóclea da cobaia, aos implantes especiais para cobaia com propriedades mecânicas diferentes ou ao ângulo diferente na inserção do implante na cóclea (a posição da cocleostomia na cobaia vs. cóclea humana).
Em alguns casos, observamos aumentos de amplitude em algumas frequências após a cocleostomia ou mesmo a inserção do eletrodo, o que pode ser devido a fístula perilinfática e ao contato com o eletrodo extracoclear. Esse fenômeno poderia aumentar a sinalização devido à detecção direta do potencial intracoclear. Outra possibilidade é que o efeito de enrijecimento devido ao eletrodo no giro basal pode aumentar o movimento em giros mais apicais.30
As alterações na resposta da ECOG durante o IC são consistentes com resultados anteriores,31–33 mostram amplitudes menores do PAC e limiares mais altos, indicam dano coclear. Não abordamos o dano coclear diretamente por meio da contagem de células ciliadas ou outras técnicas histológicas, enquanto consideramos que nosso objetivo não é elucidar a etiologia do trauma coclear. Comparações diretas entre dados histológicos e eletrofisiológicos podem ser variáveis, como visto em outros estudos.9,19 Estudos anteriores divulgaram a ECOG como um guia durante o implante coclear, identificaram marcadores de dano mecânico e os correlacionaram com o desempenho pós‐operatório.21 A magnitude da perda de amplitude do PAC e dos MCs pode ser correlacionada ao grau de dano histológico causado pelas penetrações na membrana basilar.17 Aqui não podemos fornecer a explicação definitiva do trauma coclear. Embora vários mecanismos candidatos possam estar envolvidos (dano mecânico direto às células ciliadas pela elevação da membrana basilar; descolamento da membrana tectorial das células ciliadas externas; interferência com a reciclagem de potássio ou dano mecânico à estria vascular) e danos à membrana basilar permaneçam uma possibilidade, o pequeno tamanho do efeito observado aqui provavelmente indica uma influência predominante nas células ciliadas externas.
A área da seção transversal da escala timpânica em função da distância da janela redonda foi caracterizada por Ghiz et al.34 O eletrodo usado em nosso estudo tem uma seção transversal de 0,196mm2 (0,5mm de diâmetro), com comprimento máximo de 4,5mm. Em cobaias, a área da seção transversal da escala timpânica diminui abruptamente em direção à região do primeiro giro apical (de cerca de 1,28mm2 no ponto mais amplo da área do gancho para cerca de 0,29mm2 a 5mm de distância da janela redonda).34 Nossos casos 5Ch presumivelmente atingiram ST em áreas transversais maiores em comparação com nossas inserções 6Ch (700 micrômetros mais longas), que alcançaram regiões mais estreitas. O microambiente ST circundante no qual o eletrodo está posicionado é provavelmente determinante para as diferenças encontradas em nossas inserções. Quanto mais estreita a região, menor a quantidade de perilinfa ao redor e mais perto está o eletrodo da fonte de sinal orgânico. Além disso, a possibilidade de contatos da membrana basilar ou até mesmo dano quando o eletrodo avança mais em ST é maior.
Estamos cientes de que danos à microanatomia coclear e perda auditiva após o IC podem ocorrer semanas a meses após a cirurgia,35 o que é uma preocupação crucial quando a preservação da audição é uma meta. Muitos fatores estão envolvidos, inclusive inflamação, fibrose, hidropisia, efeitos mecânicos (movimento do eletrodo) e até fatores idiopáticos.36 Esses eventos podem ocorrer com ou sem danos histológicos e/ou radiológicos claramente observáveis. Não observamos em nossas sequências de μTC macrotraumas sobre a lâmina óssea espiral ou outras transgressões no trajeto do eletrodo dentro da cóclea. Entretanto, a μTC tem acurácia e resolução limitadas para detectar traumas em estruturas membranosas, como o órgão de Corti e a estria vascular.
Nossos dados sugerem que eletrodos mais curtos têm menor impacto na fisiologia coclear, em um cenário intraoperatório. Um dilema atual é que, embora eletrodos curtos pareçam mais seguros, eles podem oferecer menos desempenho para usuários de IC, principalmente, mas não apenas no contexto de estimulação eletroacústica. A colocação e o posicionamento ideais são, portanto, objetivados. Os eventos intraoperatórios na cirurgia de IC são potencialmente cruciais para as decisões cirúrgicas e a eletrofisiologia pode ser uma ferramenta para indicar a escolha de um eletrodo em vez de outro. Finalmente, a anatomia coclear humana é altamente variável.37,38 O presente estudo sugere que as previsões do processo de implantação podem evitar implantes muito profundos e, portanto, o planejamento preciso da cirurgia com imagens,39,40 com o apoio de modelos cocleares41–43 e eletrofisiologia,24,44,45 que podem ajudar a evitar o trauma coclear.
ConclusãoNesse modelo de implante coclear, a cocleostomia teve pouco ou nenhum impacto nos potenciais de ação compostos extracocleares. Inserções mais profundas levam a uma maior perda auditiva, inclusive a região coclear apical à posição do implante. A perda auditiva foi restrita a uma faixa de frequência previsível ao redor da extremidade do implante coclear.
FinanciamentoJSCA recebeu uma bolsa da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), do Ministério da Educação. O estudo recebeu o apoio da Deutsche Forschung Gemeinschaft dentro do Cluster of Excellence Hearing 4 All e MedEl Comp., Innsbruck, Áustria.
Contribuição dos autoresJosé Santos Cruz de Andrade e Peter Baumhoff contribuíram igualmente para este trabalho: aquisição e análise de dados, redação e revisão do artigo. Andrej Kral fez a análise dos dados, escreveu e revisou o artigo. Oswaldo Laércio Mendonça Cruz e Thomas Lenarz escreveram e revisaram o artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.
A Daniela e Karl‐Jürgen Kühne por seu suporte técnico.
Como citar este artigo: Andrade JS, Baumhoff P, Cruz OL, Lenarz T, Kral A. Cochlear implantation in an animal model documents cochlear damage at the tip of the implant. Braz J Otorhinolaryngol. 2022;88:546–55.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.