O carcinoma adenoide cístico (CAC) é um tumor raro, com uma incidência anual de 1,4 casos por milhão de habitantes no norte de Portugal.1 Representa o tumor maligno mais comum das glândulas submandibulares (15%–30%).2 O CAC afeta mais comumente as glândulas salivares (maiores e menores), mas pode surgir numa ampla variedade de locais anatômicos dentro e fora da região da cabeça e pescoço, como na árvore traqueobrônquica, esôfago, mama, pulmões, próstata, colo uterino e vulva.3 Histologicamente, há três padrões de crescimento definidos usados para descrever estes tumores: o cribriforme, o tubular e o sólido.2
O CAC foi descrito como um tumor que cresce e invade tecidos locais, com alta propensão de infiltração através de invasão perineural, sendo a metastização de linfonodos regionais é considerada rara.2,3 Desta forma, margens cirúrgicas livres não são geralmente alcançadas, apesar da impressão pré‐operatória por cirurgiões experientes de que a ressecção completa é possível.3
Este comportamento biológico traduz‐se no desenvolvimento característico de metástases à distância (MD) tardias, apesar do tratamento ideal com cirurgia combinada com radioterapia (RT), com uma taxa de sobrevida favorável aos 5 anos mas baixa a longo prazo.3,4 O papel da quimioterapia (QTX) ainda é controverso, mas geralmente é recomendada em contexto de tratamento paliativo.3
O desenvolvimento frequente de metástases à distância determina os desfechos desfavoráveis. Mesmo quando o controlo locorregional é alcançado, os doentes frequentemente desenvolvem MD vários anos após o diagnóstico inicial.4 Vários estudos tentaram determinar os fatores que influenciam o seu desenvolvimento, com alguns resultados inconsistentes. De acordo com Shingaki et al.,4 o status das margens cirúrgicas parece ser o único fator associado. Os mesmos autores relataram que a recorrência local não afeta o risco de metastização à distância. A invasão perineural foi, também, implicada na predisposição para MD em alguns estudos.2 As MD ocorrem mais frequentemente nos pulmões, seguidas pelos ossos, fígado e, raramente, cérebro. A sobrevida está significativamente associada ao local da metastização e é melhor em doentes com metastização pulmunar em comparação com metastização óssea ou noutros órgãos.2
Neste artigo, relatamos o caso de uma doente com CAC que desenvolveu carcinomatose paquimeníngea. Alguns casos de MD hematogênica da dura‐máter por CAC estão publicados, porém, que seja de nosso conhecimento, este é o primeiro caso de CAC primário da glândula submandibular.
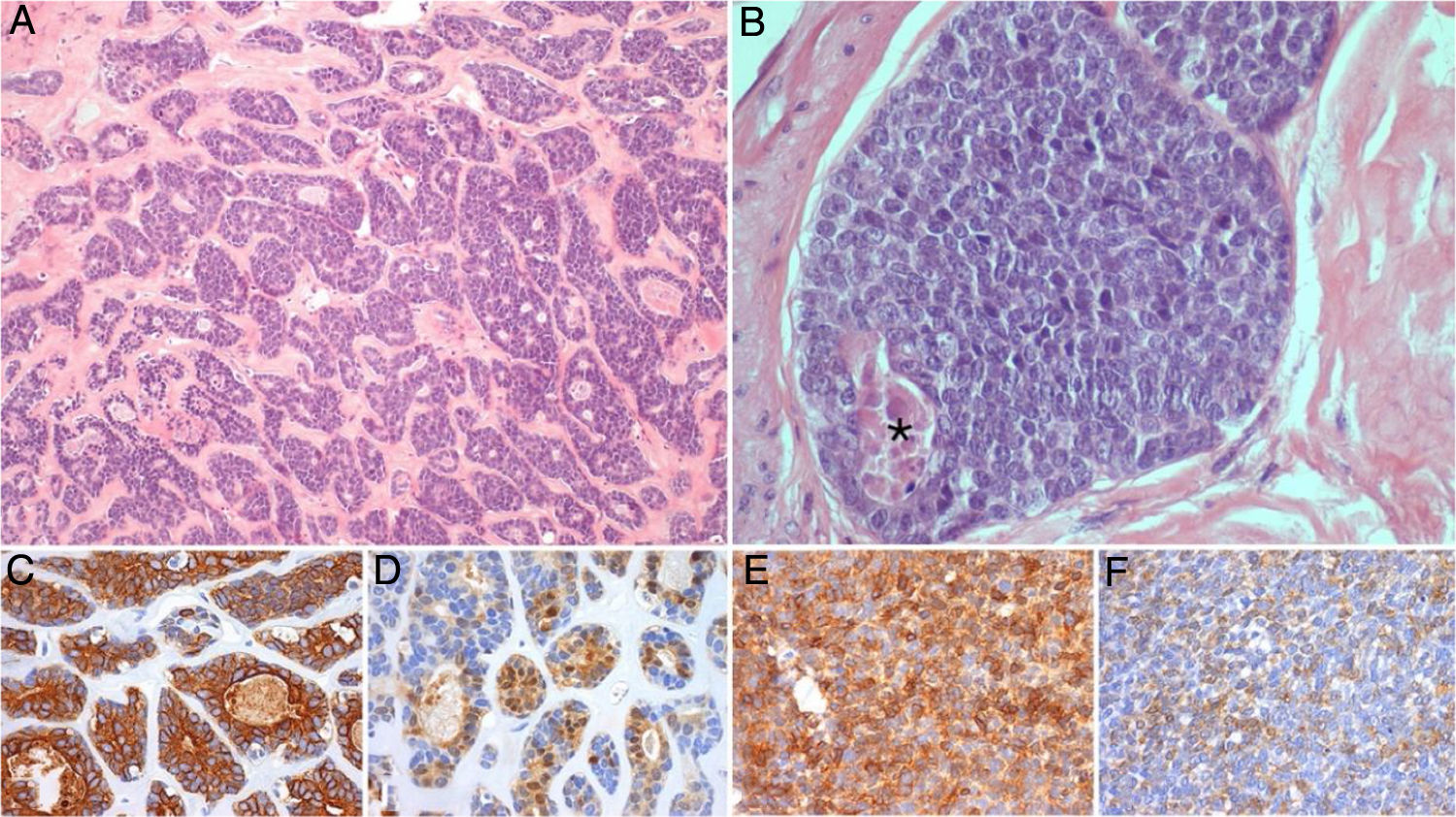
Relato de casoRelatamos o caso de uma doente de 56 anos que se apresentou com edema indolor na glândula submandibular esquerda. Após biópsia aspirativa compatível com adenoma pleomórfico, foi submetida a submandibulectomia esquerda com esvaziamento ganglionar dos compartimentos adjacentes. O relatório histológico definitivo foi comatível com CAC de alto grau, com padrão sólido presente em mais de 30% (fig. 1); metastização ganglionar estava presente.
Fotomicrografias representativas do tumor submandibular primário: A e B (Hematoxilina e Eosina, 100x e 400x) mostram um carcinoma adenoide cístico de alto grau, com padrões cribriforme e sólido (esse representa mais de 30% do volume tumoral), com áreas de necrose (*); coloração imuno‐histoquímica para CK7 (C, 200x), PS100 (D, 200x), AML (E, 200x) e CD117 (F, 200x) demonstra a população de células bifásicas característica desse tumor, composta por células ductais e mioepiteliais.
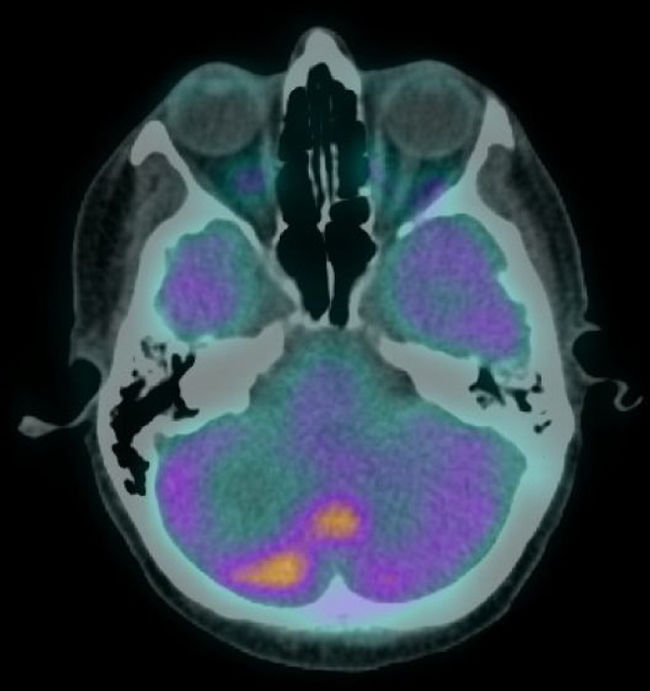
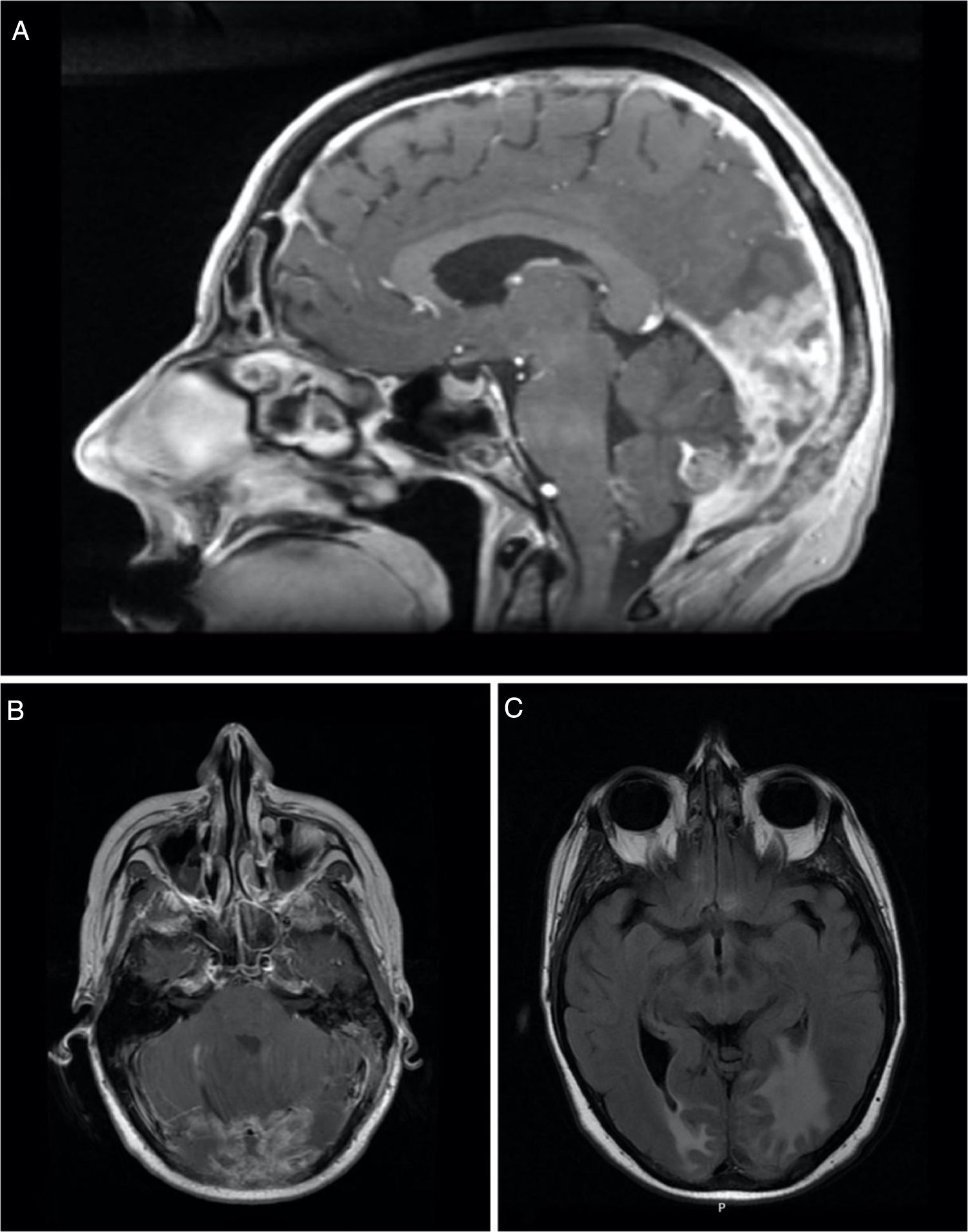
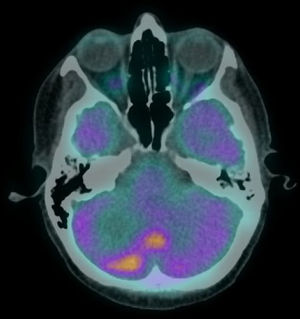
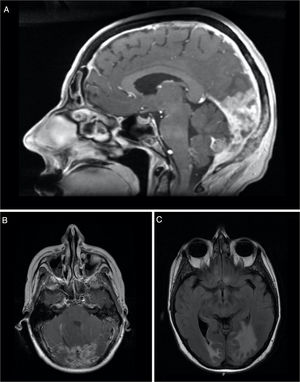
A doente foi estadiada como pT2N2a (ENE+) R1 (AJCC 8ª edição) e foi proposta para tratamento complementar com RT e QTX radiossensibilizante. Recebeu 50 a 60Gy na base do crânio e níveis ganglionares IA a IV à esquerda e 66Gy no leito cirúrgico (em 28 + 3 frações, com técnica VMAT‐SIB), com cisplatina concomitante, ficando em vigilância. Após 8 meses, foi diagnosticada metastização vertebral e foi submetida a um procedimento cirúrgico para estabilização vertebral de L3 e D8. Na altura, o FDG‐PET/TC objetivava apenas extenso envolvimento ósseo, pelo que foi proposta para RT paliativa a D8 e L3 (20Gy em 5 frações, técnica 3DRT) e iniciou QTX com carboplatina e paclitaxel e bifosfonatos. Após completar os 6 ciclos, o FDG‐PET/TC revelou agravamento da metastização óssea e metastização hepática, e a doente iniciou uma 2ª linha de QTX com gencitabina. Três meses depois, o FDG‐PET/TC questionou a existência de envolvimento metastático cerebelar (fig. 2) e a ressonância magnética confirmou carcinomatose paquimeníngea da fossa posterior, região occipital direita e região occipital‐temporal esquerda, com envolvimento do osso adjacente e cerebelo (fig. 3).
Imagem sagital (A) e axial (B) de ressonância magnética (RM) ponderada em T1 realçada por contraste mostra espessamento e realce da dura‐máter, sugestivos de carcinomatose paquimeníngea (seta). Imagem axial (C) de RM ponderada em T2‐FLAIR mostra edema vasogênico no lobo occipital direito e região occipital‐temporal esquerda.
O exame neurológico revelou apenas ligeira ataxia e hipoestesia na coxa esquerda. A doente foi proposta para RT holocraniana tendo recebido 30Gy em 10 frações, e iniciou QTX com doxorrubicina lipossômica peguilada. Nos meses seguintes, manteve tratamento com QTX apresentando‐se neurologicamente estável, sem evidências de agravamento clínico intracerebral. A doente morreu por metastização sismética múltipla 4 meses após o término da RT.
DiscussãoA frequência geral de invasão intracraniana por CAC tem sido reportada como sendo entre 4% e 22%.5 Uma revisão da literatura revelou uma grande variedade de metastização intracraniana por CAC. Em geral, este envolvimento pode ocorrer por uma de três formas: extensão direta, disseminação perineural e disseminação hematogênica.6
A extensão direta e a disseminação perineural há muito que são reconhecidas como formas de descrever os locais de lesões metastáticas intracranianas. Isso explica porque razão a maioria das metástases intracranianas está localizada na base do crânio, e como resultado da extensão transcraniana a partir das lesões primárias, por via direta ou por via perineural ao longo dos nervos cranianos, para estruturas vizinhas como nasofaringe, seios paranasais e glândula lacrimal. Embora metastização hematogênica para o fígado, pulmão e ossos seja relativamente comum no curso tardio da doença, verdadeira metastização hematogênica para o compartimento intracraniano é rara.5,6
Apresentamos uma doente com presumíveis metástases hematogênicas extensas para a dura‐máter a partir de um CAC da glândula submandibular. Neste caso, a via hematogênica deve ser considerada para explicar a localização da metastização. A lesão, embora parcialmente extra‐axial, está numa posição anatômica inconsistente com a disseminação perineural retrógrada do primário na glândula submandibular e, além disso, a ressonância magnética não mostrou evidência de disseminação contígua do tumor para apoiar a extensão direta através da base do crânio.
Os poucos relatos existentes na literatura consistentes com disseminação hematogênica intracraniana são, na maioria, sob a forma de metastização parenquimatosa, de tumores primários da mama,7 da parótida,8,9 do pulmão,10 da pele,11 da glândula de Bartholin12,13 e de primário desconhecido.14 Quanto à metastização para a dura‐máter, há apenas um caso publicado, da glândula parótida.15
ConclusãoA metastização hematogênica intracraniana é uma forma particularmente incomum de disseminação do CAC, com uma estreita variedade de locais primários e localizações intracranianas relatadas. Nenhum caso de envolvimento da dura‐máter a partir de um tumor primário da glândula sub‐mandibular existe reportado na literatura, o que torna este o primeiro relato de envolvimento da dura‐máter a partir de um CAC da glândula submandibular.
Conflitos de interesseOs autores declaram não haver conflitos de interesse
Como citar este artigo: Pires A, Vieira C, Jácome M, Moreira D, Arantes M. Pachymeningeal carcinomatosis: an unusual location of metastization of adenoid cystic carcinoma. Braz J Otorhinolaryngol. 2021;87:489–92.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.