A osteonecrose dos maxilares relacionada à medicação é uma complicação grave da terapia antirreabsortiva e antiangiogênica, com opção de tratamento limitada e grande impacto na qualidade de vida do paciente.
ObjetivoAvaliar os fatores de risco associados à osteonecrose dos maxilares relacionada à medicação em pacientes oncológicos em tratamento com bifosfonato Além disso, os níveis salivares de interleucina‐6 (IL‐6) foram medidos para investigar sua associação com a gravidade e o risco de osteonecrose dos maxilares relacionada à medicação.
MétodoEstudo caso‐controle com 74 pacientes com metástases ósseas de tumores sólidos e mieloma múltiplo. Os pacientes foram divididos em três grupos: 1) em tratamento por bifosfonato com osteonecrose dos maxilares relacionada à medicação; 2) submetidos ao bifosfonato sem osteonecrose dos maxilares relacionada à medicação; e 3) pré‐tratamento de bifosfonato. Os dados demográficos e médicos dos pacientes foram coletados para avaliar o risco. A avaliação clínica foi feita para diagnosticar osteonecrose dos maxilares relacionada à medicação e a saliva não estimulada foi coletada para quantificação da IL‐6.
ResultadosObservou‐se que os pacientes diagnosticados com osteonecrose dos maxilares relacionada à medicação foram submetidos a maior número de doses de bifosfonato (p=0,001) e protocolo de infusão mensal (p=0,044; OR=7,75). Pacientes que não tiveram acompanhamento de rotina com dentistas especializados durante a terapia com bifosfonato e tabagismo foram associados ao osteonecrose dos maxilares relacionada à medicação (p=0,019; OR=8,25 e p=0,031; OR=9,37, respectivamente). O grupo 1 apresentou maior frequência de tratamento com quimioterapia e corticosteroides concomitantes ao bifosfonato e procedimentos odontológicos cirúrgicos (p=0,129). Os níveis salivares de IL‐6 não apresentaram diferença estatisticamente significante entre os grupos (p=0,571) ou associação com a gravidade do osteonecrose dos maxilares relacionada à medicação (p=0,923).
ConclusãoMaior número de ciclos de bifosfonato, protocolo de infusão mensal, ausência de acompanhamento odontológico para manutenção da saúde bucal e tabagismo foram associados ao osteonecrose dos maxilares relacionada à medicação. O acompanhamento odontológico especializado durante o tratamento demonstrou ser importante na prevenção dessa complicação.
Os bisfosfonatos (BF) são agentes antirreabsortivos indicados para o tratamento de complicações esqueléticas associadas a mieloma múltiplo e metástases ósseas de tumores sólidos, além do tratamento de osteoporose e osteopenia.1,2 Apesar de seu benefício clínico, seu efeito colateral é osteonecrose dos maxilares associada à medicação (OMAM), que é uma complicação grave, com impacto direto na qualidade de vida dos pacientes e no tratamento oncológico.2,3
A osteonecrose dos maxilares relacionada a medicamentos é definida como a presença de osso ou osso exposto que pode ser examinado através de uma fístula intra ou extraoral na região maxilofacial, com persistência de mais de 8 semanas, ausência de radioterapia ou doença metastática na mandíbula de pacientes em tratamento atual ou anterior com agentes antirreabsortivos ou antiangiogênicos.4 Os sintomas podem incluir dor, inchaço, eritema e perda de dentes associada a infecções.5
A frequência do uso de BF intravenosos em pacientes com câncer varia de 1,2% a 9,9%. A frequência mais alta está associada ao mieloma múltiplo e a mais baixa a pacientes com câncer de mama.2
A fisiopatologia da OMAM ainda não foi totalmente elucidada.4,6 Acredita‐se que sua ocorrência causada por BF inicie‐se com a redução do pH após infecção oral ou cirurgia odontológica que causa a liberação e a ativação de níveis tóxicos de BF.2 Os BFs têm ação antiosteoclástica, causam uma inibição da reabsorção óssea e, consequentemente, uma supressão da remodelação óssea e também ação antiangiogênica, que causa uma isquemia.2,5 Algumas teorias, ainda sob investigação, apontam o efeito dos BFs na OMAM com inibição do sistema imunológico, suscetibilidade a infecções e toxicidade dos tecidos moles por BFs. 2
A etiologia da OMAM é multifatorial,2 como resultado da associação de fatores metabólicos, locais e genéticos.7
Vários estudos avaliaram os fatores de risco para OMAM.2,8–19 Na avaliação dos fatores relacionados ao tratamento do câncer, a OMAM foi associada ao tipo de BF,11,13,16 número de infusões,9,16 concomitância com corticosteroides13 e quimioterapia14 Alguns estudos mostraram uma associação entre tabagismo9,19 e comorbidades como diabetes e hipotireoidismo9 com a OMAM. Na avaliação de fatores locais, foi mostrada uma associação de procedimentos cirúrgicos odontológicos, como extração e OMAM.14
Existem poucos estudos que analisaram a associação dos níveis da interleucina salivar e plasmática ao processo inflamatório no início da OMAM.20,21 Valores mais elevados nos níveis salivar e sanguíneo de Interleucina‐6 (IL‐6) foram observados no grupo de pacientes com OMAM, quando comparado ao grupo de pacientes tratados com bisfosfonatos, mas sem OMAM, bem como ao grupo controle, sem o uso de BF (p<0,01), sugeriram que a interleucina 6, IL‐6, poderia ser usada como um marcador que contribui para o diagnóstico de OMAM.20 A hiperprodução de IL‐6 foi relacionada a doenças autoimunes e inflamatórias.22,23
O objetivo deste estudo foi investigar a associação de fatores de risco para OMAM em pacientes com câncer em tratamento com BF. Além disso, objetivamos avaliar os níveis salivares de IL‐6 em pacientes que recebiam tratamento atual ou não com BF e sua associação com OMAM.
MétodoDe acordo com a Declaração de Helsinque para estudos em seres humanos de 1964, foi feito um estudo caso‐controle após aprovação do comitê de ética em pesquisa do Instituto do Câncer de São Paulo ‐ Hospital 1 (Protocolo n° 2.981.115) e Centro de Câncer Erasto Gaertner ‐ Hospital 2 (Protocolo n° 3.280.348) com a inclusão de 74 pacientes após assinatura do termo de consentimento livre e esclarecido (TCLE).
Pacientes com diagnóstico de câncer de mama e outros tumores com metástase óssea (próstata, rim, pulmão, ovário e útero) e mieloma múltiplo foram incluídos no estudo.
Os pacientes foram selecionados por conveniência e divididos em 3 grupos de acordo com os sinais clínicos e tratamento oncológico. O grupo 1 foi composto por 8 pacientes com diagnóstico de OMAM em tratamento com BF, o grupo 2 compreendia 60 pacientes em tratamento com BF, mas sem exposição óssea, e o grupo 3 era composto por 6 pacientes antes do tratamento com BF. Os pacientes incluídos nos grupos 1 e 2 faziam uso de 4mg de ácido zoledrônico em pelo menos 3 doses isoladamente ou após tratamento com 90mg de Pamidronato. A última dose foi administrada até 6 meses depois da coleta salivar. O intervalo entre os ciclos de infusão variou de mensal a trimestral.
Pacientes com história de radioterapia ou tumores (inclusive metástases) que afetavam a região da cabeça e pescoço foram excluídos do estudo. Pacientes submetidos a tratamento cirúrgico para OMAM anterior ou diagnóstico de doenças autoimunes e inflamatórias, como artrite reumatoide, síndrome da artrite idiopática juvenil e doença de Castleman, também foram excluídos da amostra.
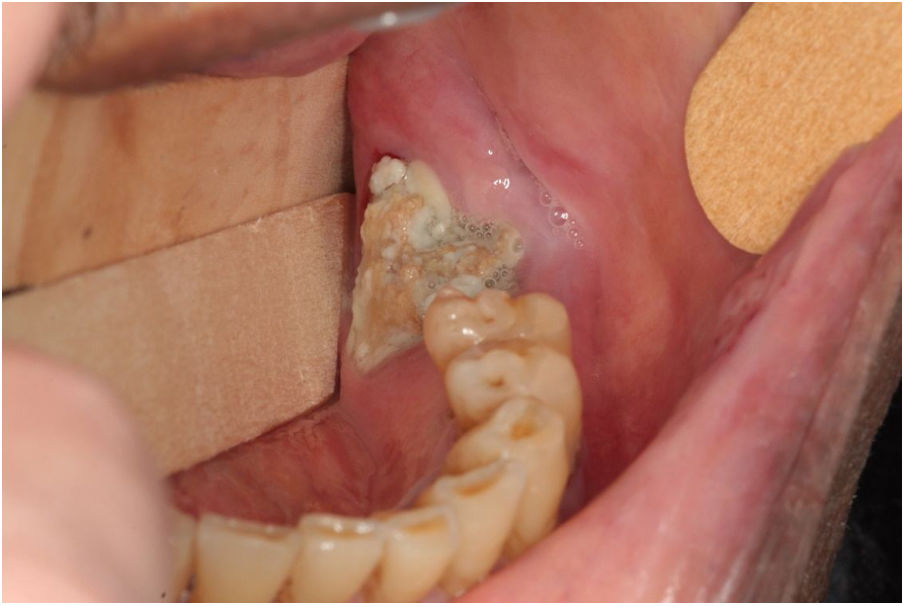
Os estágios da OMAM foram classificados em Estágio 0: ausência de evidência clínica de osso necrótico, presença de achados clínicos inespecíficos com alterações radiográficas e sintomatologia; Estágio 1: osso ou fístula exposto e necrótico, assintomático ou sem infecção; Estágio 2: presença de osso ou fístula exposto e necrótico, infecção evidenciada por dor e eritema em região óssea exposta com ou sem drenagem purulenta; Estágio 3: osso ou fístula exposto e necrótico, infecção e dor, osso exposto e necrótico que se estendia abaixo da região do osso alveolar, resultava em fratura patológica, fístula extraoral, comunicação oroantral ou osteólise que se estendia até a borda inferior da mandíbula ou assoalho do seio.4 Imagens radiográficas panorâmicas foram avaliadas para que o diagnóstico correto pudesse ser feito, bem como a classificação da OMAM. A figura 1 mostra um exemplo de OMAM diagnosticado após extração dentária e classificado como estágio 2.
Informações demográficas (sexo, idade, diagnóstico oncológico/hematológico) e tratamento do câncer (tipo e número de infusões de BF, quimioterapia e corticoterapia concomitante ao tratamento com BF) foram coletadas dos prontuários médicos.
Os pacientes foram avaliados quanto à feitura de procedimentos odontológicos durante o tratamento oncológico, como remoção de surtos de infecção como periodontia, odontologia, endodontia e procedimentos odontológicos invasivos como extrações. O acompanhamento odontológico com dentista especializado durante o tratamento com BF e a presença de tabagismo também foram avaliados.
De acordo com a técnica descrita por Navazesh em 1993, o paciente foi orientado a não fumar, beber ou se alimentar pelo menos uma hora antes da consulta odontológica para coleta da saliva não estimulada. O paciente foi instruído a expectorar toda a saliva acumulada na boca em um tubo Falcon de 15mL por 5 minutos sem engolir em intervalos de 60 segundos.24 A saliva contaminada com sangue foi descartada. As amostras de saliva foram imediatamente refrigeradas e centrifugadas a 3.000g por 10 minutos e armazenadas a ‐80° C até a análise.
O ensaio ELISA para IL‐6 humana foi usado para quantificação da IL‐6 salivar (Elabscience, Texas, EUA), por meio de detecção colorimétrica com variação entre valores de 7,81 e 500 pg/mL. Resumidamente, 100μL de saliva foram usados em cada poço que continha anticorpo específico para IL‐6 humana pré‐revestido, com incubação a 37°C por 90 minutos. Em seguida, o anticorpo de detecção biotinilado específico para IL‐6 humana foi adicionado e incubado a 37°C durante uma hora, seguido de 3 lavagens. A amostra foi conjugada com a enzima Horseradish Peroxidase (HRP), incubada a 37° C durante uma hora e lavada 5 vezes. Finalmente, o substrato reagente foi adicionado, incubado a 37°C por 15 minutos e o reagente bloqueador foi adicionado. A medida da densidade óptica (DO) no comprimento de onda de 450nm foi avaliada por espectrofotometria e o cálculo da concentração de IL‐6 humana das amostras foi feito comparando a DO das amostras com a curva padrão pré‐estabelecida. As reações foram feitas em duplicata, de acordo com as orientações do fabricante e comparadas entre os 3 grupos de estudo.
O software Statistical Package for the Social Sciences (versão 13, SPSS INC) foi usado para a análise dos dados. Foi feita análise descritiva dos dados com avaliação de frequência. O teste de Mann‐Whitney e o teste de Kruskal‐Wallis foram usados para analisar as variáveis quantitativas. O teste de Kolmogorov‐Smirnov (n>50) foi usado para analisar a normalidade da distribuição dos dados. O teste de Fisher foi usado para as variáveis categóricas nominais. O odds ratio foi calculado para avaliar a chance de ocorrência de um evento de intervalo de confiança de 95% (IC95%). O coeficiente de correlação de Spearman foi usado para avaliar a associação dos níveis de IL‐6 com a gravidade da OMAM. Um valor de p <0,05 foi considerado estatisticamente significativo.
ResultadosDos 74 pacientes avaliados, 78,4% eram mulheres. A média de idade nos grupos 1, 2 e 3 foram, respectivamente, 63,88, 56,27 e 51,33 anos (p=0,134). Os diagnósticos oncológicos foram câncer de mama (n=45), mieloma múltiplo (n=20) e outros tumores sólidos, como câncer de ovário, câncer de útero, câncer de rim, e câncer de pulmão (n=9). Os dados demográficos dos participantes são apresentados na tabela 1.
Distribuição demográfica entre os Grupos 1, 2 e 3
| Grupo | Total | |||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| Sexo n (%) | ||||
| Feminino | 5 (62,5) | 48 (80,0) | 5 (83,3) | 58 |
| Masculino | 3 (37,5) | 12 (20,0) | 1 (16,7) | 16 |
| Média de idade (desvio‐padrão) | 63,8 (13,1) | 56,2 (11,9) | 51,3 (10,8) | |
| Diagnóstico, n (%) | ||||
| Cancer de mama | 5 (62,5) | 36 (60,0) | 4 (66,6) | 45 |
| Mieloma múltiplo | 2 (25,0) | 17 (28,3) | 1 (16,7) | 20 |
| Outros | 1 (12,5) | 7 (11,7) | 1 (16,7) | 9 |
Grupo 1, Pacientes tratados com bisfosfonatos e com osteonecrose dos maxilares relacionada a medicamentos; Grupo 2, Pacientes tratados com bisfosfonatos e sem osteonecrose dos maxilares relacionada à medicação; Grupo 3, Pacientes sem tratamento com bisfosfonatos.
A mediana dos níveis salivares de IL‐6 para o grupo 1 foi de 22,34 pg/mL (mínimo de 13,86 e máximo de 198,88); grupo 2, 21,87 pg/mL (mínimo de 10,45 e máximo de 75,91); e grupo 3, 25,27 pg/mL (mínimo 19,28 e máximo 88,72), sem diferença estatisticamente significante entre os grupos (p=0,571). Esses resultados são mostrados na tabela 2. Não houve associação entre os níveis de IL‐6 salivar e os estágios de OMAM (rs=‐ 0,41 e p=0,923).
Níveis salivares de IL‐6 (pg / mL) entre os grupos 1, 2 e 3
| Grupo | p‐valor | |||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| Mediana de IL‐6 | 22,34 | 21,87 | 25,27 | 0,571a |
| Mínimo–Máximo | (15,78–198,88) | (10,45–275,91) | (19,28–88,72) | |
Grupo 1, Pacientes tratados com bisfosfonatos e com osteonecrose dos maxilares relacionada a medicamentos; Grupo 2, Pacientes tratados com bisfosfonatos e sem osteonecrose dos maxilares relacionada à medicamentos; Grupo 3, Pacientes sem tratamento com bisfosfonatos.
Os pacientes com OMAM receberam um número maior de infusões de 4mg de ácido zoledrônico em comparação aos pacientes sem OMAM em uso de BF (p=0,001). Entre os pacientes que desenvolveram OMAM, 7 (87,5%) foram submetidos a pelo menos 10 infusões. Em relação aos intervalos mensais ou trimestrais de infusão de BF, o intervalo mensal foi associado a OMAM (p=0,044).
Na avaliação das terapias oncológicas concomitantes ao uso de BF no grupo 1, o tratamento quimioterápico estava presente em 6 (75,0%) dos 8 pacientes com OMAM (p=1,000) e o tratamento com corticosteroides estava presente em 7 (87,5%) dos 8 pacientes com OMAM (p=0,427).
A tabela 3 apresenta os dados do tratamento oncológico de acordo com o tipo e número de infusões de BF, intervalo entre as infusões, quimioterapia concomitante e uso de corticoide com BF (grupos 1 e 2).
Avaliação dos fatores de risco sistêmicos e locais para OMAM entre os grupos 1 e 2
| Grupo | p‐valor | OR | IC95% | ||
|---|---|---|---|---|---|
| 1 | 2 | ||||
| Tipo de BF, n (%) | |||||
| Ácido zoledrônico | 7 (87,5) | 53 (88,3) | 1,000a | 0,92 | 0,099–8,673 |
| Pamidronato e ácido zoledrônico | 1 (12,5) | 7 (11,8) | |||
| Número de ciclos de ácido zoledrônico | |||||
| Mediana (Mínimo–Máximo) | 16,0 (10–32) | 7,0 (3–38) | 0,001b | ||
| Número de ciclos de pamidronato | |||||
| Mediana (Mínimo–Máximo) | 0,00 (0–25) | 0,00 (0–18) | 0,852b | ||
| Intervalo da infusão, n (%) | |||||
| Mensal | 6 (75,0) | 19 (31,7) | 0,044a | 7,75 | 1,194–35,092 |
| Trimestral | 2 (25,0) | 41 (68,2) | |||
| Quimioterapia, n (%) | |||||
| Sim | 6 (75,0) | 43 (70,0) | 1,000a | 1,18 | 0,155–4,597 |
| Não | 2 (25,0) | 17 (28,3) | |||
| Esteroides, n (%) | |||||
| Sim | 7 (87,5) | 42 (70,0) | 0,427a | 3,20 | 0,038–2,910 |
| Não | 1 (12,5) | 18 (30,0) | |||
| Check‐up e procedimentos durante o tratamento com BF, n (%) | |||||
| Não | 6 (75,0) | 18 (30,0) | 0,019a | 8,25 | 1,288–38,046 |
| Sim | 2 (25,0) | 42 (70,0) | |||
| Exodontia, n (%) | |||||
| Sim | 6 (75,0) | 25 (41,7) | 0,129a | 4,80 | 0,044–1,278 |
| Não | 2 (25,0) | 35 (58,3) | |||
| Tabagismo, n (%) | |||||
| Sim (ex‐fumante <5 anos) | 3 (37,5) | 4 (6,7) | 0,031a | 9,37 | 1,453–48,549 |
| Não (ex‐fumante> 5 anos) | 5 (62,5) | 56 (93,3) | |||
Grupo 1, Pacientes tratados com bisfosfonatos e com osteonecrose dos maxilares relacionada a medicamentos; Grupo 2, Pacientes tratados com bisfosfonatos e sem osteonecrose dos maxilares relacionada à medicamentos.
Pacientes sem rotina de check‐up odontológico com procedimentos para eliminação de surtos de infecção (lesões de cáries, doença periodontal, endodontia e exodontia) ou traumas protéticos mostraram associação com OMAM (p=0,019).
Dos fatores de risco odontológico para OMAM, 26 (38,2%) de 68 pacientes tratados com BF foram submetidos a exodontias (Hospital 1). Não houve diferença significante entre os grupos 1 e 2 para exodontias (p=0,129). Entretanto, dos 8 pacientes que desenvolveram OMAM, ela ocorreu após procedimentos cirúrgicos odontológicos em 6 pacientes (75,0%) e 2 casos ocorreram espontaneamente (25,0%). Dos 6 pacientes que desenvolveram OMAM após procedimentos cirúrgicos, em 5 casos os procedimentos foram feitos em serviços externos e encaminhados para tratamento da OMAM no Hospital 1 (um paciente) e Hospital 2 (4 pacientes). Apenas um paciente apresentou OMAM (Estágio 1) após extração no Hospital 1.
O maxilar foi o local mais afetado por OMAM. Quatro pacientes (50,0%) desenvolveram OMAM no maxilar, 3 pacientes (37,5%) na mandíbula, enquanto um (12,5%) apresentou exposição óssea simultânea na mandíbula e maxilar posterior.
O tabagismo foi um fator associado a OMAM (p=0,031). O odds ratio para tabagismo foi de 9,37.
A tabela 3 apresenta os dados do acompanhamento odontológico durante o tratamento com BF, extração dentária e tabagismo nos grupos 1 e 2.
A figura 1 ilustra o caso do paciente número 6, com OMAM Estágio 2, após exodontia de 38 dentes durante terapia antirreabsortiva.
A tabela 4 resume os dados demográficos, o tratamento com BF e os dados clínicos de 8 pacientes do grupo 1.
Características demográficas, clínicas e do tratamento de câncer do Grupo 1
| Paciente(N°/idade/ sexo) | Diagnóstico | Tipo deBF | Número de infusões | EstágioDa OMAM(AAOMS 2014) | Localização | Fator desencadeante da OMAM | Sintomas álgicos |
|---|---|---|---|---|---|---|---|
| 1/65/F | Mama | AZ | 13 | 2 | Mx Anterior | Implante | Sim |
| 2/77/F | Mama | AZ | 22 | 1 | Mx Posterior | Exodontia | Não |
| 3/58/F | Mama | AZ | 33 | 0 | Md Posterior | Espontâneo | Não |
| 4/47/F | Mama | AZ | 10 | 2 | Mx Posterior | Exodontia | Sim |
| 5/64/M | MM | AZ | 13 | 2 | Mx Anterior | Exodontia | Sim |
| 6/88/M | Próstata | AZ | 11 | 2 | Md Posterior | Exodontia | Sim |
| 7/58/F | Mama | AZ | 33 | 1 | Md Posterior | Espontâneo | Não |
| 8/54/F | MM | AZ | 19 | 2 | Mx Posterior | Exodontia | Sim |
| P | 25 | Md Posterior |
BF, Bisfosfonato; AZ, ácido zoledrônico; P, Pamidronato; F, feminino; M, masculino; MM, Mieloma múltiplo; OMAM, Osteonecrose dos maxilares relacionada a medicamentos; Md, Mandíbula; Mx, Maxilar.
A incidência de OMAM em pacientes com câncer que recebiam tratamento com BF intravenoso pode variar de 1,2% a 9,9%.2 Essa incidência é maior em pacientes com mieloma múltiplo em comparação com pacientes com câncer de mama ou de próstata.5,9,16 Nosso estudo, por sua vez, apresentou uma frequência de 10,8% na amostra de pacientes estudada, valor superior ao relatado na literatura, provavelmente pelo fato de o estudo ter sido feito nos dois centros de tratamento do câncer com serviço especializado de cirurgia bucomaxilofacial, o que os torna referência para o tratamento da OMAM.
A maioria dos casos de OMAM foi diagnosticada em pacientes com câncer de mama, enquanto um paciente tinha câncer de próstata e 2 tinham mieloma múltiplo (MM). Nossa amostra apresentou maior número de casos de câncer de mama, o mais frequente em nossa região, e os protocolos de infusão de BF, como dose e periodicidade, para tumores sólidos com metástases ósseas e para MM não diferem na amostra de pacientes estudada.
Vários estudos mostraram que o tempo de exposição à BF é um fator de risco para o desenvolvimento de OMAM8,9,14,16 e também mostraram uma associação entre o número de infusões de BF e o desenvolvimento de OMAM.9,16 Em estudos que avaliaram o tempo de exposição da BF, os protocolos de infusão variaram de 3 a 4 semanas e foram associados ao desenvolvimento de OMAM. Em nosso estudo, não foi viável avaliar o tempo de exposição ao risco de OMAM, uma vez que os pacientes incluídos no estudo tinham protocolos de intervalo entre as infusões de BF que variavam de mensal a trimestral. Em nosso estudo, avaliamos o número de infusões e o grupo de pacientes com OMAM recebeu um número maior de infusões de 4mg de ácido zoledrônico em comparação ao grupo de pacientes sem OMAM (p=0,001). Nossos resultados estão de acordo com os estudos que relataram uma associação do número de infusões com OMAM.8,9,16
Alguns estudos demonstraram que o risco de OMAM foi significantemente maior em pacientes que tomavam ácido zoledrônico em comparação com o pamidronato isoladamente ou após o pamidronato.9,16,25 Esse fato explica que a potência do ácido zoledrônico é 100 vezes maior do que a do pamidronato.5 Nosso estudo mostrou que a OMAM foi associada a um número maior de ciclos de ácido zoledrônico (p=0,001), como descrito na literatura.
Em relação ao intervalo de infusão de BF, há evidências de que infusões trimestrais podem diminuir o risco de OMAM em comparação com infusões mensais. Um estudo mostrou que o risco de OMAM diminui 8 vezes em infusões trimestrais em comparação com infusões mensais (p=0,049).25 Outro estudo mostrou que o regime trimestral não foi inferior ao mensal para a eficácia do tratamento do câncer e 2 casos de OMAM foram associados ao grupo de infusão mensal.26 Nosso estudo mostrou associação da OMAM com intervalo mensal de infusão (p=0,044), em acordo com a literatura. Pacientes com intervalo de infusão de BF mensal têm 7,75 vezes mais chance de OMAM em comparação com aqueles com infusão trimestral.
A associação do uso de BP concomitante com quimioterápicos foi relatada anteriormente.14 Entretanto, o estudo não classificou os tipos de quimioterapia usados de acordo com o tipo de diagnóstico de câncer para avaliar o risco de OMAM.14 Em nosso estudo, 6 (75,0%) dos 8 pacientes com OMAM receberam tratamento quimioterápico concomitante ao tratamento com BF. Entretanto, devemos considerar a diversidade dos esquemas quimioterápicos usados devido aos diferentes diagnósticos tumorais na amostra, o que compromete a avaliação da quimioterapia concomitante com BF no desenvolvimento da OMAM.
Para alguns autores, a OMAM está associada ao tratamento concomitante de corticosteroides com agentes antirreabsortivos.6,18,27 O efeito imunossupressor dos corticosteroides pode estar relacionado ao retardo da cicatrização, alteração da microbiota oral e maior risco de infecção e desenvolvimento de OMAM.18 O estudo mostrou um risco aumentado de OMAM como uso de corticosteroide, mas não classificou o risco de acordo com a indicação clínica e a dose de corticosteroide.13 Em nosso estudo, os pacientes com OMAM apresentaram uma frequência de 87,5% de uso de corticosteroide em comparação com 12,5% dos pacientes sem corticosteroide com OMAM (p=0,427). Como mencionado anteriormente para o tratamento quimioterápico, os diferentes protocolos e a periodicidade dos corticosteroides no tratamento concomitante com BF podem inviabilizar o uso desses dados para predizer o risco para OMAM.
Em relação aos fatores dentários que desencadeiam a OMAM, podemos mencionar trauma, causa espontânea,28 presença de doenças dentárias pré‐existentes, como periodontite, e procedimentos cirúrgicos odontológicos.8 Entretanto, a extração dentária é o fator local predominantemente associado a OMAM.18 Vários estudos mostraram a associação de OMAM com extração dentária.9,15,16,25 Baseado no que foi exposto, acredita‐se que procedimentos odontológicos não cirúrgicos possam prevenir a OMAM.8 Em nosso estudo, dos 8 pacientes que desenvolveram OMAM, 6 casos ocorreram após procedimentos cirúrgicos e 2 casos foram espontâneos (p=0,129). Em 5 casos de OMAM, os procedimentos cirúrgicos foram feitos em serviços externos e encaminhados para tratamento de OMAM nos Hospitais 1 (1 caso) e 2 (4 casos). Esse resultado mostra a importância da feitura da extração dentária por profissionais qualificados, como demonstrado em 26 casos de extrações em pacientes tratados com BF feitas no Hospital 1, e apenas um caso de OMAM (Estágio 1). O Hospital 1 fez protocolo cirúrgico minimamente traumático, fechamento primário da área cirúrgica, antibioticoterapia pré e pós‐operatória com amoxicilina 500mg ou clindamicina 600mg para pacientes alérgicos à penicilina e seguimento periódico desses pacientes. Essas medidas podem diminuir o risco de OMAM e, então, justificar a ausência de associação da extração com OMAM neste estudo.
As lesões de OMAM aparecem mais comumente na mandíbula do que na maxila, na proporção de 2:1. No entanto, pode se manifestar em ambas as arcadas.6 A razão para a predileção da OMAM pela mandíbula quando comparada à maxila pode ser devido à alta remodelação óssea mandibular suprimida por agentes antirreabsortivos14 e também estruturalmente pela espessura da camadas cortical e medular.6
Alguns estudos mostraram que a mandíbula foi o local mais afetado pela OMAM e, na maioria das vezes, associada à exodontia2,7,8,10,12,14,16,27 Em nosso estudo, entretanto, a região com maior envolvimento da OMAM foi na maxila, ao contrário do que foi revelado em relatos anteriores. Esse fato pode ser explicado porque 4 dos 8 casos foram associados a procedimentos cirúrgicos odontológicos exclusivamente na maxila. Nos casos de OMAM de causa espontânea, a mandíbula foi afetada, compatível com o relatado na literatura.
A terapia odontológica pré‐BF, com a implantação de medidas preventivas de atendimento odontológico em visitas de rotina ao cirurgião‐dentista,3,27,29,30 teve uma implicação direta na redução da incidência de OMAM.2,8,18 Assim, o tratamento dentário invasivo, como extrações, foi feito antes da terapia com BF, a fim de reduzir a necessidade desses procedimentos durante o tratamento com BF.8,10,12,29 Entretanto, durante a terapia com BF, o monitoramento odontológico clínico e radiográfico desses pacientes também é importante.8 Otto et al., 2012, mostraram que apenas 7 (10,6%) dos 66 pacientes com OMAM foram encaminhados ao dentista antes do tratamento com BF.2 Water et al., 2008, relataram que 6 de 8 pacientes OMAM (75,0%) tinham consultas odontológicas de rotina.15 A amostra deste estudo originou‐se de serviços com diferentes protocolos de assistência; enquanto o Hospital 1 caracteriza‐se por ser um serviço clínico odontológico que faz procedimentos como odontologia, endodontia, periodontia e extrações, além de acompanhamento radiográfico/clínico até um ano após a última infusão de BF, o Hospital 2 é caracterizado por serviço de cirurgia bucomaxilofacial que fornece orientação e prevenção, mas com limitação para a feitura de procedimentos clínicos, encaminha os pacientes quando necessário. A importância do monitoramento odontológico durante o tratamento com BF é enfatizada como resultado de nosso estudo, uma vez que 6 pacientes (75,0%) com OMAM não fizeram check‐up odontológico durante o tratamento com BF com procedimentos odontológicos (odontologia, endodontia, periodontia e extrações) e apenas 2 pacientes (25,5%) tiveram consultas de rotina com procedimentos odontológicos. Isso resultou em uma diferença estatística entre os grupos 1 e 2 (p=0,019). Nossos resultados mostraram que os pacientes que não eliminaram focos de infecção antes ou durante o tratamento com BF apresentaram maior risco para OMAM, segundo Otto et al., 2012.2 Acredita‐se que pacientes submetidos a check‐ups odontológicos durante o tratamento com BF tenham orientações de higiene, procedimentos como remoção de focos de infecção e procedimentos preventivos e essas medidas terão impacto direto no desenvolvimento do OMAM.
Outros estudos relataram o tabagismo como fator de risco para OMAM.9,19 O resultado de nosso estudo mostrou que fumantes têm 9,37 vezes mais chance de desenvolver OMAM do que não fumantes (p=0,031). O hábito tabágico promove retardo na cicatrização óssea e pioria da condição periodontal.31,32 Entre os efeitos deletérios das toxinas encontradas na fumaça do tabaco estão a vasoconstrição e a agregação plaquetária induzida pela nicotina e redução da capacidade de transporte de oxigênio pela hemoglobina.31 O aumento da vasoconstrição pode levar à isquemia associada à fisiopatologia da OMAM.
No metabolismo ósseo, a IL‐6 induz a diferenciação dos osteoclastos, resulta na reabsorção óssea.22 Os BFs afetam a produção de osteoblastos através de mediadores de osteoclastogênese, inclusive o ligante do receptor ativador do fator nuclear kappa B (RANKL), a osteoprotegerin (OPG) e a IL‐6, o que resulta na diminuição da formação/ativação de osteoclastos. Esse evento promove um aumento na produção de IL‐6 e OPG e uma diminuição na produção de RANKL, inibe o turnover ósseo e causa necrose óssea. 32 A avaliação da mucosa de pacientes com OMAM também mostrou níveis significativamente elevados de níveis de IL‐6 e razão RANKL/OPG em pacientes com OMAM, sugeriu a importância de avaliar esses marcadores durante a terapia com BF para monitorar o início da OMAM.28 No processo infeccioso durante a necrose óssea, os mediadores da resposta inflamatória, IL‐6 e o fator de necrose tumoral alfa (TNF‐alfa) mostraram níveis moderadamente altos em casos de OMAM.33 Um estudo mostrou níveis salivares elevados de IL‐1 alfa, IL‐1RA e IL‐1 beta em processos inflamatórios de OMAM.21 Outro estudo relatou valores significativamente mais altos para IL‐6 plasmático e salivar no grupo de pacientes com OMAM em comparação com os grupos controle.20 No presente estudo, não foi encontrada associação entre a concentração salivar de IL‐6 com OMAM (p=0,571). A mediana de IL‐6 foi maior nos pacientes do grupo 3, que não receberam tratamento quimioterápico e não apresentaram adequação oral e, portanto, níveis elevados de IL‐6 poderiam estar associados à condição periodontal. Outra hipótese para níveis mais elevados de IL‐6 em pacientes do grupo 3 pode estar associada ao fator terapêutico, ainda não iniciado, e que, a depender do agente quimioterápico prescrito, pode diminuir os níveis de IL‐6.23 Não houve associação entre estágios mais elevados de OMAM e níveis mais elevados de IL‐6 salivar (p=0,923), como relatado anteriormente.20
ConclusãoFatores de risco, como um número maior de ciclos de ácido zoledrônico, protocolo de infusão mensal, ausência de check‐up odontológico durante o tratamento com BF com procedimentos odontológicos, inclusive extrações, e hábito tabágico, foram associados a maior risco de desenvolvimento de OMAM. Outros fatores, como tratamento concomitante com corticosteroides e agentes quimioterápicos, procedimentos odontológicos invasivos, foram mais frequentes em pacientes com OMAM. O nível salivar de IL‐6 não foi associado a maior risco e gravidade para OMAM. O acompanhamento odontológico por equipe especializada com procedimentos para retirada de focos de infecção durante o tratamento com BF mostrou ser um aspecto importante na prevenção dessa complicação.
Os procedimentos cirúrgicos odontológicos são inevitáveis em alguns casos durante o tratamento com BF e, quando feitos por cirurgiões orais especializados, podem melhorar a evolução do paciente e reduzir o risco de desenvolver OMAM.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À CAPES ‐ Coordenação de Aperfeiçoamento de Pessoal de Nível Superios.
Como citar este artigo: Kemp APT, Ferreira VHC, Mobile RZ, Brandão TB, Sassi LM, Zarpellon A, et al. Risk factors for medication‐ related osteonecrosis of the jaw and salivary IL‐6 IN cancer patients. Braz J Otorhinolaryngol. 2022;88:683–90.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.