Introdução: Os tumores de lábio e da cavidade oral diferem em vários aspectos; portanto, o conhecimento das diferenças entre eles pode ajudar na melhor compreensão do comportamento biológico das neoplasias que ocorrem nesses locais.
Objetivo: Considerando que a angiogênese e a linfangiogênese são dois elementos importantes que podem influenciar diversos aspectos da biologia dos tumores, objetivamos comparar esses fatores entre o carcinoma de células escamosas (CCE) de lábio inferior e da cavidade oral.
Método: No total, foram selecionados 84 CCEs primários (45 tumores da cavidade oral e 39 tumores de lábio). Esses tumores foram corados por processo imunohistoquímico com anticorpo monoclonal anti-D2-40 e CD105. Avaliamos a densidade média de microvasos (DMV) no tecido tumoral, enquanto que a densidade vascular linfática (DVL) foi calculada tanto no tecido neoplásico como no front de invasão. Os dados foram estatisticamente analisados com o uso do teste t e valores de p < 0,05 foram considerados significantes.
Resultados: Chegamos a uma média para DMV ± DP de 31,94 ± 18,9 para CCEs na cavidade oral e de 27,54 ± 20,8 no lábio inferior, sem diferença significante (p = 0,32). As médias para DVL ± DP foram de 13,05 ± 8,2 e 16,57 ± 10,79 no tecido neoplásico da cavidade oral e lábio inferior, respectivamente. Os valores correspondentes foram 9,94 ± 5,59 e 12,50 ± 7,8 no front invasivo. Não foram observadas diferenças significantes nas duas variáveis DVL entre os dois locais.
Conclusão: De acordo com os nossos resultados, a pesquisa por fatores adicionais, além daqueles relacionados à vasculatura, deve ter continuidade, para auxiliar no esclarecimento das diferenças do comportamento biológico entre CCEs no lábio inferior e na cavidade oral.
Introduction: Tumors of the lip and oral cavity differ in various aspects; therefore a clarification of the distinctions among these sites may help to better understand the biologic behavior of neoplasms occurring in these locations.
Objective: Considering that angiogenesis and lymphangiogenesis are two major elements that can influence various aspects of tumor biology, we aimed to compare these factors between squamous cell carcinoma of the lower lip and oral cavity.
Methods: A total of 84 primary squamous cell carcinomas including 45 oral and 39 lower lip tumors were selected and immunohistochemically stained with monoclonal antibody against D2-40 and CD105. Mean microvessel density was assessed in tumoral tissue, while lymphatic vessel density was calculated in both neoplastic tissue and invasion front. Data were statistically analyzed using t-test and p-values of <0.05 were considered significant.
Results: We found a mean microvessel density ± standard deviation of 31.94 ± 18.9 in oral cavity and 27.54 ± 20.8 in lower lip squamous cell carcinomas, with no significant difference (p = 0.32).Mean lymphatic vessel density ± standard deviation was 13.05 ± 8.2 and 16.57 ± 10.79 in of oral cavity and lower lip neoplastic tissue, respectively. The corresponding values were 9.94 ± 5.59 and 12.50 ± 7.8 in the invasive front. Significant differences were not observed in either of the lymphatic vessel density variables between the two sites.
Conclusion: According to our results, it seems that the search for additional factors other than those related to the vasculature should continue, to help clarify the differences in biologic behavior between lower lip and oral cavity squamous cell carcinomas.
Introdução
Carcinomas de células escamosas (CCEs) têm origem nas células epiteliais de diversos órgãos, e seu comportamento biológico depende de diferentes fatores, sendo um deles a localização anatômica do tumor.1 Um bom exemplo para isso é a existência de consideráveis diferenças etiológicas e prognósticas entre CCEs de lábio e de cavidade oral. As neoplasias de lábio demonstram menor tendência para metástase em linfonodos regionais e taxa de sobrevida mais elevada, de aproximadamente 90%.2,3
São muitos os fatores envolvidos na etiopatogênese do CCE. Contrariamente ao que ocorre no CCE de cavidade oral, em que o uso do tabaco é o fator etiológico mais bem conhecido, foi sugerido que a exposição crônica à luz solar seja um elemento importante no CCE de lábio inferior, que, sabidamente, recebe maior quantidade de radiação ultravioleta, em comparação com o lábio superior.2,4,5 Estudos recentemente publicados demonstraram que as expressões de alguns marcadores relacionados ao microambiente tumoral e às células neoplásicas dos CCEs labiais são diferentes dos que ocorrem na cavidade oral.2,3 Portanto, nos parece que as diferenças entre esses dois locais não se limitam à etiologia e ao prognóstico, mas que também podem estar relacionadas a fatores moleculares associados ao seu estroma e às estruturas celulares.2,3 Em consequência, vários investigadores acreditam que o CCE de lábio deve ser considerado como uma entidade distinta, devendo ser avaliado como tal. Por outro lado, alguns estudos celulares-moleculares nesses locais não demonstraram qualquer diferença biológica nos marcadores avaliados.6,7
A angiogênese é um processo importante e fundamental na progressão e metástase de malignidades. Antes de 1960, os pesquisadores acreditavam que a nutrição e a irrigação sanguínea dos tecidos neoplásicos eram proporcionadas graças à dilatação dos vasos sanguíneos disponíveis no tumor. Estudos subsequentes revelaram que a angiogênese – a formação de novos vasos sanguíneos – é vital para o crescimento e propagação das malignidades.8 O desenvolvimento de uma rede de novos vasos sanguíneos no tumor é condição essencial para proporcionar nutrientes e oxigênio e para remover resíduos. Para que a angiogênese tenha início, diversas moléculas são liberadas pelas células malignas, que enviam sinais aos tecidos circunjacentes do hospedeiro. Essa situação pode resultar na ativação de certos genes, seguida pela produção de proteínas, o que leva à indução da angiogênese.9,10
Linfangiogênese é a formação de novos vasos linfáticos a partir de vasculatura preexistente; analogamente à angiogênese, a linfangiogênese possui vários mecanismos de indução.11 O crescimento dos vasos linfáticos ocorre em uma série de processos normais e patológicos, por exemplo, cicatrização de feridas, inflamação e progressão para malignidades.12,13
Os CCEs da cavidade oral e do lábio têm sido avaliados em separado em termos de angiogênese e linfangiogênese, e já foram publicados diversos artigos que abordam a associação desses processos com o prognóstico e a invasão do CCE.14-16 No entanto, um número limitado de estudos com resultados conflitantes comparou a angiogênese e a linfangiogênese entre esses locais.17,18 Merece destaque que, nessas investigações, os CCEs de lábios superior e de lábio inferior foram reunidos em um mesmo grupo e avaliados como uma entidade isolada. Considerando que o CCE de lábio inferior não foi ainda exclusivamente avaliado em comparação com o CCE de cavidade oral, e considerando também as importantes diferenças entre tumores de lábio superior vs. inferior,19 objetivamos comparar a angiogênese e a linfangiogênese entre CCEs de lábio inferior e de cavidade oral, com o uso dos marcadores CD105 e D2-40.
Método
Amostras
O presente estudo retrospectivo foi realizado com base em indivíduos com CCE primário, consecutivamente examinados no Instituto do Câncer do Complexo Hospitalar Imam Khomeini, filiado à Universidade de Ciências Médicas de Tehran entre 2007 e 2012. Para tanto, consultamos o arquivo de prontuários desse centro. Casos com história de quimioterapia, radioterapia ou de qualquer outro tratamento antes da cirurgia foram excluídos do estudo, bem como amostras de biópsia excisional com necrose significativa e tecido inadequado. Idade e gênero foram registrados para cada paciente, de acordo com os dados clínicos anotados em seus prontuários clínicos. Os blocos de parafina do material fixado em formalina para todas as lesões, também em correspondência com o prontuário de cada paciente, foram recuperados do arquivo da Patologia, para a análise imuno-histoquímica. Esse projeto foi aprovado pelo comitê de ética da Universidade de Ciências Médicas de Tehran (código nº 70-10646).
Coloração imuno-histoquímica
As secções histológicas (3 μm) fixadas em formalina e incluídas em parafina foram montadas em lâminas revestidas de poli-L-lisina e submetidas à desparafinização em xileno, seguidas de reidratação em série de álcool e recuperação de antígeno. Para D2-40, essa operação foi realizada pela imersão das amostras em tampão citrato (0,1M, pH = 6) e aquecimento em forno de micro-ondas durante dois ciclos de 15 minutos cada; para CD105, foi realizado pré-tratamento com proteinase K durante 5 minutos. Em seguida, a peroxidase endógena foi bloqueada pela incubação das secções em solução de peróxido de hidrogênio a 3% e metanol durante meia hora. Em seguida à lavagem com tampão Tris-salina (TBS), as amostras foram tratadas com anticorpos monoclonais D2-40 (D2-40, Dako Cytomation) ou CD105 (SN6h, Dako, Glostrup, Dinamarca) durante 1 hora em câmera úmida a diluições de 1:1000 e 1:30, respectivamente. TBS foi utilizado na lavagem antes da incubação com o EnVision System (Dako Cytomation, Glostrup, Dinamarca) à temperatura ambiente, durante 30 minutos. A reação antígeno-anticorpo foi visualizada com diaminobenzidina e a contracoloração foi efetuada com hematoxilina de Mayer. Com as lâminas experimentais, foram simultaneamente processados controles positivos, consistindo de carcinoma de mama com imunorreações conhecidas para D2-40 e tecido hepático normal para CD105, juntamente com controles negativos (omissão do anticorpo primário para controle negativo).
Avaliação da coloração
A densidade microvascular (DMV) e a densidade de vasos linfáticos (DVL) foram quantificadas de acordo com o método descrito previamente.20 Resumidamente, com o uso de um microscópio de dois cabeçotes (Olympus BH2, Tóquio, Japão), dois patologistas orais selecionaram cinco pontos representativos a x100 de ampliação; em seguida, foi feita a contagem de microvasos a x400 (área do campo: 0,18 mm2) e foi calculada a média da contagem de microvasos para cada amostra. Qualquer possível discordância foi resolvida por consenso.
Análise estatística
A análise estatística foi realizada com o uso do teste t, e p < 0,05 foi considerado significante.
Resultados
Obtivemos um total de 84 casos de CCE, 45 dos quais estavam localizados na cavidade oral e 39 no lábio inferior. Das 39 amostras de CCE de lábio inferior, cinco (13,5%) eram mulheres e 34 (86,5%) eram homens vs. 31 (68,9%) pacientes homens e 14 (31,1%) mulheres com CCE de cavidade oral. A faixa etária dos pacientes com CCE de lábio inferior e de cavidade oral foi de 31-90 (média: 65) e 19-64 (média: 61) anos, respectivamente. Os tumores da cavidade oral estavam localizados na língua (21: 46,7%), assoalho da boca (8: 17,8%), mucosa bucal (6: 13,3%), gengiva (6: 13,3%) e maxila (4: 8,9%).
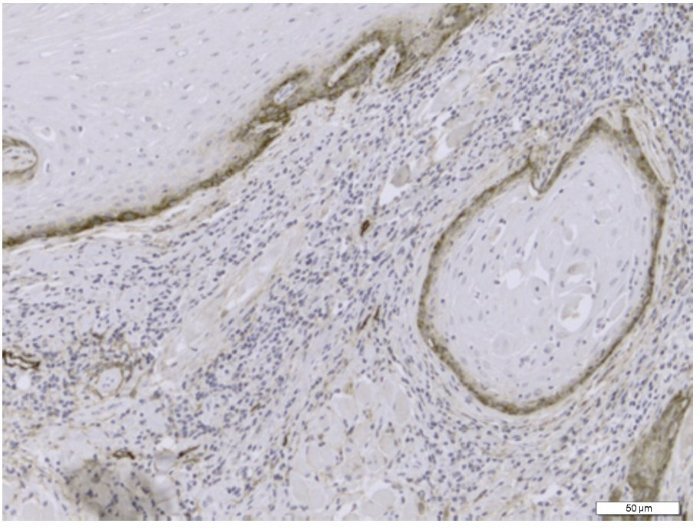
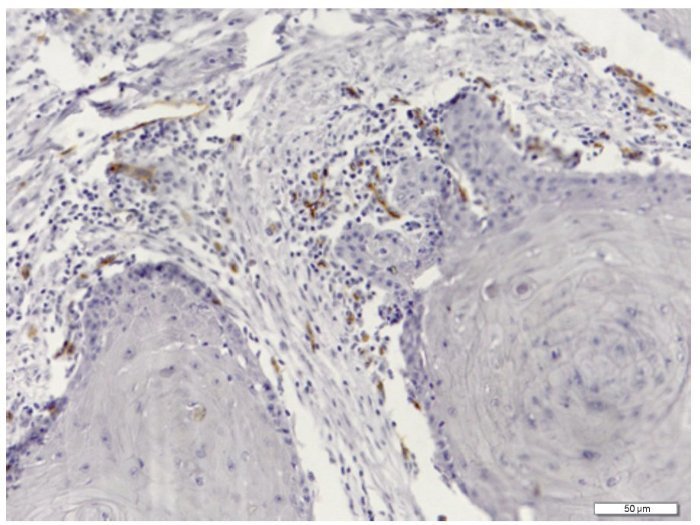
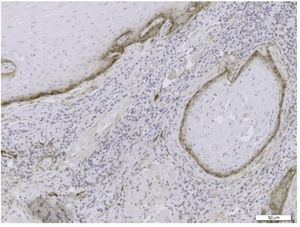
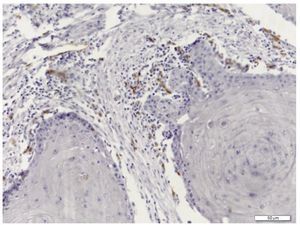
A avaliação imuno-histoquímica da DVL foi realizada em separado no tecido neoplásico e no front invasivo do tumor (fig. 1), enquanto a DMV foi avaliada globalmente nos tecidos de CCE (fig. 2).
Figura 1 Secção representativa da densidade de vasos linfáticos com o uso da imuno-histoquímica com anticorpo monoclonal anti-D2-40 (Magnificação original x200).
Figura 2 Densidade microvascular demonstrando neoformação de vasos imunocorados com anticorpo monoclonal anti-CD105 (Ampliação original x200).
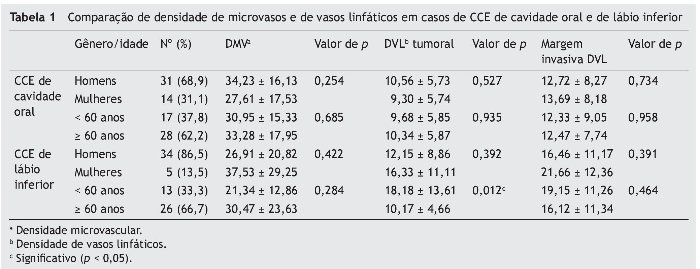
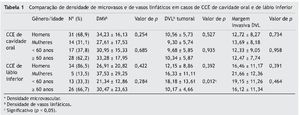
A média da DMV ± DP foi de 31,94 ± 18,9 na cavidade oral e de 27,54 ± 20,8 no lábio inferior. Os valores médios mais altos e mais baixos da DMV (92,00 e 5,30, respectivamente) foram observados no grupo de CCE da cavidade oral. Não foi observada diferença significante entre o lábio inferior e a cavidade oral (p = 0,32)
A média da DVL ± DP no tecido tumoral foi de 13,05 ± 8,2 no grupo de CCE da cavidade oral e de 16,57 ± 10,79 no grupo de CCE do lábio inferior. A margem invasiva do tumor teve médias de DVL ± DP de 9,94 ± 5,59 e 12,50 ± 7,8 na cavidade oral e no lábio inferior, respectivamente. Os valores mais altos e mais baixos das médias de DVL foram observados no front tumoral, quando comparados com o tecido neoplásico; o valor mais alto foi de 48,67 em um tumor de cavidade oral e o mais baixo foi de 0,67 em um tumor de lábio inferior. Nem no tecido tumoral (p = 0,105) ou no front invasivo (p = 0,098) foram observadas diferenças significantes entre o lábio inferior e a cavidade oral.
A tabela 1 lista uma comparação de DMV e DVL entre CCEs de cavidade oral e de lábio inferior, de acordo com a idade e o gênero. Com base em nossos resultados, pacientes com CCE de lábio inferior com menos de 60 anos de idade demonstraram DVL neoplásica significantemente mais elevada, em comparação com pacientes acima dos 60 anos (p = 0,012).
Discussão
A metástase de células malignas em linfonodos é um dos principais fatores prognósticos em muitos tumores sólidos, como o CCE oral.21 A angiogênese e a linfangiogênese proporcionam novos vasos, através dos quais as células malignas podem deixar a área circunjacente do tumor primário.13 Diferentes aspectos desses dois processos foram avaliados em casos de CCE de cavidade oral e de lábio com o uso de vários marcadores.13-18 Atualmente, CD105 é utilizada na avaliação de vasos neoformados. Essa proteína se liga preferencialmente às células endoteliais ativas envolvidas no processo de angiogênese. Por essa razão, CD105 se expressa intensamente nas células endoteliais proliferativas, enquanto sua expressão é fraca ou negativa em vasos normais. O poder e a capacidade de CD105 para diferenciação quantitativa entre células endoteliais ativas/proliferativas e normais/quiescentes tornam possível avaliar com maior precisão os vasos sanguíneos tumorais neoformados.22,23
Por outro lado, é menor o número de estudos tratando de vasos linfáticos, devido à ausência de técnicas oculares apropriadas. No passado, muitos pesquisadores acreditavam que os tumores, devido à ausência de vasos linfáticos, não podiam induzir linfangiogênese. Na última década, foram identificados anticorpos específicos contra células endoteliais linfáticas, o que levou a uma modificação no ponto de vista geral com relação a esse processo.11 D2-40 é um marcador que se expressa em células endoteliais de vasos linfáticos; nos últimos anos, tem sido utilizado na avaliação da DVL.24
No presente estudo, usamos D2-40 e CD105 com o objetivo de avaliar a angiogênese e a linfangiogênese em pacientes com CCE de lábio inferior e de cavidade oral. Nossos resultados demonstraram valores mais altos para DMV na cavidade oral em comparação com o lábio, mas a diferença não foi significante. Concordando com nossos achados, Mărgăritescu et al.,25 que usaram CD-105, relataram não ter encontrado diferença significativa entre esses locais; no entanto, esses autores constataram maiores valores de DMV em CCEs de lábio. Contrastando com essa posição, Oliveira-Neto et al.17
demonstraram diferenças significantes para DMV entre CCEs de lábio e de cavidade oral. Esses autores observaram que DMV estava mais elevada em tumores orais. A exposição crônica ao sol, como pode ser observado na pele fotoenvelhecida, foi sugerida como um fator capaz de diminuir o número de vasos sanguíneos na derme superior,26 enquanto a mucosa da cavidade oral é conhecida por sua rica vascularidade e eficácia da irrigação sanguínea. Esse fato pode ser responsável pelos valores mais altos para DMV em nossos CCEs intraorais. Além de levar em conta o papel promotor de metástases da angiogênese, a DMV mais alta dos tumores de cavidade oral, nesse estudo, acompanha os resultados de estudos prévios, nos quais os tumores de cavidade oral demonstram maior tendência para metástase em linfonodos e também uma taxa de sobrevida mais baixa, quando comparados aos tumores de lábio.2,3
Contrariamente aos nossos achados para DMV, a média de DVL nessa investigação foi mais alta em CCEs de lábio inferior vs. cavidade oral; mas, como ocorre com a DMV, não foi observada diferença significante entre os locais, nem no tecido tumoral, nem na margem invasiva. Oliveira-Neto et al.17 também demonstraram que a diferença em DVL entre a cavidade oral e o lábio inferior não foi significante; no entanto, seus resultados demonstraram uma DVL ligeiramente mais elevada em CCEs de lábio, em comparação com os tumores de cavidade oral. Contrastando com nossos achados, Watanabe et al.,18 em uma amostra de 105 CCEs de cavidade oral e de apenas três casos de tumores labiais, observaram uma DVL média significantemente mais alta nos CCEs de lábio vs. cavidade oral. Tendo em vista que a metástase de CCE em linfonodos ocorre mais comumente na cavidade oral do que no lábio inferior, e que os vasos linfáticos proporcionam um acesso mais facilitado ao sistema linfático para as células malignas, era de se esperar que a DVL média fosse mais elevada nos CCEs de cavidade oral, em comparação com os tumores labiais, enquanto que, em nosso estudo, observamos o contrário. Diferentes fatores celulares e moleculares estão envolvidos no desenvolvimento e progressão da metástase linfática, senda a linfangiogênese apenas mais um fator. A avaliação de outros fatores efetivos pode revelar mais adequadamente as diferenças biológicas entre CCEs de lábio inferior e de cavidade oral.
As diferenças estatisticamente significantes nos dois fatores entre o lábio e a cavidade oral, observadas na presente investigação, são comparáveis ao observado em estudos precedentes; tais estudos constataram que o câncer de lábio está intimamente relacionado a malignidades do trato digestivo superior.5 Além disso, é digno de nota que em todos os estudos acima mencionados as “amostras labiais” incluíam os lábios superior e inferior, enquanto que nós excluímos de nossa amostra casos de CCE de lábio superior. Em consequência, nossos achados refletem as DMVs e DVLs dos tumores de lábio inferior em comparação com neoplasias orais; portanto, nossos resultados não podem ser comparados acuradamente com essas investigações. A importância da exclusiva seleção do CCE de lábio inferior se reflete no fato de que tais neoplasias se revelaram biologicamente distintas dos tumores de lábio superior. Nessas localizações, as malignidades também diferem em prevalência e possivelmente em etiologia: o CCE de lábio inferior é mais comum que o tumor de lábio superior, e o papel da radiação UV e do fumo com cachimbo são mais importantes como fatores causadores de CCE de lábio inferior vs. lábio superior.19,27 Por outro lado, o crescimento da malignidade no lábio inferior é mais lento que o crescimento no lábio superior; além disso, tem melhor prognóstico. Por essas razões, alguns investigadores sugerem que o CCE de lábio superior deve ser avaliado como entidade distinta, para que sejam produzidos resultados mais confiáveis.26-29 Com relação aos dados demográficos, observamos uma DVL neoplásica significantemente mais alta em pacientes com CCEs de lábio inferior com menos de 60 anos, em comparação com indivíduos com 60 ou mais anos de idade. Esse achado concorda com estudos prévios, que demonstraram um curso agressivo da doença em alguns pacientes jovens, e com estudos que indicaram diferenças no perfil molecular de pacientes jovens e idosos com CCE.30 Devemos mencionar que, se tivéssemos acesso aos dados de estadiamento TNM, sobrevida e metástases dos pacientes, poderíamos comentar com maior convicção sobre a relação da metástase com a angiogênese e a linfangiogênese nos CCEs de lábio inferior e de cavidade oral.
Comentários finais
Nos últimos anos, estudos publicados sobre vários marcadores celulares e moleculares em CCEs de lábio e de cavidade oral revelaram algumas diferenças indicativas de suas variações biológicas.2,3 Por outro lado, a expressão de outras proteínas não demonstrou diferenças entre esses dois grupos.7,8
Com base nos resultados da presente investigação, não parece que a angiogênese e a linfangiogênese ajudem no esclarecimento da diferença biológica entre CCEs de lábio inferior e de cavidade oral. Parecenos que a busca por outros fatores, além daqueles relacionados à vasculatura, deverá ter continuidade, para ajudar no esclarecimento das diferenças de comportamento biológico entre CCEs de lábio inferior e de cavidade oral.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 18 de abril de 2015;
aceito em 6 de junho de 2015
* Autor para correspondência.
E-mail: shahrooetemad@yahoo.com (S. Etemad-Moghadam).
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.06.008
☆ Como citar este artigo: Alaeddini M, Etemad-Moghadam S. Lymphangiogenesis and angiogenesis in oral cavity and lower lip squamous cell carcinoma. Braz J Otorhinolaryngol. 2016;82:385-90.